不同光质对杉木组培苗叶绿素含量及荧光参数的影响
周锦业 彭珠清 许珊珊 丁国昌 林思祖
摘 要 研究不同单、复色LED光源对杉木组培苗叶绿素含量及荧光参数的影响。结果表明:单色LED处理下,杉木组培苗叶绿素a、叶绿素b以及叶绿素总量均以30 μmol/(m2·s)蓝光处理的最大,而FV/Fm和FV/F0值均以70 μmol/(m2·s)蓝光处理的最大。不同复色LED光源对杉木组培苗叶绿素a、叶绿素总量以及FV/F0值作用大小顺序均为:R>B>G;对叶绿素b含量和FV/Fm值作用大小顺序均为:R>G=B。促进杉木叶绿素积累的最优光色光强组合为70 μmol/(m2·s)R+60 μmol/(m2·s)G+30 μmol/(m2·s)B,而有效提高FV/Fm和FV/F0值的最优光色光强组合为60 μmol/(m2·s)R+50 μmol/(m2·s)G+40 μmol/(m2·s)B。
关键词 杉木;组织培养;LED;叶绿素;叶绿素荧光
中图分类号 S791.27 文献标识码 A
杉木(Cunninghamia lanceolata)属于杉科杉木属,是中国南方主要用材树种之一,在木材产业中占据重要地位。目前杉木人工林营建以实生苗为主,但实生苗存在育苗周期较长、人工成本高且母本优良性状不易保存等问题。因此近些年众多学者在杉木无性繁殖方面进行了深入研究,并取得了良好的研究成果,但是研究主要集中于培养基的选择和优化,对于组培微环境研究较少[1-2]。然而组织培养过程不仅应注重培养基的研究,同时需改善组培苗生长环境以提高其生长速度和质量[3]。
光是组培育苗不可或缺的环境因子之一,由于室内光强不足以支撑植物正常生长,因此需采用人工光源进行适当补光[4]。杉木组培人工光源目前以荧光灯为主,但荧光灯光能利用率较低,且工作过程中发热严重,造成控制温度的成本增加,因此开发新型人工光源成为提升杉木组培苗质量和降低组培成本的重要途径之一。LED(light emitting diode)以其体积小、能耗低、寿命长、发光稳定等特点而逐渐占领组培人工光源市场[5],在观赏植物[6-12]、药用植物[13-15]及蔬菜果树[16-22]等种苗繁育中均有应用,但在杉木组培快繁中的应用研究鲜见报道。本试验旨在通过研究不同光质对杉木组培苗叶绿素含量及荧光参数的影响,探索其在杉木组培快繁中的应用前景,以期为寻求杉木组培快繁中的新型人工光源提供理论依据。
1 材料与方法
1.1 材料
研究选用材料为4号杉木无性系,试验地点位于国家林业局杉木工程技术研究中心组培室,培养条件为:温度(25±2)℃、光照周期12 h/d。
1.2 方法
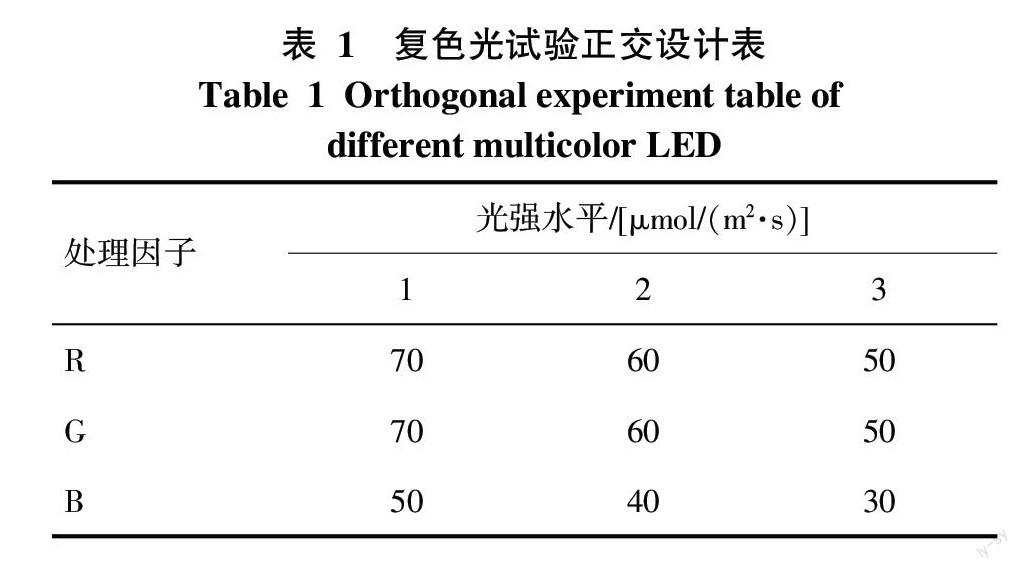
1.2.1 试验设计 试验分为单色和复色2个实验。光色分为红光(R)、绿光(G)和蓝光(B)3种,其中红、绿和蓝光主波长分别为630、505、460 nm。单色光实验光强分别为70、50、30 μmol/(m2·s)的RGB光色的9组试验,处理结果1~9依次为70 μmol/(m2·s)R、70 μmol/(m2·s)G、70 μmol/(m2·s)B、50 μmol/(m2·s)R、50 μmol/(m2·s)G、50 μmol/(m2·s)B、30 μmol/(m2·s)R、30 μmol/(m2·s)G和30 μmol/(m2·s)B。复色光实验采用正交设计,选用L9(34)正交表,各处理因子和水平如表1所示。对照组(处理0)为三雄极光照明的28W荧光灯,光照度1 000~2 000 lx,光强18~25 μmol/(m2·s)[23],每组处理重复3次,培养30 d后测定各项指标。
1.2.2 参数测定 (1)叶绿素含量:准确称取0.05 g杉木组培苗并剪碎,加入5 mL丙酮、乙醇和水的混合液(V ∶ V ∶ V=63.3 ∶ 31.7 ∶ 5),在暗处浸提12 h后,测定浸提液在A645和A663波长处的吸光度值[24]。
叶绿素a含量(mg/g):Chla=0.005×(12.7×A663-2.69×A645)/0.05
叶绿素b含量(mg/g):Chlb=0.005×(22.9×A645-4.68×A663)/0.05
叶绿素总含量(mg/g):Chl(a+b)=Chla+Chlb
(2)叶绿素荧光特性:叶绿素荧光参数采用PSI公司的Handy Fluor Cam荧光成像仪测定[15,25]:其中,F0为暗反应下的初始荧光,Fm为暗反应下的最大荧光,FV=Fm-F0为可变荧光,FV/Fm为PSⅡ(光系统Ⅱ)最大光化学效率,Fm/F0为PSⅡ电子传递情况。
1.3 数据处理
采用Microsoft Excel对试验结果进行基本处理,用DPS7.05版数据处理软件进行方差、极差和多重比较分析。
2 结果与分析
2.1 不同单色LED光源对杉木组培苗叶绿素含量及荧光参数的影响
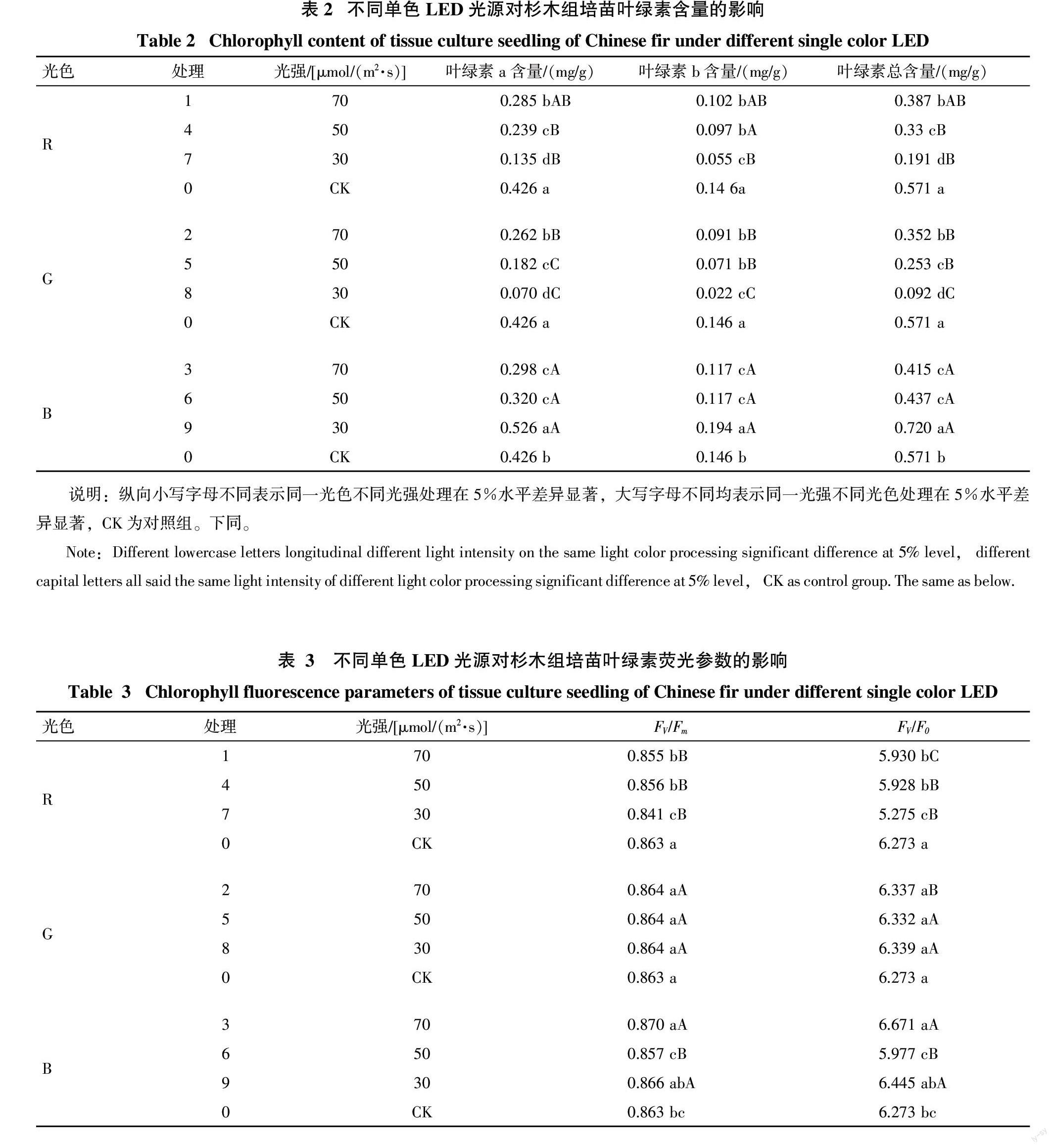
2.1.1 不同单色LED光源对杉木组培苗叶绿素含量的影响 利用不同单色LED光源培养杉木组培苗30 d后,测定叶片中叶绿素含量。结果显示(表2),处理9叶绿素a、叶绿素b和叶绿素总量均最大,分别达到0.526、0.194、0.720 mg/g,与对照相比分别提高了23.50%、32.88%和26.09%;其余各处理组叶绿素a、叶绿素b及叶绿素总量值均低于对照,其中以处理8含量最小,仅分别为0.070、0.022、0.092 mg/g,与对照相比分别降低了83.10%、84.93%和83.89%。分析同一光色不同光强处理下杉木组培苗叶绿素含量的差异可知,叶绿素a、叶绿素b和叶绿素总量随光强的变化趋势一致,R和G处理下叶绿素含量随着光强增加而增加,其中R处理下叶绿素a、叶绿素b和叶绿素总量的最大最小值之间分别相差111.11%、85.45%和102.62%,G处理相差274.29%、313.64%和282.61%;B处理下叶绿素含量随着光强的增强而减小,最大最小值间的差异分别为76.51%、65.81%和73.49%。同一光强不同光色处理时,杉木组培苗叶绿素a、叶绿素b和叶绿素总量的大小均表现为B>R>G。
杉木组培苗叶绿素含量的多重比较分析结果显示(表2),9组处理的叶绿素a、叶绿素b和叶绿素总量与对照相比差异均达到显著水平。同一光色不同光强处理时,R和G的3个处理组的叶绿素a和叶绿素总含量均达到显著差异水平;B中的处理9与处理3、6两组相比叶绿素含量差异显著。同一光强不同光色处理后,70 μmol/(m2·s)的G与B相比叶绿素含量差异显著;30 μmol/(m2·s)的RGB两两处理间叶绿素含量均差异显著。
2.1.2 不同单色LED光源对杉木组培苗叶绿素荧光参数的影响 利用不同单色LED光源培养杉木组培苗30 d后,测定组培苗PSⅡ最大光能转换效率(FV/Fm)以及PSⅡ潜在活性(FV/F0)值。结果显示(表3),组培苗FV/Fm和FV/F0值均以处理3[70 μmol/(m2·s)B]的最大,分别为0.870和6.671,与对照相比分别提高了0.81%和6.34%;处理7最小,仅分别为0.841和5.275,与对照相比分别降低了2.55%和15.91%。同一光色不同光强处理时,R处理的FV/Fm值随着光强增加先增后减;G处理的FV/Fm值无变化;B处理的FV/Fm随着光强的增强先减后增。通过分析FV/F0值的变化可知,R处理的FV/F0值随着光强增加而增大;G和B处理FV/F0值随着光强增加均为先减后增。就同一光强不同光色处理而言,70 μmol/(m2·s)和30 μmol/(m2·s)处理下,杉木组培苗FV/Fm和FV/F0值大小均为B>G>R;而50 μmol/(m2·s)处理则表现为G>B>R。
对杉木组培苗叶绿素荧光参数值进行多重比较分析(表3)可知,处理1、3、4、6和7的FV/Fm和FV/F0值与对照相比差异显著。就同一光色不同光强而言,R中的处理7和处理1、4相比差异显著;G的不同光强处理间差异均不显著;B中的处理6与处理3、9相比差异显著。同一光强不同光色处理,70 μmol/(m2·s)时R的FV/Fm与G、B相比差异显著,FV/F0值两两间差异显著;50 μmol/(m2·s)时G和R、B相比FV/Fm和FV/F0值均差异显著;30 μmol/(m2·s)时R处理的FV/Fm和FV/F0值与G、B相比差异显著。
2.2 不同复色LED光源对杉木组培苗叶绿素含量及荧光参数的影响
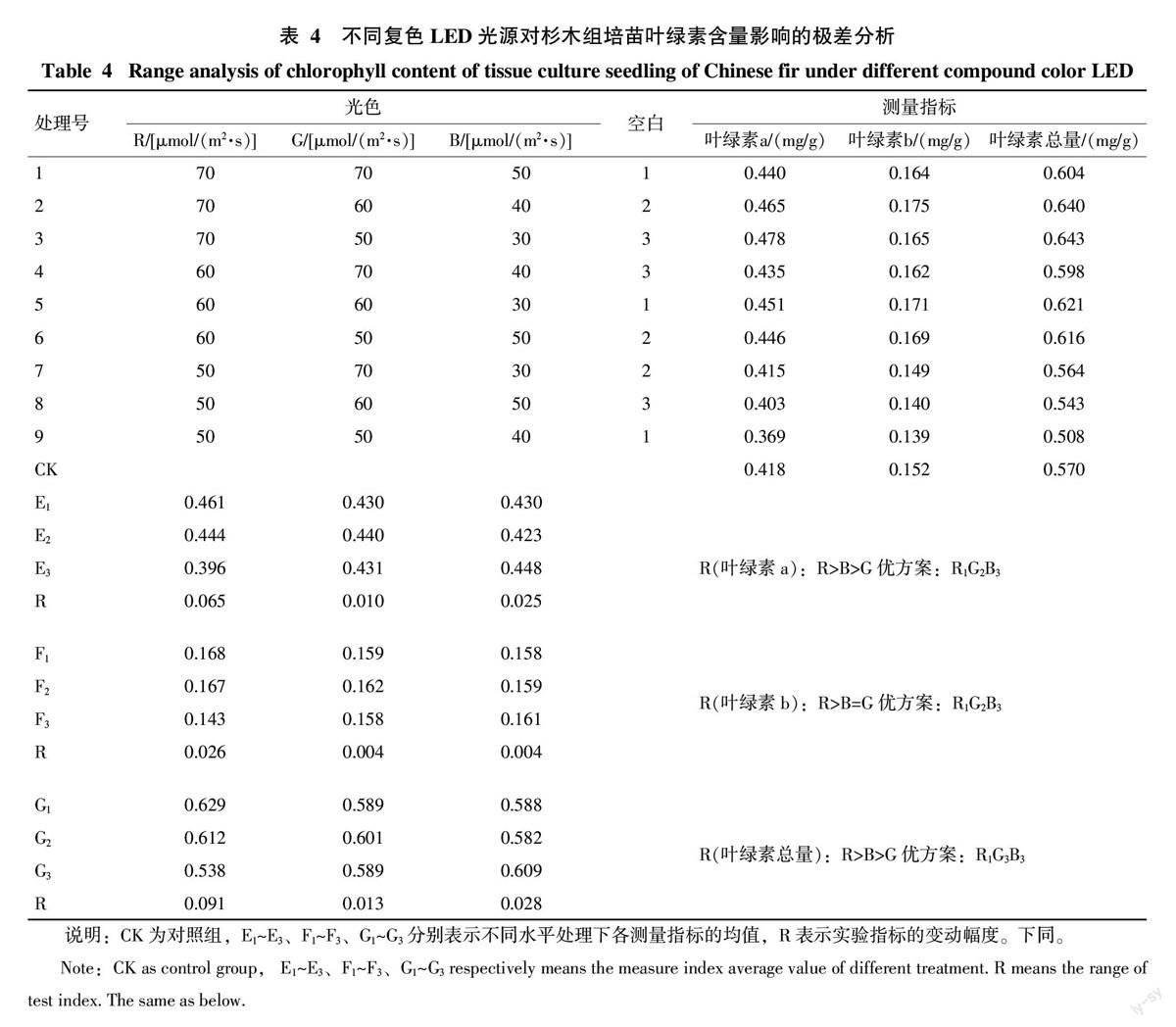
2.2.1 不同复色LED光源对杉木组培苗叶绿素含量的影响 利用不同复色LED光源培养的杉木组培苗叶绿素含量测定结果如表4所示。结果表明,处理3的叶绿素a和叶绿素总量最大,分别为0.478、0.643 mg/g,与对照相比分别提高了14.35%和12.81%;而处理2的叶绿素b含量最大,为0.175 mg/g,与对照相比提高了15.13%。处理9的叶绿素a、叶绿素b和叶绿素总量均最小,分别仅为0.369、0.139、0.508 mg/g,与对照相比分别降低了11.72%、8.55%和10.88%。杉木组培苗叶绿素含量值的极差分析显示,3种处理因子对组培苗叶绿素a和叶绿素总量作用大小均为:R>B>G,表明R对杉木组培苗叶绿素a和叶绿素总量影响最大,其次为B,G影响最小;3种处理因子对叶绿素b含量作用大小为R>G=B,说明R对叶绿素b含量影响最大,B、G作用小。根据极值分析可知,提高杉木组培苗叶绿素a、叶绿素b和叶绿素总量的优化光照组合均为R1G2B3,即70 μmol/(m2·s)R+60 μmol/(m2·s)G+30 μmol/(m2·s)B。
2.2.2 不同复色LED光源对杉木组培苗荧光参数的影响 测定不同复色LED光源下的杉木组培苗叶绿素荧光参数,结果表明(表5),处理2、3、4、5和6的FV/Fm和FV/F0值均高于对照组,其中处理2、3、4和6的FV/Fm最大,均为0.869,与对照组比提高了0.46%;处理3的FV/F0值最大,达到6.63,与对照组相比提高了3.27%。其余各处理的荧光参数值均小于或等于对照,其中以处理8最小,FV/Fm和FV/F0值分别为0.864和6.34,与对照相比降低了0.12%和1.25%。对叶绿素荧光参数值进行极差分析,结果显示,3种处理因子对组培苗FV/Fm作用大小为:R>G=B,表明R对组培苗FV/Fm影响最大,G和B影响较小;3种处理因子对FV/F0作用大小为R>B>G,说明R对组培苗FV/F0值影响最大,B次之,G影响最小。根据极值分析可知,提高组培苗FV/Fm以及FV/F0值的优化光照组合为R2G3B2,对应处理因子水平为:60 μmol/(m2·s)R+50 μmol/(m2·s)G+40 μmol/(m2·s)B。
3 讨论与结论
植物光合作用是将光能转化为化学能,而植物的光形态建成反应主要是包括红光反应和蓝光反应[26]。红光反应是指植物通过以吸收红光及远红光为主的光敏色素参与光形态建成的过程;而蓝光反应是指植物感受外界光质和光方向,并将信号转导成为植物代谢及遗传的过程,继而使植物改变其生长以适应外界环境的变化[27-31]。叶绿素是参与植物光合作用的重要物质,可以吸收自然光中的可见波段用于光合作用。不同叶绿素种类所吸收的光谱也有所差异,叶绿素a最大的吸收光波长集中于420~663 nm,叶绿素b则集中在460~645 nm,因此植物体内叶绿素含量及其荧光参数值大小直接关系到植株的光合作用能力[15,25]。
本研究初步探明了不同光质光强对杉木组培苗叶绿素含量及荧光参数的作用效果。与荧光灯相比,单色LED光照试验仅有30 μmol/(m2·s)蓝光处理的叶绿素含量值明显高于对照,表明低强度蓝光有利于杉木组培苗叶绿素含量积累,红光和绿光则有抑制作用,这与部分研究结果类似。赵娟等[32]发现利用蓝膜覆盖后烟草幼苗叶绿素含量值最高,蓝光与白光处理相比可以显著提高豌豆苗叶片中叶绿素a、b含量[33];陈祥伟等[20]对小白菜进行研究,结果认为蓝光处理下叶绿素含量最高;刘敏玲等[13]和周锦业等[15]研究发现,蓝光有利于金线莲组培苗叶绿素积累;但是陈祥伟等[18]和余阳等[19]对乌塌菜和葡萄进行研究后却认为,红光有利于提高叶绿素含量。绿光处理对植物生长影响较小,主要由于植物对绿光波谱的吸收量较小,叶秀妹等[34]指出绿光照射的六棱景天组培苗生长状况最差,马绍英等[35]指出绿光照射下葡萄组培苗光合作用速率为负值。
杉木组培苗叶片的PSⅡ最大光能转换效率和PSⅡ潜在活性可以反映出其潜在光合作用能力,不同单色光处理下FV/Fm值变化较小,而FV/F0值间有一定差异。红光处理下FV/F0值随着光强增加而增大,表明低强度红光照射的植株PSⅡ最大光能转换率偏低;绿光处理的FV/F0值变化幅度较小,表明绿光光强变化不会对植株PSⅡ最大光能转换效率造成影响;蓝光处理下FV/F0值随着光强的增加先减后增,说明中等强度蓝光照射的杉木PSⅡ最大光能转换效率较低,70 μmol/(m2·s)的蓝光能够提高杉木叶片FV/Fm和FV/F0值。柯学等[36]研究也发现,蓝膜覆盖的烟草叶片叶绿素a/b、净光合速率、FV/Fm、PSⅡ实际光化学量子效率(ΦPSⅡ)均较高。
不同复色光照处理下的杉木组培苗生长状况均良好,可以满足杉木组培苗光合作用需求,和单色光照相比,其叶绿素含量和荧光参数与对照的差异值均减小。不同光色对杉木组培苗叶绿素a、叶绿素总量以及FV/F0值作用大小均为:R>B>G,表明红光对其影响最大,其次为蓝光,绿光影响最小;光质对叶绿素b含量和FV/Fm值作用大小均为:R>G=B。提高杉木组培苗叶绿素含量的最优光色光强组合为:70 μmol/(m2·s)R+60 μmol/(m2·s)G+30 μmol/(m2·s)B;提高FV/Fm和FV/F0值的最优光色光强组合为60 μmol/(m2·s)R+50 μmol/(m2·s)G+40 μmol/(m2·s)B。陈祥伟等[18]也指出,红 ∶ 蓝光=7 ∶ 1为增加乌塌菜叶片光合色素的最优组合;红蓝黄绿紫复合光对牡丹叶片色素积累最有利[6];红蓝光比例为4 ∶ 1时黄瓜叶绿素含量最高[21];红蓝白复合光有利于大花蕙兰组培苗叶绿素合成[8];铁皮石斛试管苗的叶绿素a、叶绿素b和叶绿素总量在50%R+50%B处理下均达到最大值[14]。
参考文献
[1] 欧阳磊, 郑仁华, 翁玉榛, 等. 杉木优良无性系组培快繁技术体系的建立[J]. 南京林业大学学报(自然科学版), 2007, 31(3): 47-51.
[2] 庞 丽, 林思祖, 曹光球, 等. 杉木优良无性系组培苗诱导根的研究[J]. 江西农业大学学报, 2008, 30(2): 283-286.
[3] 王 蒂. 植物组织培养[M]. 北京: 中国农业出版社, 2004:46-50.
[4] Casal J J. Light quality effects on the appearance of tillers of different order in wheat(Triticum aestivum)[J]. Annals of Applied Biology, 2008, 112(1): 167-173.
[5] 周锦业, 丁国昌, 汪 婷, 等. LED光源在种苗繁育中的应用现状及前景分析[J]. 江西农业大学学报, 2013, 35(2): 370-374.
[6] 郭丽丽, 刘改秀, 郭 琪, 等. LED复合光质对洛阳红形态和生理特性的影响[J]. 核农学报, 2015, 29(5): 995-1 000.
[7] 陈星星, 徐明辉, 何松林. 新型光源发光二极管(LED)下白掌组培苗移栽后生长状况研究[J]. 中国农学通报, 2014, 30(19): 196-200.
[8] 郭 莹, 李海燕, 阮氏月, 等. LED不同光质对大花蕙兰‘爱神×虎雪兰‘霞光杂交组培苗叶绿素含量的影响[J]. 北方园艺, 2015(18): 77-80.
[9] Heo J W, Lee C W. Influence of mixed LED radiation on the growth of annual plants[J]. Journal of Plant Biology, 2006, 49(4): 285-290.
[10] Zhou Y, Singh B R. Red light stimulates flowering and anthocyanin biosynthesis in American cranberry[J]. Plant Growth Regulation, 2002, 38(2): 165-171.
[11] Nhut D T, Takamura T, Watanabe H. Artificial lighting source using lighting-emitting diode(LED)in the efficient micro propagation of Spathiphyllum plantlets[J]. Acta Horticulture, 2005, 23(1): 123-128.
[12] Heo J, Lee C. Growth responses of marigold and salvia bedding plants as affected by monochromic or mixture radiation provided by a lighting-emitting diode(LED)[J]. Plant Growth Regul, 2002, 38(1): 225-230.
[13] 刘敏玲, 苏明华, 潘东明, 等. 不同LED光质对金线莲生长的影响[J]. 亚热带植物科学, 2013, 42(1): 46-48.
[14] 尚文倩, 王 政, 侯甲男, 等. 不同红蓝光质比LED光源对铁皮石斛试管苗生长的影响[J]. 西北农林科技大学学报(自然科学版), 2013, 41(5): 155-159.
[15] 周锦业, 丁国昌, 何荆洲, 等. 不同光质对金线莲组培苗叶绿素含量及叶绿素荧光参数的影响[J]. 农学学报, 2015, 5(5): 67-72.
[16] 吴根良, 郑积荣, 李许可. 不同LED光源对设施越冬辣椒果实品质和产量的影响[J]. 浙江农林大学学报, 2014, 31(2): 246-253.
[17] 苏娜娜, 邬 奇, 崔 瑾. LED单色光质对黄瓜幼苗叶片和下胚轴中内源激素含量的影响[J]. 应用与环境生物学报, 2014, 20(1): 45-49.
[18] 陈祥伟, 刘世琦, 王 越, 等. 不同LED光源对乌塌菜生长、光合特性及营养品质的影响[J]. 应用生态学报, 2014, 25(7): 1 955-1 962.
[19] 余 阳, 刘 帅, 李春霞, 等. LED光质对‘夏黑葡萄光合特性和生理指标的影响[J]. 果树学报,2015,32(5):879-884.
[20] 陈祥伟, 刘世琦, 刘 庆, 等. 不同LED光源对小白菜生长及光合特性的影响[J]. 北方园艺, 2013(22): 1-4.
[21] 徐文栋, 刘晓英, 焦学磊, 等. 不同红蓝配比的LED光调控黄瓜幼苗的生长[J]. 植物生理学报, 2015, 51(8): 1 273-1 279.
[22] Wu M C, Hou C Y, Jiang C M, et al. A novel approach of LED light radiation improves the antioxidant activity of pea seedlings[J]. Food Chemistry, 2007, 101(4): 1 753-1 758.
[23] 杨 梅, 曹光球, 黄燕华, 等. 邻羟基苯甲酸对不同化感型杉木无性系内源激素含量的化感效应[J]. 中国生态农业学报, 2011, 19(1): 124-129.
[24] 杨敏文. 快速测定植物叶片叶绿素含量方法的探讨[J]. 光谱实验室, 2002, 19(4): 478-481.
[25] 周锦业, 官国栋, 林 宇, 等. 东南沿海不同相思树种叶绿素荧光特性的季相变化[J]. 西南林业大学学报, 2014, 34(1): 21-26.
[26] (美)泰兹, (美)奇格尔著. 宋纯鹏, 王学路译. 植物生理学(第四版)[M]. 北京: 科学出版社, 2009: 367.
[27] Allen J F. A redox switch hypothesis for the origin of two light reactions in photosynthesis[J]. FEBS Letters, 2005, 579: 963-967.
[28] Kuhlbrandt W, Wang D, Fujiyoshi Y. Atomic model of plant light-harvesting complex by electron crystallography[J]. Nature, 1994, 367: 614-621.
[29] Aukerman M J, Hirschfeld M, Wester L, et al. A deletion in the PHYD gene of the Arabidopsis Wassilewskija ecotype defines a role for phytochrome D in red/far-red light sensing[J]. Plant Cell, 1997, 9(8): 1 316-1 325.
[30] Kinoshita T, Emi T. Blue-light and phosphorylation-dependent binding of a 14-3-3 protein to phototropins in stomatal guard cells of broad bean[J]. Plant Physiol, 2003, 133: 1 452-1 463.
[31] Lin C. Plant blue-light receptors[J]. Trends Plant Sci, 2000, 5: 337-342.
[32] 赵 娟, 柯 学 , 徐超华, 等. 不同光质对烟草叶片中类半胱氨酸蛋白酶基因表达和活性的影响(英文)[J]. Agricultural Science & Technology, 2012, 13(2): 276-279.
[33] 刘文科, 杨其长, 邱志平, 等. LED光质对豌豆苗生长、光合色素和营养品质的影响[J]. 中国农业气象, 2012, 33(4): 500-504.
[34] 叶秀妹, 肖世明, 杨露云, 等. 六棱景天组织培养与快速繁殖研究[J]. 热带作物学报, 2012, 33(9): 1 663-1 669.
[35] 马绍英, 李 胜, 牛俊义, 等. LED不同光质对葡萄砧木试管苗生理生化特性的影响[J]. 甘肃农业大学学报, 2010, 45(5): 56-62.
[36] 柯 学, 李军营, 李向阳, 等. 不同光质对烟草叶片生长及光合作用的影响[J]. 植物生理学报, 2011, 47(5): 512-520.

