月季‘卡罗拉’的组培快繁技术
闫海霞 蒋月喜 黄昌艳 邓杰玲 何荆洲新 王晓国
摘 要 以‘卡罗拉月季为试材,研究了不同基本培养基、不同植物生长调节剂种类和浓度对月季组培快繁影响,以期建立月季‘卡罗拉组培快繁技术体系。结果表明:适宜月季‘卡罗拉茎段表面灭菌的最佳组合是75%酒精灭菌30 s结合0.1%升汞处理10 min,污染率为0,芽诱导率为100.00%。在组织培养过程中,以WPM为基本培养基有利于各阶段的培养,最适宜增殖培养的培养基是WPM+3.00 mg/L 6-BA+0.10 mg/L NAA,增殖系数为4.48,小苗长势好,植株健壮;最适宜的生根培养基为WPM+0.30 mg/L IBA,生根率96.00%,小苗长势好,主根平均长度3~4 cm。
关键词 月季;卡罗拉;组培;木本培养基
中图分类号 S685.12 文献标识码 A
The Tissue Culture and Rapid
Regeneration of Rosa hybrida‘Carola
YAN Haixia, JIANG Yuexi, HUANG Changyan,
DENG Jieling, HE Jingzhou, WANG Xiaoguo, BU Zhaoyang*
Flower Research Institute, Guangxi Academy of Agricultural Sciences, Nanning, Guangxi 530007, China
Abstract The tissue culture technique system of Rosa hybrida‘Carola under different media, different concentration of plant hormone combinations was studied.The results showed that the best sterilization method was 0.1% HgCl2 with 10 minutes and 75% alcohol with 30 second, the contamination was 0 and survival rate was 100.00%. In the process of tissue culture, the woody plant medium as the basic medium is conducive to the cultivation of each stage, the most suitable culture medium for multiplication was WPM+3.00 mg/L 6-BA+0.10 mg/L NAA, the multiplication coefficient was 4.48. The optimum culture medium for rooting culture was 1/2MS+NAA0.20 mg/L, and the rooting rate was 96.00%.
Key words Rosa hybrida;Carola;Ttissue culture; Woody plant medium
doi 10.3969/j.issn.1000-2561.2016.09.014
月季属蔷薇科蔷薇属多年生落叶或常绿灌木,原产我国,现世界各地广泛栽培。月季品种约有3万多个,‘卡罗拉是目前市场上销量最大的切花月季品种之一,其花色纯正、花茎直挺、花期长,抗病性强,适应性广,产量稳定,在众多切花月季品种中,品质极其出众。多数月季品种的种苗繁育主要依靠扦插繁殖,尤其在商品化生产上。但扦插苗繁殖需要大量的插穗,繁殖速度慢、效率低、品种退化较快,且受季节等条件限制难以周年生产。而组织培养繁殖快,能在短期内获得大量的植株,还可保持品种的优良性状,不受季节条件限制,是种苗规模化生产的有效途径。1980年Hasegawa成功在MS培养基上建立了月季试管苗无性系,开辟了月季组培的先河。近年来,月季的组织培养研究越来越多[1-8]。‘卡罗拉的组培快繁研究也有相关报道。俞艳芳等[9]以茎段为外植体成功建立了‘卡罗拉组培快繁体系,芽诱导培养基、增殖培养基、生根培养基分别为:MS+0.80 mg/L6-BA、MS+2.00 mg/L 6-BA+0.20 mg/L NAA、1/2MS+0.30 mg/L IBA。周艳等[10-11]以‘卡罗拉的不同器官为外植体进行研究,结果表明:最适宜的芽诱导培养材料是茎段,芽诱导、继代和生根培养基分别为1/2MS+1.50 mg/L 6-BA+0.50 mg/L NAA、1/2MS+1.00 mg/L 6-BA+0.30 mg/L NAA和1/2MS+0.50 mg/L NAA+0.10 mg/L IBA。瞿素萍[12]研究了5个切花月季品种叶片直接和间接再生2 种途径,发现‘卡罗拉的直接再生能力、愈伤组织诱导率、间接分化率均高于其余4个切花品种。本试验以月季‘卡罗拉的茎段为外植体,研究了灭菌方式、不同培养基以及不同植物生长调剂种类和浓度对增殖培养、生根培养的影响,以期建立该品种的快繁体系,为今后种苗繁殖提供有效途径,为完善月季组培快繁技术以及大规模生产提供科学依据。
1 材料与方法
1.1 材料
月季品种‘卡罗拉。
1.2 方法
1.2.1 外植体表面灭菌 选取带饱满芽、无病虫害的健康枝条,以带1个芽的茎段为外植体,用少量洗衣粉或洗洁精浸泡并不断摇匀,10 min后再用流水冲洗10 min,边洗边用毛刷将茎段表面刷干净。然后转入超净工作台上,将洗净的茎段按表1的组合方式进行灭菌,每使用一种灭菌剂处理后均用无菌水冲洗茎段3次,再接入MS培养基上进行芽诱导培养。每个处理的茎段接种数为20个,每个处理重复3次。每天观察污染以及芽诱导情况,并统计,连续观察10 d。计算公式如下:
污染率/%=污染数/接种数×100;
芽诱导率/%=芽萌发的茎段数/接种数×100。
培养条件:温度(28±2)℃,光照时间每天12 h。下同。
1.2.2 增殖培养 将从茎段上萌发的嫩芽切取下来,接入含有不同植物生长调节剂种类和浓度的培养基上(表2)进行增殖培养基。每个处理接种量为40株,每个处理重复3次。每天观察生长情况,继代周期20 d。并计算增殖系数:增殖系数=新芽数/接种数。
WPM(木本培养基)培养基:配置1 L WPM培养基,称取WPM培养基固体粉末2.14 g,另取硝酸钙0.56 g,加热溶解于1 000 mL蒸馏水中,蔗糖为20 g/L,琼脂3.5~4.0 g/L,pH为5.8~6.0。
1.2.3 生根培养 当增殖出的小苗长至高2.0~3.5 cm时,转接于生根培养基中(表3)。每个处理接种量为25株,每个处理重复3次。每天观察生长情况,并计算生根率:
生根率/%=生根数/接种数×100。
1.3 统计分析
试验数据采用SPSS 19.0 统计软件进行差异显著性测验(Duncans 多重比较)。
2 结果与分析
2.1 外植体表面灭菌
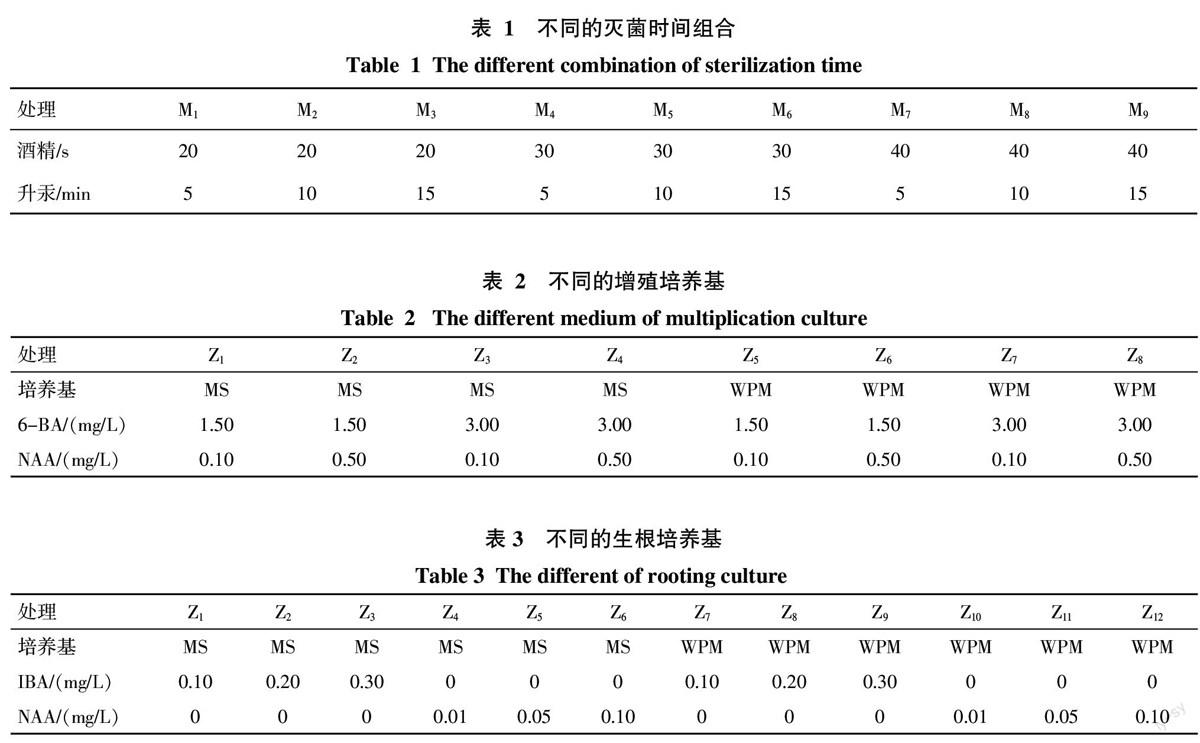
从表4可以看出,M1、M2、M3、M4、M7的污染率存在显著差异,M5、M6、M8、M9的污染率无显著差异,M5、M6、M8、M9的污染率均为0,显著低于M1、M2、M3、M4、M7的污染率。在芽诱导率方面,M5的芽诱导率最高,为100.00%,显著高于其余处理的芽诱导率,M1的芽诱导率最低,为13.33%,与M2差异不显著,两者均显著低于其余处理的芽诱导率。由此表明,月季‘卡罗拉茎段的污染率和成活率因酒精和升汞的灭菌时间不同而有所不同。酒精灭菌时间为20 s时,污染率较高,但随着升汞灭菌时间的增加显著下降,而芽诱导率与污染率呈负相关;酒精灭菌时间为30 s或40 s时,污染率显著下降,直至污染率为0,此时,芽诱导率随着升汞时间的增加呈现出先上升后下降的趋势。由此可见,酒精和升汞的灭菌时间对芽诱导的成活影响很大,时间过短,污染率大,从而导致芽诱导率降低,灭菌时间过长,由于灭菌剂的毒害极大地降低芽诱导率。综上可得,适宜月季‘卡罗拉茎段表面灭菌的最佳组合是75%酒精灭菌30 s结合0.1%升汞处理10 min,污染率为0,芽诱导率为100.00%(图1)。
2.2 增殖培养
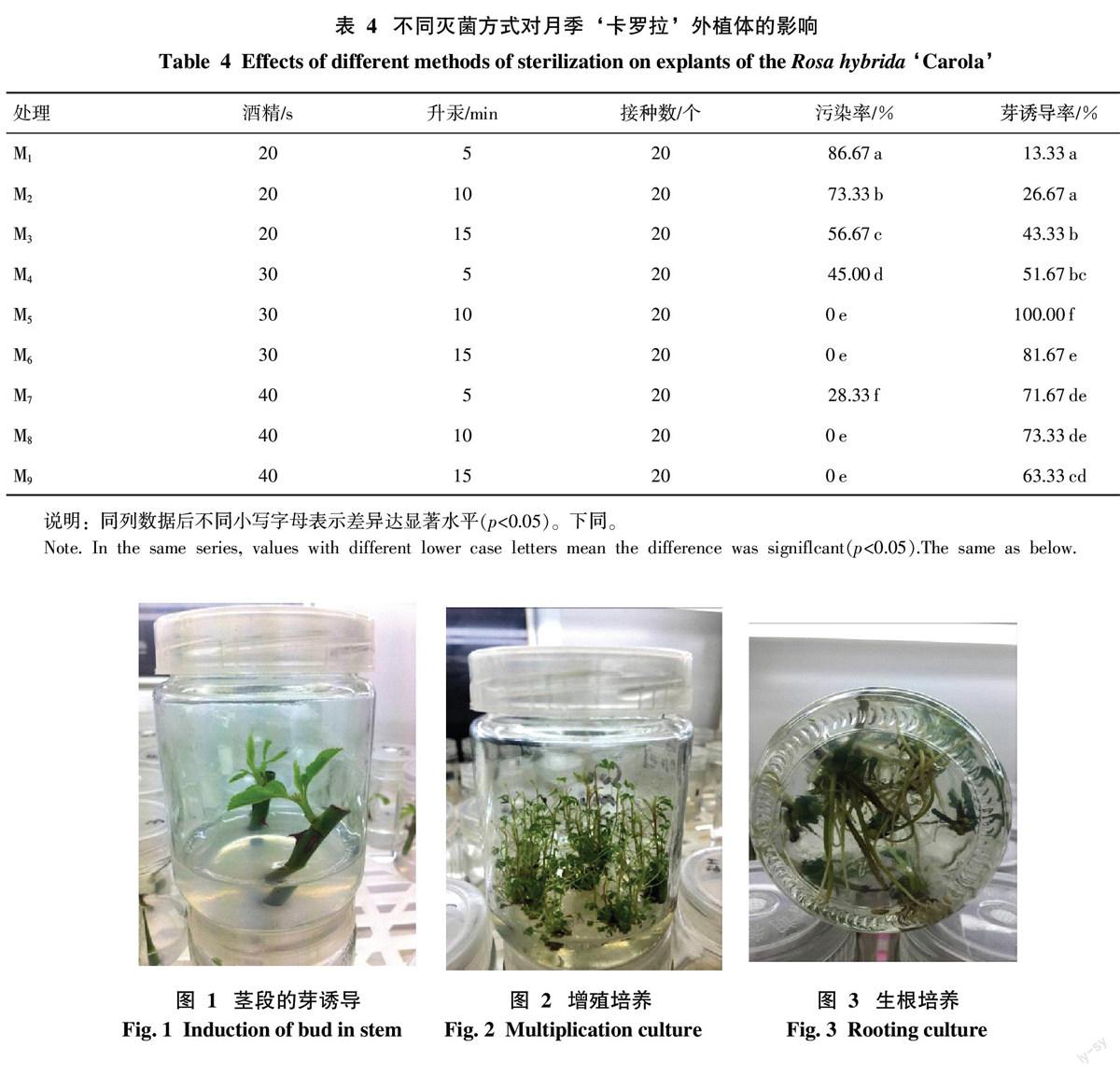
从表5可以看出,新芽数的变化即是增殖系数的变化。Z7的增殖系数与其余7种处理存在显著差异,为4.48,并显著高于其他处理的增殖系数,Z1的增殖系数与其余7种处理存在显著差异,为2.80,并显著低于其他处理的增殖系数。Z3和Z1、Z2、Z4的增殖系数存在显著差异,Z7与Z5、Z6、Z8的增殖系数有显著差异。由此表明,不同的基本培养基对增殖系数的影响不同,以WPM为基本培养基对增殖培养的影响有显著提高的作用。此外,植物生长调节剂的种类和浓度组合对增殖培养也有影响。在相同的基本培养基上,以6-BA的浓度为3.0 mg/L,IBA的浓度为0.1 mg/L时的增殖系数最高,小苗长势好,植株健壮,其中以WPM为基本培养基时的增殖系数达到最大。综上可知,以WPM为基本培养基进行月季‘卡罗拉的增殖培养,其增殖效果高于MS的,最适宜增殖培养的培养基是WPM+3.00 mg/L 6-BA +0.10 mg/L NAA,增殖系数为4.48,小苗长势好,植株健壮(图2)。
2.3 生根培养
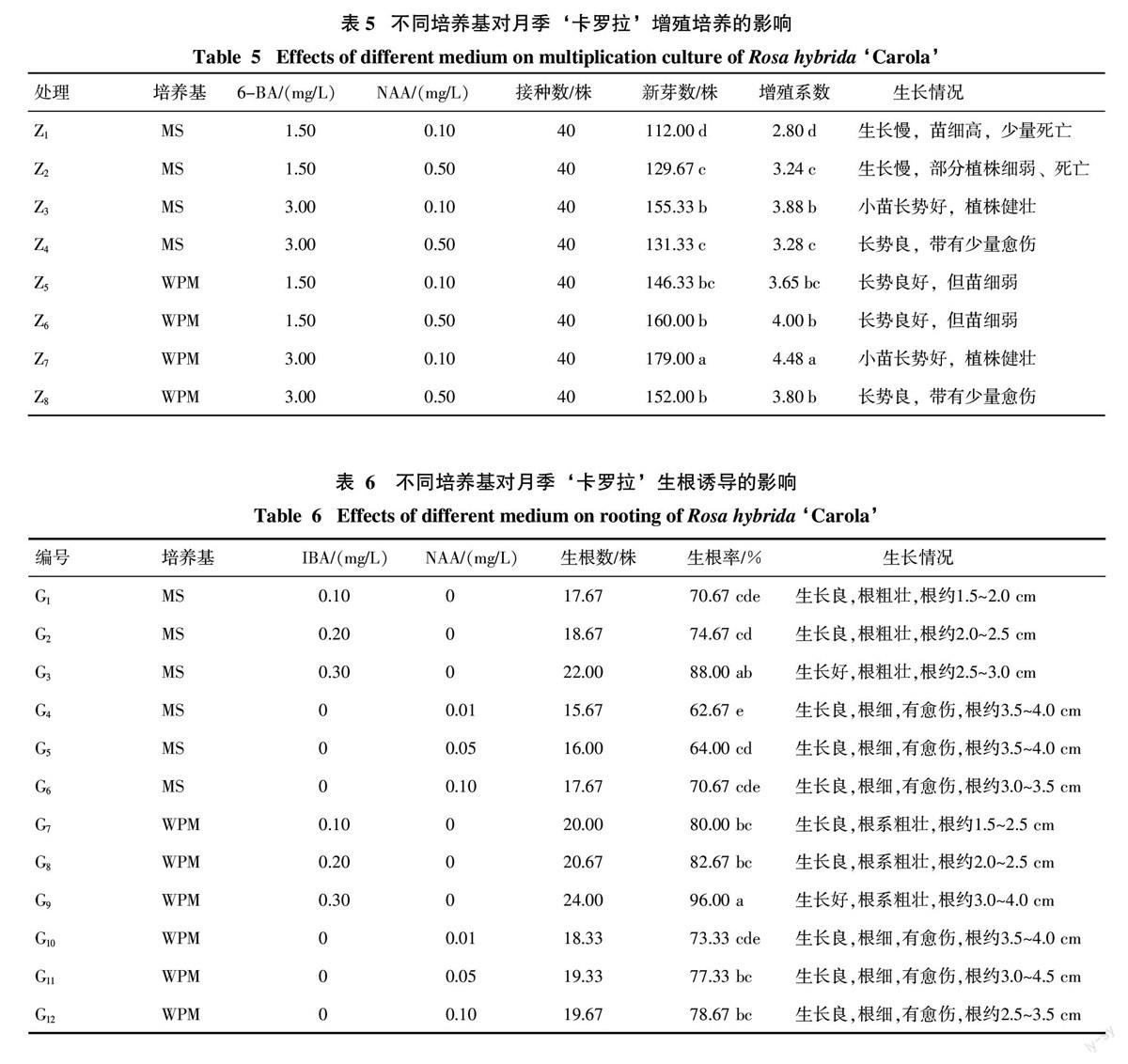
由表6可知,G9的生根率与其余7种处理存在显著差异,为96.00%,并显著高于其他处理的生根率,G4的生根率与其余7种处理存在显著差异,为62.67%,并显著低于其他处理的生根率。G3、G4的生根率存在显著差异,G1、G2、G5、G6之间的生根率无显著差异,G7、G8、G10、G11、G12的生根率无显著差异。由此表明,月季‘卡罗拉的生根诱导受基本培养基、IBA和NAA的浓度影响明显。当以MS为基本培养基时,IBA的浓度为0.30 mg/L时,生根率达最大,为88.00%,植株长势好,根粗壮,根约2.5~3.0 cm;当以WPM为基本培养基时,培养基G9的生根率为最高,植株生长好,根系粗壮,根约3~4 cm。此外,进一步分析可知,随着植物生长调节剂浓度的升高,生根率升高,其中IBA的生根效果较NAA的生根效果好。综上可知,以WPM为基本培养基进行月季‘卡罗拉的生根培养,其生根效果较MS的好,最适宜的生根培养基为WPM+0.30 mg/L IBA,生根率96.00%,小苗长势好,主根平均长度3~4 cm(图3)。
3 讨论与结论
本试验以75%的酒精和0.1%的升汞为消毒药剂,茎段表面灭菌的最佳组合是75%酒精灭菌30 s结合0.1%升汞处理10 min,污染率为0,芽诱导率为100.00%。这和前人的灭菌方法是相同[9-10],但芽诱导率有一定的差异,例如周艳[10]灭菌后的芽诱导率为81.00%。出现这种差异的原因可能是:外植体自身的成熟度,组织培养的环境条件、培养基的组成、取材的季节等引起的。此外,通过本研究得出:外植体的表面灭菌受消毒药剂的灭菌时间影响较大,在相同的酒精灭菌时间下,茎段的污染率随着升汞灭菌时间的增加呈不断下降趋势的结果,而芽诱导率则表现为:在酒精灭菌时间为20 s时,诱导率随着升汞灭菌时间的增加而上升,当酒精灭菌时间为30、40 s时,芽诱导率随着升汞灭菌时间的增加先上升后下降。酒精对植物材料的表面有浸润的作用,75%酒精的穿透力强,其渗透压与细菌的渗透压相近,可渗入菌体内部,从而使细菌的所有蛋白脱水、变性凝固,最终杀死细菌,但同时也很容易杀伤植物细胞,灭菌时间过长会破坏植物的内部组织,导致严重失水而死,影响芽诱导率。升汞的消毒时间过长,会使Hg2+与植物组织内的硫基蛋白结合形成不可逆沉淀,使外植体失去活性而影响成活率。由此可见,灭菌时间过短,灭菌效果不佳,污染率偏高,时间过长,虽然无污染,但是影响了芽诱导率。因此,掌握酒精和升汞的灭菌时间对无菌材料的获得极为重要。
WPM是针对木本植物的培养基,目前关于WPM培养基在月季上的应用不多。WPM与MS的成分区别在于:WPM培养基用K2SO4替换了MS培养基中的KNO3,NH4NO3的用量为MS培养基的1/4,氮盐以CA(NO4)2的形式供应。在本试验的增殖和生根培养研究中,以WPM为基本培养基对增殖系数、生根率均比MS的高。因为MS培养基中盐浓度过高,特别是氮盐含量过高会导致生根不适应,因此需要减少无机盐用量[13],而WPM是作为一种低盐培养基,则有利于植株的生根。WPM有利于月季‘卡罗拉的增殖和生根培养,但在诱导丰花月季叶片的愈伤组织时,MS培养基的诱导率比WPM的高[14],可见,WPM对不同品种、不同培养阶段的影响不同。WPM培养基对防止产生褐化具有较好的效果,李纯佳[15]的研究表明WPM培养基是防止产生褐化的适宜基本培养基,主要原因在于:WPM培养基的无机盐总含量较低,有利于减轻外植体褐变。本试验还发现,在MS培养基上进行培养,少量新切取下来的嫩芽培养一段时间后会出现植株死亡的情况,严重影响了继代增殖的效果,但在WPM的培养基上无此情况出现,具体原因有待进一步进行研究。
适宜的植物生长调节剂种类和浓度配比是月季丛生芽增殖和生根的关键。在月季组织培养中,低浓度的6-BA有利于芽的增殖,高浓度对芽增殖有抑制作用,适宜的NAA浓度有利于芽和叶生长,偏高则会产生大量愈伤组织,不利于侧芽的直接分化和生长。6-BA的有效浓度为0.10~3.00 mg/L,NAA的有效浓度为0.005~0.5 mg/L、也有用到1.0~2.0 mg/L[16],本实验6-BA浓度为3.00 mg/L ,NAA浓度为0.10 mg/L。在生根诱导过程中,随着植物生长调节剂浓度的升高,生根率升高,其中IBA的生根效果较NAA的生根效果好。原因可能是:IBA移动速度慢,是长效化合物; NAA的生理活性虽高,但毒性较IBA高[17]。
综上所述,以月季‘卡罗拉茎段为外植体,最佳表面灭菌的组合是75%酒精灭菌30 s结合0.1%升汞处理10 min,污染率为0,芽诱导率为100.00%。在组织培养过程中,以WPM为基本培养基有利于各阶段的培养,最适宜增殖培养的培养基是WPM+3.00 mg/L 6-BA+0.10 mg/L NAA,增殖系数为4.48,小苗长势好,植株健壮;最适宜的生根培养基为WPM+0.30 mg/L IBA,生根率96.00%,小苗长势好,主根平均长度3~4 cm。
参考文献
[1] 龚维红, 尤伟忠,丁小晏. 3个不同月季品种的组培技术研究[J]. 现代农业科技, 2014(12): 170-171.
[2] 王丰华, 管远清, 徐榕雪, 等. 6-BA浓度对红色大花月季愈伤组织诱导的影响[J]. 山东农业科学, 2014, 46(12): 54-56.
[3] 冯 欢, 易姝利, 谢佳恒,等. 微型月季愈伤组织诱导及植株再生[J]. 植物学报, 2014, 49(5): 595-602.
[4] 张艳秋, 屈连伟, 李生龙, 等. 月季‘红色恋曲组培快繁研究[J]. 辽宁农业科学, 2014(5): 27-29.
[5] 周晓馥, 杨伟新, 丁 雪,等. 月季茎段快繁体系的优化[J]. 北方园艺, 2014(22): 98-102.
[6] 陈 雪, 张金柱, 潘兵兵,等. 月季愈伤组织的诱导及植株再生[J]. 植物学报, 2011, 46(5): 569-574.
[7] 蔺红苹, 吴飞凤. 丰花月季‘美神组织培养研究[J]. 北方园艺, 2010(5): 143-145.
[8] 刘 慧. 微型月季茎段组培快繁技术研究[J]. 北方园艺, 2011(14): 114-116.
[9] 俞艳芳, 管帮富, 毛平生, 等. 月季‘卡罗拉组培快繁研究[J]. 现代园艺, 2012(7): 3-5.
[10] 周 艳,黄承玲,陆 叶,等. 切花月季卡罗拉组培与快繁研究—基本外植体和初代培养基筛选[J]. 种子, 2011, 30(11): 92-94.
[11] 周 艳, 任启飞, 陆 叶,等. 切花月季的快速繁殖技术[J]. 贵州农业科学, 2012, 40(10): 18-21.
[12] 瞿素萍, 王继华, 唐开学, 等. 5个切花月季品种的叶片离体培养和再生能力的基因型效应[J]. 西南大学学报(自然科学版), 2007, 29(12): 108-112.
[13] Hyndman S E, Hasegawa P M, Bressan R A. Stimulation of root initiation from cultured rose shoots through the use of reduced concentrations of mineral salts[J]. Hortscience, 1982, 17(1): 82-83.
[14] 赵松峰. 不同培养基及糖浓度对丰花月季叶愈伤组织诱导的影响[J]. 北方园艺, 2009(4): 56-58.
[15] 李纯佳, 张 颢, 周宁宁,等. 大花香水月季(Rosa odorata var. gigantea)茎段组织培养的抗褐化研究[J]. 西南农业学报, 2012, 25(3): 1 047-1 050.
[16] 张文英,李好琢. 月季组培快繁技术[J]. 农业科技与装备, 2010(6): 106-107.
[17] 闫海霞, 卢家仕, 黄昌艳,等. 萘乙酸和吲哚丁酸对月季扦插成活效果的影响[J]. 南方农业学报, 2013, 44(11): 1 870-1 873.

