广西甘蔗鞭黑粉菌遗传多样性分析
林珊宇 贤小勇 颜梅新 朱桂宁


摘要:【目的】分析广西甘蔗主产区甘蔗鞭黑粉菌遗传多样性水平,为研究病菌毒力变化及甘蔗病害综合治理提供新思路。【方法】从广西各甘蔗主要产区采集甘蔗鞭黑粉菌样品,提取其中70份单倍体菌株基因组DNA,使用优化的随机扩增多态性DNA标记(RAPD)反应体系和经筛选获得的RAPD引物进行PCR扩增,电泳谱带使用NTSYS 2.1进行聚类分析,并构建系统发育进化树。【结果】使用筛选出的10个RAPD引物进行扩增,获得77条条带,每个引物扩增得到的条带数为4~11条,大小为150~3000 bp,包含6个多态性位点,群体多态位点百分率为7.79%。70个甘蔗鞭黑粉菌的相似系数为0.96~1.00,在0.96的遗传系数上菌株可分为两大类,其中类群1聚集了来自横县校椅镇的两个菌株,其余68个菌株分布在类群Ⅱ中。【结论】广西甘蔗鞭黑粉菌遗传分化度较低,片段多态性和菌株地理来源、寄主和交配型无显著相关性。
关键词: 甘蔗鞭黑粉菌;RAPD;遗传多样性;广西
中图分类号: S432.1 文献标志码:A 文章编号:2095-1191(2016)09-1506-06
Abstract:【Objective】Genetic diversity of Sporisorium scitamineam from main sugarcane growing area of Guangxi was studied, in order to provide new ideas for comprehensive control of sugarcane smut. 【Method】S. scitamineam was collected from main sugarcane growing areas of Guangxi, and genomic DNA were extracted from 70 haploid strains. Optimized random amplified polymorphic DNA(RAPD) reaction system and 10 RAPD primers screened deliberately were used to detect polymorphism of S. scitamineam by PCR amplification. Then, according to electrophoretogram, Cluster analysis was conducted to construct phylogenic tree with NTSYS2.1 software. 【Result】The results showed that, 10 RAPD primer pair could amplify 4-11 bands each, with a total of 77 bands, each band ranged from 150 to 3000 bp in length, but only 6 polymorphic sites were detected, which accounted for a polymorphic ratio of 7.79% in population. The genetic similarity coefficient of 70 S. scitamineam strains ranged from 0.96 to 1.00, and those strains were clustered into 2 clusters at genetic similarity level of 0.96, the first cluster was comprised of 2 strains collected from Xiaoyi town of Hengxian county, while the remaining 68 stains were clustered into the second cluster. 【Conclusion】S. scitamineam is at low level of genetic differentiation in Guangxi. Polymorphism of S. scitamineam had no significant correlation with its geographical origin, hosts and mating types.
Key words: Sporisorium scitamineam; RAPD; genetic diversity; Guangxi
0 引言
【研究意义】甘蔗是我国主要的糖料作物,广西是我国甘蔗主要产区。担子菌门甘蔗鞭黑粉菌能引起甘蔗鞭黑穗病,病原菌侵染甘蔗生长点后,病株抽出覆盖黑色粉状厚垣孢子的黑穗,不仅造成甘蔗产量损失,还使蔗糖糖分降低,影响品质。1877年该病害在南非纳塔尔首次被发现,经过数十年传入中国后逐步蔓延,特别是近20年来由于蔗区布局调整,甘蔗种植以旱地为主,品种选育重高产轻抗病,导致甘蔗鞭黑穗病由次要病害上升为主要病害,在我国各蔗区频繁发生,华南的广东、广西、福建已成为该病的常发区(沈万宽,2004;王伯辉,2007)。据韦昌联(2012)报道,广西甘蔗主栽品种新台糖22號的甘蔗鞭黑穗病平均发病率为18%,宿根蔗高达50%,甘蔗鞭黑穗病发生日趋严重。生产实际中,选育和引进抗鞭黑穗病新品种是控制该病的有效措施,但目前选育推广的高产高糖甘蔗品种多数不抗鞭黑穗病,也有些从国外引进的抗病品种经抗性鉴定但结果与预期相反(沈万宽等,2014a,2014b),原因可能是有些病原菌基因型能够与特定寄主基因型相互作用导致寄主抗性在短时间内丧失(Brown,1995)。因此,从遗传机制水平研究植物致病病原菌群体遗传变异对抗性育种具有重要意义。【前人研究进展】近年来分子技术发展迅速,并在真菌群体结构及物种间亲缘关系方面得到应用,甘蔗鞭黑粉菌种属的划分也从DNA层面得到探讨。Piepenbring等(2002)对黑粉菌属(Ustilago)的其中3个种——玉米黑粉菌(Ustilago maydis)、甘蔗鞭黑粉菌(Ustilago scitaminea Syd.)和茭白黑粉菌(Ustilago esculenta)的孢子堆特征、冬孢子壁超微结构及rDNA等系统发育因素进行研究,结果发现甘蔗鞭黑粉菌无论在形态上还是在rDNA的同源性上均与Sporisorium属有较高的相似性,因而将其学名更改为Sporisorium scitamineum。甘蔗鞭黑粉菌生理小种的分化也被多个甘蔗种植国或地区报道(Gillaspie et al.,1983;Lee et al.,1999;Grisham,2001)。2001年由美国、印度、澳大利亚、巴西和中国台湾联合采用11个甘蔗品种作为鉴别寄主对10个国家的甘蔗鞭黑粉菌进行小种普查,结果显示仅我国台湾有3个生理小种,其余均为2个生理小种(Hsieh and Lee,1978)。目前,研究病原菌种内不同来源群体遗传多样性常用的方法为随机扩增多态性DNA标记(Random amplified polymorphic DNA,RAPD)分析技术,该技术可将病原菌种群的遗传变异进行描述和量化,且具有高效、稳定的优点(Baysal et al.,2010;Gupta et al.,2010)。国内外有关学者应用RAPD和其他相关手段研究了甘蔗鞭黑粉菌遗传多样性特征,但是得到的结论尚不统一。国外有些学者认为甘蔗鞭黑粉菌亲缘关系较紧密(Singh et al.,2005);陈健文等(2012)利用SSR标记分析了30个来自广东省甘蔗主产区的甘蔗黑穗病菌菌株的遗传多样性,结果表明广东蔗区甘蔗鞭黑粉菌分子遗传多样性属中等水平;Xu等(2004)和Shen等(2012)则认为华南地区甘蔗鞭黑粉菌的遗传变异相对丰富,但不存在地理来源和寄主来源共分化现象。【本研究切入点】目前,我国甘蔗鞭黑粉菌遗传分化的相关资料较少,尤其是使用RAPD标记对广西菌株遗传多样性的研究尚无文献报道。【拟解决的关键问题】采用RAPD标记分析广西甘蔗主产区甘蔗鞭黑粉菌遗传多样性水平,了解广西甘蔗鞭黑粉菌病原群体的变异情况,为研究病菌毒力变化及甘蔗病害综合治理提供新思路。
1 材料与方法
1. 1 供试菌株
供试菌株为从广西各甘蔗主要种植地采集甘蔗鞭黑穗病标样分离所得的单倍体菌株,每个标样1对,并分别与已知交配型的标准菌株JG35(“-”交配型)和JG36(“+”交配型)进行配合后确定其交配型。采集地包括南宁、武宣、宜州、隆安、扶绥、贵港、龙州、横县和柳州等9个市(县)(表1)。参照陈建文等(2012)的方法,经分离获得70个(35对)鞭黑粉菌单孢菌株。
1. 2 试验方法
1. 2. 1 菌株基因组DNA提取 参照沈万宽等(2006)的方法,并稍作改进。挑取不同交配型菌株单菌落于28 ℃下200 r/min扩大培养1~2 d,取菌液2.0 mL,于6000 r/min离心5 min,弃上清液,用液氮充分研磨后置于2.0 mL EP管中,加入900 μL含2% CTAB抽提缓冲液,65 ℃水浴1~2 h,期间不时摇匀,加入900 μL酚/氯仿(1∶1)剧烈振荡30 s,12000 r/min离心10 min,取上清液置于新的2.0 mL离心管中,加入等体积氯仿缓慢颠倒混匀,12000 r/min离心10 min,取上清液置于新的1.5 mL离心管中,加入1/10体积5 mol/L NaCl和等体积冷异丙醇,混匀后置-20 ℃冰箱中20~30 min,4 ℃下12000 r/min离心10 min,弃上清液,沉淀分别用冷70%乙醇和冷无水乙醇各洗1次,室温下风干,溶于双蒸水中,用紫外分光光度计在260和280 nm下测定OD,检测DNA的质量和浓度,并稀释至30 ng/μL,-20 ℃保存备用。
1. 2. 2 RAPD反应体系 经过优化,RAPD-PCR反应体系为20.00 μL,其中包括:10×PCR Buffer 2.00 μL,25 mmol/L MgCl2 1.32 μL,2.5 mmol/L dNTP 1.20 μL,0.1 mmol/L引物0.50 μL,5 U Taq酶0.60 μL,30 ng/μL模板DNA 1.00 μL,ddH2O 13.38 μL。扩增程序:94 ℃预变性5 min;94 ℃ 1 min,37 ℃ 0.5 min,72 ℃ 1.5 min,进行40个循环;72 ℃延伸7 min。反应结束后取5.00 μL扩增产物于1.8%琼脂糖凝胶中电泳60 min(90 V),在凝胶成像系统上检测并拍摄保存。
1. 2. 3 遗传多样性分析 从80条RAPD引物中筛选出若干条扩增条带清晰、稳定性高的引物用于样本扩增。对电泳谱带进行记录,在相应位点处有条带的记为“1”,无条带的记为“0”,将0/1矩阵输入计算机。使用NTSYS 2.1对结果进行分析,建立系统发育进化树。
2 结果与分析
2. 1 引物筛选及随机扩增产物分析结果
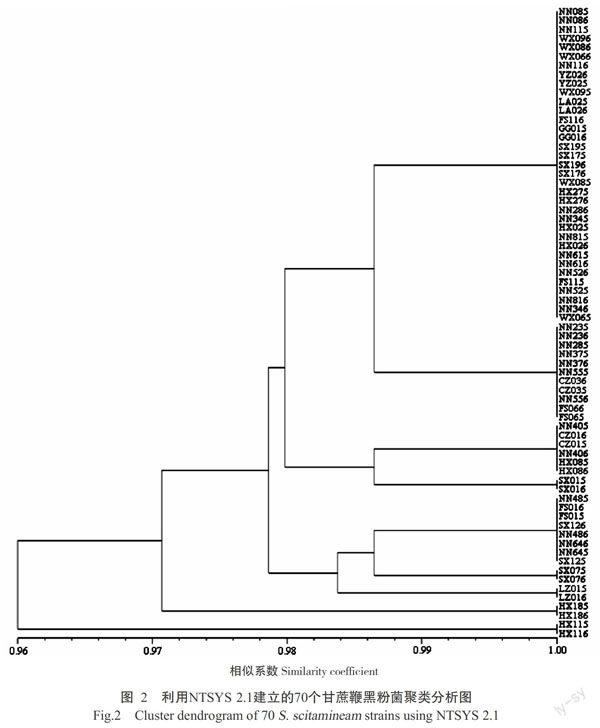
从80条RAPD随机引物中筛选得到10条稳定性高、谱带清晰的引物对70个单倍体菌株的基因组进行PCR扩增,供试引物共扩增出77条谱带,不同引物扩增产物谱带数为4~11条,条带大小为150~3000 bp(图1)。扩增图谱具有一定多态性的引物有5个,分别为S17、S39、S130、S143和S172,产生多态性位点6个,即群体多态位点百分率为7.79%,多态性比例偏低,说明供试菌株表现出一定的遗传变异,但遗传差异不明显。对扩增出的77条谱带进行统计和分析,得到供试菌株的聚类树状图(图2),从图2可看出70个甘蔗鞭黑粉菌的相似系数在0.96~1.00。在0.96的遗传系数处,70个菌株可分为两大类,横县校椅镇的两个菌株HX115和HX116经引物S39、S143和S172扩增的产物缺失3条主带,构成类群Ⅰ,其余68个来自南宁、武宣、宜州、隆安、扶绥、贵港、横县、龙州和柳州的菌株聚集在类群Ⅱ。在约0.971的遗传系数上,类群Ⅱ中的68个菌株又可分为两个亚类,一个亚类只包含来自横县良圻的两个菌株HX185和HX186,另一个亚类包含由其余66个菌株构成的若干生理小类。聚类分析结果表明,3对来自横县的菌株分布在不同的大类和亚类中,暗示它们具有相对丰富的遗传多态性。此外,只有一对菌株NN285和NN286扩增出的条带不一致而被分为不同的类群,其他成对的菌株扩增获得的谱带均分别相同。
2. 2 “+”、“-”担孢子遗传差异分析结果
为研究甘蔗鞭黑粉菌“+”、“-”交配型单倍体担孢子遺传差异,对异型的担孢子进行分子标记,使用80条RAPD随机引物对1对标准菌株JG35(“-”交配型)和JG36(“+”交配型)的担孢子基因组DNA进行扩增,每条RAPD引物能扩增出1~12条谱带,片段大小为150~3000 bp,获得了大量DNA指纹图谱。结果显示所使用的80条RAPD随机引物对JG35和JG36的基因组DNA扩增得到的指纹图谱一致,谱型无差异。
3 讨论
RAPD标记技术是以RAPD引物对供试菌株基因组进行PCR扩增,根据DNA条带的位置相似程度进行聚类,将菌株划分成不同的遗传群体,以此对真菌群体的遗传多样性进行描述。该技术是以种群核苷酸序列变异为基础的遗传标记,是DNA水平遗传多态性的直接反应,不受目标性状表达的影响,是一种十分有效和可靠的亲缘关系鉴定方法(Williams et al.,1990)。
本研究使用80条RAPD引物对1对标准甘蔗鞭黑粉菌单倍体JG35和JG36基因组DNA进行扩增,扩增产物电泳得到条带数为1~12条,条带大小为150~3000 bp,表明指纹标记数量较丰富,序列大小与Shen等(2012)使用RAPD标记中国西南甘蔗鞭黑粉菌结果一致,但电泳条带数略有上升,可能是选择的材料和RAPD引物不同所致。
在引物筛选过程中发现80条RAPD随机引物对JG35和JG36的基因组DNA扩增得到的指纹图谱一致,谱型无差异,35对菌株经过10条筛选出的RAPD引物扩增,只有1对菌株的“-”交配型(NN285)比“+”交配型(NN286)少扩增出1个位点,其他34对菌株间具有相同的DNA指纹图谱,说明NN285和NN286两型担孢子的序列差异是由偶然的变异引起;也表明仅靠覆盖范围有限的RAPD分子标记来区分“+”、“-”交配型会显得力度不够,未能达到鉴别异种交配型菌株的目的。RAPD标记技术还常用于区分和标记病原菌中的不同生理小种,虽然对于甘蔗鞭黑粉菌具有不同生理小种已有报道(许莉萍和陈如凯,2000),但广西甘蔗鞭黑粉菌小种类型多数为小种1,虽然也可能存在小种2,但极为有限。本实验室对小种2的采集和鉴定工作仍未完成,因此尚无法断言RAPD谱带的差异是因不同小种引起。
综合分析10个引物对广西不同蔗区甘蔗鞭黑粉菌的扩增图谱,进一步研究菌株间的相似性系数,全部菌株的相似性系数为0.96~1.00,反映了甘蔗鞭黑粉菌菌株间的遗传多样性较低的特点。聚类分析结果显示,来源于同一甘蔗品种或地点的甘蔗鞭黑粉菌并未完全聚在同一类群中,说明寄主和地理的变化对甘蔗鞭黑粉菌进化影响较小。此结论与部分学者的研究结果契合:Braithwaite等(2004)、Singh等(2005)、Raboin等(2007)分别应用AFLP、RAPD和SSR技术对采自不同大洲和国家甘蔗种植区及美国、毛里求斯、南非同一蔗区时隔16年采集的甘蔗鞭黑粉菌株进行分析,结果表明,全部美洲群体和非洲群体株系属于一个单一的谱系,地理和时间的变化与甘蔗鞭黑粉菌的进化具有较低的协同性。部分区域分离到的菌株很少变异,预示甘蔗鞭黑粉菌基因组上很小的变异甚至单个基因的突变就能引起表型变化,经过足够时间形成了广泛适应寄主的表现型。
甘蔗鞭黑穗病自19世纪在南非纳塔尔的“中国种”甘蔗品种上首先发现以来,已给除几内亚以外的所有植蔗国或地区带来危害(Presley,1978)。抗病品种的选育是对抗甘蔗鞭黑粉菌的重要策略,甘蔗抗病育种的前瞻性在于研究甘蔗鞭黑穗病菌群体遗传多样性水平,探明中国甘蔗鞭黑穗病菌主要遗传类群和致病力分化类型。本研究供试菌株来自我国甘蔗主产区广西,寄主为广西甘蔗当家品种新台糖22号和近年来推广的其他品系,样本选择具有一定的代表性,研究结果是对我国甘蔗鞭黑粉菌遗传多样性研究的补充和完善。但当前的研究尚需进一步深入,因此今后的思路在于开展甘蔗鞭黑粉菌遗传多样性和小种分化及致病力关系的研究,以期为甘蔗抗鞭黑穗病育种提供科学依据。
4 结论
广西甘蔗鞭黑粉菌遗传分化度较低,RAPD多态性和菌株地理来源、寄主和交配型無显著相关性,该研究结果对广西甘蔗育种和产业布局具有指导意义。
参考文献:
陈健文,冯淑杰,钟玫,刘睿,沈万宽,陈仲华,杨湛端,徐苑娴,邓海华. 2012. 基于SSR标记的广东省甘蔗黑穗病菌遗传多样性研究[J]. 广东农业科学,39(24):154-157.
Chen J W,Feng S J,Zhong M,Liu R,Shen W K,Chen Z H,Yang Z D,Xu Y X,Deng H H. 2012. Genetic diversity analysis of sugarcane smut fungus in Guangdong providence revealed by SSR markers[J]. Guangdong Agricultural Sciences,39(24):154-157.
沈万宽. 2004. 广东蔗区甘蔗病害现状与综合防治措施[J]. 甘蔗糖业,(1):1-5.
Shen W K. 2004. Sugareane disease in Guangdong sugareane regions in recent years and integrated controlling methods[J]. Sugarcane and Canesugar,(1):1-5.
沈万宽,姜子德,杨湛端,刘睿,陈健文,邓海华. 2014a. 甘蔗抗黑穗病的鉴定新方法及其品种抗性评价[J]. 华中农业大学学报,33(2):51-56.
Shen W K,Jiang Z D,Yang Z D,Liu R,Chen J W,Deng H H.2014a. New resistance identification method and resistance evaluation of sugarcane varieties to smut disease[J]. Journal of Huazhong Agricultural University,33(2):51-56.
沈万宽,杨湛端,刘福业. 2014b.甘蔗品种(品系)对黑穗病的抗性鉴定与评价[J]. 华中农业大学学报,33(5):40-44.
Shen W K,Yang Z D,Liu F Y. 2014b. Identification and evaluation of some sugarcane varieties or clones for smut resistance[J]. Journal of Huazhong Agricultural University,33(5):40-44.
沈万宽,周国辉,邓海华,周凌云. 2006. 甘蔗宿根矮化病菌PCR检测及目的片段核苷酸序列分析[J]. 中国农学通报,22(12):413-416.
Shen W K,Zhou G H,Deng H H,Zhou L Y. 2006. Detection of sugarcane ratoon stunting disease pathogen with polymerase chain reaction(PCR) and nucleotide sequence analysis[J]. Chinese Agricultural Science Bulletin,22(12):413-416.
王伯辉. 2007. 我国甘蔗病害的发生现状与研究进展[J]. 中国糖料,(3):48-51.
Wang B H. 2007. The occurrence status and the research progress of sugarcane disease in China[J]. Sugar Crops of China,(3):48-51.
韦昌联. 2012. 广西蔗区新台糖22号种性退化现状分析及对策措施[J]. 南方农业学报,43(12):2113-2117.
Wei C L. 2012. Analysis and countermeasures of the degradation status of sugarcane variety ROC22 in Guangxi[J]. Journal of Southern Agriculture,43(12):2113-2117.
许莉萍,陈如凯. 2000. 甘蔗黑穗病及其抗病育种的现状与展望[J]. 福建农业学报,15(2):26-31.
Xu L P,Chen R K. 2000. Current status and prospects of smut and smut resistance breeding in sugarcane[J]. Fujian Journal of Agricultural Sciences,15(2):26-31.
Baysal ,Siragusa M,Gümrükcü E,Zengin S,Carimi F,Sajeva M,Teixeira da Silva,Jaime A. 2010. Articles molecular characterization of Fusarium oxysporum f. melongenae by ISSR and RAPD markers on eggplant[J]. Biochemical Genetics, 48(5-6):524-537.
Braithwaite K S, Bakkeren G, Croft B J, Brumbley S M. 2004. Genetic variation in a worldwide collection of the sugarcane smut fungus Ustilago scitaminea[J]. Molecular Microbiology,6(16):2339-2348.
Brown J K M. 1995. 5 Pathogens responses to the management of disease resistance genes[J]. Advances in Plant Pathology,11(6):75-102.
Gillaspie A G, Mock R G, Dean J L. 1983. Differentiation of Ustilago scitaminea isolates in greenhouse tests[J]. Plant Di-
sease,67(4):373-375.
Grisham M P. 2001. An international project on genetic variability within sugarcane smut[J]. Sugar Cane Technol.,24(2):459-461.
Gupta V K,Jain P K,Misra A K,Gaur R,Gaur R K. 2010. Comparative molecular analysis of Fusarium solani isolates by RFLP and RAPD[J]. Microbiology,79(6):772-776.
Hsieh W H, Lee C S. 1978. Compatability and pathogenicity of two races of Ustilago scitaminea Syd. in Taiwan[J]. Taiwan Sugar,25:46-48.
Lee C S,Yuan C H,Liang Y G. 1999. Occurrence of a new pathogenic race of culmicolous smut of sugarcane in Taiwan[J]. Proceedings of International Society of Sugar Cane Tec-
hnologists,23:406-407.
Piepenbring M,Stoll M,Oberwimkler F. 2002. The generic position of Ustilago maydis, Ustilago scitaminea, and Ustilago esculenta(Ustilaginales)[J]. Mycological Progress,1(1):71-80.
Presley J. 1978. The culmicolous smut of sugarcane[J]. Sugary Azucar,73(10):34-39.
Raboin L M, Selvi A, Oliveira K M,Paulet F,Calatayud C,Zapater M F,Brottier P,Luzaran R,Garsmeur O,Carlier J,Hont A D. 2007. Evidence for the dispersal of a unique li-
neage from Asia to America and Africa in the sugarcane fungal pathogen Ustilago scitaminea[J]. Fungal Genetics and Biology,44(1):64-76.
Shen W K,Xi P G,Li M H,Liu R,Sun L H,Jiang Z D,Zhang L H. 2012. Genetic diversity of Ustilago scitaminea Syd. in Southern China revealed by combined ISSR and RAPD analysis[J]. African Journal of Biotechnology,11(54):11693-11703.
Singh N,Somai B M,Pillay D. 2005. Molecular profiling demonstrates limited diversity amongst geographically separate strains of Ustilago scitaminea[J]. Fems Microbiology Letters,247(1):7-15.
Williams J G K,Kubelik A R,Livak K J,Rafalsky J A,Tingey S V. 1990. DNA polymorphisms amplified by arbitary primers are useful as genetic markers[J]. Nucleic Acids Research,18(22):6531-6535.
Xu L P,Que Y X,Chen R K. 2004. Genetic diversity of Ustilago scitaminea in mainland China[J]. Sugar Tech,6(4):267-271.
(責任编辑 麻小燕)

