海南岛益智种质资源表型变异及ISSR分析
王祝年 邱燕连 晏小霞 陈永锋 叶才华
摘 要 对海南岛72份益智种质的遗传多样性进行系统评价。利用相关分析、主成分分析探究各表型性状的相互关系,结合表型性状及ISSR标记研究资源的遗传多样性。结果表明:不同益智种质的各种性状均存在变异,所调查的14个性状可归类为营养器官、产量、果实形态等3个部分,各部分平均变异系数表现为CV产量(0.464)>CV营养器官(0.143)>CV果实形态(0.121)。性状相关分析中,91对性状组合中有34对呈极显著相关。主成分分析前7个主成分积累贡献率达到89.29%,前3个贡献率最大的主成分积累贡献率达到64.86%,单果体积因子第一,产量因子第二,单果形态因子第三。经基于表型性状的聚类分析,72份样本可分为9组。利用20条ISSR引物对68份益智种质材料基因组DNA进行研究,共扩增出466条条带,其中446条为多态性带,占总条带的95.71%;当相似系数为0.762时,68份样本被分为6组,其中42.65%的样品被分到第Ⅲ组。依据ISSR标记的聚类与表型性状的表现并不完全一致,这可能是由于DNA结构差异不一定在表型性状上得到相应表现,本研究所调查的表型性状只是益智表型性状的一部分,而ISSR标记所分析的位点则覆盖整个基因组。
关键词 海南岛;益智;表型性状;ISSR;聚类分析
中图分类号 Q949.71+8.33 文献标识码 A
益智(Alpinia oxyphylla Miquel)属姜科山姜属植物,为中国四大南药之一,主产于中国海南,广东、云南、广西、福建亦有少量栽培。益智以干燥成熟果实入药,已有悠久的药用历史,其性温味辛,具有暖肾固精缩尿、温脾止泻摄唾的功能[1]。此外,益智还是极有开发价值的香料植物,已被广泛应用于保健食品和药膳等,属药、香、食同源植物,具有广泛的研究和应用价值,已开发出系列产品。
近年来,学者们陆续对益智进行了相关研究,取得了很大的进展,研究范围包括化学成分[2-4]、药理[5-7]、栽培技术[8]、组织培养[9]、遗传多样性[10-11]、食品开发[12-14]等多方面的内容,但关于益智遗传育种方面的研究尚未见报道。海南岛益智主要为农户自发引种栽培,各地间种质资源交流频繁,遗传变异复杂,遗传背景不明,尚未有专门的机构对其进行深入研究,基于此,本课题以海南岛益智种质资源为材料,结合形态标记和ISSR分析,开展海南岛益智种质资源的遗传多样性研究,旨在为益智的遗传改良和生产应用以及海南岛益智种质资源的保护和合理利用提供科学依据。
表型变异是基因型与环境共同作用的结果,可在一定程度上反映生物遗传变异的程度,是理解物种适应机制的重要方法[15]。ISSR(inter-simple sequence repeats)简单序列重复区间扩增多态性是由Zietkiewicz等[16]于1994年提出的一种以PCR(polymerase chain reactiong,聚合酶链式反应)扩增为基础的分析标记技术,被广泛应用于居群遗传学、品种鉴定、物种分类以及物种的遗传多样性研究中[17-19]。
1 材料与方法
1.1 材料
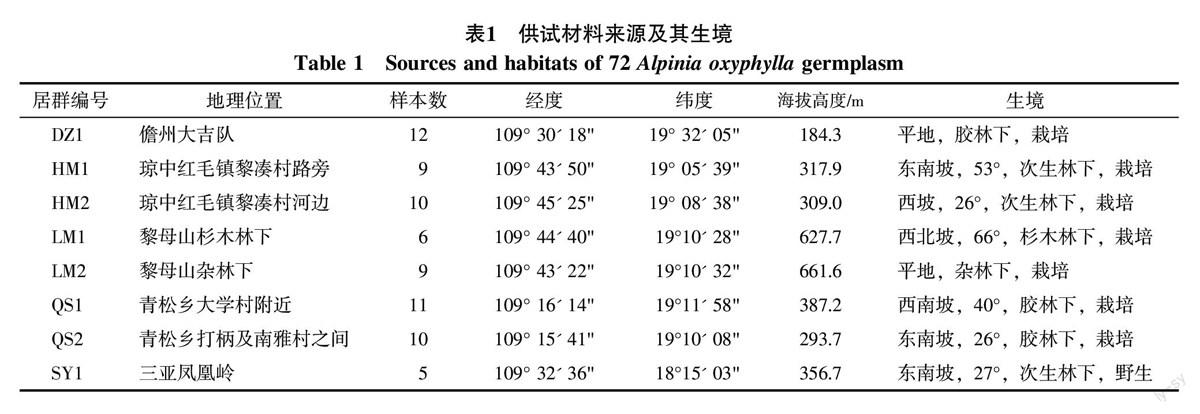
本课题于2014年5~6月对海南岛5个地区8个居群72份益智种质材料性状进行观测。各个采集地的地理位置、经纬度、海拔高度、生境特点和样本数见表1,由于各种原因,部分样品被他人提前收走,未能获得数据,导致各居群样本数不一致。居群中除SY1(三亚凤凰岭居群)为纯野生居群外,其余均为栽培居群。
1.2 方法
1.2.1 表型性状的数据处理 每丛为一份种质材料(或称样品),各表型性状皆以测量该性状的最长(宽)处为准,株高、茎杆直径、果穗重、果序长、座果率等性状每丛测10个重复并取其平均值;每份样品取30粒正常发育的单果,用游标卡尺测量果长、果宽。采集地点的地理因子用手持GPS定位仪记录。
1.2.2 ISSR分析 从上述72份种质材料中,取68份(分子标记材料缺HM2-3、LM1-1、QS1-3、QS2-6)材料;采用改良的CTAB法[20]提取益智嫩叶总DNA,并利用紫外分光光度计(岛津UV-2700)检测DNA的纯度和浓度,用10 g/L琼脂糖凝胶电泳检测DNA质量,最后将每一份样本DNA稀释至50 ng/μL,于-20 ℃保存备用。ISSR引物为哥伦比亚大学(UBC)公布的100条引物序列,由美国生命技术公司广州合成部(life technologies)合成。从确定的反应体系中筛选出20条多态性好及扩增条带清晰的引物用于后续试验。ISSR反应体系为:10×PCR buffer(Mg2+plus)3.0 μL,模板DNA(50 ng/μL) 1.0 μL,引物(100 μmol/L)1.0 μL,dNTPs(2.5 mmol/L)1.5 μL,Taq酶(5 U/μL)0.2 μL,加ddH2O补足至20 μL,总反应体积为20 μL。PCR反应程序为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸2 min,共36个循环;72 ℃延伸10 min,4 ℃保存。PCR扩增反应在德国Biometra公司生产的T1 PCR扩增仪上进行,PCR反应结束后取7 μL PCR产物与1 μL 6×loading Buffer混匀,点入15 g/L琼脂糖凝胶(每100 mL加入5 μL GoldViewTM DNA染料)中,电泳缓冲液为0.5×TBE,电压90 V,电泳约40~50 min;电泳结束后在凝胶成像系统中观察并拍照。
1.3 数据处理
用Excel软件对所获得的表型性状数据进行统计,以变异系数CV(标准差/平均值)作为各形态性状变异的测度;运用SPSS19.0软件对形态数据经标准差标准化后进行系统聚类。以扩增条带在相对迁移位置的有无,记为“1”或“0”,用NTSYS-PC2.1对扩增条带数据进行分析,通过类平均法(UPGMA)对68份种质进行遗传相似性聚类。
2 结果与分析
2.1 表型性状多样性
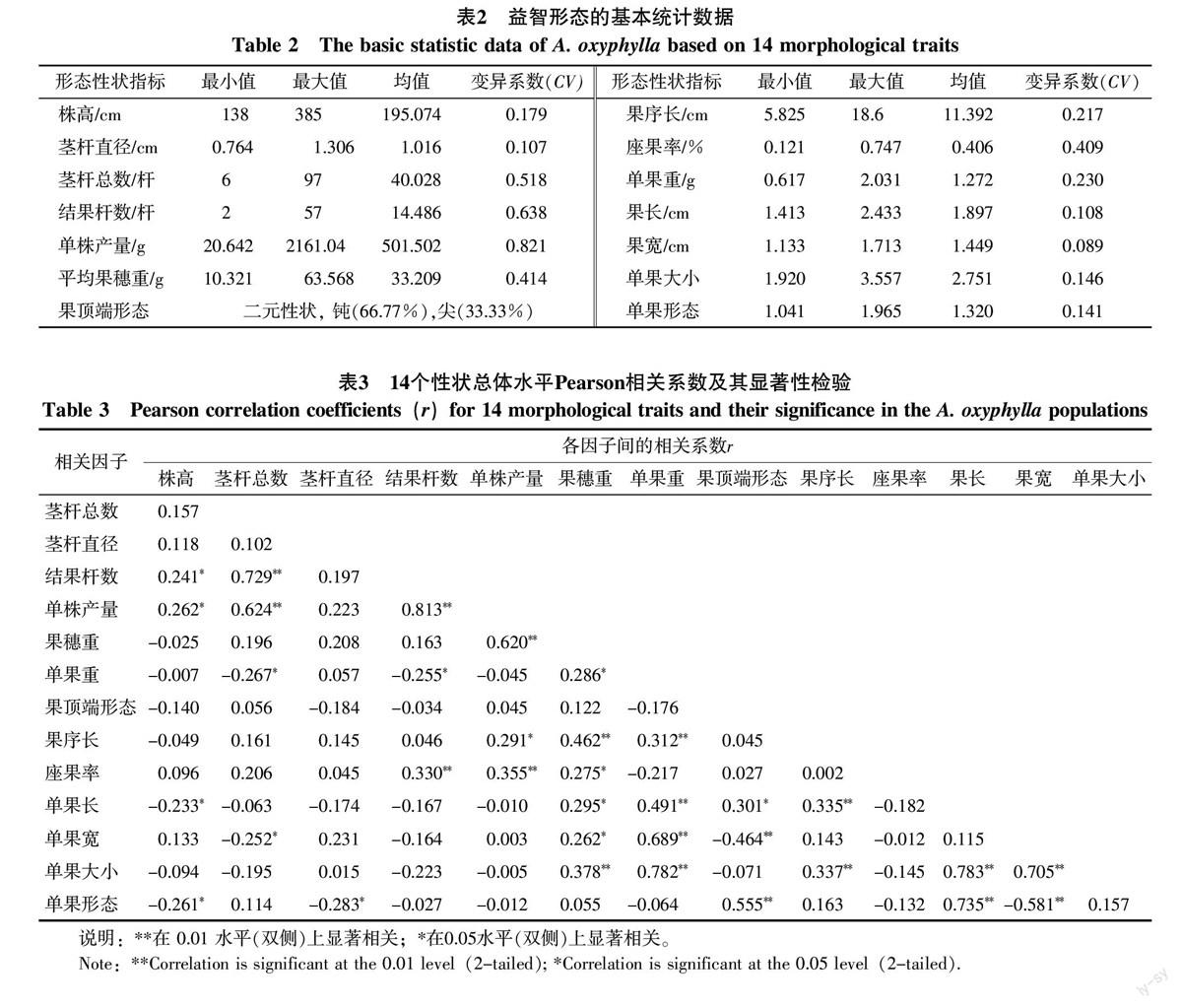
样品形态性状指标的分析结果(表2)表明,72份益智材料的14个性状均存在一定程度的变异,变异系数为0.089~0.821。14个性状可归类为营养器官、产量、果实形态等3个部分。营养器官部分包括株高、茎杆直径2个性状。株高的变异幅度呈中等大小,从138~385 cm不等;茎杆直径变异幅度较株高小。产量部分主要包含茎杆总数、结果杆数、单株产量、果穗重、果序长、座果率、单果重等7个性状。单株产量是所有性状中变异程度最大的,变异系数为0.821,同时受到其余6个性状的影响。果实形态包括果长、果宽、单果大小(果长×果宽)、单果形态(果长/果宽)及果顶端形态等5个性状,在野外调查及观测中,常见到果实有大、中、小及长、圆之分。按大小可粗略将益智果实分为大果、中果、小果,按形态可分为圆果、椭圆果,果顶端形态有钝和尖2种形态。圆果型果实的果长/果宽接近于1,但绝不小于1,果粒之间排列紧密,互相挤压;椭圆果型果实的果长/果宽大于1,果粒之间排列较为疏松,果粒之间不互相挤压;果长/果宽越大,果实越长,排列越疏松。在所调查到的样品中,果长/果宽范围为1.041~1.965,比值小的极近于球形,比值大的果长较果宽长近2倍。由于果顶端形态为质量性状,因此未计算其变异系数,3个部分平均变异系数表现为CV产量(0.464)>CV营养器官(0.143)>CV果实形态(0.121),果实形态的变异较小,说明其指标有一定的遗传稳定性。
2.2 益智表型性状的相关性
72份益智样品14个性状间表现出不同程度的相关性(表3)。91对性状组合中有34对具有显著相关关系。单株产量分别与茎杆总数、结果杆数、果穗重、座果率呈极显著正相关,果穗重分别与果序长、单果大小(果长×果宽)呈极显著正相关,结果杆数分别与茎杆总数、座果率呈极显著正相关,果序长分别与单果重、单果长呈极显著正相关,单果大小分别与单果重、果序长、果长、果宽呈极显著正相关,单果形态(果长/果宽)分别与果顶端形态、果长呈极显著正相关,与果宽呈极显著负相关,果顶端形态与果宽呈极显著负相关。
2.3 主成分分析
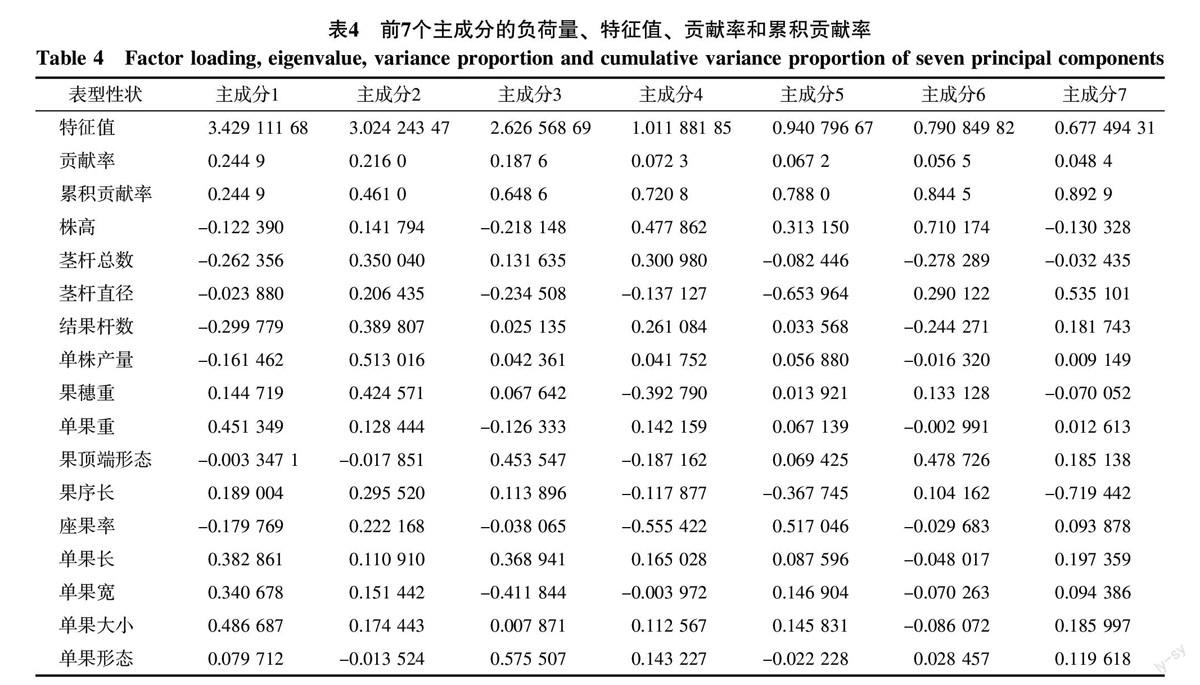
对14个表型性状进行主成分分析的结果(表4)表明,前7个主成分积累贡献率达到89.29%,基本可以包含14个性状所含有的信息。第一主成分贡献率为24.49%,对它影响最大的性状包括单果大小(0.486 687)、单果重(0.451 349)、果长(0.382 861)、果宽(0.340 678),该成分与单果的体积有关,可以称为单果体积因子;第二主成分贡献率为21.60%,对它影响最大的性状包括单株产量(0.513 016)、果穗重(0.424 571)、结果杆数(0.389 807)、茎杆总数(0.350 040)、果序长(0.295 520)、座果率(0.222 168),该成分与产量有关,可以称之为产量因子;第三主成分贡献率为18.76%,对它影响最大的性状包括单果形态(果长/果宽)(0.575 507)、果顶端形态(0.453 547)、单果宽(-0.411 844)、单果长(0.368 941),该成分与形态有关,可以称之为单果形态因子;第四、五、六、七主成分贡献率较小,分别为7.23%、6.72%、5.65%、4.84%,对第四、六主成分影响最大的性状都是株高,对第五主成分影响最大的性状为茎杆直径,株高与茎杆直径都为营养器官,因此可以将第四、五、六3个主成分统称为营养器官因子;对第七主成分影响最大的为果序长,属于产量因子。
2.4 益智种质资源表型性状的聚类分析
用SPSS19.0软件对72个供试材料进行聚类分析,获得基于表型性状的树状图(图1)。在距离值为13时,72个样品被分为9组,其中组Ⅰ与组Ⅱ相近,组Ⅴ、组Ⅵ、组Ⅶ相近,组Ⅷ、组Ⅸ相近,各个采集地的样品分散在各个组里。经分析各组信息后,将单果分为大果、中果、小果,小果单果重为0.60~1.20 g;中果单果重为1.20~1.65 g,大果单果重为1.65~2.10 g;产量分为3个级别,果穗重与单株产量接近总体平均值的设为中等,远低于总体平均值的设为产量较低,远高于总体平均值的设为产量较高。据实际测量及观察的结果可设定,当果长/果宽在1.0~1.2时,果近于圆形;当比值在1.2~1.4时,果略呈椭圆形;当比值在1.4~1.6时,果呈椭圆形;当比值在大于1.6,果呈长椭圆形。各组特点见表5。
2.5 ISSR分析
取68份益智种质材料的分子材料并用20条引物对其进行PCR扩增,部分引物扩增结果见图2,大部分扩增片段大小在200~1 500 bp。20个ISSR引物共扩增出466条谱带,其中多态性条带为446条,多态性比例(PPB)为95.71%(表6),表明益智种质材料具有丰富的遗传多样性,ISSR标记可很好地揭示供试益智种质材料的遗传差异和亲缘关系。采用UPGMA方法对数据进行聚类分析,得到益智种质材料的ISSR聚类图(图3),由图3可见,68份样品相似系数在0.72~0.86,表明群体遗传多样性水平不高,来自各个群体的样本基本上按照采集地点聚在一起。在相似系数0.762水平上,68份样品被分为6组。第Ⅰ组有12份样品,包括DZ1的10份样品和HM1的2份样品。第Ⅱ组有18份样品,包含HM1的7份样品,HM2的6份样品,DZ1的2份样品,LM1的2份样品,LM2的1份样品,本组各居群样品比较分散。第Ⅲ组有29份样品,包含LM1的1份样品,LM2的8份样品,QS1的10份样品,QS2的10份样品。第Ⅲ组在相似系数0.772水平上又可分为4个亚组,分别为A、B、C、D 4个亚组,A亚组包含LM1的1份样品;B亚组有14份样品,包含LM2的8份样品,QS2的1份样品,QS1的5份样品;C亚组包含QS1的3份样品;D亚组有11份样品,包含QS1的2份样品,QS2的9份样品。各居群中以LM2及QS2的样品较为集中,QS1的样品较为分散。第Ⅳ组有2份样品,包含HM2的1份样品和LM1的1份样品。第Ⅴ组为HM2的2份样品。第Ⅵ类为SY1的5份样品。从总体看,各样品主要按来源聚在一起,其中以SY1、DZ1、LM2、QS2的样品较为集中,LM1、QS1、HM1、HM2的样品较为分散。SY1的样品(野生)全部集中在一个类群中,并与其他样品(野生抚育)最早在相似系数0.72水平上被分成2大类群,可见,SY1的野生居群与其余栽培居群具有较大的遗传差异。
3 讨论与结论
在野外调查及测量中发现,益智各表型性状均存在各种变异,如株高、杆围、叶形、果序长等均呈连续型的变异,较为明显且易于分辨及归纳的为果实性状,常见到果实有大、中、小及长、圆之分,果序长短差异较大,但在同一丛中各性状表现均较为一致。本研究利用SPSS19.0软件对收集到的益智形态数据进行聚类分析,72个样品被分为9组,将表型性状较为接近的材料很好地聚在一起。
主成分分析可以将多个相关指标综合成较少的相互独立或不相关的新指标,并保持绝大部分的信息量。本研究经主成分分析综合得到7个主成分,积累贡献率达到89.29%,其中前3个贡献率最大的主成分积累贡献率达到64.85%,单果体积因子第一,产量因子第二,单果形态因子第三。
本研究中,利用ISSR分子标记对68份益智种质材料进行分析,采用UPGMA方法对数据进行聚类分析,结果显示68份样品相似系数在0.72~0.86,来自各个群体的样本基本上按照采集地点聚在一起,可以看出,ISSR分子标记聚类具有很高的灵敏度,能够准确地将来自不同采集地点的样本聚在一起。
本研究中,依据ISSR标记的聚类与表型性状的聚类结果不完全一致,在表型分析中散布在各组的SY1种群,在ISSR标记聚类中全部聚成一组,而在ISSR标记中亲缘关系较近的DZ1-6和LM1-4在表型分析中则相距较远。
本研究首次将益智种质资源的ISSR分子标记与表型性状的聚类进行对比分析,旨在探索分子标记聚类方法与表型性状的聚类是否一致,并通过2种方法的结合对海南岛益智种质资源进行更为合理的鉴定与分类,然而2种聚类方法的结果并不完全一致。其原因可能在于:(1)所采用的72份益智种质资源材料均为自然授粉的地方品种, 遗传背景较复杂;(2)表型性状是基因与环境间、基因与基因间互作的结果,分子标记揭示的是物种在DNA序列上的差异,因此,DNA结构差异不一定在表型性状上得到相应表现,即使能够表现,其表现的形式也可能因为基因间的互作或调控而呈现多种多样,这也是许多作物中表型分类与分子标记分类不完全一致的主要原因[21-23];(3)也可能是由于本研究所调查的表型性状只是益智所有表型性状的一部分,而ISSR标记所分析的位点则覆盖整个益智基因组;(4)试验研究结果也受到研究者习惯的影响,不同的研究者得出的结果可能不完全一致。同时,本研究表明,当供试材料形态相近时,表型聚类分辨能力有限,而ISSR分子标记聚类则具有更高的灵敏度,能够准确地将来自不同采集地点的样本聚在一起。因此,运用分子标记技术研究益智地方群体种质的遗传多样性,可以不受环境、发育时期和器官等的限制,从基因组水平上揭示其遗传变异的程度,且在早期就可进行新品种的鉴定。
参考文献
[1] 国家药典委员会. 中华人民共和国药典-一部-(2010年版)[S]. 北京: 中国医药科技出版社, 2010: 273.
[2] Itokawa H, Aiyama R, Ikuta A. A pungent diarylheptanoid from Alpinia oxyphylla[J]. Phytochemistry, 1981, 20(4): 769-771.
[3] Itokawa H, Aiyama R, Ikuta A. A pungent principle from Alpinia oxyphylla[J]. Phytochemistry, 1982, 21(1): 241-243.
[4] 罗秀珍, 余竞光, 徐丽珍, 等. 中药益智化学成分的研宄[J]. 药学学报, 2000, 35(3): 204-207.
[5] 易美华, 薛献明, 肖 红, 等. 益智提取物对油脂抗氧化作用研究[J]. 海南大学学报(自然科学版), 2002, 20(1):28-32.
[6] 易美华, 肖 红, 尹学琼, 等. 益智提取物对超氧阴离子自由基清除作用研究[J]. 中国食品学报, 2002, 2(4):21-24.
[7] Lin R J, Yen C M, Chou T H, et al. Antioxidant, anti-adipocyte differentiation, antitumor activity and anthelmintic activities against Anisakis simplex and Hymenolepis nana of yakuchinone A from Alpinia oxyphylla[J]. BMC Complementary and Alternative Medicine, 2013, 13: 237.
[8] 杨福孙, 甘炳春, 李榕涛, 等. 野生抚育益智主要性状与产量的回归模型及相关分析[J]. 中国农学通报, 2010, 26(2): 272-276.
[9] 朱文丽, 刘小涛, 莫 饶, 等. 益智的组织培养与快速繁殖[J]. 植物生理学通讯, 2005, 41(3): 335.
[10] Wang H Y, Liu X J, Wen M F, et al. Analysis of the genetic diversity of natural populations of Alpinia oxyphylla Miquel using inter-simple sequence repeat markers[J]. Crop Science, 2012, 52(4): 1 767-1 775.
[11] 刘晓静. 益智自然种群的演化和遗传多样性评价[D]. 海口: 海南大学, 2008.
[12] 陈东良, 李平颜, 许 燕, 等. 天然益智鹧鸪茶及其研制加工[J]. 热带农业工程, 2008, 32(1): 8-10.
[13] 阳辛凤, 利美莲. 益智与益智酒抗氧化活性的研究[J]. 华南热带农业大学学报, 2001, 7(3): 20-23.
[14] 洪 雁, 李远志, 卢昌阜, 等. 益智果脯无硫加工工艺研究[J]. 现代食品科技, 2012, 28(11): 1 526-1 529.
[15] 姜建国, 严 媛, 宋冬林. 盐藻Psy基因保守序列的克隆及同源性分析[J]. 华南理工大学学报(自然科学版), 2004, 32(10): 76-79.
[16] Zietkiewicz E, Rafalskia, Labuda D. Genome fingerprinting by simple sequence repeat(SSR)-anchored polymerase chain reaction amplification[J]. Genomics, 1994, 20(2): 176-183.
[17] Hadrys H, Balick M, Schierwater B. Applications of random amplified polymorphic DNA(RAPD)in molecular ecology[J]. Molecular Ecology, 1992, 1(1): 55-63.
[18] Shimamoto Y, Hasegawa A, Abe J, et al. Glycine soja germplasm in Japan: isozyme and chloroplast DNA variation[J]. Soybean Genetics Newsletter, 1992, 19: 73-77.
[19] Yu H, Kiang Y T. Genetic variation in South Korean natural populations of wild soybean(Glycine soja)[J]. Euphytica, 1993, 68(3): 213-221.
[20] 黄晓丹, 张云贵, 应铁进. 高质量植物基因组DNA的提取[J]. 植物生理学通讯, 2006, 42(2): 311-314.
[21] 庞朝友, 杜雄明, 马峙英. 棉属种间杂交基因渐渗系SSR标记及其表型性状的聚类分析[J]. 作物学报, 2006, 32(9): 1 371-1 378.
[22] Schut J W, Qi X, Stam P. Association between relationship measures based on AFLP markers, pedigree data and morphological traits in barley[J]. Theoretical and Applied Genetics, 1997, 95(7): 1 161-1 168.
[23] 陈学军, 程志芳, 陈劲枫, 等. 辣椒种质遗传多样性的RAPD和ISSR及其表型数据分析[J]. 西北植物学报, 2007, 27(4): 662-670.

