磷对铝胁迫下尾巨桉生长生理方面的缓解作用1)
侯文娟 胡厚臻 鲁莹莹 李桃祯 滕维超 王凌晖
(广西大学,南宁,530000)
磷对铝胁迫下尾巨桉生长生理方面的缓解作用1)
侯文娟胡厚臻鲁莹莹李桃祯滕维超王凌晖
(广西大学,南宁,530000)
摘要实验以尾巨桉Dp2-29(E. urophylla×E. grandis Dp2-29)为实验材料,用沙培法研究外源磷(P)对铝胁迫下尾巨桉生长和生理方面的缓解作用。结果表明:(1)5 mmol·L-1铝显著抑制尾巨桉的根、茎、叶生物量,显著提高根冠比。(2)铝胁迫抑制叶片叶绿素a、叶绿素b和类胡萝卜素质量分数,降低ω(叶绿素a)/ω(叶绿素b)值。(3)铝胁迫下叶片细胞膜透性显著增大,膜脂过氧化的产物丙二醛显著增加,细胞可溶性糖和可溶性蛋白质量分数显著降低,游离脯氨酸质量分数显著增大。(4)P缓解铝胁迫对光合色素的影响以及调节活性氧代谢以维持细胞膜结构稳定,有效缓解铝胁迫对尾巨桉生长、光合色素以及抗性生理造成的伤害,磷铝互作有利于缓解铝胁迫,P施用浓度为200 μmol·L-1时,缓解铝胁迫效果较好。
关键词尾巨桉Dp2-29;铝胁迫;磷;生长;生理
分类号Q945
Relieve Effect of Exogenous P on the Eucalyptus Growth and Physiological Feature under Al Stress//
Hou Wenjuan, Hu Houzhen, Lu Yingying, Li Taozhen, Teng Weichao, Wang Linghui
(Guangxi University, Nanning 530000, P. R. China)//Journal of Northeast Forestry University,2016,44(5):5-9,19.
To verify the growth and physiological Feature of exogenous phosphorus on ameliorating aluminum toxicity in Eucalyptus, we plantedE.urophylla×E.grandisDp2-29 in sand solutions, and then detected the root and above-ground biomass, photosynthetic pigments, and antioxidant physiological indexes. Al of 5 mmol·L-1significantly inhibited the root and above-ground biomass and increased the root shoot ratio. Al of 5 mmol·L-1significantly inhibited the leaf Chl a/b and the contents of leaf Chl a, Chl b and Car. Al stress significantly increased cell membrane permeability and MDA (the product of plasmalemma peroxidation) and free proline contents, decreased soluble sugar and soluble protein content inEucalyptusleaf. Exogenous P played an important role in formation and inhibit decomposition of photosynthetic pigments, maintaining cell membrane structure stability by regulating reactive oxygen metabolism under Al toxicity, thereby reducing the Al damage to Eucalyptus growth photosynthetic pigments and resistance physiology. P of 200 μmol·L-1was better in the relieve effect under Al stress.
KeywordsEucalyptus urophylla×E. grandis Dp2-29; Al stress; P; Growth; Physiological
铝是地壳中含量最丰富的金属元素,一般情况下都以难溶性的化合物形式存在于土壤中,对植物体没有伤害,但当土壤为酸性,特别是pH低于5时,铝被大量活化为活性羟基铝和3价铝(Al3+)等土壤高活性铝,Al3+对植物生长的影响最大,是导致植物铝中毒最主要的原因[1-2]。据了解,全球酸性土壤占可耕作土地的30%左右[3]。另外,由于酸雨的大面积发生和连续施用含氨和氨化物的肥料等导致酸性土壤面积不断增大,现在研究普遍认为铝胁迫已成为酸性土壤中致使森林衰退和农作物减产的最主要的原因之一[4-6]。我国南方15个省区由于土壤与气候原因,土地酸铝程度不断加剧,严重影响其农作物及林地产量[7]。
酸性土壤中的铁、铝氧化物能络合土壤和外施入的磷,形成的复合物难以被根系吸收,造成植物体缺磷。因此,酸性土壤中,低磷、高铝经常同时存在[8-9]。在探讨解决铝毒难题时,学者便尝试施加磷来缓解铝胁迫,并取得成效,磷缓解铝毒的机理,多数人认为是由于磷与铝产生沉淀反应,形成无毒的磷铝复合物的结果[10]。而形成位置为植物根表、根细胞壁、根细胞内以及液泡中[11-12]。
桉树(Eucalyptus)是我国南方地区最重要的速生用材林树种,作为短周期商品林,桉树生长迅速,轮伐期短,能在短时间内生产大量木材资源。现阶段桉树研究较多,但多集中在林地施肥[13-15]和胁迫方面[16-17],而施加外援物质以抵抗胁迫环境的研究较少,至今还没有针对桉树这方面的研究[18-19]。而我国约半数的桉树人工林经营模式实行的是多代连栽,南方富铝化酸性土壤更易产生活性铝,严重约束了桉树的生产力,带来了巨大的经济损失。因此,研究速生桉耐铝机制,并通过外源物质提高桉树耐铝性,是改良和利用酸性土地资源的一条有效途径。本实验研究施加外源磷对酸铝胁迫下桉树的影响,以指导桉树种植,切实改良南方酸性土地资源,提高酸性土壤利用率。
1材料与方法
供试苗木为广西林科院提供的3个月龄尾巨桉Dp2-29(E.urophylla×E.grandisDp2-29)组培苗。在广西大学林学院苗圃基地完成实验,苗木移植到装有灭菌河沙的多孔塑料花盆中,花盆规格为500 mm(径)×400 mm(高),每盆1株,每天浇水,1周后,每周每盆浇1次1 L改良霍格兰营养液,缓苗1个月后,开始进行P-Al处理。开始处理后,改为每两周浇1次pH为4.1~4.2的改良Hoagland营养液。铝的供体为分析纯AlCl3·6H2O,磷的供体为KH2PO4。
采用完全随机试验,参考杨梅等[13]和杨林通[20]的研究,略有改动,每处理10个重复,缓苗1个月后开始处理,包括:磷3个浓度(0、50、200 μmol·L-1)、铝2个浓度(0、5 mmol·L-1),共计6个处理。处理液的pH用HCl(或NaOH)调节到4.1~4.2,保证酸性环境。每周浇1次处理液,P-Al处理20周。
每个处理精选3株生长情况具备代表性的桉树,测其生物量,根茎叶分别装入纸袋,105 ℃杀青后于80 ℃烘干至恒质量,对其根茎叶称量生物量。每个处理均匀取10个重复的功能叶片剪碎混合测量相关生理指标,生理指标按照植物生理学实验指导[21]要求测量,叶绿素、类胡萝卜素质量分数用丙酮-乙醇混合提取法;电导率用电解质外渗量法;丙二醛质量分数用硫代巴比妥酸(TBA)法;游离脯氨酸质量分数用酸性茚三酮法;叶片可溶性糖质量分数用蒽酮比色法;叶片可溶性蛋白质量分数用考马斯亮蓝法。
2结果与分析
2.1铝-磷互作对尾巨桉生物量的影响
由表1可知,无磷施加时,铝胁迫组根茎叶生物量相对于对照分别减少了28.57%、34.78%和44.97%,说明铝胁迫对尾巨桉植株的生长状况影响是极显著的。无铝胁迫施加的情况下,桉树的根系和地上部分生物量随P的增加而略微增加但没有显著影响。
铝胁迫情况下,2个浓度P施加都极显著提高了桉树根、茎、叶生物量,根生物量分别提高了20.61%和25.92%,茎生物量分别提高了34.01%和35.5%,叶生物量分别提高了43.08%和45%。随着施P量的增加尾巨桉根系和地上部分生物量均持续增加,而施加2个浓度的P之间则没有显著差异。表明施加P能显著改善铝胁迫对尾巨桉的生长抑制,高浓度与低浓度施加在缓解铝胁迫方面差异不显著,但施加P对无铝正常尾巨桉生长却几乎没有影响。
相同P量的施加,铝胁迫略微提高了尾巨桉植株的根冠质量比,只有无P添加下影响显著,其他两组不显著。相同铝含量施加时,不同P水平施加之间根冠比之间几乎没有差别。可见,无P施加下,铝胁迫能显著增加尾巨桉根冠质量比,施加P缓解时,铝对尾巨桉根冠比的没有显著影响。
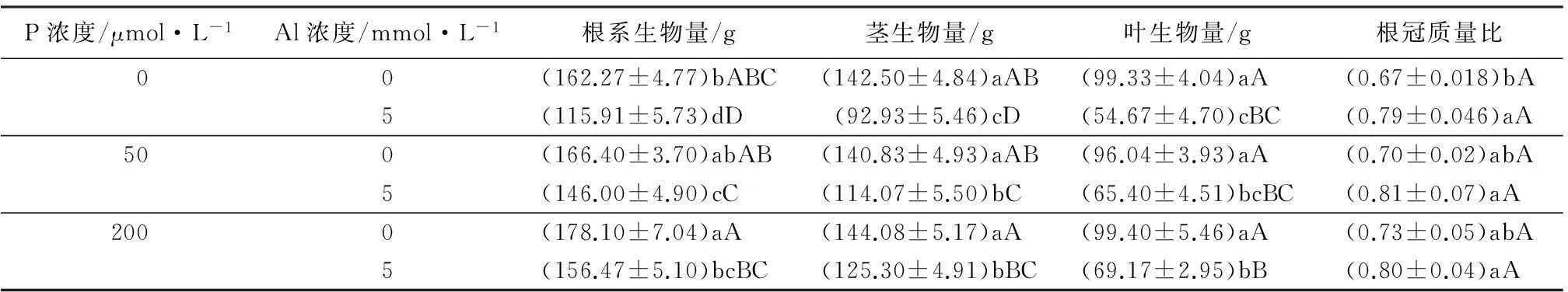
表1 铝-磷互作对尾巨桉生物量的影响
注:表中数值为“平均值±标准差”;同列中,不同大写字母表示差异极显著(p<0.01)、不同小写字母表示差异显著(p<0.05)。
2.2铝-磷互作对尾巨桉叶片色素的影响
由表2可知,在无P添加情况下,铝胁迫极显著的降低了尾巨桉叶片叶绿素a和类胡萝卜素质量分数,分别降低了39.23%和37.89%,对叶绿素b质量分数也有降低但并不显著(11.95%),铝胁迫使ω(叶绿素a)/ω(叶绿素b)的值显著降低。表明铝胁迫能抑制光合色素质量分数,降低ω(叶绿素a)/ω(叶绿素b)的值,且色素中叶绿素a、类胡萝卜素比叶绿素b更敏感。无铝胁迫情况下,添加两个浓度的P对尾巨桉叶片叶绿素a和类胡萝卜素质量分数并没有显著影响,但显著提高了叶片的叶绿素b质量分数,降低了ω(叶绿素a)/ω(叶绿素b)的值。无铝胁迫的正常条件下,额外施加P对尾巨桉叶片叶绿素a和类胡萝卜素质量分数并没有显著促进作用,但能明显增加叶绿素b质量分数。铝胁迫条件下,叶片叶绿素a和类胡萝卜素质量分数随P施加的增加而显著增加,50 μmol·L-1和200 μmol·L-1的P施加下,叶绿素a质量分数分别增加了35.79%和41.60%,类胡萝卜素质量分数分别增加了15.92%和8.43%,且两个浓度之间差异不显著,叶绿素b质量分数随P增加变化不显著,ω(叶绿素a)/ω(叶绿素b)的值随P增加而显著增加。表明铝胁迫环境下,施加P能有效缓解胁迫对叶片叶绿素a和类胡萝卜素质量分数的抑制作用,并增加ω(叶绿素a)/ω(叶绿素b)的值,但施加高浓度与低浓度P的作用差距不显著。相同P添加下,铝胁迫对叶片叶绿素总量(叶绿素(a+b))有显著降低作用。铝胁迫条件下,施加P能显著提高叶绿素(a+b)质量分数,但施加的两个浓度间没有显著差异,可见,施加P能缓解铝胁迫对叶片叶绿素(a+b)质量分数的抑制作用。

表2 铝-磷互作对尾巨桉叶片色素的影响
注:表中数值为“平均值±标准差”;同列中,不同大写字母表示差异极显著(p<0.01)、不同小写字母表示差异显著(p<0.05)。
2.3铝-磷互作对尾巨桉叶片质膜透性的影响
逆境会破坏植物的细胞膜,致使质膜透性增大,从而导致细胞内的电解质外渗,表现出相对电导率不断升高的现象。由表3可知,相同P添加下,施加铝胁迫都显著提高了尾巨桉叶片的相对电导率,其中P施加量为0时,铝胁迫相对电导率较无铝胁迫组增加量是其无铝胁迫组的267.14%,而50 μmol·L-1和200 μmol·L-1P施加情况下增量分别为225.62%和200.11%。可见,铝胁迫能显著提高尾巨桉叶片质膜透性,而施加P能提高植物耐铝性。无铝胁迫组随着P施加量的增加呈现不显著的轻微下降的趋势,而铝胁迫组随P施加量的增加呈现显著的持续下降的变化趋势,50 μmol·L-1和200 μmol·L-1的P施加下叶片相对电导率分别较0 μmol·L-1P施加组降低了26.97%和38.33%。可见,是否施加P和P施加量对无铝胁迫尾巨桉叶片相对电导率几乎没有影响,但施加P对铝胁迫尾巨桉叶片相对电导率却有极显著的降低作用,且施用大浓度(200 μmol·L-1)的效果更好。表明P可以有效缓解铝胁迫对尾巨桉叶片质膜透性造成的伤害。
2.4铝-磷互作对尾巨桉叶片丙二醛质量分数的影响
植物器官衰老时或在逆境条件下,自由基作用于脂质发生过氧化反应,产生丙二醛,可通过丙二醛了解膜脂过氧化的程度,以间接测定膜系统受损程度和细胞内活性氧含量[22]。由表3可知,0、50、200 μmol·L-1的P施加情况下,铝胁迫组较其对应P施加的无铝组丙二醛分别增加了115.44%、83.55%和55.41%。前两组之间差异显著,与200 μmol·L-1的P施加之间丙二醛变化不显著。可见,铝胁迫能显著提高叶片过氧化水平,提高叶片丙二醛质量分数。而施加P可缓解这一症状,提高植株耐铝性。无铝胁迫时,叶片丙二醛质量分数随P施加量的增加而呈现持续下降的变化趋势,但差异并不显著。铝胁迫条件下,叶片丙二醛质量分数随P施加量表现出连续下降的变化趋势,50 μmol·L-1和200 μmol·L-1的P施加,叶片丙二醛质量分数分别下降了29.19%和37.65%,其两者之间差异不显著,但都与0 μmol·L-1P施加组间差异显著。实验表明,无铝胁迫时,额外施加两个浓度是P,对尾巨桉叶片丙二醛质量分数都没有显著影响;而铝胁迫环境下,施加P则能有效降低叶片丙二醛的质量分数,高浓度P比低浓度P缓解效果稍好,但两浓度之间差异不显著。也就是说施加P能有效缓解铝胁迫对尾巨桉叶片造成的过氧化反应伤害,但量个浓度的缓解作用差异不显著。

表3 铝-磷互作对尾巨桉叶片抗性生理指标的影响
注:表中数值为“平均值±标准差”;同列中,不同大写字母表示差异极显著(p<0.01)、不同小写字母表示差异显著(p<0.05)。
2.5铝-磷互作对尾巨桉叶片可溶性糖质量分数的影响
由表3可知,0 μmol·L-1和50 μmol·L-1P施加情况下,铝胁迫能显著减少尾巨桉叶片的可溶性糖质量分数,减少量分别为对应无铝胁迫的25.14%和14.70%,而200 μmol·L-1P添加下,铝胁迫与不施加铝可溶性糖质量分数有减少但差异不显著,减少了7.53%。可见随着P施加量的增大,铝胁迫对可溶性糖质量分数的影响作用越小,施加P提高了植株耐铝性。无铝施加情况下,P施加3组之间叶片可溶性糖质量分数几乎没有差别;而铝胁迫条件下,叶片可溶性糖质量分数随P施加量的增加而持续增加,50 μmol·L-1和200 μmol·L-1P添加量,叶片之间可溶性糖质量分数没有显著差异,但均极显著高于无P添加组,增量分别为无P添加组的13.5%和21.1%。可见无铝胁迫环境下,额外施加P对叶片可溶性糖质量分数并没有显著影响,但铝胁迫环境下,施加P就能显著缓解铝胁迫对尾巨桉叶片可溶性糖质量分数造成的影响,且高浓度与低浓度P施加效果差异不大。
2.6铝-磷互作对尾巨桉叶片可溶性蛋白质量分数的影响
由表3可知,相同P添加情况下,铝胁迫组叶片可溶性蛋白质量分数均极显著低于其对应的无铝胁迫组,减少量分别为其无铝胁迫组的81.89%、48.3%和32.29%,可见铝胁迫能显著抑制尾巨桉叶片可溶性蛋白的质量分数,而施加P则大大减小了铝胁迫对其的伤害程度,增加植株耐铝性。无铝添加情况下,添加50 μmol·L-1和200 μmol·L-1P显著减少了叶片可溶性蛋白的质量分数,但其两者之间差异不显著。在铝胁迫环境下,叶片可溶性蛋白的质量分数随P的增加而持续显著增加,50 μmol·L-1和200 μmol·L-1P添加组分别是0 μmol·L-1P添加组的1.97和2.75倍,表明无铝胁迫额外下,施加P对叶片可溶性蛋白质量分数有显著抑制作用。铝胁迫条件下,施加P有效增加叶片的可溶性蛋白质量分数,且与施加浓度呈显著正相关。
2.7铝-磷互作对尾巨桉叶片游离脯氨酸质量分数的影响
酸铝胁迫等逆境环境可以诱导植物产生比较多的脯氨酸,脯氨酸是植物细胞渗透调节物质,调节渗透势以维持细胞的正常功能。由表3可知,添加相同P的情况下,其对应铝胁迫组都极显著的增加了叶片脯氨酸质量分数,且增加幅度随P的增加而持续降低,增加量分别为对应无铝胁迫组的41.66%、29.61%和20.94%,可见铝胁迫对叶片渗透势的影响是极显著的,且随着P质量分数的增加这种影响也越来越小。无铝胁迫下,叶片脯氨酸质量分数0 μmol·L-1P添加组>200 μmol·L-1P添加组>50 μmol·L-1P添加组,且50 μmol·L-1P添加组与另外两组差异显著,铝胁迫环境下,50 μmol·L-1P添加组和200 μmol·L-1P添加组的叶片脯氨酸极显著小于0 μmol·L-1P施加组,其减少量分别为0 μmol·L-1组的18.4%和19.08%,两组之间脯氨酸差异不显著,可见,无铝胁迫下施加50 μmol·L-1的P比另外两组能提供更好的条件来适应细胞渗透势,减少脯氨酸的产生,而铝胁迫条件下,添加P能极显著减少铝胁迫对叶片渗透势的伤害,50 μmol·L-1和200 μmol·L-1P的添加效果差异不大。
2.8铝-磷互作下,尾巨桉各指标之间的线性相关性和双因素方差分析
由表4可知,生长(根、茎和叶生物量)与生理指标(光合色素、电导率、丙二醛、可溶性糖、可溶性蛋白和脯氨酸)之间普遍存在显著或极显著相关性。其中根茎叶生物量与光合色素均呈正相关,与类胡萝卜素为显著相关,与叶绿素a和叶绿素(a+b)为极显著正相关,与电导率、丙二醛和脯氨酸均为极显著负相关,与可溶性糖和蛋白之间为显著或极显著正相关,可见,植物生长与叶绿素a、类胡萝卜素质量分数和抗性生理指标的关系非常密切。由方差分析结果得,单Al、单P以及铝-磷互作,对桉树的生长和生理方面的作用基本上都是极显著的。可见,铝磷互作能极显著的缓解铝胁迫在生长生理方面带来的伤害,可以阻止根茎叶生物量、光合色素质量分数、可溶性糖和可溶性蛋白质量分数的降低,阻止电导率增加,阻止丙二醛和脯氨酸质量分数的增加。

表4 铝-磷互作尾巨桉各指标之间的线性相关性和双因素方差分析
注:** 表示P<0.01;*表示P<0.05;ns表示不显著。
3结论与讨论
实验结果表明,施加铝胁迫能显著抑制尾巨桉32-29的根、茎、叶生物量,较地上部分而言,根系受伤害较轻,导致根冠质量比增大,也是调节自身生物量配置抵御逆境的表现,与Nguyen et al[23]和张启明等[24]的研究结果一致。施加P能有效缓解铝胁迫的抑制作用,显著提高铝胁迫下根系和地上部分生物量,与Jiang et al[25]研究结果相似。
叶片光合色素的含量将影响叶绿素对光能的吸收、传递及他们之间的分配,以及转换合成的量,从而影响光合作用[26]。类胡萝卜素能保护叶绿素免遭光氧化的破坏,降低单线态氧对光合膜的损伤[27]。本实验中,铝胁迫极显著的降低了尾巨桉叶片叶绿素a、类胡萝卜素质量分数和ω(叶绿素a)/ω(叶绿素b)的值,而对叶绿素b质量分数影响不显著。叶绿素质量分数的下降不利于植物叶片捕捉光合作用需要的光能,严重影响叶片光合作用的正常进行,而类胡萝卜素和ω(叶绿素a)/ω(叶绿素b)的值下降则可能预示植物抗逆性的下降,这与肖祥希等[28]的研究结果相似。有实验推测,Al3+可能在根质外体和植株体内竞争和取代Mg2+,影响植物对镁的吸收和运输,使植物缺镁,从而抑制叶绿素的合成[5]。无铝胁迫情况下,添加两个浓度的P对尾巨桉叶片叶绿素a和类胡萝卜素的质量分数并没有显著影响,但显著提高了叶片叶绿素b的质量分数,降低了ω(叶绿素a)/ω(叶绿素b)的值。铝胁迫条件下,叶片叶绿素a、类胡萝卜素和ω(叶绿素a)/ω(叶绿素b)的值随P施加的增加而显著增加,叶绿素b质量分数随P增加变化不显著。可见施加P可有效缓解酸铝胁迫对植物光合色素产生的伤害,提高植物的光能捕捉能力,还可缓解植物缺镁,提高桉树光合作用能力,增强尾巨桉耐铝性。
铝胁迫导致植物细胞最直接最明显的伤害,主要包括:细胞膜结构和功能遭到破坏,透性增大,膜的稳定性降低,细胞内的离子、糖类、氨基酸等被动外渗。在本实验中,铝胁迫下,尾巨桉叶片细胞膜脂过氧化加剧,膜脂过氧化的产物丙二醛显著增加,细胞膜透性显著增大,细胞可溶性糖和可溶性蛋白的质量分数显著降低,游离脯氨酸质量分数显著增大。可见尾巨桉在高浓度铝胁迫下依然能够大量积累脯氨酸,来降低细胞渗透势,维持压力势,保持和稳定大分子物质,尽量维持细胞膜正常功能,但铝胁迫依然破坏膜透性,抑制了糖及可溶性蛋白的产生,加重了膜质过氧化水平。虽然桉树有一定抗铝机制,但过量的酸铝胁迫依然能够破坏植物生理平衡,对叶片抗氧化系统产生毒害。这与其他学者[29-31]对柑橘、白蜡、龙眼等研究得到的结论基本一致。而施加P能有效减少铝胁迫对上述指标的伤害程度,提高尾巨桉的耐铝性。无铝胁迫时,额外施加P对叶片抗氧化生理指标几乎没有影响,但显著降低了其可溶性蛋白的质量分数,这与孙常青等[32]的实验结果相同。可能是因为,施加的改良霍格兰营养液中,P元素含量已可以满足桉树生长需要,额外施加P反而形成高肥胁迫效果,而可溶性蛋白的质量分数可能对过量的P反应较为敏感,出现显著降低的现象。但在铝胁迫条件下,施加P对叶片相对电导率、丙二醛质量分数和游离脯氨酸有极显著的降低作用,对可溶性糖和可溶性蛋白的含量的促进作用也是极显著的,且施用大浓度(200 μmol·L-1)P的效果更好。可见,P可以有效缓解铝胁迫对叶片质膜透性和过氧化反应对叶片正常生理功能造成的伤害,磷铝互作有利于缓解铝胁迫。Yang LT et al[29]的研究结果也表明,增加根系P含量可以减轻铝对其生长和光合等方面的抑制作用。Jian et al[33]研究发现的,荞麦根尖中P的含量与Al的固定和解Al毒有很好的关系。由此可知,提高植物对P的吸收,从而促进土壤中Al的固定,可能是Al胁迫下施加外源P缓解作用的机理。
参考文献
[1]MA J F, FURUKAWA J. Recent Progress in the research of external Al detoxification in higher Plants: a minireview[J]. Journal of Inorganic Biochemistry,2003,97(1):46-51.
[2]KOCHIAN L V, PINEROS M A, HOEKENGA O A. The Physiology, genetics and molecular biology of Plant aluminum resistance and toxicity[J]. Plant and Soil,2005,274(1):175-195.
[3]H. R. VON UEXKÜLL, E. MUTERT. Global extent, development and economic impact of acid soils[J]. Plant and Soil,1995:171(1):1-15.
[4]HORST W J. The role of the apoplast in Aluminum toxicity and resistance of higher Plants: a review[J]. Journal of Plant Nutrition and Soil Science,1995,158(5):419-428.
[5]MATSUMOTO H. Cell biology of aluminum toxicity and tolerance in higher Plants[J]. Internationale Review of Cytology,2000,200:1-46.
[6]刘厚田,田仁生.重庆南山马尾松衰亡与土壤铝活化的关系[J].环境科学学报,1992,12(3):297-305.
[7]周蓉.花生耐铝性及遗传改良研究进展[J].花生学报,2003,32(增刊):144-148.
[8]LIAO H, WAN H, SHAFF J. Phosphorus and Aluminum Interactions in Soybean in Relation to Al Tolerance: Exudation of Specific Organic Acids from Different Regions of the Intact Root System[J]. Plant Physiology,2006,141(2):674-684.
[9]YAN X, BEEBE S E, LYNCH J P. Genetic Variation for Phosphorus Efficiency of Common Bean in Contrasting Soil Types: I Vegetative Response[J]. Crop Science,1995,35(4):1086-1093.
[10]唐春红,吴朝学,姚姜铭,等.不同桉树专用追肥对桉树生长的影响[J].南方农业学报,2012,43(8):1154-1157.
[11]WANGQK,WANGSL,LIUYX.ResponsestoNandPfertilizationinayoungEucalyptusdunniiplantation:Microbialproperties,enzymeactivitiesanddissolvedorganicmatter[J].AppliedSoilEcology,2008,40(3):484-490.
[12]LACLAU J P, ALMEIDA J C, GONÇALVES J L, et al. Influence of nitrogen and potassium fertilization on leaf lifespan and allocation of above-ground growth in Eucalyptus plantations[J]. Tree Physiology,2009,29(1):111-124.
[13]杨梅,吴幼媚,黄寿先,等.不同桉树优良无性系幼苗对酸铝的抗性生理响应差异[J].林业科学,2011,47(6):181-187.
[14]RYAN P R, SKERRETT M, FINDLAY G P, et al. Aluminum activates an anion channel in the apical cells of wheat roots[J]. Proceedings of the National Academy of Sciences of the United States of America,1997,94(12):6547-6552.
[15]TAYLOR G J. Current views of the aluminum stress response: the physiological basis of tolerance[J]. Current Topics in Plant Biochemistry and Physiology,1991,10:57-93.
[16]PFEFFER P E, TU S I, GERASIMOWICZ W V, et al. In vivo P NMR Studies of Corn Root Tissue and Its Uptake of Toxic Metals[J]. American Society of Plant Biologists,1986,80(1):77-84.
[17]ALVAREZ E, FERNANDEZ-MARCOS M L, MONTERROSO C, et al. Application of aluminium toxicity indices to soils under various forest species[J]. Forest Ecology & Management,2005,211(3):227-239.
[18]乔永旭.低温处理过程中水杨酸对红掌叶片生理指标的影响[J].东北林业大学学报,2010,38(2):11-12.
[19]姚侠妹,张瑞娥,偶春,等.外源5-氨基乙酰丙酸对盐胁迫下栀子幼苗生理特性的影响[J].东北林业大学学报,2015,43(4):37-41.
[20]杨林通.柑橘耐铝机理及磷和一氧化氮对铝毒的调控[D].福州:福建农林大学,2011.
[21]陈建勋.植物生理学实验指导[M].广州:华南理工大学出版社,2002.
[22]覃世杰,谭长强,侯文娟,等.植物生长调节剂GGR6对中国无忧花生理生化的影响[J].北方园艺,2014(22):72-75.
[23]NGUYEN N T, HIEP N D, FUJITA K. Iron Enhances Aluminum-induced Leaf Necrosis and Plant Growth Inhibition in Eucalyptus camaldulensis[J]. Plant & Soil,2005,277(1/2):139-152.
[24]张启明,陈荣府,赵学强,等.铝胁迫下磷对水稻苗期生长的影响及水稻耐铝性与磷效率的关系[J].土壤学报,2011,48(1):103-111.
[25]JIANG H X, TANG N, ZHENG J G, et al. Phosphorus alleviates aluminum-induced inhibition of growth and photosynthesis in Citrus grandis seedlings[J]. Physiologia Plantarum,2009,137(3):298-311.
[26]PING-ZHAO C, LUO J G, WANG L, et al. Causation of Sodium Bisulfite Affect Photosynthesis in Leaves of Umbilical Orange[J]. Acta Agriculturae Boreali-occidentalis Sinica,2004,13(1):69-75.
[27]TAKAHAMA U, TAKAHASHI K. Suppression of lipid peroxidation by β-carotene in illuminated chloroplast fragments: evidence for β-carotene as a quencher of singlet molecular oxygen in chloroplasts[J]. Plant & Cell Physiology,1978,19(8):1565-1569.
[28]肖祥希,刘星辉,杨宗武,等.铝胁迫对龙眼幼苗光合作用的影响[J].热带作物学报,2005,26(1):63-69.
[29]YANG L T, QI Y P, CHEN L S, et al. Nitric oxide protects sour pummelo (Citrus grandis) seedlings against aluminum-induced inhibition of growth and photosynthesis[J]. Environmental & Experimental Botany,2012,82(5):1-13.
[30]李淑娟,詹亚光,杨传平,等.混合盐胁迫对引种绒毛白蜡生长及相关生理指标的影响[J].东北林业大学学报,2010,38(1):15-17.
[31]肖祥希,杨宗武,肖晖,等.铝胁迫对龙眼叶片活性氧代谢及膜系统的影响[J].林业科学,2003,39(S1):52-57.
[32]孙常青,杨艳君,郭志利,等.施肥和密度对杂交谷可溶性糖、可溶性蛋白及硝酸还原酶的影响[J].植物营养与肥料学报,2015,21(5):1169-1177.
[33]JIAN Z S, LI Y J, FENG H Y, et al. Immobilization of aluminum with phosphorus in roots is associated with high aluminum resistance in buckwheat[J]. Plant Physiology,2005,138(1):297-303.
收稿日期:2015年10月14日。
第一作者简介:侯文娟,女,1988年7月生,广西大学林学院,硕士研究生。E-mail:1083921118@qq.com。通信作者:滕维超,广西大学林学院,讲师。E-mail:vincentt@yeah.net。
1)国家自然科学基金项目(31360174)。
责任编辑:王广建。

