苯醚甲环唑对斑马鱼抗氧化酶的影响
穆希岩,黄 瑛,沈公铭,柴婷婷,朱丽珍,李绪兴,雷云雷,冯庚菲,李应仁,李学锋*,王成菊*(.中国农业大学理学院,北京 0093;.中国水产科学研究院资源与环境研究中心,北京 004)
苯醚甲环唑对斑马鱼抗氧化酶的影响
穆希岩1,2,黄 瑛2,沈公铭2,柴婷婷1,朱丽珍1,李绪兴2,雷云雷2,冯庚菲2,李应仁2,李学锋1*,王成菊1*(1.中国农业大学理学院,北京 100193;2.中国水产科学研究院资源与环境研究中心,北京 100141)
摘要:以斑马鱼为模式生物研究了三唑类杀菌剂苯醚甲环唑对斑马鱼脑和肝脏中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)和谷胱甘肽还原酶(GR)四种抗氧化酶活性的影响.结果发现:苯醚甲环唑暴露后,斑马鱼脑中CAT酶活性随暴露时间延长呈现出先升高后降低的趋势.50µg/L及更高浓度的苯醚甲环唑能够显著抑制斑马鱼脑和肝脏中GPx的活性,且对脑中GPx活性的抑制程度更强.另外,500µg/L苯醚甲环唑处理后,斑马鱼肝脏和脑中GR活性表现出不同的变化趋势,肝脏中GR活性下降,而脑中GR活性升高.上述结果表明50µg/L的苯醚甲环唑即可影响斑马鱼的抗氧化系统,其对农业水域中的鱼类影响值得重视.
关键词:苯醚甲环唑;斑马鱼;抗氧化酶;脑;肝脏
* 责任作者, 教授, lxf1966@263.net; wangchengju@cau.edu.cn
三唑类化合物具备高化学和光化学稳定性、低生物降解性以及容易在环境中转移等特点,这些特性使得三唑类杀菌剂能够在环境中的水和土壤中长期存在[1].作为销量最大的三唑类农药之一,苯醚甲环唑是先正达公司开发的三唑类内吸型杀菌剂[2],兼具保护和治疗的双重活性,杀菌谱广,对多种菌属有持久的保护和治疗作用.其杀菌原理在于能够抑制羊毛甾醇去甲基酶(CYP51)活性,从而阻碍菌类麦角甾醇的合成,并进一步影响细胞壁的形成,造成细胞质外溢,最终导致病原菌死亡[3-5].
近年,很多研究报道了苯醚甲环唑在环境中的检出情况(表1),其在农作物种植地区附近的地表水域中的检出浓度达到0.3mg/L;而在非农业地区的地表水中检出最大值也可达0.15µg/L.根据欧洲食品安全局2010年的出版物提供的数据,苯醚甲环唑对大型溞(Daphnia magna)具有高毒性(慢性NOEC为5.6µg/L),苯醚甲环唑也因此被认为对水生生物具有高风险性[12].在我国南方,很多地区采用稻田养殖的方法来提高经济效益[13-14],而苯醚甲环唑作为水稻常用农药,其对稻田中养殖的水生生物具有潜在威胁.
已有研究表明三唑类农药能够诱导鱼类的氧化应激作用.Li等[15]的研究发现,0.2µg/L的丙环唑处理虹鳟鱼(Oncorhynchus mykiss)30d后,肝脏中SOD活性显著提高;而当处理浓度达到50µg/L时,SOD和CAT活性均出现上升.Vasylkiv 等[16]的研究证明,用三唑类除草剂杀草强注射处理金鱼(Carassius auratus)24h后,金鱼肌肉、肾脏、心脏、肝脏和脑组织均中CAT活性均显著下降,下降率分别为61%、64%、48%、40%和27%.而目前关于苯醚甲环唑对鱼类抗氧化系统影响的研究还很少.
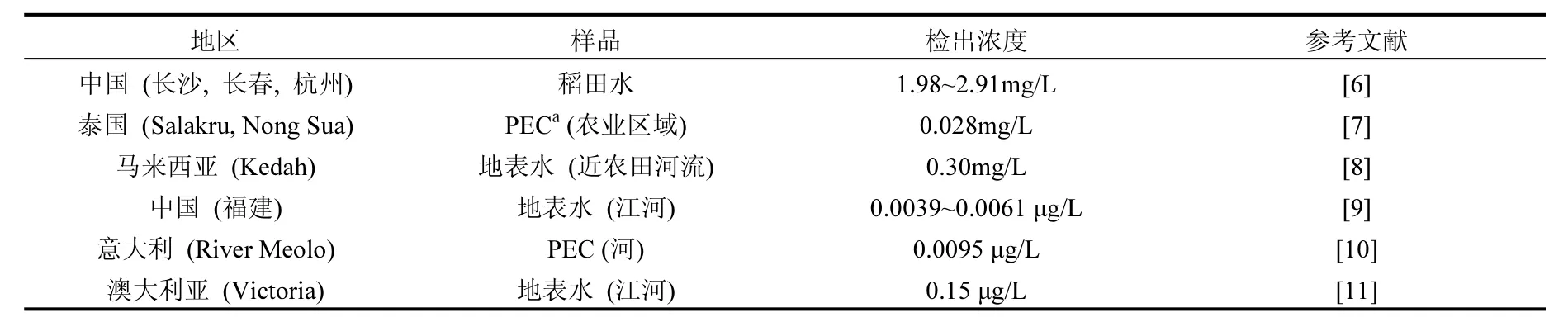
表1 苯醚甲环唑在环境水域中的含量Table 1 The reported environmental difenoconazole dosage in water area.
斑马鱼作为模式生物具有很多优势,包括成鱼个体小、易于大规模养殖、繁殖率高、成本低等.本试验研究了苯醚甲环唑15d暴露后,斑马鱼成鱼脑和肝脏中四种抗氧化酶活性的变化情况,旨在探讨三唑类农药对斑马鱼抗氧化系统的损害作用及可能的作用机制,揭示三唑类农药对鱼类生理功能的影响.
1 材料与方法
1.1 试验鱼与饲养条件
斑马鱼成鱼,购于北京高峰水族馆,体长3.00~4.00cm,体重0.15~0.30g.在试验室驯养30d以上,驯养用水经曝气去氯处理,pH值为7.0~8.5,水中溶氧量饱和度大于80%,水温为(27±1)℃.采用自然光照与白炽灯光照,光照周期为14/10 (光/ 暗).驯养期间每天喂食2次去壳活丰年虾(Eubranchipus vernalis),每天换水1/3.驯养期间死亡率小于5%.
1.2 药品与试剂
96%苯醚甲环唑(Difenoconazole,CAS: 119446-68-3)原药为农业部药检所提供;原药由丙酮(分析纯)配制成一定浓度的农药储存液,储存液进一步用重组水稀释至指定浓度.重组水配置方法参考OECD的推荐方法[17],配好的重组水中含有2mmol/L Ca2+、0.5mmol/L Mg2+、0.75mmol/L Na+和0.074mmol/L K+.
1.3 苯醚甲环唑暴露试验
参照国家环保总局制定的《化学农药环境安全评价试验准则》中“鱼类毒性试验”和OECD-203设计试验[17-18].参考本试验组已发表论文中苯醚甲环唑对斑马鱼的急性毒性数据(96h-LC50为1.45mg/L)[19],确定暴露浓度.将随机挑选的斑马鱼成鱼暴露于1, 50, 500µg/L的苯醚甲环唑溶液中;分别设溶剂对照和空白对照.除空白对照外,其余各处理组的暴露溶液中均含有相同含量的丙酮(0.05mL/L).暴露试验在5L烧杯中进行,每个烧杯中盛有药液5L和15条鱼,每个暴露组和对照组均有6个烧杯,每2个烧杯一组(共30条鱼),作为1个重复.试验期间每天饲喂干饲料1次,饲喂量为鱼体重的1%.暴露试验持续15d,每天观察鱼的死亡情况,及时清理死鱼,判断死鱼的标准是玻璃棒轻触鱼的尾部无可见运动.每24h更换全部药液以保持稳定的测试物浓度和洁净的水质.每周检测水温、pH值和溶氧量各3次.
1.4 样品收集及前处理
分别在暴露后3,8,15d时,从每个重复组中选取6条斑马鱼,用MS-222溶液于冰上麻醉后,迅速取出脑和肝脏组织,并放于1.5mL离心管中,称重后置于液氮中临时保存,样品全部取完后,统一存放于-80℃冰箱中.用于生化指标测定.
将冷冻样品在冰上解冻后,加入150µL预冷的磷酸缓冲溶液,用电动匀浆器充分匀浆后继续加入适量磷酸缓冲溶液并充分混匀,保证匀浆液质量体积比为1:20(m/V).混匀后的匀浆液在4℃下14000r/ min离心30min后,吸取上清液用于酶活性检测.
1.5 暴露溶液中苯醚甲环唑含量分析
在第一次配好药液后,以及每次取斑马鱼样品之前,从烧杯中取水样20mL进行苯醚甲环唑含量分析,每个处理组取3个重复样品.将样品倒入分液漏斗中,用10mL乙酸乙酯萃取2次后,合并萃取液.每个样品取约1mL萃取液用氮气吹干后,加入1mL乙腈重新溶解.将重新溶解的样品通过0.22µm的滤膜后,使用气质联用仪进行分析检测.色谱及质谱分析条件参考本课题组已发表方法[20].
1.6 酶活性测定
CAT活性检测以Beers等[21]的方法为基础并进行一定的改进.反应体系为900µL的磷酸钾缓冲溶液(50mmol/L,pH7.0,含有10mmol/L的过氧化氢),和100µL酶液.在室温(24℃ )下开始反应,并记录反应后3分钟内的吸光值变化.以每分钟清除1mmol/L H2O2所需要的蛋白质质量为一个酶活单位,计算时使用的H2O2的摩尔吸光系数为40mol/(L·cm).酶活单位用U/mg蛋白质表示.
谷胱甘肽还原酶(GR)活性的分析方法参考Mu等[22]的方法测定.1mL的反应体系含有900µL的磷酸钠缓冲溶液(0.1mol/L,pH:7.6,含有0.1mmol/L的氧化型谷胱甘肽(GSSG)、0.5mmol/L的EDTA)和100µL的酶液样品.在26
℃下开始反应,并记录开始反应后3min内的吸光值变化.以每分钟氧化1µmol/L的NADPH所需要的蛋白质质量为一个酶活单位,计算时使用的NADPH的摩尔吸光系数为6220mol/(L·cm).酶活单位用U/mg蛋白质表示.
SOD和GPx的活性测定使用试剂盒(南京建成,南京)进行测定.酶活性计算方法参照试剂盒配套的使用手册完成.
1.7 数据统计与分析
使用SPSS 16.0对试验所得数据进行统计分析.采用One-Way ANOVA法进行单因素方差分析,以Dunnett post hoc方法完成显著性比较; P<0.05表示差异显著,P<0.01表示差异极显著.
2 结果与讨论
2.1 溶剂效应
显著性分析结果表明,溶剂对照组和空白对照组中试验涉及的所有指标的检测结果之间不存在显著差异(数据未给出).在本文中出现的对照组(control)数据均来自于溶剂对照.
2.2 苯醚甲环唑分析结果
分析结果表明所有处理组水样的实测浓度与理论浓度偏差均小于20%(表2),根据OECD试验指导的要求,本试验中的理论浓度能够代表其实际浓度[23].
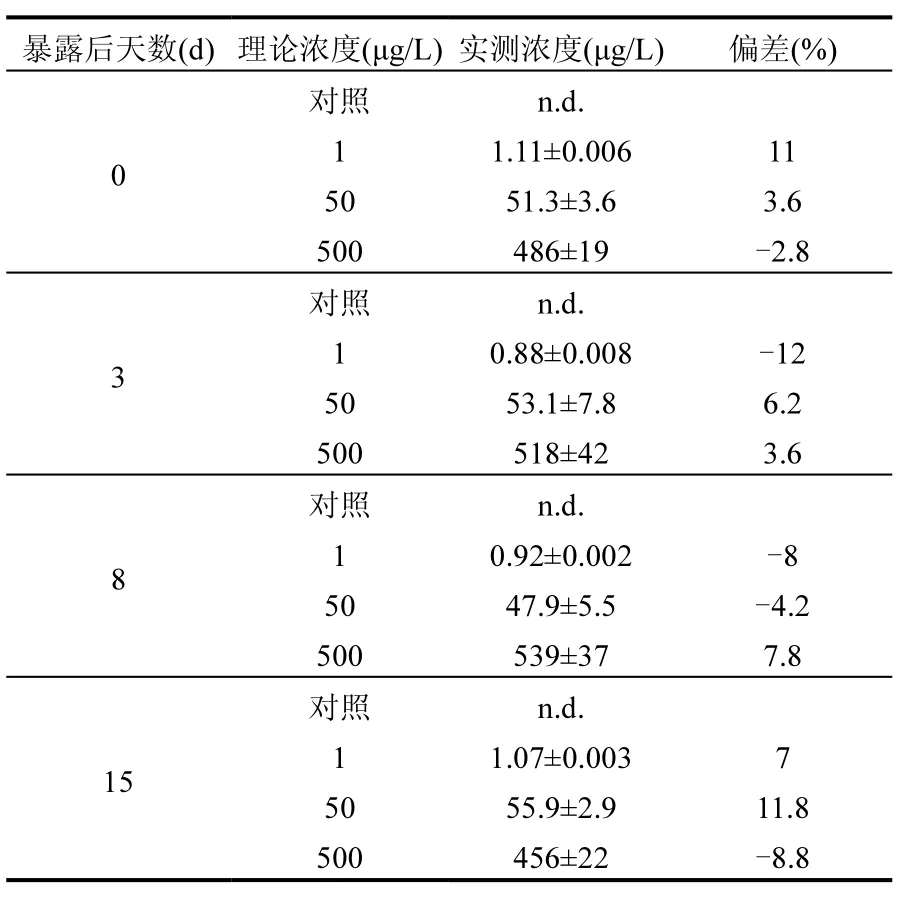
表2 苯醚甲环唑暴露溶液实测浓度Table 2 Chemical analysis result of difenoconazole solution
2.3 抗氧化酶活性变化
2.3.1 SOD活性变化 由图1可知,苯醚甲环唑处理后3d和8d时,斑马鱼脑中SOD活性未出现明显变化,当暴露时间达到15d时,50µg/L处理组中斑马鱼脑SOD活性显著下降,活性约为对照组的80%.斑马鱼肝脏在1µg/L苯醚甲环唑暴露8d 后,SOD活性显著上升.其余处理组中肝SOD活性在各时间点变化均不明显.
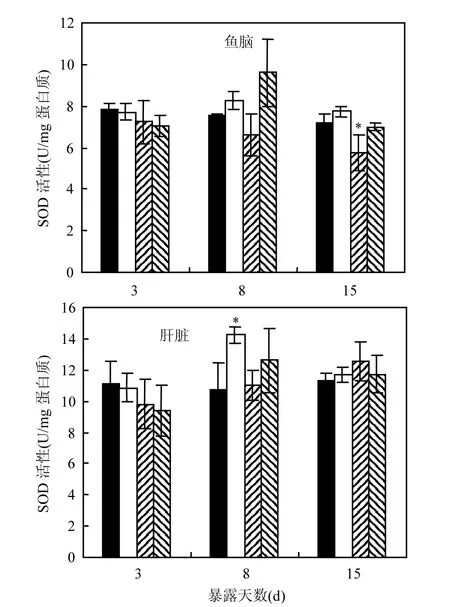
图1 苯醚甲环唑处理后斑马鱼脑和肝脏中SOD活性Fig.1 The activity of SOD in brain and liver tissue of zebrafish*代表处理组与对照组的显著性差异,P<0.05,*

当生物体内的氧化剂与抗氧化剂比率失衡时,就会产生氧化应激作用,该作用还能进一步对生物体内的脂类、蛋白质、碳水化合物和核酸等物质造成氧化损伤[24].活性氧(ROS)的大量激增是氧化应激作用的主要表现形式,而过量的活性氧会导致严重的细胞结构损伤[25].生物体内的解毒过程是多种酶的共同作用的结果,首先在SOD的作用下,将ROS转化成为H2O2,而产生的H2O2 由CAT和GPx进一步分解为水和氧气[26].因此,测试抗氧化酶的活性被认为是鉴别生物体内氧化应激作用的一种有效方法.
Zhu等[27]测定了5种三唑类农药(腈菌唑、氟康唑、氟硅唑、氟菌唑和氟环唑)对稀有鮈鲫(Gobiocypris rarus)胚胎SOD活性的影响,发现0.2mg/L氟康唑和腈菌唑处理72h时后,稀有鮈鲫胚胎SOD活性显著上升,而另外3种三唑类农药在该浓度下对SOD活性无显著影响;当处理浓度达到1.0mg/L时,除氟硅唑外,4种三唑类农药均能显著诱导稀有鮈鲫胚胎中SOD活性;而当处理浓度提高至5mg/L时,5种三唑类农药对稀有鮈鲫胚胎中SOD活性产生明显的抑制作用.该研究表明,三唑类化合物在不同暴露浓度下,对鱼类SOD活性的影响趋势不同.Li等[15]发现,50µg/L丙环唑处理30d后,能够诱导虹鳟鱼脑中SOD活性显著上升.与上述结果不同,苯醚甲环唑处理后,斑马鱼脑和肝脏中SOD活性变化未见明显规律.这说明不同三唑类农药对鱼类抗氧化系统的影响可能存在差异.
2.3.2 CAT活性变化 由图2可知,在暴露后3d 时,50,500µg/L处理组中斑马鱼脑CAT活性显著升高,活性分别为对照组的1.4倍和1.5倍.在8d 时,50µg/L组中脑CAT活性回复至正常水平,500µg/L组中脑CAT活性仍显著高于对照组,约为对照组的1.25倍.而当暴露时间达到15d 时,50,500µg/L处理组中斑马鱼脑CAT活性较对照组显著下降,活性分别为对照组的67%和65%.
在暴露后3d时,所有处理组中斑马鱼肝CAT活性均低于对照组,其中50,500 µg/L组CAT活性甚至不足对照组的50%.在8d时,所有暴露组CAT活性均显著低于对照组,各组斑马鱼肝脏CAT活性分别为对照组的77%、59%和71%.当暴露时间达到15d后,1 µg/L组斑马鱼肝CAT活性与对照组无明显差异,而50,500µg/L组中CAT活性仍显著低于对照组,分别为对照组的68%和63%.
一些研究已经发现三唑类化合物能够影响水生生物体内的过氧化氢酶活性,Li等[28]发现,以致死中浓度(LC50)剂量的丙环唑处理虹鳟鱼后,虹鳟鱼肝脏中CAT活性升高,而同时鳃中CAT活性下降,该研究反映出三唑类化合物处理后,不同组织的氧化应激效应可能存在差异.Bagnyukova等[29]的研究结果表明,三唑类除草剂杀草强暴露后,金鱼(Carassius auratus)脑中CAT活性显著下降,且下降呈明显的浓度梯度效应.本试验组之前的研究也发现苯醚甲环唑短期处理8d后,斑马鱼胚胎和成鱼肝脏中CAT活性显著下降,同时伴随CAT酶的编码基因表达下调[30].在本研究中,苯醚甲环唑处理后,斑马鱼脑和肝脏中的CAT活性均出现显著变化.其中肝脏中CAT的变化情况更加明显,在检测的3个时间点中,暴露组中斑马鱼肝脏CAT活性均显著低于对照组.这一结果与我们之前的研究结果相符合[30].另外,与其他3种酶相比,CAT在肝脏中表现出的应激反应更为迅速、明显,其活性在暴露后第3d就出现显著变化;而SOD、GR和GPx 3种酶的活性在暴露8d后才出现显著变化.
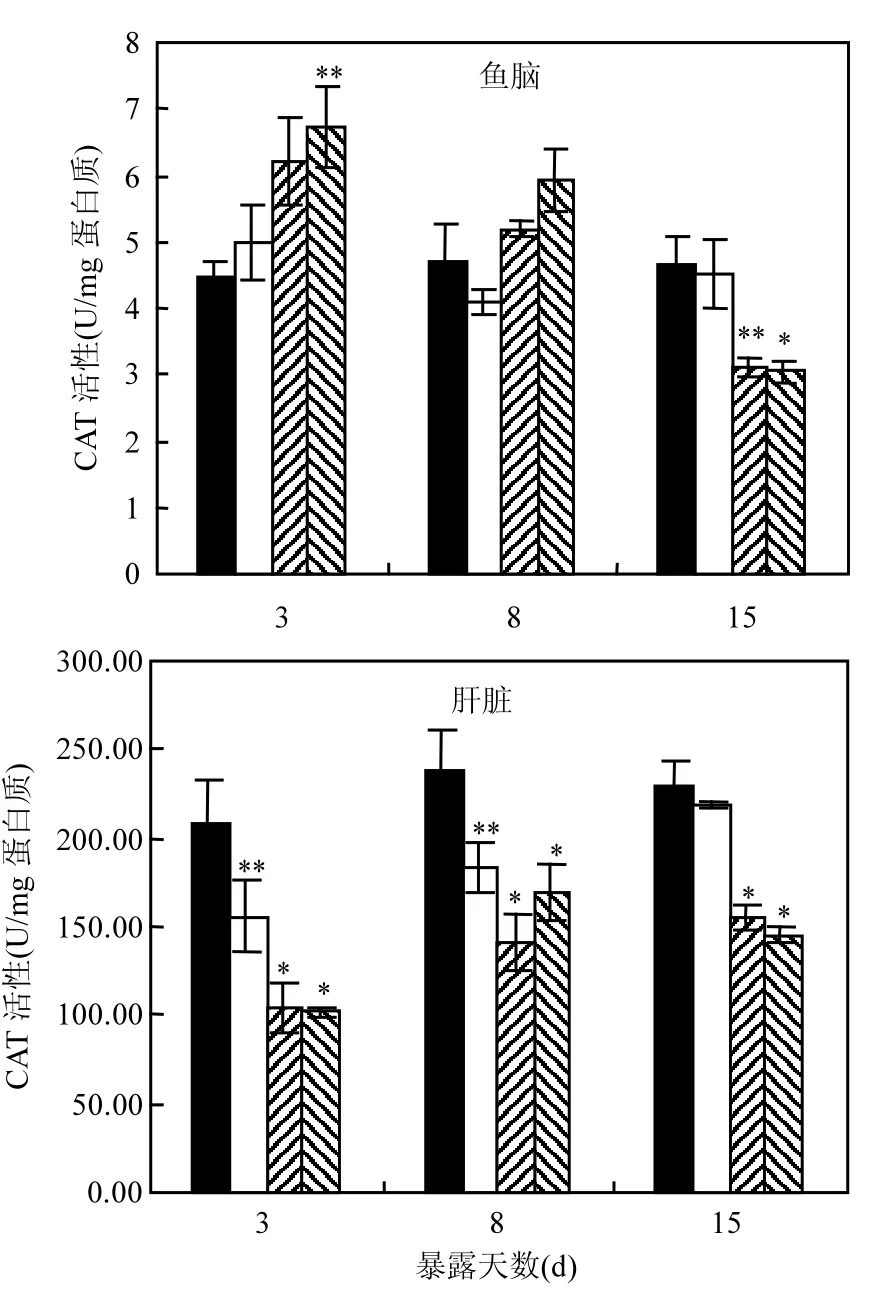
图2 苯醚甲环唑处理后斑马鱼脑和肝脏中CAT活性Fig.2 The activity of CAT in brain and liver tissue of zebrafish*代表处理组与对照组的显著性差异(P<0.05, *; P<0.01, **)

苯醚甲环唑处理后,斑马鱼脑CAT活性变化呈现出基于暴露时间的不同趋势.在暴露后3d和8d时,CAT活性上升;而在15dpe时,CAT活性下降.Li等[31]的研究发现0.5mg/L丙环唑处理7d后,虹鳟鱼脑中CAT活性显著上升,而在暴露后15d 和30d时,CAT活性显著低于对照组,该结果中CAT酶活性变化趋势与本研究相同.CAT能够催化H2O2生成水和氧气,从而减轻自由基对鱼体的氧化损伤.当污染物处理浓度在一定范围内累积增加,活性氧自由基的大量产生会诱导CAT催化反应,使其活性增强[32],这可能是本试验中8d之前CAT活性上升的原因.然而随着暴露浓度的增加或暴露时间的延长,一旦污染物在生物体内的含量达到一定浓度,就会导致包括抗氧化酶在内的细胞内酶受损,从而其清除活性氧的功能也随之丧失[33].因此,本研究中出现的CAT活性下降,很可能是斑马鱼脑中抗氧化能力不足的信号[34].类似的CAT活性变化趋势也出现在高效氯氰菊酯处理后的斑马鱼中[22].而苯醚甲环唑处理后,斑马鱼肝脏中CAT活性仅出现下降,并未见上升,这可能是由于肝脏作为主要代谢解毒器官,其氧化应激作用的敏感性更强,反应更快,在第一次取样前CAT活性已经完成了由升高到降低的调节过程.周常义等[35]的研究发现,三唑磷处理后,泥蚶(Tegillarca granosa)血液中的CAT活性在暴露后第1d时显著上升,而从暴露后第2d开始, CAT活性即显著低于对照组,该研究表明暴露于三唑类化合物后,CAT活性由上升到下降的趋势变化过程可能只需较短时间,支持了上述假设.
2.3.3 GR活性变化 由图3可知,在暴露后3d 时,1µg/L处理组中斑马鱼脑GR活性显著升高,活性约为对照组的1.5倍.而在8d时,各处理组GR活性与对照组均无显著差异.暴露15d后,50, 500µg/L处理组中斑马鱼脑GR活性较对照组显著上升.
斑马鱼肝脏中GR活性在暴露后3d和8d时均未发生显著变化,当暴露时间达到15d时, 1µg/L和500µg/L处理组中斑马鱼肝GR活性显著下降,分别为对照组的65%和72%.
本研究中,苯醚甲环唑处理后,斑马鱼脑和肝脏中GR活性变化趋势不同,其中脑中GR活性上升,而肝脏中GR活性显著降低.Mu等[22]的研究发现,高效氯氰菊酯处理30d后,斑马鱼脑中GR活性升高,而肝脏中GR活性下降,该研究结果趋势与本研究相似.谷胱甘肽还原酶的功能是维持细胞内还原型谷胱甘肽(GSH)的含量.调控GR活性变化的机制目前尚不明确,但是有研究认为氧化态谷胱甘肽(GSSG)含量升高,可能是诱导GR活性的关键因素[36].因此后续研究可通过测定苯醚甲环唑处理后,目标组织中的GSSG含量变化,来进一步明确GR活性变化的机理.
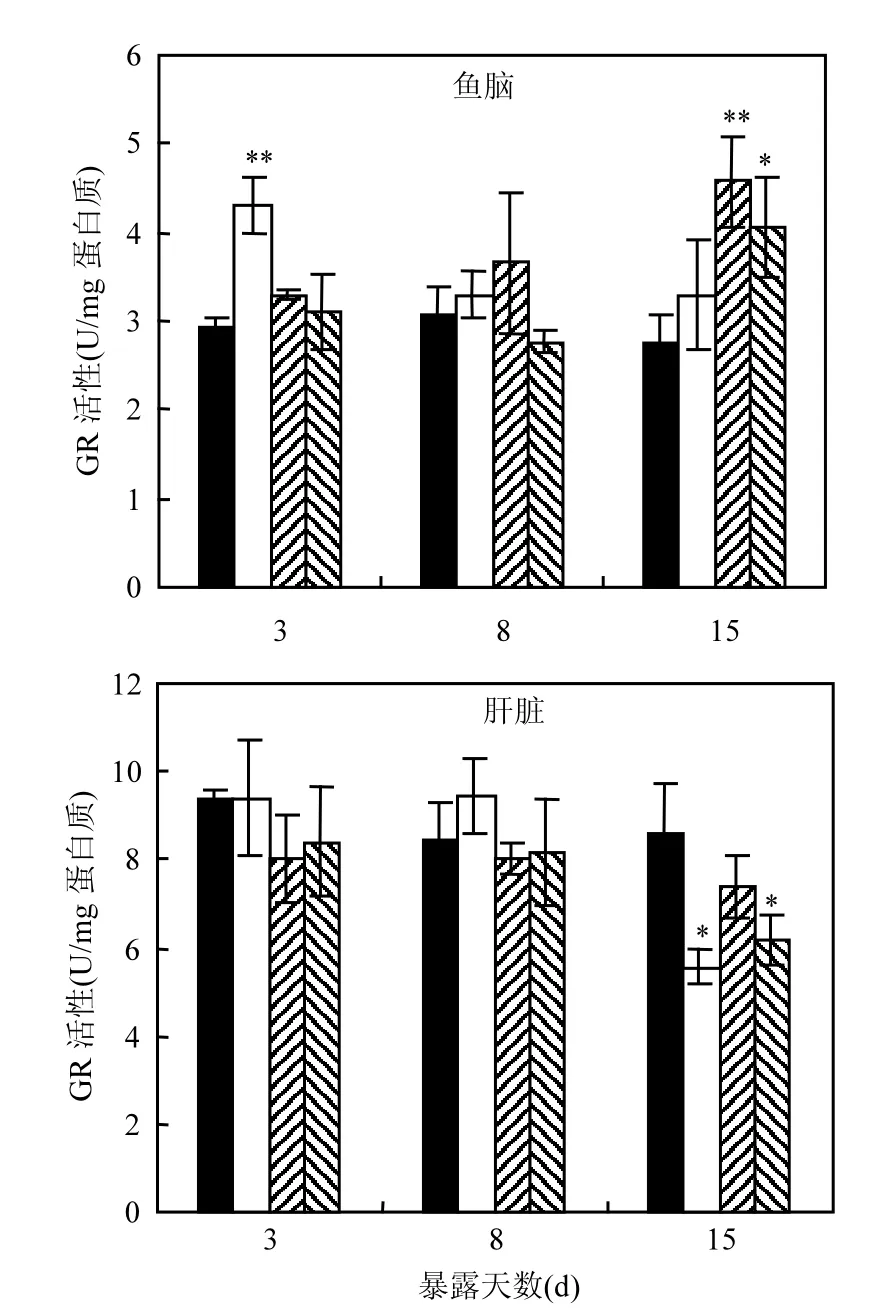
图3 苯醚甲环唑处理后斑马鱼脑和肝脏中GR活性Fig.2 The activity of GR in brain and liver tissue of zebrafish*代表处理组与对照组的显著性差异(P<0.05, *; P<0.01, **)

2.3.4 GPx活性变化 由图4可知,500µg/L苯醚甲环唑能够显著抑制斑马鱼脑中谷胱甘肽过氧化物酶的活性,且抑制程度随暴露时间的延长而增加,不同取样时间时500µg/L组GPx活性分别相当于对照组的79%(3d)、73%(8d)和48%(15d).50µg/L组的GPx活性在15d时,也出现显著下降,约为对照组的50%.
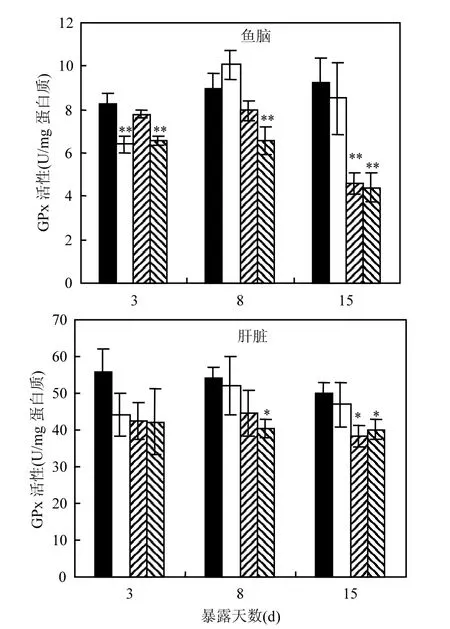
图4 苯醚甲环唑处理后斑马鱼脑和肝脏中GPx活性Fig.4 The activity of GPx in brain and liver tissue of zebrafish*代表处理组与对照组的显著性差异(P<0.05, *; P<0.01, **)
在暴露后3d时,苯醚甲环唑处理对斑马鱼肝脏中GPx活性无明显影响.而在暴露后8d时, 500µg/L组中GPx活性较对照组显著下降.当暴露时间延长至15d时,50,500µg/L处理组中GPx活性均显著低于对照组,酶活性分别为对照组的77%和80%.
谷胱甘肽过氧化物酶被认为是能够有效防止脂质过氧化的保护性酶,它能催化过氧化氢的还原反应,对由活性氧和羟自由基诱发的脂质过氧化物及过氧化氢有极强的清除能力,从而保护生物大分子和生物膜结构免受过氧化物损伤[37]. Li等[38]的研究发现,丙环唑长期处理后,虹鳟鱼肝脏中GPx活性显著升高;与此同时鳃和肌肉中的GPx活性显著下降.李红艳等[39]的研究发现,三唑磷暴露3d和7d时,斑节对虾鳃中GPx活性被显著抑制,但当暴露时间达到14d时,GPx活性较对照组显著升高.在本研究中,苯醚甲环唑处理后,斑马鱼脑和肝脏中GPx活性均出现下降,其中脑中GPx活性下降程度更大.脑中含有大量容易被氧化的多不饱和脂肪酸[40],在暴露于外源有毒物质后,很容易发生脂质过氧化,因此迫切需要激活GPx,以消除脂质过氧化物;然而脑自身并非解毒代谢器官,自身抗氧化能力有限,因此可能出现GPx抗氧化系统的失调,进一步导致其活性下降.Li等[31]研究了丙环唑对虹鳟鱼脑中抗氧化系统的影响,发现在7d时,虹鳟鱼(Oncorhynchus mykiss)脑中GPx活性无明显变化且未出现脂质过氧化;当暴露时间达到20d后,虹鳟鱼脑中GPx活性显著下降,同时伴随脂质过氧化物含量显著升高.该研究结果与本文中的结果及推论相一致. 2.4 环境中苯醚甲环唑对鱼类的氧化应激作用根据本研究的结果,1µg/L的苯醚甲环唑就能引起斑马鱼脑和肝脏中的抗氧化酶活性出现变化,而50µg/L的苯醚甲环唑能够对斑马鱼的抗氧化系统产生比较明显的干扰作用.结合表1可知,目前苯醚甲环唑在普通地表水中的检出浓度均远低于本试验中能引起斑马鱼氧化应激作用的浓度.但是应注意在靠近农业区的水域中,苯醚甲环唑可达较高水平(0.3mg/L),因此苯醚甲环唑对农业水域中的鱼类,尤其是在稻田中饲养的家鱼的影响应得到重视.
3 结论
3.1 斑马鱼脑中CAT活性在苯醚甲环唑暴露后3d时显著高于对照组;而在苯醚甲环唑暴露后15d时,显著低于对照组.50µg/L或更高浓度的苯醚甲环唑能够显著抑制斑马鱼肝脏中CAT活性. 3.2 50µg/L或更高浓度的苯醚甲环唑能够显著抑制斑马鱼脑和肝脏中的GPx活性,其中斑马鱼脑中GPx被抑制程度更强.
3.3 50µg/L的苯醚甲环唑能够对斑马鱼的抗氧化系统产生较明显的干扰作用,而该浓度低于农业水域中苯醚甲环唑的浓度,其对农业水域中的鱼类影响值得重视.
参考文献:
[1] Wang C, Wu Q, Wu C, et al. Application of dispersionsolidification liquid-liquid microextraction for the determination of triazole fungicides in environmental water samples by highperformance liquid chromatography [J]. Journal of Hazardous Materials, 2011,185:71-76.
[2] 柏亚罗.2012-2016年专利过期农药品种点评(上) [J]. 中国农药, 2014,2014(1):16-32.
[3] Ragsdale N N. Inhibition of fungal ergosterol synthesis [C]// Siegel M R, Sisler H D. Antifungal Compounds: Interactions in Biological and Ecological Systems., Marcel Dekker Inc., New York, 1997:333–363.
[4] Hamada M S, Yin Y, Ma Z. Sensitivity to iprodione, difenoconazole andfludioxonil of Rhizoctonia cerealis isolates collected from wheat in China. Crop. Prot., 2011,30:1028–1033. [5] Buchenauer H. DMI-fungicidesdside effects on the plant and problems ofresistance [C]//Modern Selective Fungicides., Gustav Fischer Verlag, New York, 1995:259–290.
[6] 张志勇,王冬兰,张存政,等.苯醚甲环唑在水稻和稻田中的残留[J]. 中国水稻科学, 2011,31(2):339-342.
[7] Satapornvanit K, Baird D J, Little D C, et al. Risks of pesticide use inaquatic ecosystems adjacent to mixed vegetable and monocrop fruit growingareas in Thailand [J]. Australas. J. Ecotoxicol., 2004,10:85-95.
[8] Latiff K A, Bakar N K A, Isa N M. Preliminary study of difenoconazoleresidues in rice paddy watersheds [J]. Malays. J. Sci., 2010,29:73-79.
[9] 游明华.天然水中9种三唑类农药的检测方法及其非生物降解研究 [D]. 厦门:厦门大学, 2009.
[10] Verro R, finizio A, Otto S, et al. Risk in intensive agricultural areas. I:screening level risk assessment of individual chemicals in surface waters [J]. Environ. Sci. Technol., 2009,43:522–529.
[11] Schäfer R B, Pettigrove V, Rose G, et al. Effects of pesticides monitored with threesampling methods in 24sites on macroinvertebrates and microorganisms [J]. Environ. Sci. Technol., 2011,45:1665–1672.
[12] EFSA. Conclusion on the Peer Review of the Pesticide Risk Assessment of the Active Substance Difenoconazole [M]. 2011, European Food Safety Authority, Parma, Italy.
[13] 王雨林.稻田养鱼发展的现实意义分析 [J]. 安徽农业科学, 2009,37(27),13256-13258.
[14] 黎玉林,刘燕丽.稻田养鱼对农业资源利用效率的影响 [J]. 中国农学通报, 2006,22(10):467-472.
[15] Li Z, Zlabek V, Li P, et al. Biochemical and physiological responses in liver and muscle of rainbow trout after long-term exposure to propiconazole [J]. Ecotoxicology and Environmental Safety, 2010,73:1391-1396.
[16] Vasylkiv O Y, Kubrak O I, Storey K B, et al. Catalase activity as a potential vital biomarker of fish intoxication by the herbicide aminotriazole. Pesticide Biochemistry and Physiology, 2011,101: 1-5.
[17] OECD. OECD Guidelines for the Testing of Chemicals [S]. In: Section 2: Effects on Biotic Systems Test No. 203: Acute Toxicity for Fish. 1992, Organization for EconomicCooperation and Development, Paris, France.
[18] GB/T 27861-2011 化学品鱼类急性毒性试验 [S]. 2011.
[19] Mu X, Pang S, Sun X, et al. Evaluationof acute and developmental effects of difenoconazole via multiple stagezebrafish assays [J]. Environ. Pollut., 2013,175:147–157.
[20] Mu X, Wang K, Chai T, et al. Sex specific response in cholesterol level in zebrafish (Danio rerio) after long-term exposure of difenoconazole [J]. Environ. Pollut., 2015,197:278-286.
[21] Beers R F, Sizer I W. A spectrophotometric method for measuring the breakdown of hydrogen peroxide by catalase [J]. J Biol. Chem., 1952,195:133-140.
[22] Mu X, Wang K, Chen X, et al. Impact of environmental concentrations of betacypermethrin on the antioxidant system in the brain and liver of zebrafish (Danio rerio) [J]. Chemistry and Ecology, 2014,30:643-652.
[23] OECD. OECD Guidelines for the Testing Chemicals [S]. In: No. 204: Fish, Prolonged Toxicity Test: 14-day Study. 1984, Organization for Economic Cooperation and Development, Paris, France.
[24] Jin Y, Zheng S, Pu Y, et al. Cypermethrin has the potential to induce hepatic oxidative stress, DNA damage and apoptosis in adult zebrafish (Danio rerio) [J]. Chemosphere, 2011,82:398-404.
[25] Barzilai A, Yamamoto K I. DNA damage responses to oxidative stress [J]. DNA Repair 3, 2004:1109-1115.
[26] Pi J, Zhang Q, Fu J, et al. ROS signaling, oxidative stress and Nrf2in pancreatic beta-cell function [J]. Toxicol. Appl. Pharmacol., 2010,244:77-83.
[27] Zhu B, Liu L, Gong Y, et al. Triazole-induced toxicity in developing rare minnow (Gobiocypris rarus) embryos [J]. Environ Sci Pollut Res., 2014,21:13625-13635.
[28] Li Z, Zlabek V, Velisek J, et al. Multiple biomarkers responses in juvenile rainbow trout, oncorhynchusmykiss, after acute exposure to a fungicide propiconazole [J]. Environ. Toxicol., 2013,28: 119–126.
[29] Bagnyukova T V, Vasylkiv O Y, Storey K B, et al. Catalase inhibition by amino triazole induces oxidative stress in goldfish brain [J]. Brain Research, 2005,1052:180-186.
[30] Mu X, Chai T, Wang K, et al. Occurrence and Origin of Sensitivity Toward Difenoconazole in Zebrafish (Danio reio) During Different Life Stages [J]. Aquatic Toxicology, 2015,160: 57-68.
[31] Li Z H, Zlabek V, Grabic R, et al. Effects of exposure to sublethal propiconazole on the antioxidant defense system and Na+-K+-ATPase activity in brain of rainbow trout, Oncorhynchus mykiss [J]. Aquat. Toxicol., 2010,98:297-303.
[32] 杨 帆,邹 容,孙翰昌,等.辛硫磷对岩原鲤肝脏抗氧化防御系统的胁迫与生物响应 [J]. 水生态学杂志, 2011,32(6):115-120. [33] 陈家长,孟顺龙,胡庚东,等.低浓度阿特拉津对鲫鱼过氧化氢酶(CAT)活性的影响 [J]. 农业环境科学学报, 2008,27(3):1151-1156.
[34] Dogan D, Can C, Kocyigit A, et al. Dimethoate-induced oxidative stress and DNA damage in Oncorhynchus mykiss [J]. Chemosphere, 2011,84:39-46.
[35] 周常义,严重玲,黄 成,等.三唑磷对泥蚶急性毒性及血清SOD, CAT酶活性的影响 [J]. 海洋科学, 2004,28(12):43-48.
[36] Carleberg I, Mannervik B. Purification and characterization of flavoenzyme glutathione reductase from rat liver [J]. J. Biol. Chem., 1975,250:5475–5480.
[37] Srikanth K, Pereira E, Duarte A C, et al. Glutathione and its dependent enzymes’ modulatory responses to toxic metals and metalloids in fish-a review [J]. Environ. Sci. Pollut. Res., 2013,20: 2133–2149.
[38] Li Z, Zlabek V, Grabic R, et al. Modulation of glutathionerelated antioxidant defense system of fish chronically treated by the fungicide propiconazole [J]. Comparative Biochemistry and Physiology, Part C, 2010,152:392-398.
[39] 李红艳,张 喆,陈海刚,等.三唑磷对斑节对虾肝胰腺和鳃的氧化胁迫效应 [J]. 农业环境科学学报, 2013,32(12):2345-2351.
[40] Mates J M. Effects of antioxidant enzymes in the molecular control of reactive oxygen species toxicology [J]. Toxicol., 2000,153:83-104.
Impact of difenoconazole on the antioxidases of zebrafish (Danio rerio).
MU Xi-yan1,2, HUANG Ying2, SHEN Gong-ming2, CHAI Ting-ting1, ZHU Li-zhen1, LI Xu-xing2, LEI Yun-lei2, FENG Geng-fei2, LI Ying-ren2, LI Xue-feng1*, WANG Cheng-ju1*(1.College of Sciences, China Agricultural University, Beijing 100193, China;2.Fishery Resource and Environment Research Center, Chinese Academy of Fishery Sciences, Beijing 100141, China). China Environmental Science, 2016,36(4):1242~1249
Abstract:To investigate the effect of difenoconazole on zebrafish antioxidases, adult zebrafish were exposed to three concentrations of difenoconazole for 15days. The activity of superoxide dismutase (SOD), catalase (CAT), glutathione peroxidase (GPx) and glutathione reductase (GR) was measured at 3, 8 and 15 days post exposure (dpe) respectively. Results indicated that the brain CAT activity was increased at 3 and 8 dpe but decreased at 15 dpe. 50µg/L or higher difenoconazole could inhibit brain and hepatic GPx activity of zebrafish, and the inhibition in brain was stronger than liver. In addition, brain GR activity was induced by 500µg/L difenoconazole while hepatic GR activity was reduced under the same exposure. These results implicated that 50µg/L could alter the antioxidant system of zebrafish and its effects on fish living in agricultural water areas should be concerned.
Key words:difenoconazole;zebrafish;antioxidase;brain;liver
作者简介:穆希岩(1987-),男,北京人,中国水产科学研究院资源与环境研究中心助理研究员,主要研究方向为渔业生态环境.发表论文12篇.
基金项目:农业部科研专项,农药风险评估综合配套技术研究-水生生物慢性毒性方法(200903054-02);农业部财政项目物种资源保护(2130135)
收稿日期:2015-09-20
中图分类号:X171.5
文献标识码:A
文章编号:1005-6923(2016)04-1242-09

