镉胁迫下红麻幼根的生理响应
邓勇,黄思齐,李建军,唐慧娟,李辉,陈安国,李德芳,陈金湘
(1.湖南农业大学棉花研究所,长沙 410128;2. 中国农业科学院麻类研究所,长沙 410205)
镉胁迫下红麻幼根的生理响应
邓勇1,2,黄思齐2,李建军2,唐慧娟2,李辉2,陈安国2,李德芳2,陈金湘1*
(1.湖南农业大学棉花研究所,长沙 410128;2. 中国农业科学院麻类研究所,长沙 410205)
摘要:红麻具有生长迅速、生物量大、抗重金属能力强以及适应性广等特点,并且红麻不仅能够治理土壤污染,还可以获得较高的经济效益。本研究以中红麻13号为材料,采用水培技术,研究不同浓度镉胁迫(10、50、100、150和200 μM)在不同处理时间(1、2、3、4、5和6天)下对红麻幼苗根系的膜质过氧化,非酶抗氧化物质含量及抗氧化酶活性的影响。结果表明红麻幼根丙二醛、AsA含量与胁迫时间和镉浓度呈现正相关。GSH含量在较低镉浓度下随镉胁迫的时间延长呈上升趋势,而150 μM和200 μM镉处理下,GSH含量随时间的延长先增加后减少。SOD和POD活性在较低浓度下都随镉胁迫时间的延长呈先增加后减少的趋势,而200 μM镉处理下的SOD活性和在150 μM与200 μM镉处理下POD活性均随镉胁迫时间的延长呈减少趋势。在较低浓度镉胁迫下,植株通过提高体内的抗氧化保护酶的活性以及合成AsA和GSH等非酶抗氧化物质来抵御镉胁迫,在一定程度上缓解了镉胁迫的伤害。综上所述,AsA和GSH含量及抗氧化酶活性的变化可能是红麻抵御镉毒害与抗性的重要生理基础。
关键词:红麻;镉胁迫;抗氧化系统
由于矿产资源的不合理开发,工业“三废”的大量排放和重金属超标农药肥料的过量施用,导致重金属污染越来越严重[1]。我国被镉、砷、铅等重金属污染的面积已经高达上千万公顷,而且出现日益加剧的趋势。土壤重金属污染的治理极其迫切,而植物修复技术具有成本低、效果好、无二次污染、固土防流失等优点,引起国内外广泛关注[2]。但目前发现的很多超富集植物都存在生物量较小,生长缓慢等效率偏低[3]的问题。而红麻具有生长周期短、生物量大(为树木的三到四倍)、抗重金属能力强、适应性广等特点[4],又因为是纤维作物,不易将重金属带入食物链[5]。因此,红麻有望用于治理大面积受重金属污染的土壤,不仅能够治理土壤污染,还可以获得较高的经济效益[6]。
前人研究发现,活性氧累积造成氧化胁迫,是镉毒害的重要机制之一[7]。植物体内的抗氧化酶系统和非酶抗氧化物质的调节作用是其抗镉的主要生理机制[8]。超氧化物歧化酶(SOD)是植物清除活性氧的第一道防线,它的功能是将体内的O2-转化为氧化作用较弱的H2O2;而过氧化物酶(POD)与过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)等组成活性氧清除系统的第二道防线,主要将H2O2转化为无害的H2O和O2,从而在一定程度上缓解镉毒害导致的氧化损伤[9]。抗坏血酸(AsA)和还原型谷胱甘肽(GSH)以及脯氨酸、类胡萝卜素、维生素E等非酶抗氧化物质不仅可以清除活性氧,有的还能作为相关酶的底物[10-11],或协同提高相关酶的活性[12],从而在一定程度上提高植物对逆境胁迫的耐受能力[9]。Iannelli[13], Sandalio[14]和Parameswaran[15]的研究表明,植物抗氧化系统对镉胁迫的反应有差异,这取决于物种对镉胁迫耐性的差异以及镉浓度、处理时间的不同。杨居容等[16]发现,耐性强的作物在镉胁迫下抗氧化酶活性升高,而耐性弱的作物抗氧化酶的活性下降。邵国胜等[17]研究表明,耐性品种在镉胁迫下抗氧化酶活性显著高于敏感性品种。可见,植物体内抗氧化防御系统的能力强弱可能是其对镉胁迫耐性差异的关键因素。
关于镉胁迫下红麻生理响应特性的报道很少。李兰平[18]发现铅、镉胁迫下杂交品种生理指标的变化,与亲本相比受胁迫影响最不明显,表现出显著的杂种优势。李丰涛[6]分析耐性不同的两个红麻品种镉胁迫下生理指标的差异,认为GR活性在抵御镉胁迫中起重要作用,并从蛋白水平上研究外源GSH对红麻镉胁迫的缓解效应。本试验以中红麻13号为材料,采用不同浓度的镉胁迫处理,以未进行胁迫处理的作为对照,研究不同浓度镉胁迫在不同处理时间下红麻幼根生理响应的特性,以期明确镉胁迫下红麻幼苗的适应情况,为红麻耐镉品种的培育及红麻修复镉污染土壤的研究提供一定的理论参考。
1材料与方法
1.1试验材料
参试材料为中红麻13号,由中国农业科学院麻类研究所一年生麻类作物遗传改良创新团队提供。
1.2试验方法
发芽试验:红麻种子使用前用蒸馏水清洗,后置于发芽盒滤纸上。发芽盒置于25℃培养箱中在黑暗条件下萌发48 h。培养条件如下:光周期16/8 h,昼夜温度为30/26℃,相对湿度为60/100,光强为700 μmol/(m2·s)。
幼苗培养:转移到1 /4 Hoagland培养液中水培,在培养室内培养5天,培养条件同上。Hoagland营养液配方为Ca(NO3)25.79 mM,KNO38.02 mM ,NH4H2PO41.35 mM,MgSO44.17 mM,MnSO48.90 μM,H3BO348.3 μM,ZnSO40.94 μM,CuSO40.20 μM,(NH4)2MoO40.015 μM,Fe-EDTA 72.6 μM,用 NaOH调节 pH 6.5 左右。
试验处理:预培养5天的红麻幼苗,挑选长势一致的幼苗转移到含有不同浓度CdCl2(10,50,100,150,200 μM)的1/4 Hoagland培养液中,培养液每两天换一次。以转移到不含CdCl2培养液的幼苗作为对照(CK),实验设三次重复。
1.3取样测定
镉处理后连续6天每天取样,取各处理的红麻根系用去离子水冲洗干净,称取0.5 g鲜样,液氮研磨,分别用于丙二醛、AsA和GSH含量和抗氧化酶的活性检测。
用硫代巴比妥酸比色法测定丙二醛(MDA)含量[19];GSH 含量参照孙群和胡景江的方法测定[20];抗坏血酸(AsA)含量参照邹琦的方法测定[21];抗氧化酶的酶活性测定所需上清液的提取参照李合生等[22]的方法,抗氧化酶活性的测定采用用试剂盒法,试剂盒由南京建成生物有限公司提供。
1.4数据处理
利用 Microsoft Excel 2013 和 SPSS 22软件进行数据分析,采用新复极差法对第六天的生理指标进行差异显著性检验。
2结果与分析
2.1镉胁迫对红麻丙二醛( MDA)含量的影响
如图1所示,镉胁迫下红麻幼苗根系MDA含量随镉胁迫时间的延长呈上升趋势,而对照中变化极小。红麻根系MDA含量随镉浓度的增加,在10 μM镉处理下,低于对照,而50 μM及更高浓度的镉处理下,都高于对照,且随着镉浓度的增加MDA含量增加的幅度上升。如表1所示,10 μM镉处理下,MDA含量与对照没有显著差异,而50 μM及更高浓度的镉处理下,都显著高于对照(P<0.05)。MDA含量在200 μM镉处理下达到最大值,比对照高87.2%。

图1 镉胁迫对红麻幼根MDA含量的影响
表1镉胁迫六天对红麻幼根的生理特性的影响
Tab.1Effects of different Cd treatments for 6 days on the physiological characteristics of Kenaf roots
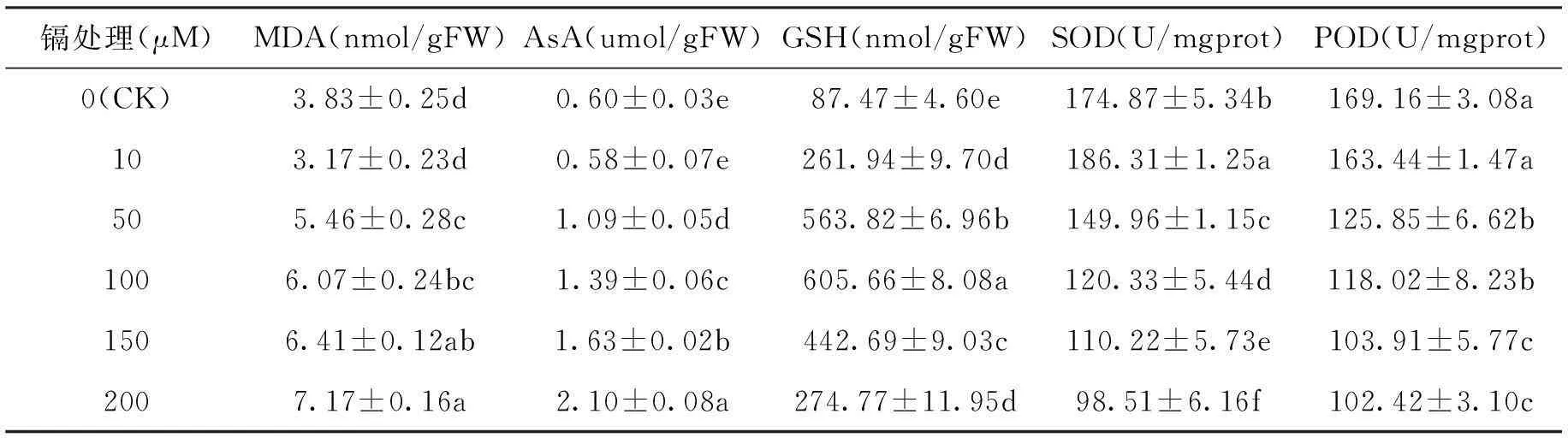
镉处理(μM)MDA(nmol/gFW)AsA(umol/gFW)GSH(nmol/gFW)SOD(U/mgprot)POD(U/mgprot)0(CK)3.83±0.25d0.60±0.03e87.47±4.60e174.87±5.34b169.16±3.08a103.17±0.23d0.58±0.07e261.94±9.70d186.31±1.25a163.44±1.47a505.46±0.28c1.09±0.05d563.82±6.96b149.96±1.15c125.85±6.62b1006.07±0.24bc1.39±0.06c605.66±8.08a120.33±5.44d118.02±8.23b1506.41±0.12ab1.63±0.02b442.69±9.03c110.22±5.73e103.91±5.77c2007.17±0.16a2.10±0.08a274.77±11.95d98.51±6.16f102.42±3.10c
注:同列不同字母表示差异达显著水平(P<0.05)。
2.2镉胁迫对红麻AsA 和GSH 含量的影响
如图2所示,红麻幼苗根系AsA含量随镉胁迫时间的延长呈上升趋势,但150 μM和200 μM镉处理下响应较迅速,第二天增加幅度较高。而10~100 μM镉处理下,前四天增加幅度较小,第五天增加幅度较大。图3中GSH含量在10~100 μM镉处理下随处理时间的延长呈上升趋势;150 μM镉处理下,GSH含量随处理时间的延长先增加后减少再增加;200 μM镉处理下,GSH含量随处理时间的延长先增加后减少。AsA含量随镉浓度的升高呈上升趋势,而GSH含量随镉浓度的升高先增加后减少。如表1所示,红麻AsA含量在10 μM镉处理下与对照相比没有显著差异,而50 μM及更高浓度的镉处理下,都显著高于对照(P<0.05)。各处理下GSH含量都显著高于对照(P<0.05)。AsA含量在200 μM镉处理下达到最大值,是对照的3.50倍。GSH含量在100 μM镉处理下达到最大值,是对照的6.92倍。

图2镉胁迫对红麻幼根AsA含量的影响图3镉胁迫对红麻幼根GSH含量的影响
Fig.2Effect of Cd on AsA content in kenaf rootsFig.3Effect of Cd on GSH content in kenaf root
2.3镉胁迫对红麻SOD 和POD活性的影响
如图4所示,在10~150 μM镉处理下红麻幼苗根系SOD活性随镉胁迫时间的延长呈先增加后减少的趋势。但200 μM镉处理下,SOD活性随镉胁迫时间的延长基本呈减少趋势。如图5所示,对照与 10 μM镉处理下红麻幼苗根系POD活性随镉胁迫时间的延长呈先增加后减少再增加的趋势。在50~100 μM镉处理下POD活性随镉胁迫时间的延长呈先增加后减少的趋势。而150~200 μM镉处理下, POD活性随镉胁迫时间的延长有些波动,但基本呈减少趋势。如表1所示,10 μM镉处理下,POD活性与对照相比没有显著差异,而SOD活性显著高于对照(P<0.05)。在50 μM及更高浓度的镉处理下,SOD活性与POD活性都显著低于对照(P<0.05)。SOD活性在200 μM镉处理下最低,只有对照的56.3%,在10 μM镉处理下最高,比对照高6.5%。POD活性在200 μM镉处理下最低,只有对照的60.5%。

图4镉胁迫对红麻幼根SOD活性的影响图5镉胁迫对红麻幼根POD活性的影响
Fig.4Effect of Cd on SOD activity in kenaf rootsFig.5Effect of Cd on POD activity in kenaf roots
3讨论
3.1镉胁迫对红麻丙二醛含量的影响
植物在重金属胁迫下,细胞内活性氧积累导致膜脂过氧化反应,内膜系统的完整性被破坏,丧失了细胞膜差别性渗透能力,进而离子交换平衡被打破,导致一系列生理生化代谢素乱[23]。丙二醛是脂质过氧化作用的产物之一,它的含量高低在一定程度上反映了自由基引起细胞膜损伤的程度,MDA 含量越高,膜脂过氧化程度越严重[24]。本研究中,10 μM镉处理下,红麻丙二醛含量与对照没有显著差异,可能与其抗氧化酶SOD、POD的活性较高有关,随着镉浓度上升,SOD、POD活性降低,丙二醛含量也随之增加,这与Metwal等人[25]的研究结果一致。Tang等[26]认为在长时间逆境胁迫后,MDA 含量会有下降,但本研究表明镉处理六天以内,红麻幼苗丙二醛含量与胁迫时间和镉浓度、处理时间可能呈现正相关。也许随着处理时间的进一步延长,植物可能会增强对逆境的耐受性,其清除自由基的酶催化和非酶系统也会加强,MDA含量可能会降低。
3.2镉胁迫对红麻AsA和GSH 含量的影响

3.3镉胁迫对红麻SOD和POD活性的影响
为了清除体内的活性氧,减轻和修复氧化损伤,植物形成了一套完整的抗氧化防御系统,包括酶催化系统和非酶系统两类[29]。SOD和POD是抗氧化防御系统最重要的抗氧化酶之一,其活性越高,植物对活性氧伤害的防御能力越强。本研究中,SOD和POD活性在较低浓度下都随镉胁迫时间的延长呈先增加后减少的趋势。这可能是因为随着镉胁迫的持续,过多的活性氧影响了 SOD 和POD酶活性,而Koca等[30]认为可能是非酶促系统的应激反应加强的结果。本研究中AsA和GSH含量在低浓度镉胁迫下随时间延续呈上升趋势,也许能佐证这种观点,尤其AsA含量在前四天变化幅度很小,第五天才大量增加。抗氧化酶系统与非酶抗氧化物质可能存在互作,一同组成了复杂的抗氧化网络,是植物抵御镉毒害与抗性的重要生理基础。而200 μM镉处理下的SOD活性和150 μM 、200 μM镉处理下的POD活性均随镉胁迫时间的延长呈减少趋势,与Shah等的研究结果一致[31],可能是因为高浓度的镉引起了过量自由基及过氧化氢产生,从而导致SOD 和POD酶本身受到损伤。
综合以上分析可以得知,红麻幼根受镉毒害的程度随镉浓度的增加与胁迫时间的延长而加重。在较低浓度镉胁迫下,植株通过提高体内的抗氧化保护酶的活性以及合成AsA、GSH等非酶抗氧化物质来抵御镉胁迫,在一定程度上缓解了镉胁迫的伤害。随着镉胁迫持续,不同抗氧化酶的活性及非酶抗氧化物质的含量受到的影响也不同。植物体内的抗氧化酶系统与非酶抗氧化物质可能存在互作,一同组成了复杂的抗氧化网络,是植物抵御镉毒害与抗性的重要生理基础。还需要进一步研究红麻耐镉机制,以提高红麻对镉胁迫的耐受性,并为红麻耐镉品种的培育以及红麻修复镉污染土壤的研究提供参考。
参考文献:
[1]郭琰. 环境正义与中国农村环境问题[J]. 学术论坛,2008(07):38-41.
[2]陈兴兰,杨成波. 土壤重金属污染、生态效应及植物修复技术[J]. 农业环境与发展,2010(03):58-62.
[3]Piechalak A,Tomaszewska B,Baralkiewicz D.Enhancing phytoremediative ability of Pisumsativum by EDTA application[J].Phytochemistry,2003,64: 1239-1251.
[4]赵丹,莫良玉,刘铭,等. 氮胁迫对红麻生理生化特性及干茎产量的影响[J]. 南方农业学报,2011(06):609-611.
[5]李兰平. 红麻对Pb、Cd的耐受性及其生理生化基础研究[D].南宁:广西大学,2012.
[6]李丰涛. 红麻对重金属的吸收特征及外源GSH缓解镉毒的机理研究[D].福州:福建农林大学,2013.
[7]Romero-Puertas M C, McCatthy I,Sandalio L M, PaIma J M, et al. Cadmium toxicity and oxidative metabolism of pea leaf peroxisomes[J]. Free Radical Research, 1999,31 Suppl:25-31(7).
[8]肖清铁. 水稻耐镉胁迫的生理响应[D].福州:福建农林大学,2011.
[9]单长卷. 干旱胁迫下冰草AsA、GSH代谢及茉莉酸的信号调控作用[D].西安:西北农林科技大学,2010.
[10]Shao H B, Guo Q J, Chu LY, et al. Understanding molecular mechanism of higher plant plasticity under abiotic stress[J]. Biointeifaces,2007,54(I):37-45
[11]上官李娜. 镉胁迫下镉敏感/钝感水稻突变体内AsA-GSH的循环变化研究[D].杭州:浙江大学,2008.
[12] 宋纯鹏,程艳丽,梅慧生. 维生素E对小麦叶片衰老的影响[J]. 植物学通报,1993(03):48-50.
[13] Iannelli M A, Pietrini F, Fiore L, et al. Antioxidant response to cadmium in Phragmites australis plants[J]. Plant Physiology and Biochemistry,2002,40:977-982.
[14]Sandalio L M, Dalurzo H C, Gomez M,et al.Cadmium-induced changes in the growth and oxidative metabolism of pea plants[J].Journal of Experimental Botany, 2001, 52: 2115-2126.
[15]Parameswaran A, Majeti N V P. Modulation of cadmium-induced oxidative stress in Ceratophyllum demersum by zinc involves ascorbate-glutathione cycle and glutathione metabolism [J]. Plant Physiology and Biochemistry,2005,43: 107-116.
[16]杨居荣,贺建群,蒋琬茹.Cd污染对植物生理生化的影响[J].农业环境保护,1995, 14: 193-197.
[17]邵国胜,Muhammad Jaffar Hassan,章秀福,等.镉胁迫对不同水稻基因型植株生长和抗氧化酶系统的影响[J].中国水稻科学,2004, 18(3): 239-244.
[18]李正文,李兰平,周琼,等. 不同浓度Cd、Pb对红麻抗逆生理特性的影响[J]. 湖北农业科学,2013,15:3568-3571.
[19]白宝璋,勒占忠,李德春. 植物生理生化测定技术[M].北京:中国科学技术出版社, 1995.
[20]孙群, 胡景江. 植物生理学研究技术[M]. 西安:西北农林科技大学出版社, 2006:1-200.
[21]邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2006:1-191.
[22]李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2001.
[23]Alscher R G, Erturk N, Heath L S. Role of superoxide dismutases ( SODs) in controlling oxidative stress in plants[J]. J. Exp. Bot. , 2002, 53: 1331-1341
[24]Liu Z J, Zhang X L, Bai J G, et al. Exogenous paraquat changes antioxidant enzyme activities and lipid peroxidation in drought -stressed cucumber leaves [J]. Sci. Hortic. , 2009, 121: 138-143.
[25]Metwally A, Finkemeier I, Georgi M, et al. Salicylic acidalleviates the cadmium toxicity in barley seedlings[J]. Plant physiology, 2003, 132: 272-281.
[26] Tang B, Xu S Z, Zheng X L, et al. Changes of Antioxidative Enzymes and Lipid Peroxidation in Leaves and Roots of Waterlogging-Tolerant and Waterlogging-Sensitive Maize Genotypes at Seedling Stage[J]. Agricultural Sciences in China,2010(05):651-661.
[27]Vo¨geli L R, Wagner G J. Relationship between cadmium, glutathione and cadmium binding peptides (phytochelatins) in leaves of intact tobacco seedlings[J]. Plant Science, 1996, 114:11-18.
[28]曾斌,王飞娟,朱诚,等. AsA-GSH循环对水稻突变体耐汞性的作用[J]. 作物学报,2008(05):823-830.
[29]Noctor G, Foyer C H. Ascorbate and glutathione: keeping oxidative oxygen under control[J]. Annu Rev Plant Physiol Plant Mol Boil, 1998, 49: 249-279.
[30]Koca H, Bor M, Ozdemir F, et al.The effect of salt stress on lipid peroxidation, antioxidative enzymes and praline content of sesame cultivars [J]. Environ Exp Bot, 2007, 60: 344-351.
[31]Shah K ,Kumar R G, Verma S, et al.Effect of cadmium on lipid peroxidetion,superoxide anion generation and activities of antioxidant enzymes in growing rice seedlings[J]. Plant Science,2001,161:1135-1144.
2016年1月麻类纤维及麻制品进出口情况统计资料
2016年1月进口

金额单位:美元
2016年1月出口

金额单位:美元
数据来源:中国纺织工业联合会统计中心
2016年2月麻类纤维及麻制品进出口情况统计资料
2016年第38卷第2期中国麻业科学PLANTFIBERSCIENCESINCHINA
2016年2月进口
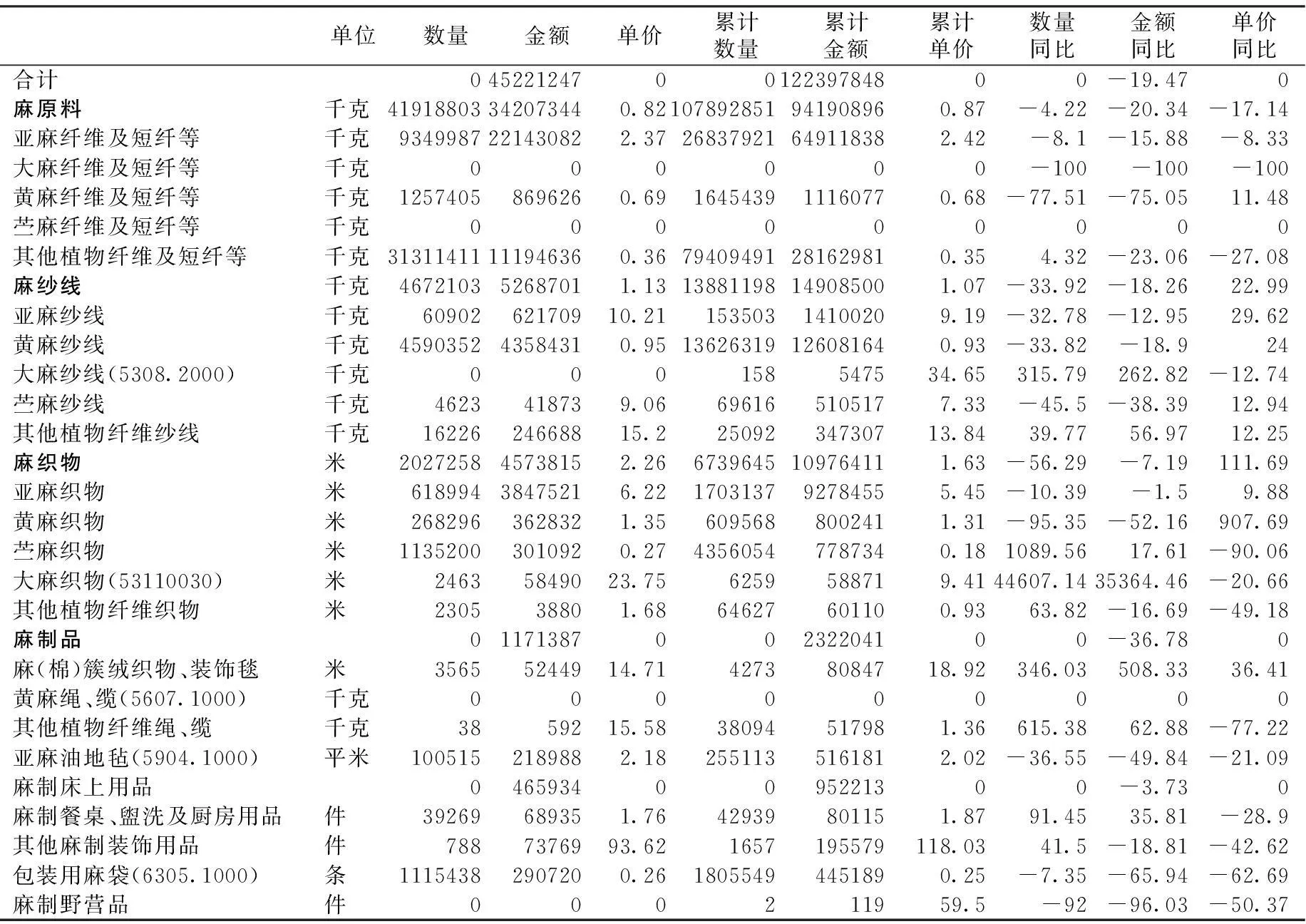
金额单位:美元
2016年2月出口

金额单位:美元
数据来源:中国纺织工业联合会统计中心
Physiological Response in the Roots of Kenaf
(HibiscusCannabinus) Seedings under Cadmium Stress
DENG Yong1,2,HUANG Siqi2,LI Jianjun2,TANG Huijuan2,LI Hui2,CHEN Anguo2,LI Defang2, CHEN Jinxiang1*
( 1. Cotton Research Institute of Hunan Agricultural University, Changsha 410128,China;2. Institute of Fiber Crops,Chinese Academy of Agricultural Sciences,Changsha 410205,China )
Abstract:Kenaf (Hibiscus cannabinus) is characterized by rapid-growth, large-biomass, strong-resistance and wide-adaptability. Kenaf is expected to be applicable to treat widespread contamination by heavy metal, not only for the remediation of soil pollution, but also for high economic benefits. In this study, a hydroponic experiment was conducted to investigate the physiological mechanism of kenaf in response to cadmium (Cd) stress with different concentrations (10, 50, 100, 150 and 200 μM) and different treatment time points (1, 2, 3, 4, 5 and 6 d). China Kenaf No. 13 was treated with different concentrations of Cd. The results showed that the contents of MDA and AsA in the kenaf seedlings had positive correlations with stress time and Cd concentration which were compared with the control. The content of GSH increased with Cd stress at lower concentration, while first increased and then decreased with the treatment of 150 μM or 200 μM Cd. The activity of SOD and POD increased at beginning and then decreased at lower concentrations. With the treatment of 200 μM Cd, SOD and POD activity decreased with the stress time increasing. POD activity showed the same phenomena as the treatment of 150 μM Cd. Under the low concentration of Cd stress, the activity of antioxidant enzymes and the content of antioxidant substances were enhanced in plants aimed at improving their tolerance to Cd stress. In conclusion, the changes of the AsA and GSH content and the antioxidant enzyme activity might play an important physiological role to resist damage by Cd stress.
Keywords:Kenaf; Cd stress; Antioxidant system
中图分类号:S563.5
文献标识码:A
作者简介:邓勇 (1988- ) ,研究生,作物学,研究方向为作物育种。E-mail: 904365543@qq.com。*通讯作者: 陈金湘(1955- ),教授,博导,主要从事棉花育种与栽培。E-mail:jinxiangc@163.com。
基金项目:国家自然基金资助,项目编号:31300240
收稿日期:2016-02-27
文章编号:1671-3532(2016)02-0089-06

