亮甲酚蓝染色法评价斑马鱼卵母细胞体外成熟度的实验研究
方 晨,张 钊,韦祥相,李贤梅,张小雪
(贵州大学 动物科学学院水产系,贵州 贵阳 550025)
亮甲酚蓝染色法评价斑马鱼卵母细胞体外成熟度的实验研究
方晨,张钊,韦祥相,李贤梅,张小雪*
(贵州大学 动物科学学院水产系,贵州 贵阳 550025)
摘要:通过不同浓度亮甲酚蓝(BCB)对斑马鱼卵母细胞进行染色,探讨该方法用于判断鱼类卵母细胞成熟度的可行性,并利用该法对孕酮促斑马鱼卵母细胞体外成熟实验中的卵母细胞成熟情况进行了判断和分析。结果表明:(1)BCB染色法用于判断鱼类卵母细胞成熟度是可行的。(2)低浓度(1 nmol/L和10 nmol/L)孕酮处理6 h,对斑马鱼卵母细胞的成熟并无明显促进作用,高浓度的孕酮(100 nmol/L和1000 nmol/L)不利于卵母细胞的成熟。(3)浓度为100 nmol/L的孕酮处理12 h,对卵母细胞成熟的促进作用显著。
关键词:亮甲酚蓝(BCB);斑马鱼;卵母细胞;孕酮
与传统动物育种技术相比较,现代育种技术缩短了产生新品种的时间,对所要求的性状具有明确的针对性,因此逐渐受到动物育种工作者的重视。现代动物育种的生物技术包括胚胎工程技术、动物克隆技术、转基因动物技术和电融合技术等,而在这些技术中常常需要成熟的卵母细胞用于实验,为此卵母细胞体外成熟培养和成熟度的判断已成为相关育种实验中必须解决的问题之一,同时也是现代动物育种技术成功与否的重要前提。
目前,卵母细胞的体外培养技术研究多见于哺乳类,且技术相对成熟,如牛[1]、山羊[2]、猪[3]等,而关于水生脊椎动物鱼类的卵细胞体外培养的研究还较少,仅见李书鸿等[4]对斑马鱼卵母细胞体外成熟条件进行的研究。
卵母细胞的成熟包括核成熟和细胞质成熟。对于卵母细胞成熟度的判断,通常情况下是通过光学显微镜来观察卵母细胞是否排除第一极体来作为核成熟的标准[5],而在胞质成熟上,还没有确切的评判标准。然而也有研究认为:线粒体重排和皮质颗粒迁移程度可作为卵母细胞质成熟的标志[6]。在传统实验中对鱼类卵母细胞成熟度的判定往往是根据其形态学特征进行,如成熟的卵母细胞形态上表现为:生发泡破裂, 核仁消失, 纺锤体形成,染色质浓缩为染色体, 第一极体的排出等[7], 但是在实际应用过程中,该技术操作繁琐,不易判断卵母细胞的质量。
近年来,为了准确快速地判断卵母细胞的成熟度,获得高质量的实验用卵母细胞,一种新的、无害方法——亮甲酚蓝(BCB)染色法逐渐应用于多种动物卵母细胞的筛选[8]。亮甲酚蓝(BCB)是一种生物染料,可被卵母细胞中的葡萄糖-6-磷酸脱氢酶作用由蓝色变为无色,故通过BCB染色可以筛选出已完成生长的即发育潜能较佳的卵母细胞。这一技术在小鼠、猪、牛、羊等多种哺乳动物的体外生殖技术上得到了成功应用[9-11],而这一技术在鱼类卵母细胞发育潜能筛选方面的应用,目前尚未见报道。本研究采用亮甲酚蓝染色法,对经过孕酮诱导的卵母细胞的成熟度进行评估,目的是分析这种方法在判断鱼类卵母细胞成熟度的可行性以及该方法在孕酮促斑马鱼卵母细胞体外成熟实验中的应用情况,为鱼类的育种实验提供参考依据。
1材料与方法
1.1药品与试剂
17α-羟基孕酮(aladdin-e,上海),胶原酶Ⅱ型(Solarbio,北京),台盼蓝(genview,北京),亮甲酚蓝(源叶生物,上海),青链酶素(Solarbio,北京),二甲基亚砜(DMSO)( aladdin-e,上海),DMEM培养液(Hyclone,美国),氯化钠等化学试剂为分析纯试剂。
1.2主要仪器
解剖镜(Olympus, SZ61型),显微镜(Olympus, CH20型) ,超净工作台(苏州净化,SW-CJ-ID型)等。
1.3实验材料
1.3.1 实验用斑马鱼
实验用斑马鱼购买于贵阳花鸟市场。饲养于实验室养殖箱内,水源为曝气24 h以上的自来水, 水温(26±2)℃,自然光照饲养。每天早晚投喂饲料各一次。每天早上吸污并换水1/4,饲养一段时间后,视残饵及水质而调整换水频率。挑选腹腔饱满,卵巢发育比较好的鱼体用于实验。
1.3.2 主要溶液配制
胶原酶消化溶液:准确称量0.015 g胶原酶溶入1 mlDMEM培养液中配成15%的母液存放在-20℃冰箱中保存备用。实验用时把母液稀释50倍配成0.3%的胶原酶溶液用于分解组织。
孕酮母液:准确称量0.33 g羟基孕酮溶于10 ml二甲基亚砜中,配成0.1 mol/L的储存液于4℃冰箱中保存备用。
台盼蓝溶液:准确称量0.4 g台盼兰溶于10 ml 0.85%生理盐水中配成4%母液存放在4℃冰箱中保存备用。实验时用生理盐水把母液稀释10倍配成0.4%台盼蓝溶液用于细胞染色。
亮甲酚蓝溶液:准确称量0.166 g亮甲酚蓝溶于10 ml0.85%生理盐水水,配成0.05 mol/ L的母液于4℃冰箱中保存备用。实验时用生理盐水稀释成20 μmol/ L的浓度用于细胞染色。
1.4实验方法
1.4.1卵母细胞获取
从养殖箱中挑选腹腔饱满的斑马鱼用于实验。鱼体秤重(1.25±0.18) g,称重后把鱼体放在解刨盘中,将左体壁全部剪去,用解剖镊取出2侧的卵巢,卵巢称重(0.26 ±0.04)g。
卵巢称重后放入青链霉素中涮洗1-2次,取出后放在载玻片上用解剖刀切割成大小相同的小段(每小段30-50个卵母细胞左右),然后放入胶原酶溶液中在20℃环境下酶解20 min左右,用生理盐水涮洗卵母细胞3-4次以除去剩余的胶原酶后,置DMEM培养液中室温保存备用。
1.4.2亮甲酚蓝染色条件的筛选
设置10 μmol/L、20 μmol/L、30 μmol/L、40 μmol/L、50 μmol/L、和60 μmol/L六个亮甲酚蓝染色浓度,和六个染色时间(30 min,60 min,90 min,120 min,150 min),用亮甲酚蓝对斑马鱼卵母细胞进行染色,结合卵母细胞的显微测量,比较染色效果, 挑选效果最佳的染色组合用于后续实验。
1.4.3孕酮浓度和作用时间梯度的设置
取适量孕酮母液溶于二甲基亚砜(DMSO)中制成,用DMEM培养液稀释成1 nmol/L,10 nmol/L,100 nmol/L和1000 nmol/L 4个浓度,以0 nmol/L作为对照组。将前述准备好的斑马鱼卵母细胞置不同浓度的孕酮溶液中于20℃温度下培养。每次实验要保证每种浓度有2份卵母细胞(一份用于台盼兰染色,一份用于亮甲酚蓝染色),培养时间分别为6 h,12 h,24 h。
1.4.4台盼蓝染色
经过不同时间孕酮培养后,取出一份用生理盐水涮洗细胞3-4次后,加入台盼蓝溶液常温下染色5 min,解剖镜和显微镜观察、拍照,并计算细胞的存活率。
1.4.5亮甲酚蓝染色
经过不同时间孕酮培养后,取出另一份用生理盐水涮洗细胞3-4次后,加入亮甲酚蓝20℃温度下染色150 min(避光),用解剖镜和显微镜观察、拍照,并计算细胞的成熟率。
1.5统计分析
所有实验重复3次以上,所得的实验结果均采用Excel和SPSS 17.0进行分析,多组样本均数比较采用单因素方差分析,实验数据均以平均值±标准差表示。
2结果
2.1最佳亮甲酚蓝染色条件
通过染色效果比较,并结合显微测量结果进行分析,筛选出亮甲酚蓝浓度在20 μmol/L、染色时间为150 min的染色效果最佳。(图1)

图1 亮甲酚蓝染色的斑马鱼卵母细胞(10×10)Fig.1 Zebrafish oocytes stained by BCB
2.2孕酮处理后卵母细胞的存活率
台盼蓝染色鉴别细胞存活率(见图2和表1)。
从表1可以看出,斑马鱼卵母细胞在不同浓度和不同时间孕酮处理后,存活率有一定波动,孕酮浓度10 nmol/L和100 nmol/L分别处理6 h和12 h后斑马鱼卵母细胞的存活率有一定的增加,但总体来说孕酮对卵母细胞的存活率影响不大。

图2 台盼蓝染色的卵母细胞(10×10)Fig.2 Zebrafish oocytes stained by Trypan blue

孕酮浓度(nmol/L)孕酮处理时间(h)61224078.57±2.5377.98±1.3478.24±1.31178.95±5.2475.18±5.1881.00±1.001092.68±2.6488.60±1.1088.91±0.6710090.63±3.2782.98±0.6284.46±1.25100078.26±4.8378.93±6.7982.35±2.91
2.5孕酮处理后卵母细胞的成熟情况
从表2可以看出:孕酮浓度在1 nmol/L、处理6 h,孕酮对卵母细胞的成熟有一定的促进作用,但与对照组比较,差异不显著性(p=0.403);孕酮浓度在100 nmol/L、处理12 h,孕酮对卵母细胞成熟的促进作用显著(p=0.008)。而100 nmol/L和1000 nmol/L孕酮浓度处理6 h,斑马鱼卵母细胞的成熟率反而下降明显。在孕酮处理12 h和24 h,实验组(除孕酮浓度在100 nmol/L、处理12 h)和对照组卵母细胞成熟率明显低于各组孕酮处理6 h的成熟率,差异都显著(p<0.05)。
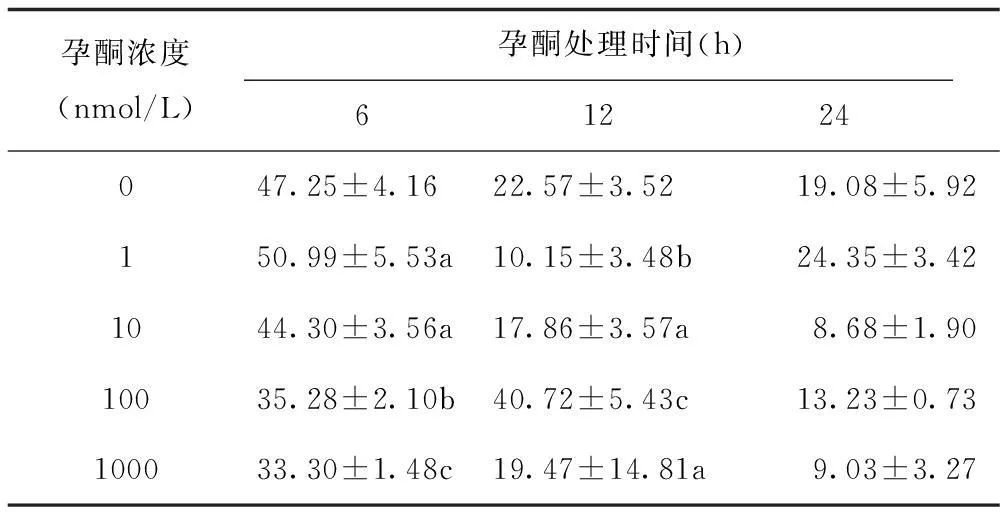
表2 不同浓度孕酮处理不同时间后斑马鱼卵
注:a表示与对照组差异不显著,b表示与对照组差异显著,c表示与对照组差异极显著,下同。
从表3可以看出:孕酮处理6 h,浓度在1-1000 nmol/L区间斑马鱼卵母细胞半成熟的比率随孕酮处理浓度的增加而增加,在100 nmol/L和1000 nmol/L剂量组半成熟的卵母细胞比率分别达47.92%和56.48%左右,与对照组相比差异显著(p<0.05)。而处理12 h和24 h,随着孕酮浓度的增加,斑马鱼卵母细胞的半成熟率变化不明显,各实验组与对照组相比差异不显著(p>0.05)。
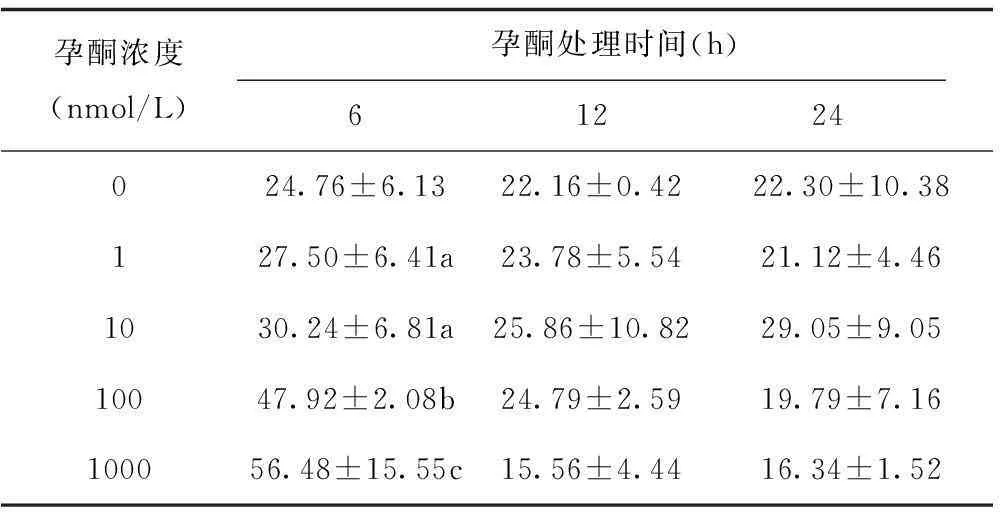
表3 不同浓度孕酮处理不同时间后斑马鱼卵母细胞的
3讨论
葡萄糖-6-磷酸脱氢酶(G6PDH)是与卵母细胞能量代谢相关的一种酶,随着卵母细胞的生长发育,其含量也在不断变化。该酶在生长期的卵母细胞内活性很高,但在已完成生长的卵母细胞中活性下降。在本实验中,亮甲酚蓝对不同成熟度卵母细胞的染色,是随着卵母细胞成熟度的加大而逐渐变深,呈现一个渐进的过程,而不是突变的一个过程。因此,我们以染色最深、且观察不到细胞核的卵母细胞判为成熟卵细胞,而把呈较浅蓝色的卵母细胞判为半成熟卵母细胞。这种判断与卵母细胞的成熟过程相符,因为在卵母细胞的成熟过程中,葡萄糖-6-磷酸脱氢酶的活性呈现的是逐渐降低的过程,而不是表现为突然消失的现象。同时,实验中我们通过测量染色后的卵母细胞的卵泡直径,通过直径大小来判断卵母细胞的成熟情况[12],发现与BCB染色后的判断基本吻合。因此,BCB染色法对判断鱼类卵母细胞成熟度是可行的。
卵母细胞体外成熟(IVM)是指从卵巢中获取未成熟卵,经过适宜的体外培养条件,卵母细胞发育成熟并具有受精和胚胎发育能力。影响卵母细胞体外成熟的因素有很多,比如采集方法,卵泡大小及卵母细胞形态,培养的温度、时间、气相环境、培养液及其 pH 值、激素等等。已有研究证明外源雌激素可以促进动物性腺发育[13],但是外源激素的量和作用时间对于处于不同发育时期的卵母细胞的作用差异十分明显。如本实验结果所表现的情况:用孕酮培养6 h后,加入低浓度孕酮(孕酮浓度1 nmol/L和10 nmol/L)卵母细胞的成熟率和对照组相比变化不大,推测低浓度孕酮对斑马鱼卵母细胞的成熟并无明显促进作用;但随着孕酮浓度持续增加(孕酮浓度100 nmol/L和1000 nmol/L),卵母细胞的成熟率和对照组相比反而有所下降且差异显著,推测是高浓度的孕酮不利于卵母细胞的成熟。孕酮培养12 h和24 h后,对照组和大部分实验组的卵母细胞成熟率与6 h相比,均下降明显且差异极显著,推测是培养时间过长,培养的环境发生了变化导致卵母细胞成熟率下降,具体原因有待进一步的研究。
上述研究表明,用亮甲酚蓝染色来判断鱼类卵母细胞的成熟度,相对于其他的判断方法,有便捷且能保持卵母细胞存活等优势,因此,可作为鱼类卵母细胞现代育种技术的辅助手段。关于鱼类卵母细胞体外成熟过程中孕酮的最佳用量和处理时间,估计与处理前卵母细胞的成熟度以及培养后期的环境有密切关系,如何根据体外成熟培养前卵母细胞的成熟情况进行外源激素孕酮的浓度调整,还有待进一步研究。
参考文献
[1]贾振伟, 田见晖, 安磊, 等. 牛卵母细胞体外成熟技术研究进展[J]. 中国农业科学, 2013,46(8):1716-1724.
[2]赵晓娥, 李向臣, 高立功, 等.山羊卵母细胞的体外成熟研究[J]. 中国农学通报, 2005,21(9):1-3,16.
[3]侯文文. 猪卵母细胞体外成熟及胚胎培养的相关研究[D].合肥:安徽农业大学, 2009.
[4]李书鸿, 毛钟荣, 韩文, 等. 斑马鱼卵母细胞的体外成熟及成熟卵的受精发育[J]. 生物工程学报, 1993,9(4):314-319,396.
[5]Ebner T, Moser M, Sommergruber C. First polar body morphology and blastocyst formation rate in ICSI patients [J]. Hum Reprod, 2002,17(19):2415-2418.
[6]Salamone D F, Damiani P, Fissore R A, et al. Biochemical and Developmental Evidence That Ooplasmic Maturation of Prepubertal Bovine Oocytes Is Compromised[J], Biol Reprod, 2001,64(6):1761-1768.
[7]彭南妮, 薛立群, 陈可毅. 哺乳动物卵泡卵母细胞的体外培养[J]. 湖南农业大学学报, 1997,23(6):99-103.
[8]Alm H, Torner H, Loehrke B, et al. Bovine blastocyst development rateinvitroisinfluenced by selection of oocytes by brilliant cresyl blue stainingbefore IVM as indicator for glucose-6-phosphate dehydrogenase activity [J].Theriogenology, 2005(63):2194 -2205.
[9]乔利敏, 乔富强, 姚华, 等. 亮甲酚蓝染色对牛核移植胚胎体外发育的影响[J]. 中国畜牧杂志, 2012,48(5):27-30.
[10]苏克同, 卢克焕, 卢晟盛. 亮甲酚蓝筛选对广西巴马小型猪孤雌激活及克隆重构胚早期发育的影响[J]. 南方农业学报, 2012,43(08):1218-1222.
[11]郭云云. 亮甲酚蓝染色分选后的猪卵母细胞体外发育能力的鉴定[D]. 哈尔滨:东北农业大学, 2012.
[12]王晶,王冰,李纪同,等.斑马鱼性腺发育的组织学观察[J]. 基因组学与应用生物学, 2011,30(2):168-174.
[13]沈蓓杰,杨筱珍,吴旭干,等.17α-羟基孕酮对性早熟中华绒螯蟹主要体征和卵巢发育影响的初步观察[J]. 上海水产大学学报, 2008,17(3):268-273.
An experimental study on the evaluation of thematurity of zebrafish oocytesin vitro using brilliant cresyl blue staining
FANGChen,ZHANGZhao,WEIXiang-xiang,LIXian-mei,ZHANGXiao-xue*
(AnimalScienceCollege,GuizhouUniversity,Guiyang,Guizhou550025,China)
Abstract:The feasibility of the brilliant cresyl blue (BCB) staining method to determine the maturity of zebrafish oocytes in vitro was investigated by staining the zebrafish oocytes in different concentrations of BCB. The method was also used to determine and analyse the maturity of zebrafish oocytes in vitro promoted by progesterone. The results showed: (1)it is indeed feasible to employ BCB staining method to determine the maturity of the oocytes; (2)treatment in the low concentrations of progesterone (1nmol/L and 10nmol/L) for 6 hours had no significant effect on the maturation of zebrafish oocytes while the high concentrations of progesterone (100nmol/L and 1000nmol/L) were not suitable for the oocytes to mature; (3)the treatment in the concentration of 100nmol/L progesterone for 12 hours had significant effect in promoting the maturity of the oocytes.
Keywords:Brilliant cresyl blue (BCB); Zebrafish; Oocytes; Progesterone.
文章编号:1008-0457(2016)01-0009-05国际DOI编码:15958/j.cnki.sdnyswxb.2016.01.003
中图分类号:S917.4
文献标识码:A
*通讯作者:张小雪(1962-),女,教授,主要研究方向:水产动物繁殖与发育生物学;E-mail:zhangxx508@163.com。
基金项目:贵州省优秀科技教育人才省长专项资金[黔省专合字(2009)102号];贵州大学引进人才科研项目[贵大人基合字(2007)003]。
收稿日期:2015-12-07;修回日期:2016-01-11

