超声心动图在经导管主动脉瓣置入术中的作用*
魏薪 唐红 陈茂 冯沅 朱达 郭应强
(四川大学华西医院 1.心内科;2.胸心外科, 四川 成都 610041)
·论著·
超声心动图在经导管主动脉瓣置入术中的作用*
魏薪1唐红1陈茂1冯沅1朱达2郭应强2
(四川大学华西医院 1.心内科;2.胸心外科, 四川 成都 610041)
【摘要】目的探讨超声心动图在经导管主动脉瓣置入术前、术中及术后的作用。方法59例三叶式主动脉瓣重度狭窄或反流患者行经导管主动脉瓣置入术,术前经胸超声心动图评估主动脉瓣狭窄或反流程度、测量主动脉根部内径,评估心功能,术中介入操作前经食管超声心动图再次测量主动脉根部内径;介入过程中引导瓣膜植入、监测并发症,术后即刻评估置入瓣膜效果和经胸超声心动图随访人工瓣膜功能、左室收缩功能、左室质量指数等。结果59例三叶式主动脉瓣患者中重度主动脉狭窄49例,单纯中-重度主动脉瓣反流10例。术前经胸超声心动图(TTE)所测的主动脉瓣环径与经食管超声心动图(TEE)测值比较(22.4±2.3mm vs. 24.8±2.1mm)差异有统计学意义(P<0.05),其余主动脉根部内径(主动脉窦部内径、主动脉窦管交界处内径、主动脉窦部高度,左室流出道内径,升主动脉内径)测值间比较差异均无统计学意义。术中1例患者右冠状动脉开口堵塞,经导管主动脉瓣植入术(TAVI)置入失败转入心外科开胸手术,其余患者均成功置入瓣膜。术后即刻评估瓣周漏微量或无占67%,轻度占31%,中度仅占2%。术后1周及术后3月主动脉瓣口前向血流速度、最大压差、平均压差较术前均明显降低。术后1周左室质量指数较术前明显降低,术后3月进一步降低。术后1周左室射血分数(EF)有所恢复,术后3月恢复正常。结论超声心动图检查在TAVI治疗中不可或缺,在术前评估、术中监测及术后随访中均起着非常重要的临床作用。
【关键词】超声心动描记术; 经导管主动脉瓣植入术; 主动脉瓣狭窄; 主动脉瓣反流
退行性病变是老年人心脏瓣膜病主要的原因[1],有临床症状的主动脉瓣重度狭窄患者预后极差,每年的死亡率约25%[2]。传统的外科主动脉瓣置换术是AS治疗的金标准,但超过30%的患者却没有手术机会。经导管主动脉瓣植入术(Transcatheter aortic valve implantation, TAVI)的开展给这类患者带来了福音,自2002年成功行第1例TAVI手术后,迄今已超过16万例患者通过该手术得到有效的治疗。近年PARTNER 1 研究表明[3],TAVI替代外科主动脉瓣置换术是可取的,尤其是对主动脉瓣狭窄的高危患者,5 年生存率没有明显差异。超声心动图在TAVI术前筛查、术中监测及评估,以及术后随访中都起着不可或缺的作用。我院自2012年4月开展TAVI术,积累了初步的经验,现报告如下。
1资料及方法
1.1临床资料选择2012年4月~2015年5月在我院行经导管主动脉瓣植入术的三叶式主动脉瓣病变患者59例,其中重度主动脉瓣狭窄49例,单纯中-重度主动脉瓣反流10例。男性38例,女性21例,平均年龄(72.2±7.6)岁。单纯主动脉瓣反流患者均行经心尖途径的TAVI,重度主动脉瓣狭窄患者中8例行经心尖途径,其余41例均经股动脉途径。经心尖途径置入瓣膜为杰成医疗的J-valve瓣膜,经股动脉途径置入瓣膜有美敦力公司的Core-valve瓣膜和启明公司的Venus-A瓣膜。主动脉瓣狭窄患者入选标准:不能行外科手术且有临床症状的重度主动脉瓣狭窄患者,主动脉瓣口面积小于1cm2,或平均跨瓣压差>40mmHg,最大流速>4m/s[4]。单纯主动脉瓣反流入选条件:中-重度及以上主动脉瓣反流(主动脉瓣反流程度的评估方法根据指南推荐[5]反流紧缩口宽度判定:>6mm为重度反流,3~6mm为中度反流)。临床风险评估为高危患者:Euroscore评分≥20%,或STS评分≥10%。主动脉瓣环径符合人工瓣膜要求。排除标准:左室射血分数(EF)<20%,肥厚型心肌病,心脏肿瘤或感染性心内膜炎。
1.2仪器与方法使用Philips IE33超声心动图诊断仪,经胸超声心动图(TTE)使用S5-1探头(频率1~5MHz),经食管超声心动图(TEE)使用X7-2t探头(频率2~7MHz)。
1.2.1术前测量①TTE测量:术前1周内进行评估。胸骨旁左心室长轴切面主动脉根部局部放大图,于收缩期末测量主动脉瓣环径、主动脉窦部内径、主动脉窦管交界处内径、主动脉窦部高度,左室流出道内径;升主动脉长轴切面于收缩期末距主动脉瓣环上方4-5cm处测量其内径(见图1)。主动脉短轴切面观察瓣叶数目、形态、钙化分布及程度。应用脉冲波多普勒在心尖五腔心切面测量左室流出道血流速度积分,应用连续波多普勒在多个切面测量主动脉瓣口峰值前向血流速度、峰值跨瓣压差、平均跨瓣压差及血流速度积分,取其最大值(见图2),并根据伯努力方程计算主动脉瓣口有效瓣口面积。左心室长轴切面测量室间隔厚度、左室后壁厚度、左心室内径,通过公式[6]{LVM(g)=0.8×1.04[(IVST+PWT+LVDd)3-LVDd3]+0.6,LVM为左室质量,IVST为室间隔厚度,PWT为左室后壁厚度,LVDd为左室舒张末期内径}计算左室质量,左室质量指数(LVMI)等于左室质量/体表面积。应用二维双平面法测量左室射血分数(EF),彩色多普勒超声评估各瓣膜反流程度。②术中TEE测量:32例患者行全麻应用TEE评估,27例患者行局部麻醉应用TTE评估。TEE评估在介入操作前进行,食管中段120°左右主动脉长轴切面主动脉根部局部放大图,于收缩期末测量上述主动脉根部相关指标,同样在主动脉短轴切面仔细观察瓣叶数目、形态、钙化分布及程度,并据此排除二叶式主动脉瓣患者(见图3)。必要时应用经食管三维超声心动图测量主动脉瓣环径以及冠脉开口距主动脉瓣环的距离[7,8]。
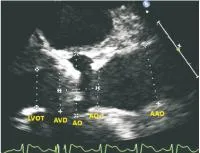
图1经胸超声心动图胸骨旁左心室长轴切面主动脉根部局部放大图
Figure1The diameters of the left ventricular outflow tract
注:左室流出道(LVOT)、主动脉瓣环(AVD)、窦部(AO)、窦管交界(AO-J)、升主动脉内径(AAO)及窦部高度。
1.2.2术中引导与监测TEE术中引导主要用于经心尖途径TAVI患者,共18例,主要操作步骤是指导导丝和鞘管过主动脉瓣口(见图4)、缓慢释放J-valve定位器,多平面确定三个定位器均位于主动脉窦以后,释放瓣膜。经股动脉途径TAVI主要是通过X-光造影下引导人工瓣膜的置入,与经心尖途径TEE术中引导的不同点是没有定位器,直接指导人工支架最下缘处于主动脉瓣环下方较好位置时开始释放瓣膜,随时监测人工支架位置,是否移位,并指导手术医师做相应的调整。
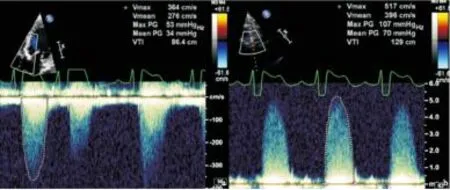
图2主动脉瓣重度狭窄患者超声检查
Figure 2Severe aortic stenosis patient.
注:a.心尖五腔心测量主动脉瓣口峰值血流速度及平均跨瓣压差(34mmHg);b.同一患者,胸骨右缘升主动脉长轴切面测量,峰值血流速度及平均跨瓣压差(70mmHg)

图3经食管超声心动图主动脉瓣短轴切面
Figure 3 Short axis view of aortic valve by echocardiography
注:a.显示主动脉瓣二叶式畸形;b.三叶式主动脉瓣钙化、狭窄。LA:左心房
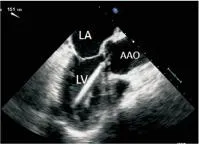
图4经食管超声心动图主动脉长轴切面监测导丝过主动脉瓣口
Figure 4The guide wire across the aortic valve into the ascending aorta in the long axis view by TEE
注:LA.左房;LV.左室;AAO.升主动脉
术中监测包括导丝及鞘管进入、球囊扩张以及瓣膜植入过程,TEE需随时监测有无心包积液、主动脉夹层,冠脉开口阻塞等并发症以及二尖瓣功能是否受影响。
术后即刻评估人工主动脉瓣活动度、开闭情况,有无瓣周或瓣口反流及程度(见图5),以及再次确定有无并发症。瓣周反流程度的评估不同于瓣口反流,根据指南推荐的方法进行测量和评估[9]。
27例应用TTE进行术中监测的患者,除了不能很好地显示冠脉开口外,同样需要监测上述并发症、评估人工瓣叶功能。
1.2.3术后随访分别在术后1周、3月对患者进行随访。应用TTE测量主动脉瓣口峰值前向血流速度、峰值跨瓣压差、平均跨瓣压差,测量左室流出道内径,并根据伯努力方程计算主动脉瓣口有效瓣口面积。应用二维双平面法测量左室射血分数。彩色多普勒超声评估有无瓣周、瓣口反流及其程度(见图6)。
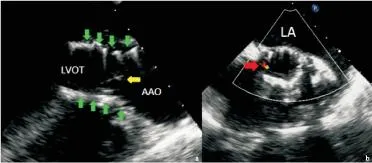
图5术后即刻经食管超声心动图
Figure 5Post-procedural TEE
注:a.主动脉长轴切面显示置入的支架(绿色箭头所示)及其内的人工瓣膜(黄色箭头所示);b.主动脉瓣短轴切面显示瓣周轻度反流(红色箭头所示)。AAO.升主动脉;LVOT.左室流出道.LA:左房
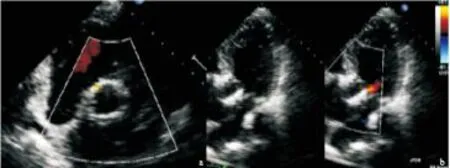
图6术后1周经胸超声心动图随访,显示主动脉瓣周微量反流
Figure 6The follow-up of TTE, panel A in aortic short axis view and panel B in apical five chamber view show trace paravalvular aortic regurgitation.
注:a.主动脉瓣短轴切面;b.心尖五腔心切面
1.3统计学分析应用SPSS 19.0统计软件,计量资料采用均数±标准差表示;术前TTE测量主动脉根部测值与TEE测值比较采用配对样本t检验。重度主动脉瓣狭窄患者术后3月与术后1周、术后1周与术前主动脉瓣口峰值前向血流速度、峰值跨瓣压差、平均跨瓣压差、射血分数、LVMI的比较采用配对样本t检验。P<0.05表示差异有统计学意义。
2结果
2.159例患者基线资料,见表1。
2.232例患者术前TEE测量与TTE测量值比较,除主动脉瓣环径差异有统计学意义外,其余指标包括主动脉窦部内径、主动脉窦管交界处内径、主动脉窦部高度、左室流出道内径、升主动脉内径,差异均无统计学意义,见表2。
2.3术中1例患者右冠状动脉开口堵塞,TAVI置入失败转入心外科开胸手术,其余患者均成功置入瓣膜,瓣膜支架位置稳定,术中无心包积液、主动脉夹层等并发症,二尖瓣功能未受影响。术后即刻评估瓣周漏中度仅占2%(1/59),轻度占31%(18/59),微量或
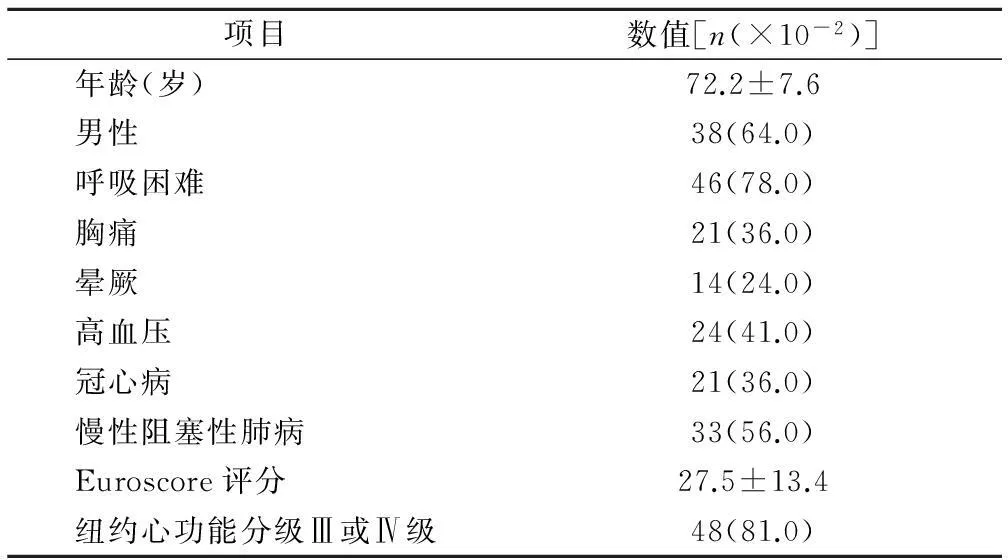
表1 59例经导管主动脉瓣植入术患者基线资料
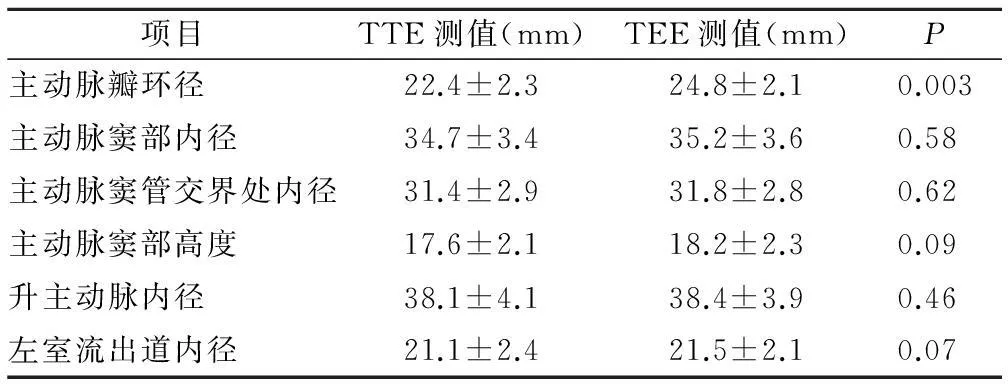
表2 32例患者术前TTE与TEE测值间的比较
无瓣周漏占67%(40/59)。
2.4术后随访1周随访率100%,术后3月随访率72%。术后1周及术后3月主动脉瓣口峰值前向血流速度、峰值跨瓣压差、平均跨瓣压差较术前均明显降低。术后1周LVMI较术前明显降低,术后3月进一步降低。术后1周左室EF有所恢复,术后3月恢复正常。术后1周及术后3月瓣周反流程度与术后即刻相比较无明显改变,见表3。
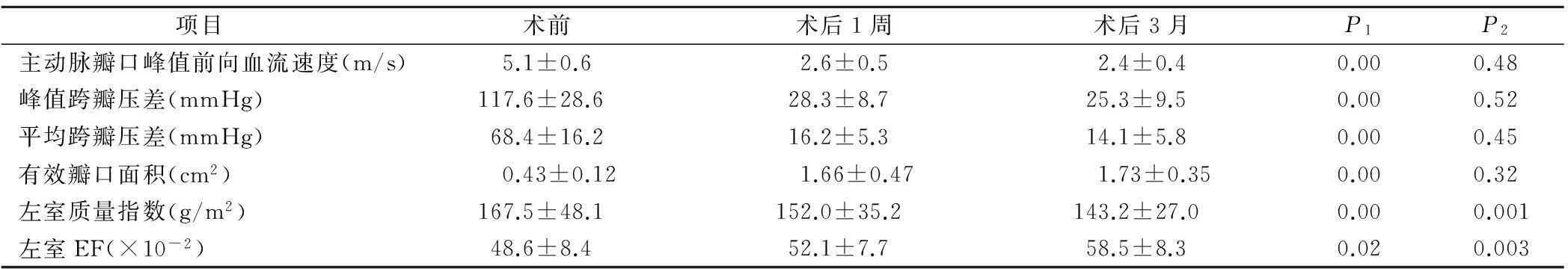
表3 术后1周、术后3月超声随访测值与术前比较
注:P1术后1周与术前比较,P2术后3月与术后1周比较
3讨论
对于外科手术高死亡风险的主动脉瓣病变患者,TAVI已经被证实是一种有效的治疗手段。目前世界16万TAVI病例主要应用的是Edwards SAPIEN瓣膜和美敦力CoreValve瓣膜,其他还包括一些小众的人工瓣膜。TAVI相关指南(包括美国和欧洲指南)提出其适应证主要是重度主动脉瓣狭窄的患者,以主动脉瓣反流为主的病变是TAVI手术的禁忌症[10,11],其主要原因是主动脉瓣反流患者人工瓣膜置入后支架难以锚定在主动脉瓣环水平,可能导致支架瓣膜不稳定或瓣周漏几率极高。然而亦有单纯主动脉瓣反流病变成功行TAVI的报道[12-14]。本研究59例患者外科手术风险极高,其中49例患者均系重度主动脉瓣狭窄,符合指南推荐的TAVI适应证,10例以主动脉瓣反流为主的患者应用J-Valve 人工瓣膜(其特点是有3个定位器可置于3个主动脉窦底,从而使支架固定并减少瓣周漏的发生[15])均取得较好的结果。
无论是主动脉瓣狭窄还是以主动脉瓣反流为主的病变,超声心动图在TAVI术前都是首选的检查方法。术前经胸超声心动图筛查主动脉瓣病变是否适合行TAVI手术,提供主动脉根部各个径线的测值。经食管超声心动图在介入术前准确评估瓣膜结构和测量主动脉根部内径,是确保手术成功的最后一道屏障。主动脉瓣环径是TAVI手术至关重要的一个测值,因为人工瓣膜型号的选择是根据主动脉瓣环径的大小来进行的,人工瓣膜选择过大或过小会引起瓣周漏明显增加或人工瓣膜功能异常甚至瓣环破裂的可能[16]。尽管目前大多数心脏中心主要依赖于CT,但对于不能行CT或CT图像质量较差的患者超声心动图的测值就成为人工瓣膜选择的主要参考。本研究显示术前TTE与TEE测量的主动脉瓣环径差异有统计学意义,可能的主要原因是大部分患者均系主动脉瓣重度狭窄、钙化,瓣环处钙化明显,钙化灶不规则导致瓣环位置不易识别。另外,老年患者合并慢性肺阻塞性肺病较多,经胸超声图像质量相对较差,TEE测值比TTE测值更为准确。目前超声心动图指南[9]推荐当TTE不能确定瓣环径时使用TEE或RT 3D-TEE测量主动脉瓣环径,我们团队既往研究发现TEE所测的主动脉瓣环径与CT测值差异无统计学意义[7]。
术中超声心动图的监测是必不可少的,虽然目前绝大多数TAVI瓣膜置入时使用X-光造影来进行引导,但TEE亦可作为实时引导瓣膜置入的工具,本研究经心尖18例患者均应用了TEE联合X-光造影的方法指导人工瓣膜植入,TEE能准确引导导丝及鞘管过主动脉瓣口,指导定位器的定位及人工瓣膜的释放,同时在各个环节监测有无心脏穿孔、心包积液、主动脉破裂、主动脉夹层、二尖瓣反流等并发症。导丝位置不正确可能导致腱索牵拉而引起急性重度二尖瓣反流。瓣膜位置过高易引起冠脉开口堵塞、主动脉破裂,而瓣膜位置过低易影响二尖瓣开闭或引起房室传导阻滞[10]。术后即刻评估非常重要,术者根据超声评估的主动脉瓣周反流程度来决定下一步处理,若瓣周反流超过中度,考虑进行球囊后扩张或植入第二枚人工瓣膜。本研究根据2011年ASE/EAE专家推荐,使用主动脉瓣短轴切面,瓣周反流口的长度占同平面支架短轴周长的比例来判断瓣周反流程度:<10%为轻度,10%~20%为中度,>20%为重度[9]。该方法需准确切割到瓣周反流口的短轴切面,切割平面过高或过低都会导致瓣周反流的低估或高估。目前,有研究发现使用三维彩色多普勒超声能准确计算反流容积,从而准确评估瓣周反流的程度[17]。
TAVI术后主要应用TTE对患者进行长期随访观察,它是评价疗效和安全性最主要的手段。术后随访TTE检查主要包括确定支架位置是否稳定,人工瓣叶开闭情况,有无赘生物;主动脉瓣口峰值前向血流速度、峰值跨瓣压差、平均跨瓣压差;主动脉瓣瓣口及瓣周反流情况;左室收缩功能;二尖瓣口有无梗阻,前瓣开闭情况;左室壁厚度,左室心肌质量改善情况。本研究显示术后1周患者血流动力学明显改善,主动脉瓣口峰值前向血流速度、峰值跨瓣压差、平均跨瓣压差均较术前明显减低;术后1周左室质量指数较术前明显降低,术后3月进一步降低。术后1周左室EF有所恢复,术后3月恢复正常。主动脉瓣狭窄患者术前后负荷明显增大,引起心肌细胞肥大,左室质量增加[18],TAVI术后左心室后负荷明显减低,使得左心室心肌细胞逐渐缩短,扩大的心腔减小,故左室质量指数明显降低。目前亦有相关文献报道了TAVI术后左心室的逆重构[19,20]。另外,TAVI术后患者后负荷减轻,降低了左室收缩时剪切力对心内膜的损伤,同时主动脉瓣口有效面积明显增加,改善了冠脉血流灌注,心功能得以改善[21]。
4结论
对于高龄、合并多器官疾病、有开胸手术史以及心功能较差的患者,外科手术死亡率高,甚至部分患者失去了手术机会。本文资料显示,TAVI必要时可以替代外科主动脉瓣置换术,尤其是对有临床症状、无法耐受外科手术的重度主动脉瓣狭窄的高危患者,欧洲和美国心脏瓣膜疾病治疗指南也有推荐,超声心动图在TAVI治疗中不可或缺,无论在术前评估、术中监测,还是在术后随访中均起着非常重要的作用。
【参考文献】
[1]Nkomo VT, Gardin JM, Skelton TN.etal. Burden of valvular heart diseases:a population-based study[J].Lancet,2006,368:1005-1011.
[2]Carabello BA, Paulus WJ. Aortic stenosis[J].Lancet,2009,373:956-966.
[3]Mack M J, Leon M B, Smith C R,etal. 5-year outcomes of transcatheter aortic valve replacement or surgical aortic valve replacement for high surgical risk patients with aortic stenosis (PARTNER 1): a randomised controlled trial[J]. The Lancet, 2015,15(15):60308-7.
[4]Baumgartner H, Hung J, Bermejo J,etal. Echocardiographic assessment of valve stenosis: EAE/ASE recommendations for clinical practice[J]. European Journal of Echocardiography, 2009, 10(1): 1-25.
[5]Lancellotti P, Tribouilloy C, Hagendorff A,etal. European Association of Echocardiography recommendations forthe assessment of valvular regurgitation. Part1: aortic and pulmonary regurgitation (native valve disease).Eur J Echocardiogr. 2010 Apr;11(3):223-244.
[6]Lang RM, Bierig M, Devereux RB,etal.Recommendations for chamber quantification[J]. Eur J Echocardiogr, 2006,7(2):79-108.
[7]魏薪,陈丽萍,陈茂,等.三维超声测量经导管主动脉瓣植入术患者主动脉瓣环径的研究[J].中华超声医学杂志,2014,23(3):1-5.
[8]孔令秋,康彧,魏薪,等.经导管主动脉瓣植入术患者冠状动脉开口位置的三维超声研究[J].中华超声影像学杂志,2013,22(10):1-4.
[9]Zamorano JL, Badano LP, Bruce C.etal.EAE/ASE recommendations for the use of echocardiography in new transcatheter interventions for valvular heart disease[J]. Eur Heart J, 2011,32(17):2189-2214.
[10] Holmes DR Jr., Mack MJ, Kaul S,etal. 2012 ACCF/AATS/SCAI/STS expert consensus document on transcatheter aortic valve replacement[J]. J AmColl Cardiol, 2012,59:1200-1254.
[11] Vahanian A, Alfieri O, Andreotti F,etal. Guidelines on the management of valvular heart disease (version 2012): the Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS)[J]. Eur Heart J, 2012,42:1-44.
[12] D′Ancona G, Pasic M, Buz S,etal. TAVI for predominant aortic valve insufficiency in a patient with a left ventricular assist device[J]. Ann Thorac Surg, 2012,93:89-91.
[13] Moritz S, Patrick D, Dietmar K,etal. Transapical implantation of a second-generation transcatheter heart valve in patients with noncalcified aorticregurgitation[J]. J AmColl Cardiol Intv, 2013,6:590-597.
[14] Kiefer P, Seeburger J, Mohr W, Holzhey M. Transcatheter aortic valve replacement for isolated aortic valve insufficiency: experience with the Engagervalve[J]. J Thorac Cardiovasc Surg, 2014,147:37-38.
[15] Wei L, Liu H, Zhu L,etal. A New Transcatheter Aortic Valve Replacement System for Predominant Aortic Regurgitation Implantation of the J-Valve and Early Outcome[J].JACC Cardiovasc Interv, 2015, 12(15):01459 -4.
[16] Jilaihawi H,Kashif M,Fontana G,etal.Cross-Sectional Computed Tomographic Assessment Improves Accuracy of Aortic Annular Sizing for Transcatheter Aortic Valve Replacement and Reduces the Incidence of Paravalvular Aortic Regurgitation[J].J Am Coll Cardiol, 2012,59:1275-1286.
[17] Gonçalves A, Almeria C, Marcos-Alberca P,etal.Three-dimensional echocardiography in paravalvular aortic regurgitation assessment after transcatheter aortic valve implantation[J].J Am Soc Echocardiogr, 2012,25(1):47-55.
[18] Gohn JN, Ferrari R, Sharpe, Netal. Cardiac remodeling-concepts and clinical implications:a consensus paper from an international forum on cardiac remodeling.Behalf of an International Forum on Cardiac Remodeling[J].J Am Coll Cardiol,2000,35(3):569-582.
[19] Collinson J, Flather M, Pepper J R,etal. Effects of valve replacement on left ventricular function in patients with aortic regurgitation and severe ventricular disease[J]. J Heart Valve Dis,2004,13(5):722-728.
[20] Gaudino M, Glieca F, Luciani N,etal.Left ventricular masrts regression after aortic stenosis:time course and determinants[J].J Heart Valve Dis,2004,13(1):55-58.
[21] Rajappan K,Rimoldi OE,CamiciPG,etal. Functional changes in coronary microcirculation after valve replacement in patients with aortic stenosis[J]. Circulation,2003,107(25):3170-3175.
Echocardiography in transcatheter aortic valve implantation
WEI Xin, TANG Hong, CHEN Mao,et al
(1.DepartmentofCardiology,WestChinaHospital,SichuanUniversity,Chengdu610041,China;2.DepartmentofCardiothoracicSurgery,WestChinaHospital,SichuanUniversity,Chengdu610041,China)
【Abstract】ObjectiveTo investigate the pre-procedural, peri-procedural and post-procedural role of echocardiography in transcatheter aortic valve implantation (TAVI).Methods59 patients underwent TAVI in our hospital with tricuspid aortic valve stenosis or regurgitation. Before TAVI, the severity of aortic stenosis or regurgitation, aortic root diameters and left ventricular function were evaluated by transthoracic echocardiography (TTE). During TAVI, the aortic root diameters were measured again by transesophageal echocardiography (TTE) pre-procedure, and the use of peri-procedural TEE was to guide prosthesis implantation, monitor complications, and evaluate the function of the prosthetic valve. After TAVI, the follow-up by TTE included the function of prosthetic valve, left ventricular function and left ventricular mass index (LVMI). ResultsOf 59 cases of tricuspid aortic valve, 49 cases were severe aortic stenosis, and 10 cases were moderate to severe aortic regurgitation. The aortic annular diameter was significantly different between TTE and TEE measurements (22.4±2.3mm vs.24.8±2.1mm), but other aortic root diameters had no statistical significance. One of the patients was transferred to surgical replacement as a result of the occlusion of the right coronary artery, but others were successfully underwent TAVI. Post-procedure, 67% patients had none or trace paravalvular regurgitation (PVL), 31% had mid PVL, and only 2% had moderate PVL. Compared with the values before TAVI, the aortic velocity, maximum gradient, and mean gradient decreased significantly one week and 3 months after TAVI. The LVMI decreased one week and more 3 months after TAVI. The left ventricular ejection fraction increased one week later, and recovered to normal 3 months later. ConclusionEchocardiography plays an important role in pre-procedural evaluation, peri-procedural monitoring and post-procedural follow-up in TAVI.
【Key words】Echocardiography; Transcatheter aortic valve implantation; Aortic stenosis; Aortic valve regurgitation
(收稿日期:2015-12-01; 编辑: 陈舟贵)
【中图分类号】R 445.1; R 543.1
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2016.04.022
通讯作者:唐红,教授,本刊编委,E-mail:hxyyth@qq.com
基金项目:四川省科技厅科技支撑计划项目(2012FZ0065)

