蓝莓花色苷对2型糖尿病小鼠氧化损伤的保护作用
李亚巍,昌盛,王黎明,金瑛(吉林医药学院药物化学教研室,吉林吉林132013)
蓝莓花色苷对2型糖尿病小鼠氧化损伤的保护作用
李亚巍,昌盛,王黎明,金瑛*
(吉林医药学院药物化学教研室,吉林吉林132013)
摘要:探讨蓝莓花色苷对2型糖尿病小鼠体内抗氧化活性影响及肝脏的保护作用。采用高脂饮食联合小剂量四氧嘧啶诱导的方法建立小鼠2型糖尿病模型。50只小鼠分为正常对照组、模型组、阳性药(吡格列酮)组、蓝莓花色苷低剂量(100mg/kg·d)给药组和蓝莓花色苷高剂量(200mg/kg·d)给药组。阳性药及蓝莓花色苷给药组,每天灌胃给药1次,连续给药30 d。末次给药12小时后,测定小鼠空腹血糖,血清中及肝脏中谷胱甘肽过氧化物酶(GSH-PX)、超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量,并观察小鼠肝脏组织形态学改变。与对照相比,模型组小鼠空腹血糖维持较高水平(P<0.01),小鼠血清及肝脏组织中SOD、GSH-Px活性明显下降(P<0.01),而MDA含量明显升高(P<0.01),小鼠肝细胞出现变性、间质水肿及炎症细胞浸润病理变化。与模型组相比,阳性药和蓝莓花色苷给药组小鼠血糖明显降低(P<0.01),SOD和GSH-Px活性升高(P<0.01),MDA含量下降(P<0.01),肝脏病理变化有所改善。蓝莓花色苷能够通过减轻实验性2型糖尿病小鼠机体的氧化损伤,并对肝脏损伤具有一定的保护作用。
关键词:蓝莓花色苷;2型糖尿病小鼠;氧化损伤
越橘(Bilberry),又称蓝浆果、蓝莓果,属于杜鹃花科(Ericaceae)越橘属(Vaccinium.SPP),多年生落叶或常绿灌木[1-2]。蓝莓果实椭圆形或偏球形,蓝紫色,味道酸甜[3-4],是我国重要的一种天然绿色野生资源,具有很高的营养价值。越橘中含有丰富的花色苷,花色苷是一种广泛存在于植物中的功能性水溶色素,是一种天然的抗氧化剂,具有抗氧化、清除自由基等多种生理活性[5]。因此,其作为具有重要生理活性的天然着色剂,广泛应用于食品、药品行业。国内外对蓝莓花色苷生理功能的研究主要集中在清除自由基作用、抗癌等方面,而其对体内生理活性影响的研究还很少[6]。
本研究将从越橘花色苷抗氧化及对肝脏损伤的保护作用方面,探讨其改善糖代谢的相关机制,为蓝莓花色苷功能食品的开发提供理论参考。
1 材料与仪器
1.1材料与试剂
长白山野生蓝莓为8月份采收,于-80℃冰箱中保存备用,按参考文献[7]方法,提取蓝莓花色苷;高糖高脂饲料(蛋黄2.5 %、蔗糖20 %、猪油10 %、基础饲料67.5 %);四氧嘧啶:SIGMA公司;盐酸吡格列酮片:江苏恒瑞医药股份有限公司;胆固醇(TC)测定试剂盒、甘油三酯(TG)测定试剂盒、谷胱甘肽过氧化物酶(GSH-PX)、超氧化物歧化酶(SOD)和丙二醛(MDA)试剂盒:南京建成生物工程研究所;二喹啉甲酸(BCA)蛋白浓度测定试剂盒:江苏碧云天生物技术研究所。其他试剂均为国产分析纯。
1.2主要仪器
550酶标仪:美国Bio-Rad公司;UV-4802型紫外可见分光光度计:上海UNICO仪器有限公司;TGL-16G台式高速离心机:上海安亭科学仪器厂;OLYMPUS光学显微镜:日本奥林巴斯(中国)有限公司;MTN-658自动生化分析仪:长春市曼特诺医疗器械有限公司。
1.3试验动物
选取健康成年KM种小鼠80只,雄性,体重18 g~ 20 g,购于吉林大学基础医学院医学实验动物中心,合格证号SCXK(吉)2008-0005。动物适应性喂养1周后开始实验,室温18℃~28℃,相对湿度62 %~80 %。
2 试验方法
2.1动物前期饲养及处理
参考文献[10],建立2型糖尿病实验动物模型,试验期间,严格按照动物饲养管理标准和规范进行饲养。随机选取出20只小鼠喂普通饲料,自由饮水,其余小鼠喂高糖高脂饲料,自由饮水。喂养8周后,两组各随机抽取4只小鼠禁食不禁水12 h,摘眼球取血,3 000 r/min离心5 min,取血清,进行血脂检测,喂高糖高脂饲料的小鼠血清中TC、TG较对照组显著升高(P< 0.01),表明高脂动物模型建模成功。取高脂模型小鼠禁食不禁水12 h,腹腔注射小剂量四氧嘧啶(180 mg/kg)。72 h后,对小鼠进行尾尖取血,用血糖仪检测小鼠空腹血糖(检测前12 h禁食不禁水),以血糖值≥10 mmol/L为建立2型糖尿病模型标准,筛选造模成功动物。
2.2动物分组及处理
选取喂养普通饲料的小鼠10只作为正常对照组;2型糖尿病模型小鼠随机分成4组,每组10只,分别为模型组、阳性对照组吡格列酮(100 mg/kg·d)、越橘花色苷高剂量组(200mg/kg·d)、越橘花色苷低剂量组(100 mg/kg·d)。灌胃给药,0.1 mL/10 g体重,连续30 d,正常对照组给予等体积生理盐水。除正常对照组外,其余各组继续喂高糖高脂饲料。
2.3生化指标检测
末次给药后,动物禁食12 h采血,小鼠眼球取血,用全自动生化分析仪测定空腹血糖(FBG)。取血后小鼠立即采用颈椎脱臼处死,迅速取出肝脏,以冰冷生理盐水清理血迹,吸干水分,准确称量,并加入9倍无菌的冰冷生理盐水手动制成10 %的心脏匀浆,离心(4 000 r/min,10 min),上清液置于-85℃冰箱待用。严格按照试剂盒说明书分别进行测定血清和肝脏组织中SOD活性、GXH-Px活性、MDA含量。SOD和GXHPx活性及MDA含量的测定方法按照试剂盒说明书进行,用分光光度计测定。
2.4肝脏织病理学检查
小鼠处死后冰浴下立即取小鼠肝脏脏,固定于10 %福尔马林溶液,病理切片常规石蜡包埋、切片、HE染色,观察肝细胞变性及坏死,炎症细胞浸润,间质水肿,血管反应,纤维增生病理学变化。
2.5数据统计
实验数据均以x±s表示,所有实验数据均采用SPSS 13.0软件处理,对照组与给药各组比较进行单因素方差分析,以P≤0.05为差异有统计学意义。
3 试验结果
3.1越橘花色苷对小鼠空腹血糖的影响
通过高脂饮食小剂量四氧嘧啶诱导的方法建立2型糖尿病模型,检测蓝莓花色苷对2型糖尿病小鼠的治疗作用。结果显示,与正常对照组相比,模型组小鼠空腹血糖维持在较高的水平(P<0.01)。而与模型组相比,阳性对照组和越橘花色苷给药组空腹血糖呈现下降趋势,结果见图1。

图1 越橘花色苷对小鼠血糖的影响Fig.1 Effect of Buleberry anthocyanidin on the blood sugar of mouse
3.2越橘花色苷对小鼠血清中SOD和GSH-Px活力及MDA含量的影响
越橘花色苷对小鼠血清中SOD和GSH-Px活力及MDA含量的影响见表1。

表1 越橘花色苷对小鼠血清中SOD和GSH-Px活力及MDA含量的影响Tabe 1 The effect of Buleberry anthocyanidin on the activity of SOD and GSH-Px and the conten of MDA in mouse serum
表1结果显示,与对照组相比,模型组小鼠血清中SOD、GSH-Px酶活力明显降低(P<0.01),而MDA含量升高明显(P<0.01)。与模型组相比,阳性对照组及蓝莓花色苷高剂量及低剂量防护组小鼠血清中SOD、GSHPx酶活力升高明显(P<0.01),而MDA含量降低明显(P<0.01)。
3.3越橘花色苷对小鼠肝脏中SOD和GSH-Px活力及MDA含量的影响
越橘花色苷对小鼠肝脏组织中SOD和GSH-Px活力及MDA含量的影响见表2。
表2结果显示,与对照组相比,模型组小鼠肝脏中SOD、GSH-Px酶活力明显降低(P<0.01),而MDA含量升高明显(P<0.01)。与模型组相比,阳性对照组及蓝莓花色苷高剂量及低剂量防护组小鼠肝脏中SOD、GSHPx酶活力升高明显(P<0.01),而MDA含量降低明显(P<0.01)。由结果可以看出,越橘花色苷能够显著改善

表2 越橘花色苷对小鼠肝脏组织中SOD和GSH-Px活力及MDA含量的影响Tabe 2 The effect of Buleberry anthocyanidin on the activity of SOD and GSH-Px and the conten of MDA in mouse hepar
2型糖尿病小鼠肝脏内氧化应激水平,从而对糖代谢进行调节。
3.4越橘花色苷对2型糖尿病模型小鼠肝脏病理改变的影响
病理切片检测表明,正常组小鼠肝脏组织中见个别肝细胞变性,其余肝细胞无变性坏死,偶见间质血管充血及炎症细胞浸润,未见间质水肿。与正常组相比,模型组小鼠肝脏组织中肝细胞变性、间质血管充血、间质水肿及炎症细胞浸润部分非常明显;与模型组相比,阳性给药组、越橘花色苷高剂量组和低剂量组小鼠肝脏组织中肝细胞变性、间质血管充血、间质水肿及炎症细胞浸润部分明显较少,表明越橘花色苷对2型糖尿病小鼠肝脏组织损伤具有一定的改善作用,见图2。
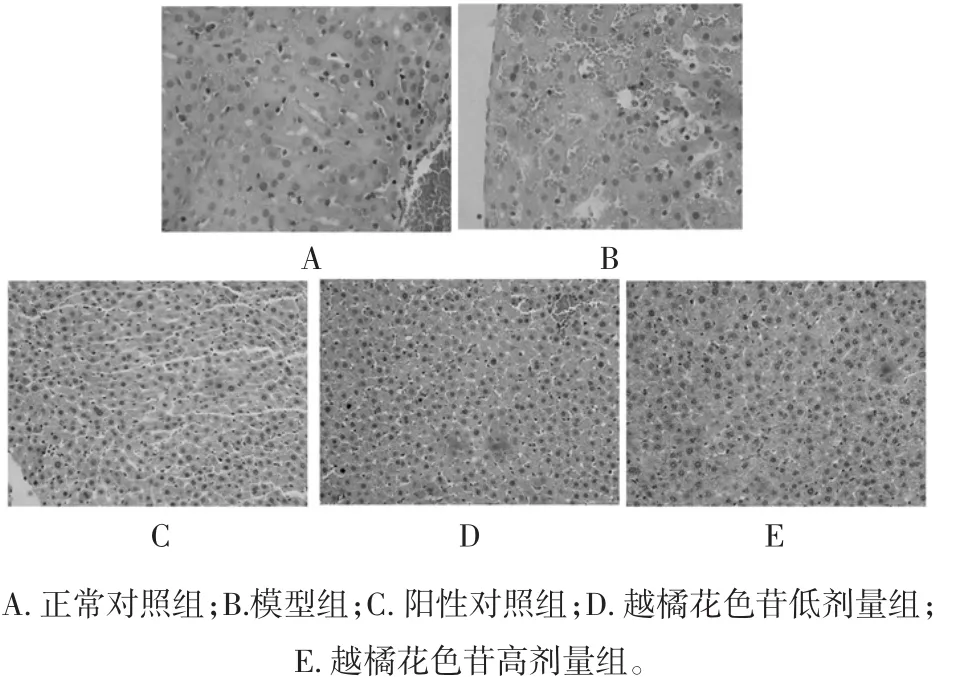
图2 肝脏组织病理切片(400X)Fig.2 Pathological sections of liver tissues(400X)
4 讨论
近年的研究表明,2型糖尿病是一种与氧化损伤密切相关的内分泌常见疾病,无论是2型糖尿病实验动物还是患者体内,确实存在氧化损伤相关指标的改变,进行抗氧化治疗能抑制或延缓2型糖尿病及其并发症的发生发展[8-10]。目前,国内外对于蓝莓的研究主要集中在抗氧化、抗癌等方面。但有关蓝莓花色苷通过抗氧化改善糖代谢的研究报道很少。本实验采用高脂饮食小剂量四氧嘧啶诱导的方法建立2型糖尿病模型,探讨蓝莓花色苷对对2型糖尿病的治疗作用。
本实验结果显示,与正常对照组相比,模型组小鼠空腹血糖维持在较高的水平,而阳性对照组和越橘花色苷给药组空腹血糖呈现下降趋势,说明蓝莓花色苷对2型糖尿病小鼠具有一定的治疗作用。正常机体内自由基代谢维持动态平衡,是由于存在有效的自由基清除系统。最重要的有SOD和GSH-Px,二者联合起来清除体内的氧自由基。在慢性高血糖状态下SOD和GSH-Px等可发生非酶促糖基化反应,使其清除自由基的能力明显下降,导致脂质过氧化的最终产物MDA生成增多[11]。可以间接反映机体内氧自由基的代谢状况、组织细胞受自由基损伤的程度及脂质过氧化程度[12]。研究结果显示,越橘花色苷能够显著提升2型糖尿病小鼠血清中SOD和GSH-Px的活力,降低其血清中MDA的含量,说明越橘花色苷能够有效清楚体内活性氧自由基和脂质过氧化物,保护机体免受自由基的损伤。
近年研究发现,肝脏是物质代谢的重要器官,也是常见的糖尿病慢性损伤的靶器官之一,肝脏中存在大量的胰岛素受体,当肝脏得不到滋养时,必然会使代谢所产生的有害物质积聚,进一步损伤肝细胞线粒体,使其能量供应受损,核糖体合成蛋白质的活性下降,肝脏合成蛋白质的能力进而减弱[13]。而肝脏的损伤又会进一步加剧血糖及脂肪代谢的紊乱。本研究结果表明,越橘花色苷对2型糖尿病小鼠肝脏的组织损伤具有一定的改善作用,可以减轻模型动物肝脏组织炎症细胞浸润及变性、水肿等,进而可以修复肝脏功能。
综上所述,蓝莓花色苷能够通过减轻实验性2型糖尿病小鼠机体的氧化损伤,有效改善血糖代谢,并对糖尿病所致的肝脏损伤具有一定的保护作用,其具体作用机制还需进一步研究。
[1]徐璐,郑建仙.欧洲越橘花色苷的研究概况[J].中国食品添加剂, 2005(4): 43-64
[2]李颖畅,孟宪军.蓝莓叶黄酮提取物抗氧化活性的研究[J].营养学报, 2008,30(4): 427-429
[3]杨桂霞,范海林,郑毅男,等.笃斯越橘果实中黄酮类化合物的分离鉴定[J].吉林农业大学学报,2005,27(6):643-644
[4]魏健,关丽华,王秀华.红豆越橘中化学成分的研究进展[J].北方园艺,2007(4):81-83
[5] KONG Jinming, CHIA L S, GOH N K, et al. Analysis and biological activities of anthocyanins[J]. Phytochemistry, 2003(64): 923-933
[6] Garzon G A, Narvaze C E, Riedl K M,et al. Chemical composition, anthocyanins,non anthocyanin phenolics and antioxidant activity of wild bilberry from Colombia[J]. Food Chem,2010,122(4):980-986
[7]朱文赫,徐俊杰,张巍,等.长白山笃斯越橘中花色苷不同提取工艺的研究[J].食品研究与开发,2012,33(4):59-62
[8] Ceriello A. New insights on oxidative stress and diabetic compl ications may lead to a"causal" antioxidant therapy [J]. Diabetes Care, 2003, 26(5): 1589 -1596
[9] Sardesai VM. Role of antioxidants in health maintenance[J].Nutr Clin Pract, 1995, 10(1): 19-25
[10] Ceriello A, M ercuri F, Quagliaro L, et al. Detection of nitroty-rosine in the diabetic plasma: evidence of oxidative stress[J].Diabetologia, 2001, 44(7): 834-838
[11] Mittler R. Oxidative stress, antioxidants and stress tolerance [J]. Trends in Plant Science, 2002, 7(9):405-410
[12] Barnham K J, Masters C L, Bush A I. Neurodegenerative Diseases And Oxidative Stress[J]. Nature Reviews Drug Discovery, 2004, 3 (3):205-214
[13]王蓉蓉,谢琳,吴晓烨,等.银杏叶提取物对实验性2型糖尿病大鼠肝脏的保护作用[J].中国病理生理杂志, 2007, 23(3):566-569
Protective Effect of Blueberry Anthocyanins on Oxidative Damage in Type 2 Diabetes Mice
LI Ya-wei,CHANG Sheng,WANG Li-ming,JIN Ying*
(Department of Pharmaceutical Chemistry,Jilin Medical College,Jilin 132013,Jilin,China)
Abstract:To investigate the antioxidant activity and the protective effect on liver of blueberry anthocyanins in type 2 diabetes mice. Type 2 diabetes mice model was induced by high-fat diet and small dose of alloxan. Fifty mices were separated into five groups:normal control group,model control group,positive control group(allox an),low-dose blueberry anthocyanins group(100 mg/kg·d)and high-dose blueberry anthocyanins group (200 mg/kg·d). The positive control and blueberry anthocyanins group were administered once daily for 30 days. We detected the fasting blood sugar of mices,the level of glutathione peroxidase(GSH-PX),superoxide dismutase(SOD)and malondialdehyde(MDA),the morphological changes of liver tissues after 12 hours behind the last time administration. Compared with the control group,the fasting blood sugar of mice maintained a higher level in model control group(P<0.01),the activity of SOD and GSH-PX in blood serum and liver tissues decreased significantly(P<0.01)while MDA content increased obviously(P<0.01). The liver cells in mice appeared pathological changes of denaturation,interstitial edema and inflammatory cell infiltration. Compared with the model control group,the blood sugar decreased obviously in positive control group(P<0.01)and blueberry anthocyanins group,the activity of SOD and GSH-PX increased(P<0.01)while MDA content decreased (P<0.01),the pathological changes of liver improved. Blueberry anthocyanins can relieve the oxidative damage of experimental type 2 diabetes mices,and had some protective effects on liver.
Key words:blueberry anthocyanins;type 2 diabetes mice;oxidative damage
收稿日期:2015-12-01
*通信作者:金瑛(1973—),女,教授,博士。
作者简介:李亚巍(1984—),女(汉),讲师,硕士研究生,研究方向:药物化学。
基金项目:国家自然科学基金资助项目(21102055)
DOI:10.3969/j.issn.1005-6521.2016.08.002

