可调控BMP-2表达的单质粒载体构建及其在ADSCs中的表达研究
王鹏,苗军,方成,胡永成,陈晓鹏
(1.天津医科大学研究生院,天津300070;2.天津市天津医院骨科,天津300211)
论著
可调控BMP-2表达的单质粒载体构建及其在ADSCs中的表达研究
王鹏1,苗军2,方成1,胡永成2,陈晓鹏1
(1.天津医科大学研究生院,天津300070;2.天津市天津医院骨科,天津300211)
目的:拟构建可调控骨形态发生蛋白(BMP-2)表达的单质粒慢病毒表达载体,为研究骨修复过程中的成骨性能打下基础。方法:通过基因重组技术获取含BMP-2的慢病毒表达载体,通过菌落PCR和基因测序鉴定;将慢病毒表达载体与包装载体pMD2.G和pSPAX在293T细胞中包装,收集病毒液,转染大鼠脂肪基质干细胞(ADSCs)。首先,从细胞形态学和MTT来初步分析诱导剂多西环素(Dox)不同浓度对ADSCs活性的影响;其次,缩小Dox浓度范围,在荧光显微镜下通过荧光表达强度判断Dox对ADSCs中基因表达的诱导效率,相同条件下,qRT-PCR分析BMP-2的mRNA的相对表达量,进一步优化Dox的诱导浓度;最后,通过Western blot检测不同Dox浓度下,转染目的基因的ADSCs中BMP-2表达,Image J软件进行灰度值分析判断二者之间的剂量依赖关系。结果:1%琼脂糖凝胶电泳证实pUC57-BMP-2经双酶切后可获得大小约1 100 bp的目的基因片段,菌落PCR和基因测序证实含目的基因的慢病毒表达载体pLVCT-BMP-2构建成功。ADSCs对Dox最大耐受浓度为6 μg/mL,Dox对ADSCs中目的基因表达的最大诱导浓度为5 μg/mL,Western blot证实ADSCs中BMP-2表达与Dox浓度(0~5 μg/mL)存在剂量依赖关系。结论:成功构建可调控BMP-2表达的单质粒慢病毒表达载体,转染ADSCs后,BMP-2的表达与Dox浓度存在剂量依赖关系。
骨形态发生蛋白-2;基因调控;多西环素;脂肪基质干细胞;慢病毒表达载体
骨形态发生蛋白(bone morphogenetic protein 2,BMP-2)是骨修复过程中不可替代的生长因子,其作用的时间和剂量与骨修复过程中的成骨性能密切相关[1-2]。目前多将BMP-2包被入微球、与载体材料混合,通过材料降解控制其释放从而实现BMP-2以时间和剂量依赖的方式作用,而蛋白质易降解,如BMP-2在大鼠体内的半衰期为16 min,灵长类只有6.7 min[3]。随着基因调控技术的发展,有望实现不同生长因子以时间和剂量依赖的方式表达,但多将目的基因和调控元件构建在不同的载体上,需要通过多次转染的方式实现BMP-2的调控表达,这种方法的转染效率低,且目的基因在无诱导条件下的背景表达高[4-5]。为了有效促进骨修复,BMP-2表达需要一种更为精确、有效的调控系统。本研究的目的:(1)构建可调控BMP-2表达的单质粒慢病毒载体;(2)优化诱导剂对ADSCs有效作用浓度,研究优化后的浓度对BMP-2表达的调控作用。
1 材料与方法
1.1 材料 FBS(HyClone公司,美国);L-DMEM培养基(GIBCO公司,美国);双抗(青霉素-链霉素,GIBCO公司,美国);MTT、多西环素(Doxycycline,Dox)、聚凝胺(Polybrene)(Sigma公司,美国);磷酸盐缓冲液(PBS)(生工,上海);rTap DNA聚合酶(宝生物工程有限公司,大连)。293T细胞由天津医科大学免疫炎症实验室张荣信教授惠赠;慢病毒表达载体pLVCT-tTRKRAB(简称pLVCT)、包装质粒pMD2.G、psPAX2购自 Addgene(美国);质粒pUC57-BMP-2由金唯智(苏州,中国)合成。Plasmid抽提试剂盒,聚合酶链反应产物回收试剂盒(Qiagen公司,德国),大鼠 BMP-2抗体(ImmunoWay生物公司,美国)。Plus-20离心超滤装置(Millipore公司,美国);倒置荧光显微镜(Olympus公司,日本)。
1.2 方法
1.2.1 调控BMP-2的慢病毒表达载体构建及鉴定 从 Genebank中提取大鼠 BMP-2基因(NM_017178.1)编码区序列,由金维智公司将BMP-2基因合成在质粒pUC57中,即pUC57-BMP-2。设计合成含PacI酶切位点(TTAATTAA)和MLu I酶切位点(ACGCGT)的一对引物,引物序列:上游引物5′-CCTTAATTAAATGGTGGCCGGGACCCGC-3′,下游引物5′-CGACGCGTCTAGCGACACCCGCAAC C-3′,以pUC57-BMP-2重组质粒为模板,PCR法扩增出大鼠BMP-2目的片段,聚合酶链反应参数为:预变性95℃,5 min;循环变性,94℃,30 s;复性,55℃,1 min;延伸,72℃,90 s,共32个循环,72℃,延伸15 min。经双酶切后在体积分数1%的琼脂糖凝胶电泳鉴定。
按聚合酶链反应产物回收试剂盒说明回收纯化目的片段,与同样经双酶切、纯化的慢病毒表达质粒pLVCT定向连接,连接产物转化感受态DH5α,将转化后的菌落平铺于含1‰氨苄霉素抗性的培养板中,37℃过夜培养,对长出的克隆进行PCR鉴定,共挑选5个克隆。其中PCR鉴定为阳性的克隆经测序鉴定,证明BMP-2已经定向连入pLVCT,命名为pLVCT-BMP-2。
在293T细胞中包装慢病毒,根据pLVCTBMP-2、pMD2.G和psPAX2测得的浓度,算出包装所需要的体积,分别于包装后的48 h和72 h收获病毒液,4℃保存。将1×106个ADSCs种植于10 cm皿中,待细胞80%融合后,在8 μg/mL的转染增强剂聚凝胺存在的前体下,用收集的病毒液感染大鼠ADSCs,6 h后更换正常培养基。
1.2.2 诱导剂浓度的优化 Dox用于诱导BMP-2表达,根据以往的研究报道,间充质干细胞(mesenchymal stem cells,MSCs)耐受Dox的浓度大约为1~10 μg/mL[6-8]。为了评估Dox对ADSCs的毒性,将ADSCs种植于6孔板中(1×105个/孔),首先设置不同的Dox浓度梯度(0、2、5、6、7 μg/mL),初步筛选诱导剂合适作用浓度,倒置显微镜下观察不同诱导浓度的诱导剂对ADSCs形态的影响;同时,将ADSCs种植于96孔板(1×103个/孔)中,72 h后采用MTT的方法在490 nm的吸光度下检测以上不同浓度下细胞的活性变化。
为了进一步优化Dox的诱导浓度,再将转染目的基因的ADSCs种植于6孔板中(1×105个/孔),添加不同浓度的Dox(0、1、3、5、5.5、6 μg/mL),通过在倒置显微镜下观察GFP的表达强度来判断诱导剂调控基因诱导表达的效率;同时,72 h后提取不同浓度下细胞的RNA,设计合适的引物(表1),采用qRTPCR检测不同诱导浓度下,目的基因的表达变化。
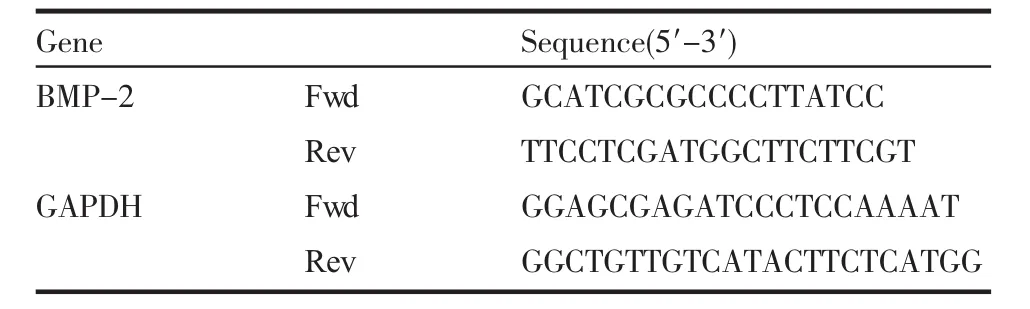
表1 qRT-PCR引物设计Tab 1 The design of qRT-PCR primer
1.2.3 BMP-2表达调控研究 将1×106个转染目的基因的ADSCs种植于10 cm皿中,添加不同浓度的 Dox,72 h后提取不同诱导浓度下总蛋白,Western blot研究 Dox浓度梯度调控 BMP-2在ADSCs中表达的剂量依赖关系,采用Image J软件通过灰度值分析,描绘诱导剂浓度与BMP-2相对表达量的关系。
1.2.4 调控BMP-2的慢病毒表达载体的构建和鉴定 慢病毒表达载体pLVCT的作用原理:如图1,pUC57-BMP-2重组质粒经克隆限制性内切酶Pac I和MLu I酶切后可获得长度为1 100 bp的片段产物(图2A)。回收目的基因片段和酶切后的慢病毒表达片段,将二者在室温下经酶联、转化感受态的DH5α,接种于琼脂培养板上,随机挑选5个单克隆菌落行PCR鉴定,均为阳性,片段大小约为1 100 bp(图2B)。基因测序与Genbank中的参考序列一致,提示成功构建HO-1基因慢病毒载体。再将阳性克隆的菌落通过摇菌、提质粒的方式可大量获得含目的基因的慢病毒表达载体。
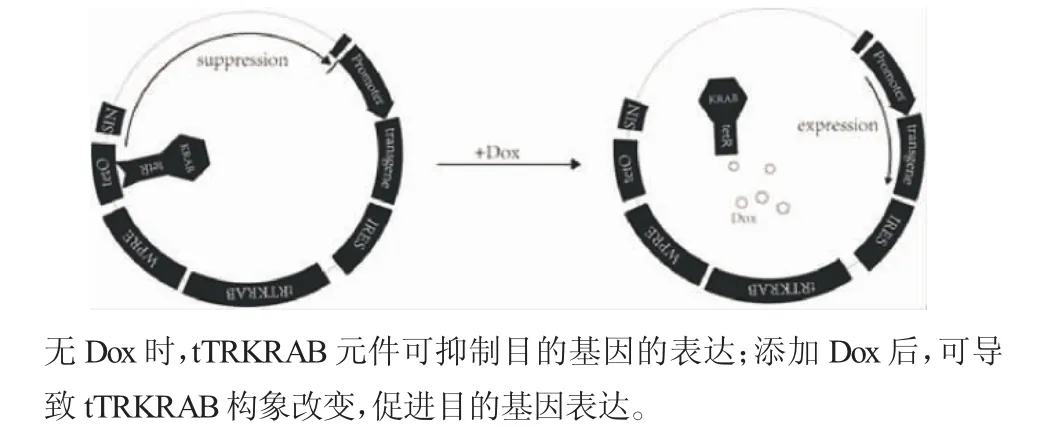
图1 pLVCT作用模式图Fig 1 The pattern action of pLVCT
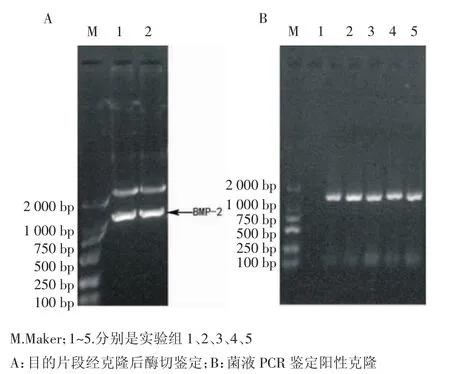
图21 %琼脂糖凝胶电泳Fig 2 1%agarose gel electrophoresis
1.3 统计学处理 采用SPSS17.0统计软件(SPSS公司,美国)进行统计数据分析。计量资料数据以s表示,两组之间比较采用t检验,检验水准α值取双侧0.05。
2 结果
2.1 诱导剂浓度的优化 Dox浓度梯度为7 μg/mL时,ADSCs的形态发生改变(图3),活性降低(图4)。因此,笔者缩小Dox的诱导浓度,倒置荧光显微镜下观察诱导剂浓度与荧光表达的剂量关系,发现Dox浓度梯度为5.5 μg/mL时,荧光强度较5 μg/mL没有明显增强(图5);以Dox浓度为0 μg/mL测得的BMP-2的mRNA为参照,其它不同浓度组BMP-2的mRNA相对表达量比较发现:Dox浓度为5 μg/mL时,mRNA的表达量较3 μg/mL增多,差别有统计学意义(P<0.05),而与5.5 μg/mL差别无统计学意义(P>0.05)(图6)。因此选择Dox为(0、1、2、3、4、5 μg/mL)作为接下来的研究对象。
2.2 BMP-2表达调控研究 从Western blot结果中可知,Dox在0、1、2、3、4、5 μg/mL范围内,随着Dox浓度的逐渐增加,BMP-2的表达逐渐增加(图7A);灰度值分析发现,Dox的诱导浓度与BMP-2的表达量存在一定的线性关系(图7B),BMP-2在Dox为5μg/mL条件下,较0μg/mL表达明显增多(P<0.05)。
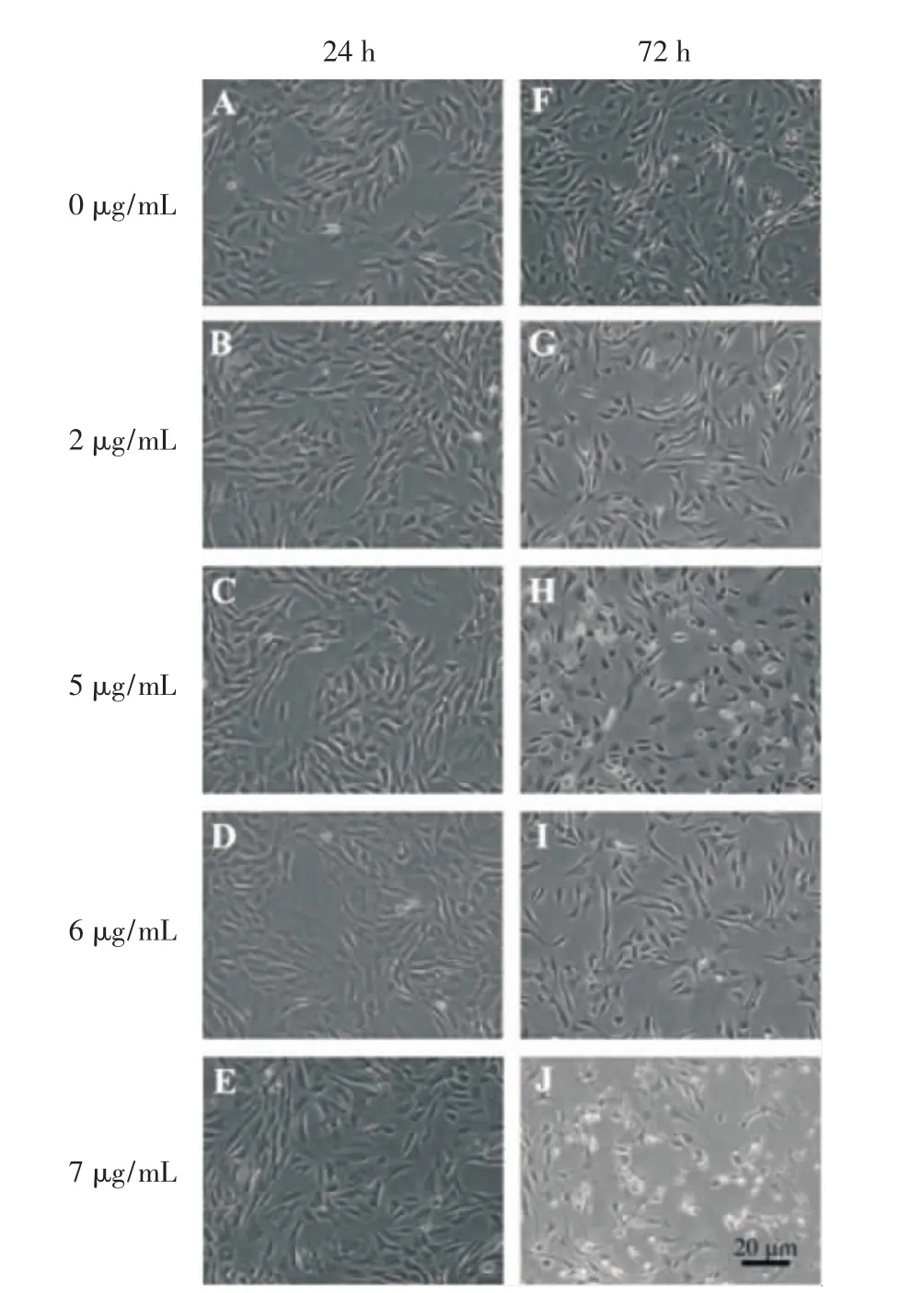
图3 不同Dox浓度下,ADSCs细胞形态变化Fig 3 The cell morphological changes of ADSCs at different concentrations

图4 不同Dox浓度下,细胞活性检测Fig 4 The cell activity assay at different Dox concentrations

图5 不同Dox浓度(0、1、3、5、5.5、6 μg/mL)下,荧光诱导强度变化Fig 5 At different Dox concentration(0,1,3,5,5.5,6 μg/mL),the change of the fluorescence induced intensity
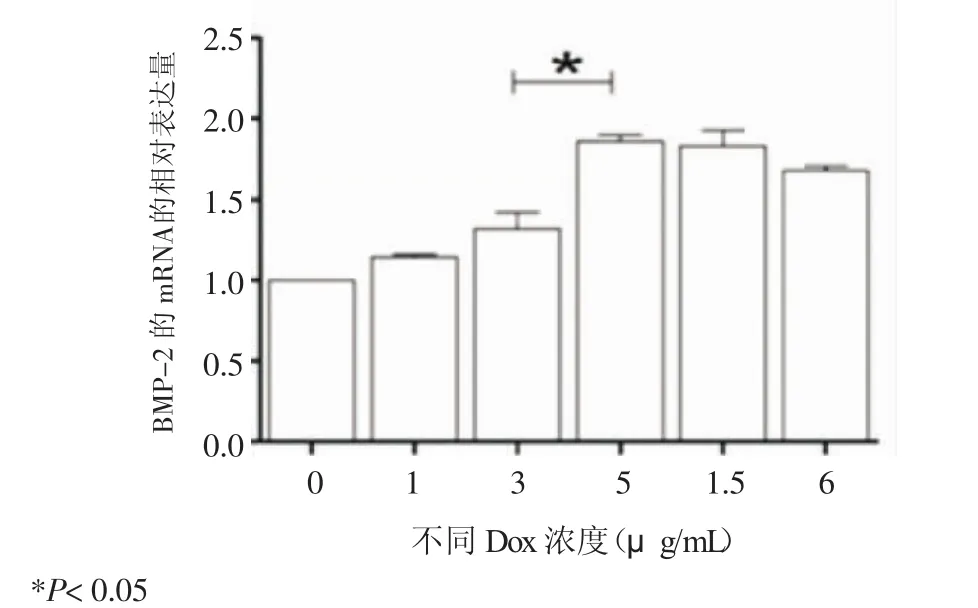
图6 不同Dox浓度下,BMP-2的mRNA表达变化Fig 6 The expression changes of mRNA of BMP-2 at different Dox concentrations
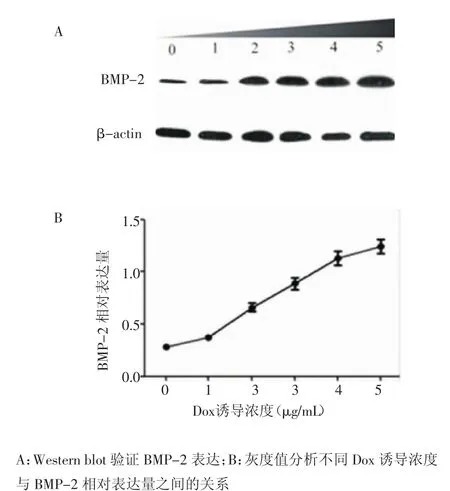
图7 不同Dox浓度下,BMP-2在ADSCs中的诱导表达分析Fig 7 The analysis of the induced expression of BMP-2 in ADSCs at different Dox concentrations
3 讨论
骨修复是细胞迁移、增殖、分化、基质合成、矿化有序发生高度协调的过程[9]。研究发现,去除BMP-2可以阻止骨折的早期修复,即便补充上调BMP-4和-7也不能逆转[3],故BMP-2在骨修复中具有不可替代的作用。Gurkan等[10]研究骨髓提取物体外成骨分化过程中发现BMP-2在不同阶段表达变化规律不同:BMP-2在2~7 d间高表达,上调Runx2、Smad4,使得细胞转向成骨分化,随后,BMP-2表达逐渐降低并维持在一定水平,在此过程中,成骨分化的细胞逐渐成熟。因此,调节BMP-2在骨修复中作用的时间和剂量是目前骨组织工程中研究的重点[2,4,11]。而基因调控技术的进步为实现生长因子以时间和剂量依赖的作用方式提供有效途径[12]。
3.1 基因调控技术的研究现状 基因调控技术包括转录前调控和转录后调控,前者包括细胞特异性调控系统、条件调控系统以及二者结合的调控系统[12]。目前,骨组织工程中基因精确调控的研究多利用条件调控系统,该系统通过影响转录因子与DNA序列结合实现下游目的基因表达开放或关闭,它根据对转录因子的作用原理不同,又可分为两种:一种是通过添加生物小分子作为配体改变转录因子的构象或结构,即配体调控系统,包括四环素(Tetracycline,Tet)调控系统和雷帕霉素调控系统等;另一种是根据生理环境的变化调节转录因子的功能状态而影响目的基因表达,即生理调控系统,包括低氧调控系统和氧化应激调控系统。
配体调控系统中小分子诱导剂与基因表达之间存在严格的剂量依赖关系,更能满足BMP-2的表达特点,其中Tet调控系统最有前景,已在动物体内实验中得到初步验证[11]。该系统由Tet阻遏蛋白(Tet repressor protein,TetR) 或反义 TetR(reverse TetR,rTetR)、Tet操纵子序列(Tet operator,TetO)与四环素衍生物Dox组成,Dox的浓度对rTetR或TetR构象改变存在剂量反应关系,从而改变与TetO结合的强弱,根据rTetR或TetR对TetO结合后目的基因的转录方式不同可以分为Tet-On和Tet-Off两大类,前者在添加Dox时改变rTetR构象,使其与TetO结合增强,从而诱导下游BMP-2表达,且BMP-2表达量与诱导剂存在剂量依赖型关系;而Tet-Off系统中添加Dox时导致TetR构象改变,与TetO结合增强,抑制下游BMP-2表达,后期当需要BMP-2持续低表达时,Dox的持续添加会减低骨代谢率,因子Tet-On系统应用范围更广[13]。为了实现BMP-2的调控表达,传统的方法多采用两种质粒共转染MSCs的方式,一个载体表达BMP-2,另一个载体表达转录激活因子,调节BMP-2的表达,本研究中采用的慢病毒表达载体为单质粒,既包含表达BMP-2的载体,又具有可调控BMP-2表达的激活因子;再将具有转录抑制作用的KRAB(Krüppelassociated box)基因序列整合到TetO上游,在未添加Dox时KRAB可以促进TetR与TetO结合,故新得到的Tet-On系统降低目的基因的背景表达,即不添加Dox时无或仅有少量目的基因表达,同时单质粒慢病毒转染的方法提高了目的基因的转染效率。
3.2 诱导剂浓度与目的基因表达的剂量依赖关系 该研究中构建的单质粒慢病毒Tet-On系统中,Dox作为诱导剂可在一定范围内通过浓度大小来控制目的基因的表达[14],而骨修复后Dox的持续添加会影响骨代谢率[15],因此,需要对Dox的诱导浓度进行筛选。本研究中,在Dox小于6 μg/mL条件下,ADSCs培养72 h后,细胞形态未发生明显改变,说明ADSCs可以耐受6 μg/mL的Dox。ADSCs这种耐受Dox药理毒性的作用较软骨细胞大[15]。可能是干细胞具有相对较强的增殖能力,可以抵抗细胞凋亡引起的数量的减少,而随着Dox浓度的增加,当Dox浓度为7 μg/mL时,细胞形态发生改变,伴随着细胞增殖能力的减弱。
为了进一步研究Dox对目的基因的诱导效率,缩小Dox浓度范围后,观察Dox浓度与荧光表达强弱的关系,当Dox浓度为5 μg/mL时,ADSCs的荧光强度达到最大,约90%;当Dox浓度增加至5.5 μg/mL时,荧光表达较5 μg/mL并没有明显增强,此外,BMP-2的mRNA相对表达量也证实Dox为5 μg/mL可作为转染后ADSCs内目的基因表达的最大诱导浓度。由于荧光表达基因位于目的基因下游,随目的基因的表达而共同表达,其强度大小可以间接反映目的基因表达[16],这些研究提示Dox浓度在5 μg/mL以内,与BMP-2的表达可能存在剂量依赖性。
为了研究Dox诱导调控ADSCs中BMP-2表达,本研究采用了目前比较成熟的方法之一,Western blot,它可以通过特异性的抗体检测细胞中目的基因的表达。在相同上样量和曝光强度条件下,可以通过对基因表达的灰度值分析来判断目的基因表达强弱[8]。本研究中,我们通过Image J软件分析结果发现,Dox浓度在0~5 μg/mL之间增加,可诱导BMP-2基因表达的增多,二者之间存在剂量反应关系。
综上,本实验构建的pLVCT-BMP-2表达载体,除了实现BMP-2蛋白的调控表达之外,还将绿色荧光蛋白作为报告基因,为体内外研究骨修复过程的示踪定位和诱导表达强度提供了一个重要且方便的工具,为下一步研究多因子联合作用奠定基础。
[1]RamazanogluM,Lutz R,Rusche P,et al.Bone response to biomimetic implants delivering BMP-2 and VEGF:an immunohistochemical study[J].J Craniomaxillofac Surg,2013,41(8):826
[2] Tsuji K,Bandyopadhyay A,Harfe B D,et al.BMP2 activity, although dispensable for bone formation,is required for the initiation of fracture healing[J].Nat Genet,2006,38(12):1424
[3] Lauzon M A,Bergeron E,Marcos B,et al.Bone repair:new developments in growth factordelivery systems and their mathematical modeling[J].J Control Release,2012,162(3):502
[4] Noël D,Gazit D,Bouquet C,et al.Short-term BMP-2 expression is sufficient for in vivo osteochondral differentiation of mesenchymal stem cells[J].Stem Cells,2004,22(1):74
[5] Mizuguchi H,Hayakawa T.Characteristics of adenovirus-mediated tetracycline-controllableexpressionsystem[J].BiochimBiophysActa, 2001,1568(1):21
[6]Qian DY,Bai B,Yan G,et al.Construction of doxycycline-mediated BMP-2 transgene combining with APA microcapsules for bone repair[J].Artif Cells Nanomed Biotechnol,2016,44(1):270
[7] Lee H H,O’malley M J,Friel N A,et al.Effects of doxycycline on mesenchymal stem cell chondrogenesis and cartilage repair[J]. Osteoarthritis Cartilage,2013,21(2):385
[8]Wang Y H,Ho M L,Chang J K,et al.Microporation is a valuable transfection method for gene expression in human adipose tissuederived stem cells[J].Mol Ther,2009,17(2):302
[9] Kempen D H,Lu L C,Heijink A,et al.Effect of local sequential VEGF and BMP-2 delivery on ectopic and orthotopic bone regeneration[J].Biomaterials,2009,30(14):2816
[10]Gurkan U A,Gargac J,Akkus O.The sequential production profiles of growth factors and their relations to bone volume in ossifying bone marrow explants[J].Tissue Eng Part A,2010,16(7):2295
[11]Wübbenhorst D,Biol D,DumLer K,et al.Tet-regulated BMP-2 gene expression in lentivirally transduced primary rabbit chondrocytes for treatment of cartilage defects[J].Arthritis Rheum, 2010,62(7):2037
[12]Jazwa A,Florczyk U,Jozkowicz A,et al.Gene therapy on demand: site specific regulation of gene therapy[J].Gene,2013,525(2):229
[13]Shiota G,Yoshida Y.“Tet-On”system toward hepatic differentiation of human mesenchymal stem cells by hepatocyte nuclear factor[J]. Methods Mol Biol,2012,826:125
[14]Stieger K,Belbellaa B,Le Guiner C,et al.In vivo gene regulation using tetracycline-regulatable systems[J].Adv Drug Deliv Rev,2009, 61(7/8):527
[15]Yao Y,He Yu,Guan Q,et al.A tetracycline expression system in combinationwithSox9forcartilagetissueengineering[J].Biomaterials, 2014,35(6):1898
[16]黄洪超,苗军,刘春蓉,等.可体内、外示踪的BMP2真核表达载体的构建和表达[J].中华骨科杂志,2010,30(12):1228
(2015-12-06收稿)
Construction of a single vector in BMP-2 expression in a controlled manner and its expression in ADSCs
WANG Peng1,MIAO Jun2,FANG Cheng1,HU Yong-cheng2,CHEN Xiao-peng1
(1.Graduate School,Tianjin Medical University,Tianjin 300070,China;2.Department of Orthopedics,Tianjin Hospital,Tianjin 300211, China)
Objective:To construct a single vector in BMP-2 expression in a controlled manner and investigate its expression in adipose derived stromal cells(ADSCs).Methods:The lentiviral vector containing BMP-2 gene was constructed through genetic recombination and identified by bacterial PCR and sequence analysis.ADSCs were transfected by lenvirus collected from 293T cell.First,cell viability was analyzed through cell morphology and MTT assay at different induced concentrations of doxycyline(Dox).Second,to estimate the efficiency of the Tet-On and determine the optimal induction concentration of Dox,the strength of fluorescence was detected.The mRNA of BMP-2 was also analyzed through qRT-PCR.Lastly,the capacity of inducing BMP-2 expression in ADSCs by Dox was investigated by Western blot and densitometric analysis.Results:pLVCT-BMP-2 was successfully generated in this research by bacterial PCR and sequence analysis. The results indicated ADSCs from rat could stand up to 6 μg/mL Dox,and Dox of 5 μg/mL was finally determined as the optimal induction concentration.The densitometric analysis of BMP-2 expression showed that BMP-2 expression in ADSCs was in a dose-dependent manner.Conclusion:Lentiviral vector containing BMP-2 could be successfully generated.The conditional BMP-2 expression is regulated by Dox in a dose-dependent manner,providing the opportunity to explore BMP-2 expression and guide the bone healing process in vivo.
bone morphogenetic protein-2;gene controlling;doxycyline;adipose derived stromal cells;lentiviral vectors
R68
A
1006-8147(2016)03-0208-05
国家自然科学基金资助项目(81472140);天津市自然科学基金资助项目(12JCYBJC16400,14JCTPJC00487)
王鹏(1990-),男,硕士在读,研究方向:骨外科;通信作者:胡永成,E-mail:yongchenghu@126.com。

