低盐胁迫对大底鳉(Fundulus grandis)血浆渗透压、鳃上皮细胞形态和通道蛋白mRNA表达的影响
关颖, GALVEZ Fernando, 张国霞,*, 张胜卿
低盐胁迫对大底鳉(Fundulus grandis)血浆渗透压、鳃上皮细胞形态和通道蛋白mRNA表达的影响
关颖1, GALVEZ Fernando2, 张国霞1,*, 张胜卿3
1. 广东省热带病研究重点实验室,南方医科大学公共卫生学院, 广州 510515
2. 路易斯安那州立大学生物系, Baton Rouge 70802
3. 广州舒国生物科技有限公司, 广州510000
为了研究水环境中的低盐度对大底鳉(Fundulus grandis)的适应性影响, 采用生理和荧光定量PCR方法探讨了盐度为5、2、1、0.5和0.1的情况下, 不同饲养时间大底鳉的血浆渗透压, 鳃上皮细胞超微结构及通道蛋白mRNA表达的变化。饲养时间小于1 d、盐度小于0.5的胁迫可以导致血浆渗透压明显降低(P<0.001); 鳃上皮表面泌氯细胞的体积增大、顶隐窝开口扩大或其细胞的形状变为三角形或不规则形。当饲养时间超过3 d时, 血浆渗透压以及鳃上皮表面泌氯细胞的形态都恢复到对照组水平 (盐度为5); 低盐胁迫上调了六种鳃通道蛋白mRNA的表达, 并下调了两种鳃通道蛋白mRNA的表达。结果显示: 广盐性的大底鳉通过调整鳃上皮的形态及通道蛋白mRNA的表达来维持机体渗透压的平衡状态。
盐度; 大底鳉; 血浆渗透压; 微结构; 通道蛋白; mRNA
1 前言
大底鳉(Fundulus grandis)为辐鳍鱼纲鲤齿目鲤齿亚目底鳉科的一种, 分布于西大西洋佛罗里达至古巴西部海域及墨西哥湾沿岸[1]。大底鳉是广盐性硬骨鱼类, 可适应0.1—35的盐度变幅。当外界环境的渗透压发生变化时, 大底鳉可通过渗透压调节器官如鳃, 小肠和肾脏等维持体内渗透压平衡。它独特的盐度适应性使其成为研究环境盐度因素的良好模型[2–3]。鳃作为大底鳉主要渗透压调节器官在维持机体渗透压平衡以及适应环境盐度变化中发挥重要的作用。在鳃丝和鳃小片表面覆盖鳃上皮, 其作用是分隔细胞外液和周围水环境。鳃上皮主要由泌氯细胞(chloride cells)和扁平细胞(pavement cells, PVC)构成。泌氯细胞主要分布在鳃小片的基底部, 为圆型或卵圆形的大细胞, 其形态分为海水型(seawatertype, SW-type)和淡水型(freshwater-type, FW-type)两种形态。SW-type的泌氯细胞的表面呈卵圆形, 仅有小量的微绒毛伸向泌氯细胞的中心; 而FW-type的泌氯细胞表面形态不规则, 并且突出于周围扁平细胞的表面, 且有微绒毛伸向泌氯细胞的中心[4]。泌氯细胞内含有丰富的线粒体和Na+-K+-ATP酶, 主要功能是分泌Cl–, 同时帮助Na+进行跨膜扩散[5]。Na+和Cl–是组成血浆渗透压的主要的离子成分, 低盐胁迫后, 硬骨鱼类必须通过自身的调节来维持机体Na+和Cl–的平衡状态。同时, 鳃上皮的通道蛋白(如水通道蛋白-3, 多种转运蛋白如(Na+-K+-ATP酶)以及紧密连接蛋白如Claudins等也参与离子转运, 从而保持血浆渗透压的平衡[6–7]。
气候变化如全球变暖, 冰川融化, 降雨量增加以及在潮汐的动力驱动下, 海水盐分通过对流输运和稀释扩散等作用导致大底鳉生存环境盐度的降低。近年来对大底鳉的生物学特征、酸碱平衡以及繁殖等方面的研究日益增多[8–9]。然而, 大底鳉在低盐环境中的生存机制还不明确。为了探讨大底鳉如何适应环境盐度的变化特别是微小的盐度变化, 本研究在实验室中模拟低盐环境来观察低盐胁迫对大底鳉血浆渗透压、鳃超微结构以及通道蛋白mRNA表达的影响。实验结果有助于了解大底鳉渗透压调节的机制, 从而为大底鳉增养殖及资源保护提供理论支撑。
2 材料与方法
2.1实验材料
实验于2012年5月至2013年12月在美国路易斯安那州立大学生物学系进行。实验用水是用盐度为20的砂滤海水和爆气自来水按比例配制, 温度控制在(21±1) ℃。水系统一周部分换水2次, 保持连续充气, 并通过生物过滤器和紫外线消毒装置来对水系统进行消毒灭菌。实验用鱼是从墨西哥湾沿岸海域捕获的天然大底鳉(Fundulus grandis), 日投饵量为其体质量的2%。实验前, 将天然大底鳉暂养在盐度为5的水系统中30天。
2.2实验方法
2.2.1 实验设计
实验设置5个盐度梯度分别为5、2、1、0.5和0.1, 其中盐度5为对照组。实验时, 将暂养在盐度为5的水系统中的成年大底鳉(体质量4.3 -16.8 g)随机分配到4个盐度梯度的水系统中, 每个盐度设置了3个平行对照。实验的取样时间为6 h, 1 d, 3 d和7 d, 从各实验组随机取9尾鱼, 取血液及双侧鳃弓。取样前12 h禁食。
2.2.2 大底鳉血液样本的制备和血生化的测定
用MS-222(间氨基苯甲酸乙酯甲烷磺酸盐)将大底鳉麻醉, 用毛细吸管在鱼体臀鳍下方动脉取血,血液离心3000 r·min-1, 8 min至完全分层, 收集上清,采用Fiske210微型冰点渗透压仪测定渗透压。血浆中Na+和Cl–含量分别采用火焰原子吸收光谱法及硫氰酸盐容量法[10]测定。
2.2.3 大底鳉鳃丝扫描电镜样本的制备
取左侧鳃弓的第一条鳃丝, 用生理盐水清洗干净后, 用2.5%的戊二醛(用0.1(mol·L-1)磷酸缓冲液配制, pH 7.4)溶液固定, 固定后样本在4 ℃下保存12 h,然后用0.1(mol·L-1)磷酸缓冲液(pH 7.4)冲洗15 min,重复3次; 再用体积分数为1%锇酸溶液固定后,在4 ℃下保存2 h。用0.1(mol·L-1)磷酸缓冲液配制(pH7.4)冲洗三次, 每次15 min。然后用50%—100%乙醇逐级脱水, 醋酸异戊酯置换, 常规临界干燥,真空离子镀膜, 在JSM-6610扫描电镜下观察和拍照。
2.2.4 大底鳉鳃组织RNA提取及荧光定量PCR
用Trizol法提取鳃组织(左侧第2、3、4条鳃丝及右侧鳃弓)的总RNA。通过NanoDrop2000微量紫外分光光度仪(Thermo公司)检测其纯度和浓度, 控制260/280吸光值的比率在2至2.1的范围内。总RNA经0.1%琼脂糖凝胶电泳检测RNA完整性, 采用High capacity cDNA Reverse Transcription试剂盒(Applied Biosystems)将RNA转为单链cDNA。利用Primer 3.0软件设计荧光定量PCR的特异性引物如表1所示。荧光定量PCR在ABI7500荧光定量PCR仪上进行, 总反应体系为20 µL(5 µL模板cDNA, 2 µL SYBR试剂,终浓度为10 nM的正向和反向引物)。反应程序为95 ℃(15 s), 60 ℃(1 min), 40个循环, 待检测样本和内参分别设置3个重复, 18s-rRNA为内参, 以确保特应性扩增。标准曲线有系统分析, 基因表达水平根据2–ΔΔCt计算相对定量[11]。
2.2.5 数据处理与分析
所得数据为均值±标准差(N=9), 应用SPSS20.0 统计软件进行分析。数据分析采用析因设计单因素方差分析, 多个样本比较采用单因素方差分析和SNK检验。
3 结果与分析
3.1低盐度胁迫对大底鳉血浆渗透压的影响
与盐度为5的对照组相比, 将大底鳉置于盐度为0.5的环境中6 h时, 血浆渗透压迅速下降19% (P<0.001), 1 d后其值恢复到对照组水平; 当大底鳉置于盐度为0.1的环境中6 h时, 血浆渗透压降低了10%, 1 d内血浆渗透压降低了20%, 达到最低点。而当环境盐度降到2或1时, 即使增加大底鳉低盐暴露的时间, 血浆渗透压也无明显变化(P=0.798或0.879)。可见, 只有环境盐度降低到0.5以下时, 才会对血浆渗透压产生明显的影响。由表2可知, 血浆渗透压降低的幅度依赖于盐度的降低幅度以及低盐环境暴露的时间。
3.2低盐度胁迫对大底鳉血浆Na+和Cl–浓度的影响
血浆渗透压主要由Na+和Cl–构成, 图1结果显示, 与盐度为5的对照组相比, 当大底鳉置于盐度为0.1的水系统中1 d, 血浆中Na+和Cl–浓度分别降低了18%和22% (P<0.001); 两种离子浓度都能在3 d后再恢复到对照组的水平。
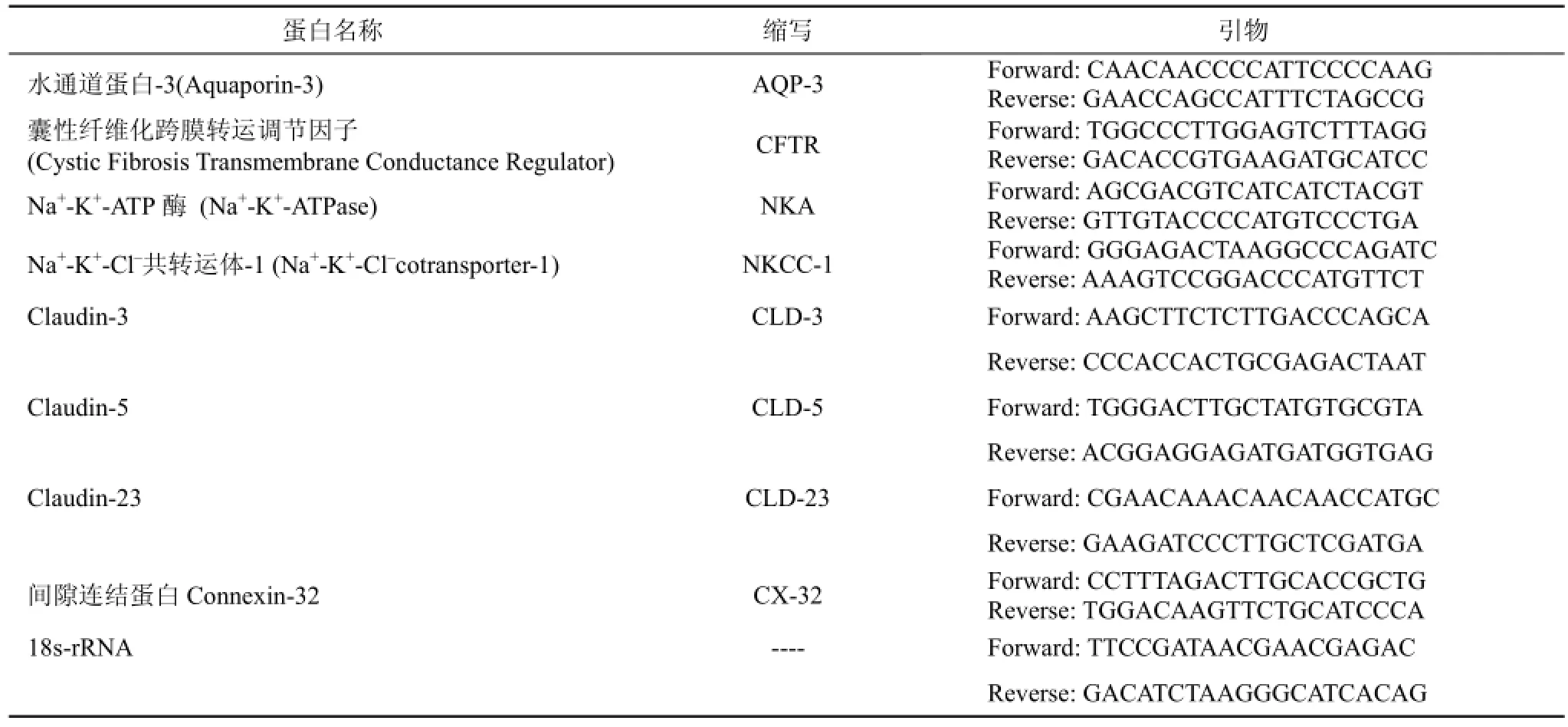
表1 荧光PCR引物序列Tab. 1 Sequences of forward and reverse primers used for quantitative PCR

表2 盐度对大底鳉血浆渗透压(mOsm·Kg–1)的影响Tab. 2 The effects of different salinities on plasma osmolality (mOsm·Kg–1)

图1 低盐度胁迫对大底鳉血浆Na+和Cl–浓度的影响Fig. 1 Effects of low salinity stress on plasma Na+and Cl–concentration.
3.3低盐度胁迫对大底鳉鳃丝超微结构的影响
短时间(≤1 d)的低盐度环境的暴露会导致血浆的渗透压和离子浓度的明显降低; 特别是在环境盐度降低到0.1 (表1, 图1)。扫描电镜的结果显示: ①对照组鳃上皮细胞为多边形, 形成了由环形隆起嵴组成的四边形至六边形不同形状的图案。与对照组比较, 在盐度为2或1的环境中7 d内, 鳃上皮细胞的形态无明显变化, 为海水型泌氯细胞形态; ②当环境盐度降为0.5 (6 h)时, 泌氯细胞膨大, 体积明显增大, 泌氯细胞的顶隐窝(apical crypt)开口扩大, 使得该上皮区域向外突出, 铺盖其上面的扁平细胞区域变小。这种变化在暴露1 d后发生好转。当环境盐度降为0.1 (6 h) 时, 泌氯细胞的形状变为三角形或不规则形, 对周围扁平细胞的挤压更加明显; 暴露时间延长到1 d, 泌氯细胞膨胀的更加剧烈, 已出现明显的淡水型泌氯细胞的形态, 表现为鳃丝中泌氯细胞向外凸起, 并且可见发达的微绒毛[12]。3 d内泌氯细胞形态转变为SW型(结果未显示)。

图2 低盐度胁迫对大底鳉上皮结构扫描电镜观察Fig. 2 Representative scanning electron micrographs of the afferent filamental epithelium of F. grandis.
3.4低盐度胁迫对大底鳉鳃上皮通道蛋白mRNA表达的影响
随着时间延长, 八种蛋白的mRNA表达水平都出现了明显的变化。将对照组所有mRNA的表达水平定义为1, 和对照组比较, AQP-3和NKA的mRNA表达量分别增加了17倍(3 d)和2倍(7 d) (图3A, 3C); CLD-3, 5, 23的mRNA表达量分别增加了2.3倍(1 d), 2.1倍(3 d)和4倍(6 h) (图3E-G); CX-32mRNA表达量增加了2.1倍(1 d) (图3H)。然而, 和对照组相比, CFTR和NKCC-1的mRNA表达量出现明显下调趋势, 分别下降了47% (3 d)和29% (3 d) (图3B, 3D)。

图3 低盐度胁迫对不同通道蛋白mRNA表达水平的影响Fig. 3 The effects of hypoosmotic exposure on the relative mRNA expressions of different transporters in gills of F. grandis.
4 讨论
4.1低盐度胁迫对血浆渗透压及鳃上皮结构的影响
通过实验室模拟的方法, 研究环境盐度的微小变化对大底鳉血浆渗透压, 鳃超微结构以及通道蛋白mRNA表达的影响。大底鳉对盐度的适应过程可以分为两个主要阶段: 一是盐度变化短期内(≤1 d),血浆渗透压呈迅速下降的趋势; 二是渗透压向变化前的状态逐渐恢复的过程。大底鳉在最初的1 d内是被动的适应外界环境, 低盐环境刺激了机体渗透压调节机制, 开始对渗透压进行主动性的恢复。大底鳉对盐度变化的适应能力很强(≤1 d), 不同种类的鱼适应盐度变化所需的时间不同, 如墨西哥湾鲟(Acipenser oxyrinchus de sotoi)[13], 由淡水向盐水转移后, 1 d内渗透压可恢复; 而布氏棘鲷(Acanthopagrus butcheri)[14]由盐水向淡水转换后, 需要3-6个月才能恢复其渗透压。本研究结果显示血浆渗透压表现出随盐度的下降而下降的趋势(表1), 该结果和其他研究者的报道表现出相同的趋势[15–16]。
环境盐度微小的变化即从1降到0.5就会导致大底鳉血浆渗透压和主要离子(Na+和Cl–)浓度的失衡(表2,图1), 血浆渗透压在大底鳉暴露于盐度为0.5的盐水中6 h就显著降低, 但是其恢复速度较快(1 d内); 但是, 当盐度降低到0.1时, 渗透压降低更加明显, 而且需要更长的时间来恢复到对照组的水平(表1)。与渗透压变化相应的出现鳃上皮的形态的改变(图2)。随着血浆渗透压的降低(≤0.5), 泌氯细胞体积膨大, 并出现泌氯细胞表面形态由SW型转变为FW型, 该结果与其他研究一致[17–18]。同时, 低盐胁迫过程中, 鳃上皮细胞出现了三角形的FW细胞, 它们与周围的扁平细胞锯齿状相连, Laurent将这些特殊的FW泌氯细胞定义为立方体细胞, 这种细胞对离子的通透性差, 可以防止离子从鳃上皮细胞中丢失, 起到保持血浆离子浓度的作用[19]。虽然泌氯细胞在鳃上皮细胞中所占的比例小, 但是它们在硬骨鱼类渗透压调节中至关重要。鳃上皮细胞中的泌氯细胞的形态从SW型转变为FW型, 导致了鳃上皮细胞的重塑。多种环境因素或生理因素都会导致硬骨鱼鳃上皮细胞的重塑, 如缺氧可以导致鲫(Carassius carassius)层间细胞团(interlamellar cell mass, ILCM)增生[20], 而低氧和高温皆可以导致鲫鳃上皮细胞ILCM凋亡而导细胞重塑[21]。虽然目前上皮细胞重塑的机制不详, 但是这种快速的细胞形态的转换有利于广盐性鱼适应外周环境的急剧变化。
4.2低盐胁迫对鳃上皮通道蛋白mRNA表达的影响
低盐胁迫导致鳃上皮中六种通道蛋白mRNA表达增加, 包括AQP-3, NKA, Claudins-3, 5, 23以及CX-32(图3)。水通道蛋白是一种位于细胞膜上的蛋白质, 在细胞膜上组成“孔道”, 可以控制水进出细胞。低盐胁迫导致AQP-3 mRNA表达增加(图3A),该结果和其它研究结果一致[8]; 高盐胁迫下, AQP-3 mRNA在大西洋鲑(Salmo salar)[22]和欧洲鳗(Anguilla Anguilla)[23]鳃上皮中表达量降低。这些结果提示硬骨鱼类可以通过水通道蛋白来调节水进出细胞来从而保持渗透压的平衡。NKA不仅可以从外环境中吸收Na+, 它还可以提供离子主动转运所需要的能量,其表达量随低盐暴露时间的延长而增加表示可能有更多耗能的通道蛋白参与到维持机体渗透压的平衡中(图3C)。而紧密连接蛋白如Claudins家族和Connexin家族在调节膜的渗透性和细胞旁通道离子转运中起到关键作用[24–25]。鳃上皮中Claudins和CX-32 mRNA水平受环境盐度的响应(图3E-H), 但对Claudins蛋白的认知主要来源于哺乳动物, 其在鱼类中的功能和分布还不明确[26]。Claudins mRNA表达增加可能和渗透压的调节有关, 研究表明,一些紧密连接蛋白会形成“紧密”的连接孔, 而另一些更容易形成“渗透性”紧密连接孔[27], 这些所谓的“紧密”或“渗透”连接孔体现了细胞旁路的通透性[28]。由连接蛋白组成的间隙连接通道是细胞间离子的转运通道, 其表达增加意味着离子有更多的机会通过细胞旁间隙。同时, 本研究结果表明低渗暴露导致大底鳉鳃组织内CFTR蛋白mRNA表达降低(图3B), 该结果与前期研究结果一致[29]。本研究显示低盐胁迫导致鳃组织中NKCC-1 mRNA表达减低(图3C), 免疫荧光的结果显示NKCC表达在泌氯细胞中, 其利用电化学梯度来将Na+和Cl–转入到胞质中, 先前的研究结果表明盐度变化影响鲈鱼(Morone saxatilis)[30]和底鳉(Fundulus heteroclitus)[8]鱼鳃组织中NKCC 蛋白mRNA的表达, 但是具体的作用还不明确。
总之, 低盐胁迫导致血浆渗透压的降低, 大底鳉通过调整鳃上皮细胞的形态以及通道蛋白mRNA的表达来进行渗透压的调整, 使其适应环境盐度的变化, 并在低盐环境中生存下来。
5 结论
广盐性的大底鳉通过调整鳃上皮的形态及通道蛋白mRNA的表达来维持机体渗透压的平衡状态,进而适应周围环境盐度的变化。
[1] PATTERSON J T, GREEN C C. Physiological management of dietary deficiency in n-3 fatty acids by spawning Gulf killifish (Fundulus grandis)[J]. Fish Physiology and Biochemistry, 2015, 41(4): 971–979.
[2] MARSHALL W S. Rapid regulation of NaCl secretion by estuarine teleost fish: coping strategies for short-duration freshwater exposures[J]. Biochimica et Biophysica Acta, 2003, 1618(2): 95–105.
[3] BURNETT K G, BAIN L J, BALDWIN W S, et al.Fundulusas the premier teleost model in environmental biology: Opportunities for new insights using genomics[J]. Comparative Biochemistry and Physiology Part D: Genomics Proteomics, 2007, 2(4): 257–286.
[4] EVANS D H, PIERMARINI P M, CHOE K P. The multifunctional fish gill: dominant site of gas exchange, osmoregulation, acid-base regulation, and excretion of nitrogenous waste[J]. Physiology Reviews, 2005, 85(1): 97–177.
[5] WHITEHEAD A. The evolutionary radiation of diverse osmotolerant physiologies in Killifish (Fundulussp.)[J]. Evolution, 2010, 64(7): 2070–2085.
[6] WHITEHEAD A, GALVEZ F, ZHANG Shujun, et al. Functional genomics of physiological plasticity and local adaptation in killifish[J]. Journal of Heredity, 2011, 102(5): 499–511.
[7] KOLOSOV D, BUI P, CHASIOTIS H, et al. Claudins in teleost fishes[J]. Tissue Barriers, 2013, 1(3): e25391.
[8] WHITEHEAD A, ROACH J L, ZHANG Shujun, et al. Salinity- and population dependent genome regulatory response during osmotic acclimation in the killifish (Fundulus heteroclitus) gill[J]. Journal of Experimental Biology, 2012, 215(8): 1293–1305.
[9] BROWN C, GOTHREAUX C, GREEN C. Effects of temperature and salinity during incubation on hatching and yolk utilization of Gulf killifishFundulus grandisembryos[J]. Aquaculture, 2011, 315(3): 335–339.
[10] MUNNS R, WALLACE P A, TEAKLE N L, et al. Measuring soluble ion concentrations Na+, K+, Cl–in salt-treated plants[J]. Methods in Molecular Biology, 2010, 639(23): 371–382.
[11] FLEIGE S, WALF V, HUCH S, et al. Comparison of relative mRNA quantification models and the impact of RNA integrity in quantitative real-time RT-PCR[J]. Biotechnology Letters, 2006, 28(19): 1601–1613.
[12] KATOH F, HASEGAWA S, KITA J, et al. Distinct seawater and freshwater types of chloride cells in killifish,Fundulus heteroclitus[J]. Canadian Journal of Zoology, 2001, 79(5): 822–829.
[13] ALTINOK I, CHAPMAN F A, GALLI S M. Ionic andosmotic regulation capabilities of juvenile Gulf of Mexico sturgeon,Acipenser oxyrinchus de sotoi[J] . Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 1998, 120(4): 609–616.
[14] GAVIN J P, GREG I J. The effect of salinity on growth and survival of juvenile black bream (Acanthopagrus butcheri)[J]. Aquaculture, 2002, 210(1): 219–230.
[15] KOZAK G M, BRENNAN R S, BERDAN E L, et al. Functional and population genomic divergence within and between two species of killifish adapted to different osmotic niches[J]. Evolution, 2014, 68(1): 63–80.
[16] PATTERSON J, BODINIER C, GREEN C. Effects of low salinity media on growth, condition, and gill ion transporter expression in juvenile Gulf killifish,Fundulus grandis[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2012, 161(4): 415–421.
[17] KATOH F, KANEKO T. Short-term transformation and long-term replacement of branchial chloride cells in killifish transferred from seawater to freshwater, revealed by morphofunctional observations and a newly established 'time-differential double fluorescent staining' technique[J]. Journal of Experimental Biology, 2003, 206(22): 4113–4123.
[18] WILSON J M, LAURENT P. Fish gill morphology: inside out[J]. Journal of Experimental Zoology, 2002, 293(3): 192–213.
[19] LAURENT P, CHEVALIER C, WOOD C M. Appearance of cuboidal cells in relation to salinity in gills ofFundulus heteroclitus, a species exhibiting branchial Na+but not Cluptake in freshwater[J]. Cell and Tissue Research, 2006, 325(3): 481–492.
[20] SOLLID J, DE ANGELIS P, GUNDERSEN K, et al. Hypoxia induces adaptive and reversible gross morphological changes in crucian carp gills[J]. Journal of Experimental Biology, 2003, 206(20): 3667–3673.
[21] SOLLID J, NILSSON G E. Plasticity of respiratory structures - adaptive remodeling of fish gills induced by ambient oxygen and temperature[J]. Respiratory Physiology & Neurobiology, 2006, 154(1/2): 241–251.
[22] TIPSMARK C K, SØRENSEN K J, MADSEN S S. Aquaporin expression dynamics in osmoregulatory tissues of Atlantic salmon during smoltification and seawater acclimation[J]. Journal of Experimental Biology, 2010, 213(3): 368–379.
[23] CUTLER C P, CRAMB G. Branchial expression of an aquaporin 3 (AQP-3) homologue is downregualted in the European eel (Anguilla anguilla) following seawater acclimation[J]. Journal of Experimental Biology, 2002, 205(17): 2643–2651.
[24] VAN ITALIE C M, ANDERSON J M. Claudins and epithelial paracellular transport[J]. Annual Review of Physiology, 2006, 68(1): 403–429.
[25] CARLISLE T C, RIBERA A B. Connexin 35b expression in the spinal cord of Danio rerio embryos and larvae[J]. Journal of Comparative Neurology, 2014, 522(4): 861–875.
[26] CLELLAND E S, BUI P, BAGHERIE-LACHIDAN M, et al. Spatial and salinity-induced alterations in claudin-3 isoform mRNA along the gastrointestinal tract of the pufferfish Tetraodon nigroviridis[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2010, 155(2): 154–163.
[27] SAS D, HU M, MOE OW, et al. Effect of claudins 6 and 9 on paracellular permeability in MDCK II cells[J]. American Journal of Physiology: Regulatory, Integrative and Comparative Physiology, 2008, 295(5): 1713–R1719.
[28] COYNE C B, GAMBLING T M, BOUCHER R C, et al. Role of claudin interactions in airway tight junctional permeability[J]. American Journal of Physiology: Lung Cellular and Molecular Physiology, 2003, 285(5): 1166–1178.
[29] SCOTT G R, CLAIBORNE J B, EDWARDS SL, et al. Gene expression after freshwater transfer in gills and opercular epithelia of killifish: insight into divergent mechanisms of ion transport[J]. Journal of Experimental Biology, 2005, 208(14): 2719–2729.
[30] TIPSMARK C K, MADSEN S S, BORSKI R J. Effect of salinity on expression of branchial ion transporters in striped bass (Morone saxatilis)[J]. Journal of Experimental Zoology Part A: Comparative Experimental Biology, 2004, 301(12): 979–991.
GUAN Ying1, GALVEZ Fernando2, ZHANG Guoxia1,*, ZHANG Shengqin3
1.Guangdong Provincial Key Laboratory of Tropical Disease Research,School of Public Health,Southern Medical University,Guangzhou510515,China
2.Department of Biology,Louisiana State University,Baton Rouge70802,USA
3.Guangzhou Shuguo Bio-Technique Co.Ltd.,Guangzhou510000,China
The objective of this paper was to describe the effect of hypoosmotic challenge on the plasma osmolality, ultrastructure of branchial epithelia, and mRNA expression of branchial transporters inFundulus grandis. Adult fish were reared in the salinity from 5 (control) to 2, 1, 0.5 and 0.1, and fish were randomly sampled from each salinity at 6 h, 1 d, 3 d, and 7 d. The results showed that plasma osmolality decreased significantly only in fish transferred to the salinity at 0.5 and 0.1, but recovered to the salinity at 5 control values by 1 d and 3 d, respectively. The ultrastructure of branchial epithelia showed that the surface of apical crypt was larger, and the volume of chloride cell swelled within 6 h in the salinity at 0.5. In salinity at 0.1,chloride cells showed a triangle or irregular shape, and they squeezed surrounding pavement cells. The mRNA expression of six branchial transporters was up-regulated, and the levels of two transporters were down-regulated during hypoosmotic challenges. The regulation of the gill morphology and mRNA expressions of branchial transporters may contribute to the freshwateradaption inFundulus grandis
salinity;Fundulus grandis; plasma osmolality; ultrastructure;transporters; mRNA
10.14108/j.cnki.1008-8873.2016.05.007
Q175
A
1008-8873(2016)05-043-07
关颖, GALVEZ Fernando, 张国霞, 等. 低盐胁迫对大底鳉(Fundulus grandis)血浆渗透压、鳃上皮细胞形态和通道蛋白mRNA表达的影响[J]. 生态科学, 2016, 35(5): 43-49.
GUAN Ying, GALVEZ Fernando, ZHANG Guoxia, et al. Effects of hypoosmotic challenges on plasma osmolality, the morphology of gill epithelia and mRNA expression of branchial transporters inFundulus grandis[J]. Ecological Science, 2016, 35(5): 43-49.
2015-06-26;
2015-08-14
广东省医学科研基金(B2014234); 南方医科大学公共卫生与热带医学学院院长基金(GW201431, GW201435)
关颖(1980—), 女, 黑龙江七台河人, 博士, 讲师, 主要从事水生生物适应性研究, E-mail: ynguan@echobelt.org
*通信作者: 张国霞, 女, 博士, 副教授, 主要从事环境和人体微生物组学, E-mail:guoxiazhang@126.com
Effects of hypoosmotic challenges on plasma osmolality, the morphology of gill epithelia and mRNA expression of branchial transporters in Fundulus grandis
——2017年渗透压相关高考真题赏析

