养分浓度和光照强度对泥炭藓有性更新的影响
冯亚敏, 卜兆君,*, 冯璐,2, 张志麒, 赵红艳, 孙强
养分浓度和光照强度对泥炭藓有性更新的影响
冯亚敏1, 卜兆君1,*, 冯璐1,2, 张志麒3, 赵红艳1, 孙强4
1. 东北师范大学泥炭沼泽研究所, 国家环境保护湿地生态与植被恢复重点实验室, 长春 130024
2. 中国科学院沈阳应用生态研究所, 沈阳 110016
3. 神农架大九湖国家湿地公园管理局, 神农架 442400
4. 吉林省环境监测中心站, 长春 130011
作为优势植物, 泥炭藓(Sphagnum)在泥炭沼泽中缺乏有性更新的原因尚不清楚。针对影响孢子萌发的光强和养分条件, 以泥炭藓(S. palustre)为材料, 通过室内孢子萌发实验, 研究不同光强和养分浓度对孢子萌发率、萌发势及萌发指数的影响。4种培养基中, 养分浓度高的营养液培养基中孢子萌发率最高, 达到60%, 其次为养分浓度与营养液相近的琼脂+营养液培养基, 萌发率为48%, 再次为养分水平很低的沼泽水培养基, 萌发率约为30%, 几乎无养分的蒸馏水培养基中萌发率最低, 约为5%。萌发势和萌发指数亦呈现相同的规律。琼脂+营养液和营养液培养基较沼泽水和蒸馏水培养基孢子萌发时间提前约3天时间。增加光强使孢子萌发率仅提高10%。研究表明, 低养分浓度和弱光照均不利于孢子萌发, 相对而言, 泥炭沼泽的贫营养特征应是限制泥炭藓有性更新的更重要因素。
泥炭藓; 孢子萌发; 沼泽水; 萌发势
1 前言
苔藓植物作为孢子植物, 代表着一类从水生向陆生过渡的高等植物类群, 在其发育过程中不可或缺的孢子萌发过程是其区别于其他植物的重要特征[1–2], 孢子萌发对于苔藓植物的遗传多样性的维持以及种群的繁荣均具有重要意义[3–4]。
目前, 苔藓植物孢子萌发研究主要集中于室内,用于萌发实验的培养基种类很丰富, 包括Knop、MS、Bristol、Beneck、Knudson、B5、N6等等。学者们曾尝试比较不同培养基的优劣, 例如, Bold[5]早在1948年培养沼泽皱蒴藓 (Aulacomnium palustre)时, 认为Knop培养基优于Bristol。李秋萍等[6]运用Knop培养基和无菌水培养金发藓(Polytrichum commune)和细叶小羽藓(Haplocladium microphyllum)时, 认为在温度、光照和湿度适宜的条件下, 其萌发率差异不大。也有学者尝试对已有的培养基进行改进, 因此出现了1/2MS、改进Knop等培养基。泥炭藓(Sphagnum)孢子培养中, 使用的培养基类型也有多种, 早期,培养液更受青睐。如Bold[5], Noguchi[7]以及Anderson和Crosby[8]运用配置的标准营养液成功的培养了不同种泥炭藓孢子的原丝体。进入上世纪80年代, Simon[9]和Rudolph[10]开始使用琼脂加营养液制成的固体培养基培养泥炭藓孢子。此后, Rudolph固体培养基较多应用于泥炭藓孢子无菌培养中, 如Sundberg和Rydin[4]在Rudolph营养液中去除了几种微量元素制成固体培养基培养泥炭藓孢子, 检测孢子活力, 证明了泥炭藓孢子库的存在。李敏, 赵建成等[11–13]用含有Knop营养液的琼脂培养基对多种真藓科植物孢子萌发和原丝体发育特征进行了大量的研究。冯璐等[14–15]运用Rudolph固体培养基进行长白山哈泥泥炭地泥炭藓孢子寿命的研究。然而, 泥炭地苔藓植物孢子萌发中, 固态和液态培养基的优劣一直缺乏比较研究。
自然环境中, 自孢蒴开裂释放到达地表后, 苔藓植物的孢子需要适宜的条件(如pH值、温度、水分等)才能萌发。迄今为止, 近自然环境条件下, 孢子萌发方面的研究还很少。有限研究表明, 不适的环境条件是苔藓植物孢子野外很少萌发的原因[3,16]。例如, During[17]发现养分缺乏是葫芦藓(Funaria hygrometrica)很难在石灰质草地萌发的一个主要原因。泥炭沼泽中, 因大量的养分束缚于死亡的植物残体中, 这里速效养分含量通常很低。以哈泥泥炭沼泽为例, 其沼泽水中磷浓度仅为2 μg/L[18]。在该类贫营养型生态系统中, 泥炭藓属植物常为优势成分, 许多种泥炭藓保持旺盛的孢子生产习性, 导致每年到达沼泽表面的泥炭藓孢子数可以达到每平方米4000余万之多[19], 但目前尚无学者在野外直接观察到孢子萌发的实验证据, Boatman和Lark[20]认为养分贫乏特别是磷缺乏是泥炭藓孢子不能萌发的主要原因。苔藓植物孢子萌发同时还需要光照。Glime[16]认为, 在光的参与下, 孢子中的叶绿体基粒能够进行光合作用, 生产葡萄糖和蔗糖, 为孢子膨大、萌发提供能量。在泥炭沼泽中, 泥炭藓配子体往往密集生长, 导致光照往往仅能到达苔藓配子体表面以下几厘米的范围[21], 光照不足是否是导致泥炭藓孢子在自然生境难以萌发尚缺乏实验验证。
全球尺度来看,泥炭沼泽主要集中分布于北半球的中高纬度地区。在我国,泥炭沼泽在亚热带山地亦有零散分布, 具有很高的保护价值。泥炭藓(Sphagnum palustre)是这些泥炭沼泽的优势植物, 也是罕有的自寒带至亚热带跨多气候带分布的泥炭藓属植物,从事其孢子生态学研究对于该物种及其生境的保护具有重要意义。本研究针对影响孢子萌发的养分和光照强度因素, 采用养分浓度不同的蒸馏水、沼泽水和Rudolph营养液(以下简称营养液)培养基, 分别在强光和弱光2种条件下, 培养泥炭藓孢子, 探讨养分和光照强度对泥炭藓孢子萌发有何影响, 尝试回答养分贫乏以及光照不足是否导致泥炭藓孢子在自然生境不能萌发的原因, 同时, 使用琼脂+Rudolph营养液(以下简称琼脂+营养液)培养泥炭藓孢子, 对比其与营养液培养基在孢子萌发方面的差异。
2 材料与研究方法
2.1供试材料
本研究以2014年7月底采自湖北省七姊妹山国家级自然保护区成熟的泥炭藓(Sphagnum palustre)孢蒴为试验材料。泥炭藓为世界广布种, 经常密集分布于泥炭沼泽相对开阔的生境中。在东亚地区,该物种为少有的自寒温带至亚热带地区广泛分布的泥炭藓属植物, 在日本、中国东北、华中、华南和西南等地区的泥炭沼泽中常为优势植物。
2.2试验设计
将泥炭藓孢蒴用75%的酒精消毒, 清洗后, 用玻璃棒捣碎, 加蒸馏水制备孢子悬液, 分别接种到蒸馏水、沼泽水、Rudolph营养液和琼脂+Rudolph营养液4种培养基。其中, 沼泽水采自长白山哈泥泥炭沼泽。4种培养基中养分浓度经化学仪器测定,具体为, 运用SmartChem140化学分析仪测定总N、总P, 运用Spectr AA220FS火焰原子吸收分光光度计测定K、Ca、Na和Mg(表1)。将孢子悬液接种于培养基中后, 在HPG-400HX型智能人工气候箱进行培养。具体光照周期、光强周期、温度周期分别设置为16/8 h、75 μmol·m–2·s–2(强光)/0和38 μmol·m–2·s–2(弱光)/0和27 ℃/22 ℃。空气湿度恒定为60%。其中, 75 μmol·m–2·s–2为室内孢子萌发实验中一般采用的光照强度[10,15], 这里称为强光条件; 38 μmol·m–2·s–2为接近自然生境苔藓植物配子体表面以下2—3 cm处的光照强度[22], 这里称为弱光。实验为析因试验设计,设置2因素(培养基类型和光照强度), 分别为4和2个水平, 计8种处理, 5次重复, 共计40个试验样品。
2.3孢子萌发特性的测定
泥炭藓孢子培养20—30天后萌发率无明显变化[14], 因此本实验分别在培养3、6、9、12、15、18、21天, 记录孢子的萌发情况。具体在显微镜下, 经放大200倍后, 随机观察200个孢子, 计数其中萌发与未萌发的孢子数量, 进而计算孢子的萌发率、萌发指数和萌发势, 计算公式如下:
萌发率=(萌发的孢子数目/孢子总数) × 100%萌发指数=Σ(Gi/Ti) (Gi指第i天孢子的萌发率, Ti指孢子培养的时间)
萌发势=(孢子萌发率达到最大时3天内新增萌发的孢子数/孢子总数) × 100%
2.4数据统计分析
采用 SPSS19.0 软件进行单因素方差分析(Oneway ANOVA)统计培养基类型和光照强度对孢子萌发率(21天)、萌发指数和萌发势的影响。经 Tukey检验进行多重比较, 分析不同处理孢子萌发率间差异的显著性, 显著性水平设定为α= 0. 05。
3 结果
3.1培养基类型对孢子萌发的影响
培养基类型对泥炭藓孢子的萌发率、萌发指数以及萌发势都有显著作用(均P<0.001)(表2)。根据每隔3天观察的结果, 可以看出, 营养液培养基中孢子最先萌发, 蒸馏水培养基中孢子萌发最晚, 9-15天时孢子萌发率变化最快。经过21天培养后, 蒸馏水培养基萌发率最低, 仅为4.7%, 沼泽水培养基萌发率次之, 为29.4%, 营养液和琼脂+营养液培养基萌发率也有显著差异, 分别为48.6%和56.5%(图1)。4种培养基中, 孢子的萌发指数和萌发势也呈现显著差异, 均表现为蒸馏水培养基均最低, 沼泽水培养基次之, 营养液培养基最高。但营养液和琼脂+营养液培养基萌发势无显著差异(图2)。
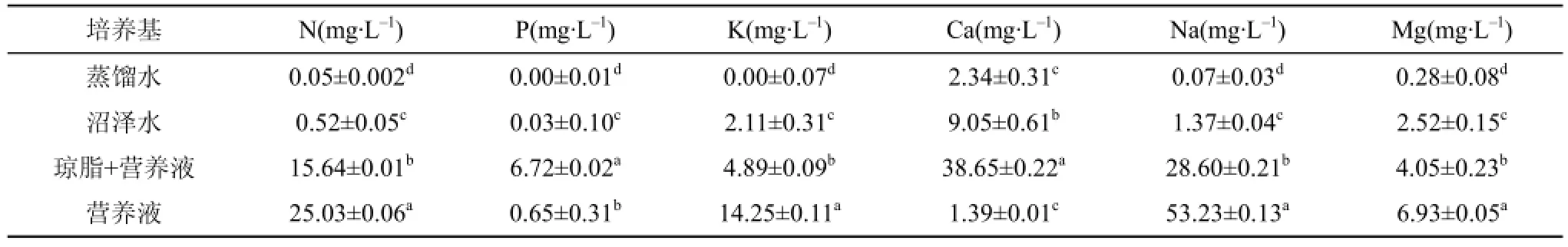
表1 4种培养基中主要元素含量(平均值±标准误)Tab. 1 Main element concentration in 4 culture media (Mean±SE)

表2 培养基类型与光强对泥炭藓孢子萌发率、萌发指数和萌发势影响的双因素方差分析Tab. 2 Two-way analysis of variance (ANOVA) for the effect of culture medium type and light intensity on the germination rate, germination index and germination potential of Sphagnum palusre spores
3.2光照对孢子萌发的影响
光照强弱对泥炭藓孢子萌发率、萌发指数都有极高的显著作用(P<0.001)(表2)。强光对泥炭藓孢子的萌发具有促进作用, 强光下, 孢子萌发更快, 萌发率更高(图3), 萌发指数也更高(图4)。
3.3不同培养基类型及光照强度对原丝体发育的影响

图1 不同培养基条件下孢子萌发率的动态(平均值±标准误)Fig. 1 Dynamics of spore germination rate under different conditions of culture media (Mean±SE)
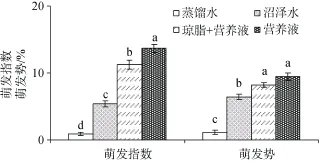
图2 不同培养基对孢子萌发指数、萌发势的影响(平均值±标准误)Fig. 2 Effect of culture media on spore germination vigor and germination index (Mean±SE)
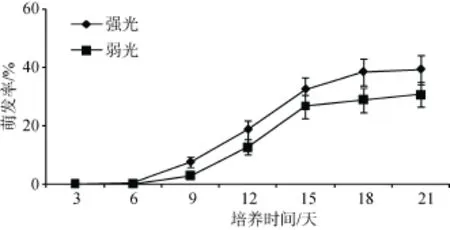
图3 不同光强条件下孢子萌发率的动态(平均值±标准误)Fig. 3 Dynamics of spore germination rate under different conditions of light intensities (Mean±SE)

图4 不同光强对孢子萌发指数、萌发势的影响(平均值±标准误)Fig. 4 Germination vigor and germination index under different conditions of light intensities (Mean±SE)
如图5所示, 培养基类型和光照强度均影响泥炭藓的原丝体发育。培养9天后, 营养液培养基中孢子开始萌发。在培养第12天, 各培养基中孢子均开始发育原丝体, 但蒸馏水培养基和沼泽水培养基的原丝体发育相对缓慢, 原丝体体长度小于100 μm。琼脂+营养液培养基中孢子发育更长的原丝体, 发育成绿丝体结构, 绿丝体伸长到200—400 μm, 营养液培养基中, 叶状原丝体原基细胞已经开始分裂,逐渐开始形成扇形叶状原丝体。至21日, 蒸馏水和沼泽水培养基中原丝体停止发育。琼脂+营养液和营养液培养基中萌发的孢子分别进入扇状原丝体和耳状原丝体阶段。
4 讨论
植物在生长和新陈代谢中必须吸收一定量的养分才能维持自身的生命活动[23], 孢子的萌发以及原丝体的发育同样需要一定量的养分。孢子萌发的所需养分来源可能有两个途径: 自身和外界, 而外界输入的矿物质对孢子的萌发有重大的意义[24]。然而,有研究表明苔藓植物孢子萌发过程中对养分的需求并不高。大多数的苔藓植物孢子在成熟后具备叶绿素, 这些叶绿素通过光合作用提供萌发所需的部分能量[25]。萌发和萌发管的形成都需要能量, 它们可能来自孢子内部的储存, 也可能来自孢子自身的光合作用[16]。Duckett 等[26]认为培养基的养分浓度即使降低1—2个数量级对孢子萌发仍无实质性的影响; Mogensen[27]对60多种苔藓植物的孢子的萌发实验发现, 仅仅使用蒸馏水即可保证孢子萌发, 且没有使孢子萌发出现延迟。
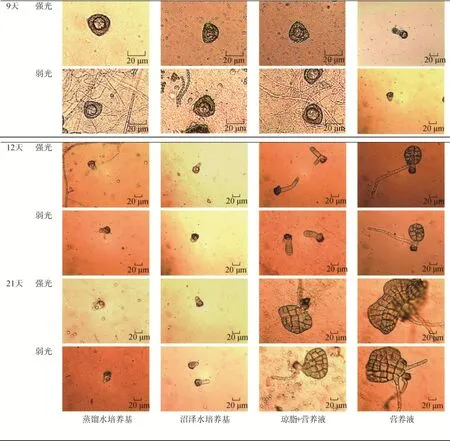
图5 不同培养基和光强条件下泥炭藓孢子原丝体发育情况Fig. 5 Development process of S. palustre spore under different conditions of culture media and light intensities
本实验中, 沼泽水中N、P、Na等元素含量都低于营养液, 尤其是N和P元素(表1), 但用蒸馏水培养基培养的孢子仍有少数萌发, 表明部分孢子能够依靠自身的养分储备, 完成孢子萌发过程, 但萌发率、萌发势、萌发指数都较低, 特别是当孢子进入原丝体发育阶段, 发育十分迟缓。用沼泽水培养的孢子, 其萌发率较蒸馏水高很多, 能够达到30%左右, 表明外源养分对孢子萌发的重要性, 但由于养分依然不足, 原丝体发育亦较缓慢, 表明沼泽水的养分条件虽然能够保证泥炭藓孢子萌发的需要, 但对于原丝体发育甚至幼苗的生长还是不够的。而且,孢蒴的成熟时间多为每年的8月份, 孢蒴开裂, 释放出孢子, 然而孢子萌发所需时间至少为3周(室内适宜条件下萌发所需时间), 气温已经开始降低,不适宜原丝体进一步发育成植株。这可能就是自然的泥炭沼泽中, 泥炭藓孢子缺乏定居直接证据的原因。
在植物生长过程中, 元素浓度过高或过低都可能会影响植物的生长发育。研究中, 琼脂+营养液和营养液两种培养基中, 孢子原丝体发育动态较为相似, 均优于蒸馏水和沼泽水培养基, 表明两种培养基中的养分水平均能够满足泥炭藓孢子的萌发。然而, 琼脂+营养液培养基中的N、K、Na和Mg浓度均远低于营养液, 但P和Ca浓度却相反。该培养基中的孢子萌发率、萌发势和萌发指数均低于营养液培养基, 表明养分的差异影响孢子的萌发。前人的研究, 可能有助于解释两种培养基的孢子萌发率差异。Gemmrich[28]发现Ca能够使地钱(Marchantia polymorpha)的萌发结构发生改变。泥炭藓属于嫌钙性植物, 对Ca的忍耐性低, Ca浓度过高, 会抑制配子体生长[29]和原丝体发育[30]。因此, 琼脂+营养液培养基中孢子萌发率低的原因应是Ca浓度过高导致的抑制作用有关, 尽管P能够促进孢子的萌发[20],但相较Ca的抑制作用而言, 其贡献可能很小。
根据目前的研究, 苔藓植物孢子的萌发都需要水分, 特别是在萌发初期, 孢子需要吸水膨胀, 进行再水合作用[28]。大多数孢子在膨胀阶段需要水分,而在延伸阶段需要光照[31–32]。光照不仅为孢子的萌发提供能量还具有为植物生长提供信号的功能[33]。弱光照强度下, 泥炭藓孢子进入膨大状态的时间较滞后, 且原丝体相对发育较慢, 弱光不利于孢子的萌发。实验所采用的弱光条件, 接近野外泥炭藓孢子散布后主要分布的环境, 因此, 自然生境条件对于泥炭藓孢子的迅速萌发不利。然而, 弱光条件下,泥炭藓孢子仍有较高萌发率, 相比养分条件甚至水分而言, 自然生境中的光照强度并非泥炭藓孢子萌发更重要的限制因子。
[1] 吴鹏程. 苔藓植物生物学[M]. 北京: 科学出版社, 1998: 10–46.
[2] 范庆书, 赵建成, 于树宏. 苔藓植物孢子萌发与原丝体发育研究进展[J]. 植物学通报, 2003, 20(3): 280–286.
[3] CRONBERG N. Reproductive biology ofSphagnum[J]. Lindbergia, 1993, 17(4): 69–82.
[4] SUNDBERG S, RYDIN H. Habitat requirements for establishment ofSphagnumfrom spores[J]. Journal of Ecology, 2002, 90(2): 268–278.
[5] BOLD H C. The prothallium ofSphagnum palustreL.[J]. The Bryologist, 1948, 51(2): 55–63.
[6] 李秋萍, 吴思苹, 鲁蓓蓓, 等. 藓类植物孢子生活力的快速检测方法初探[J]. 西北植物学报, 2013, 33(10): 2126–2130.
[7] NOGUCHI A. Germination of spores in two species ofSphagnum[J]. Journal of Hattori Botanical Laboratory, 1958, 19 (1): 71–75.
[8] ANDERSON L E, CROSBY M R. The protonema ofSphagnum meridense(Hampe) C. Muell[J]. The Bryologist, 1965, 68(1): 47–54.
[9] SIMON E. Axenic cultures ofSphagnumon solid substrates[M] //Glime J M. Methods in Bryology. Nichinan: Hattori Botanical Laboratory, 1988: 35–40.
[10] RUDOLPH H, KIRCHHOFF M, GLIESMANN S.Sphagnumculture techniques[M] //Glime J M. Methods in Bryology. Nichinan: Hattori Botanical Laboratory, 1988: 25–34.
[11] 李敏, 李茜, 胡晶晶, 等. 七种真藓科植物孢子萌发与原丝体发育研究[J]. 贵州师范大学学报, 2010, 28(4): 17–20.
[12] 李敏, 赵建成, 黄士良, 等. 垂蒴真藓原丝体发育特征的研究[J]. 西北植物学报, 2005, 25(2): 363–367.
[13] 李敏, 赵建成, 黄士良, 等. 中华缩叶藓孢子萌发与原丝体发育特征研究[J]. 西北植物学报, 2006, 26(8): 1521–1525.
[14] 冯璐, 汤袁, 卜兆君, 等. 长白山哈泥泥炭地持久孢子库的实验证据[J]. 植物研究, 2013, 33(2): 248–251.
[15] 冯璐, 卜兆君, 李振新, 等. 长白山哈泥泥炭地丘间生境泥炭藓孢子的寿命[J]. 生态学报, 2015, 35(9): 2993–2997.
[16] GLIME J M. Ecophysiology of development: Spore germination[J]. Bryophyte Ecology, 2015, 1(5): 10–40.
[17] DURING H J. Longevity of spores ofFunaria hygrometricain chalk grassland soil[J]. Lindbergia, 1987, 12(2/3): 132–134.
[18] Bu ZhaoJun, Chen Xu, Rydin H, et al. Performance of four mosses in a reciprocal transplant experiment: implications for peatland succession in NE China[J]. Journal of Bryology, 2013, 35(3): 220–227.
[19] SUNDBERG S. Spore rain in relation to regional sources and beyond[J]. Ecography, 2013, 36(36): 364–373.
[20] BOATMAN D J, LARK P M. Inorganic nutrition of the protonemata ofSphagnum papillosum Lindb.,S. magellanicum Brid.andS. cuspidatum Ehrh[J]. New Phytologist, 1971,70(6): 1053–1059.
[21] HAYWARD P M, CLYMO R S. The growth ofSphagnum: experiments on, and simulation of, some effects of light flux and water-table depth[J]. Journal of Ecology, 1983, 71(3): 845–863.
[22] SKRE O, OECHEL W C, MILLER P M. Moss leaf water content and solar radiation at the moss surface in a mature black spruce forest in central Alaska[J]. Canadian Journal of Forest Research, 1983, 13(5): 860–868.
[23] VEPRASKAS M J, FAULKNER S P. Redox chemistry of hydric soils[M] // J L Richardson, M J Vepraskas. Wetland Soils: Genesis, Hydrology, Landscapes, and Classification. Boca Raton: Lewis Publishers, 2001: 85–106.
[24] WIKLUND K. Phosphorus concentration and pH in decaying wood affect establishment of the red-listed mossBuxbaumia viridis[J]. Canadian Journal of Botany, 2003, 81(6): 541–549.
[25] KRUPA J. Studies on the physiology of germination of spores ofFunaria hygrometrica(Sibth.). II. Dependence of germination on the intensity of white light and the role of photosynthesis in this process[J]. Acta Societatis Botanicorum Poloniae, 2015, 34(4): 687–695.
[26] DUCKETT J G, BURCH J, FLETCHER P W, et al. Pressel S in vitro cultivation of bryophytes: a review of practicalities, problems, progress and promise[J]. Journal of Bryology, 2004, 26(1): 3–20.
[27] MOGENSEN G S. The biological significance of morphological characters in bryophytes: The spore[J]. Bryologist, 1981, 84(2): 187–207.
[28] GEMMRICH A R. Keimungsinduktion durch salzionen, licht und gibberellinsaure bei sporen vonMarchantia polymorphaL.[J]. Flora, 1976, 165(2): 479–480.
[29] CLYMO R S. The growth ofSphagnum: some effects of environment[J]. Journal of Ecology, 1974, 61(3): 849–869.
[30] VICHEROVA E, HAJEK M, HAJEK T. Calcium intolerance of fen mosses: Physiological evidence, effects of nutrient availability and successional drivers[J]. Perspectives in Plant Ecology Evolution & Systematics, 2015, 17(5): 347–359.
[31] BHATLA S C. Moss protonema differentiation[M]. Research Studies Press, Wiley, 1994: 98.
[32] VALANNE N. The germination phases of moss spores and their control by light[J]. Annales Botanici Fennici, 1966, 3(1): 1–60.
[33] MACIEL A S, DA S, PORTO K C, et al. Effect of light and water availability on spore germination and protonemal growth of the Neotropical moss Thamniopsis incurva (Pilotrichaceae)[J]. Cryptogamie Bryologie, 2009, 30(2): 243–257.
Effects of nutrient concentration and light intensity on the sexual regeneration of Sphagnum palustre
FENG Yamin1, BU Zhaojun1,*, FENG Lu1,2, ZHANG Zhiqi3, ZHAO Hongyan1, SUN Qiang4
1.Key Laboratory for Wetland Conservation and Vegetation Restoration,Ministry of Environmental Protection,Changchun130024,China
2.Shenyang Institute of Applied Ecology Chinese Academy of Sciences,Shenyang110016,China
3.Shennongjia Dajiuhu National Wetland Park Administration,Shennongjia442400,China
4.Environmental Monitoring Central Station of Jilin Province,Changchun130011,China
The mechanism for rare sexual regeneration inSphagnum palustre, the dominant plant in peatlands is not clear. Aiming at the two factors affecting spore germination, we choseS. palustreas study material and conducted an indoor spore germination experiment to explore the effect of light intensity and nutrient concentration on germination rate (GR), germination vigor and germination index. Among the four culture media, nutrient solution with suitable level of nutrients showed the greatest GR, 60%; agar + nutrient solution with highest level of nutrients showed higher GR, 48%; mire water with much less nutrients showed lower GR, 30%; and distilled water with the least nutrients showed the lowest GR, about 5%. Similar pattern was also observed in germination vigor and germination index. The initial germination time in nutrient solution and agar + nutrient solution was approximate 3 days earlier than that in mire water and distilled water. Enhancing light intensity only increased GR by 10% or so. This study indicates that less nutrient and light are detrimental to spore germination; theoligotrophy in peatlands is the main factor to limit sexual regeneration ofSphagnum.
Sphagnum; spore germination; mire water; germination vigor
10.14108/j.cnki.1008-8873.2016.05.005
Q948.1
A
1008-8873(2016)05-031-07
2016-04-07;
2016-05-05
国家自然科学基金(41471043 ); 国家自然科学基金(41371103)
冯亚敏(1991—), 女, 河南商丘人, 硕士研究生, 主要从事湿地生态学研究, E-mail: fengym279@nenu.edu.cn
*通信作者: 卜兆君, 男, 博士, 教授, 主要从事湿地生态学和植物生态学研究, E-mail: buzhaojun@nenu.edu.cn

