磁共振3D-ASL与1H-MRS对脑胶质瘤术前分级的对比研究
董卫敏,齐旭红,康群凤,毕冬梅,于洋,孟凡祺,温智勇
磁共振3D-ASL与1H-MRS对脑胶质瘤术前分级的对比研究
董卫敏,齐旭红,康群凤,毕冬梅,于洋,孟凡祺,温智勇*
目的探讨三维动脉自旋标记(3D-ASL)与氢质子磁共振波谱(1H-MRS)两种技术对脑胶质瘤术前分级的临床价值。材料与方法回顾性分析经病理证实的44例脑胶质瘤患者的ASL和MRS图像。按照WHO 2007标准,将病例分为两组:低级别脑胶质瘤组(Ⅰ~Ⅱ级,13例) 和高级别脑胶质瘤组(Ⅲ~Ⅳ级,31例),测量并计算肿瘤实质区、健侧脑组织区代谢物及CBF值的相对值和比值,作统计学分析。结果在44例脑胶质瘤中,3D-ASL相关参数(TBFmax,rCBF1,rCBF2)及1H-MRS相关参数(rNAA、rCr、Cho/Cr、Cho/NAA)在低、高级别组脑胶质瘤比较中差异均有统计学意义(P<0.05) ,而1H-MRS相关参数(rCho、NAA/Cr)在两组脑胶质瘤比较中差异无统计学意义(P>0.05);经受试者工作特征曲线(ROC)分析发现,3D-ASL相关参数(TBFmax,rCBF1,rCBF2)及1H-MRS相关参数(rNAA、rCr、Cho /Cr、Cho/NAA)鉴别胶质瘤分级的曲线下面积>0.5;3D-ASL+1H-MRS 鉴别胶质瘤分级的曲线下面积(0.955)>单独运用3D-ASL (0.923)或1H-MRS的曲线下面积(0.871),3D-ASL+1H-MRS诊断低、高级别胶质瘤的敏感度和特异度分别达8 7.1%、1 0 0%。结论单独就1H-MRS和3D-ASL两种技术而言,3D-ASL具有更高诊断价值。而联合1H-MRS、3D-ASL两种技术诊断胶质瘤级别,可以进行优势互补,较单独运用3D-ASL或1H-MRS更有助于准确地对高、低级别胶质瘤进行分级。
神经胶质瘤;自旋标记;磁共振波谱学;肿瘤分级
脑胶质瘤(brain glioma,BG)是颅内最常见的原发性肿瘤,约占颅内肿瘤的33.3%~58.6%[1]。参照2007年WHO制定的中枢神经系统肿瘤的分级标准[2],将胶质瘤分为四级:Ⅰ级、Ⅱ级(低级别胶质瘤)、Ⅲ、Ⅳ级(高级别胶质瘤)。临床上,高级别胶质瘤通常采用肿瘤切除术以及额外的放、化疗来治疗,而大多数低级别胶质瘤患者,只需手术治疗。因此,胶质瘤的分级对临床上制定适合的治疗策略及预后的评估至关重要[3-4]。先进的动脉自旋标记(arterial spin labeling,ASL)和磁共振波谱( magnetic resonance spectroscopy,MRS)可以分别无创的研究脑血流灌注情况和脑组织的代谢情况。本研究即探讨两种技术对脑胶质瘤术前分级的临床价值。
1 材料与方法
1.1 患者情况及分组
收集2015年10月1日至2016年6月31日间在北京电力医院诊治并经病理证实的44例脑胶质瘤患者的资料,其中男28例,女16例,年龄范围为16~69岁,中位年龄为47.5岁。将病例分为两组:低级别组(共13例,Ⅱ级13例)和高级别组(共31例,Ⅱ~Ⅲ5例,Ⅲ级8例,Ⅳ级18例)。
1.2 检查方法
使用3.0 T高场强磁共振扫描仪及24通道头颅表面线圈,对脑胶质瘤患者进行MRI检查:先行常规MRI平扫及3D-ASL灌注检查,静脉团注对比剂后进行增强扫描(序列包括T1WI矢状面、横断面及冠状面),最后行1H-MRS检查。3D-ASL为基于FSE的3D Spiral全脑采集,具体参数如下:带宽62.5 KHz,矩阵512×512,NEX3次,Post Lable Delay 1525.0 ms,TR 4683.0 ms,TE 10.7 ms,层厚4.0 mm,无间隔,层数40,扫描时间:4 min 32 s,扫描范围包括颅底至颅顶的全脑范围。MRS为二维1H-MRS检查,采用点分辨波谱(PRESS)技术,具体参数:TR 1000 ms,TE 144 ms,激励次数为1次, 扫描时间5 min 28 s。选取肿瘤实性最大层面定位,定位需涵盖肿瘤实质区、瘤周区及健侧脑组织区。由于骨骼、脂肪、含气结构等会对图像质量造成影响,定位时尽量避开这些位置。
1.3 图像获取及分析
3D-ASL:将原始数据进行后处理,获得脑血流量(cerebral blood flow,CBF)灌注图像。将脑血流量灌注图像与轴位T1增强图像融合,在功能融合图上于肿瘤实性区域灌注最明显层面设置感兴趣区(ROI),ROI放置于实性瘤体最大血流灌注区,体素6~9,获取肿瘤最大脑血流量值(TBFmax)。为校正个体差异导致的平均脑血流灌注差异,本研究同时获取同层面对侧正常白质脑血流量(CBF1)、对侧正常灰质脑血流量(CBF2)的灌注值作为对照,计算肿瘤最大脑血流量/对侧正常白质脑血流量(TBFmax/CBF1)、肿瘤最大脑血流量/对侧正常灰质脑血流(TBFmax/CBF2)的比值,即相对脑血流量rCBF1、rCBF2。每个区域选择三个ROI,求平均值以减少误差。
1H-MRS:将原始数据进行后处理,获得1H-MRS代谢物与解剖图的叠加图、代谢物比率图和分布图。在MRS定位图上,于肿瘤实性部分和健侧脑组织区分别放置1~3个ROI,记录波谱图上每个ROI所对应的N-乙酰天冬氨酸(NAA)、肌酸(Cr)、含胆碱代谢物(Cho)物质的值及Cho/Cr、NAA/Cr、NAA/Cho的比值,并计算肿瘤实质区各代谢物与健侧脑组织区代谢物的比值rCho、rCr、rNAA。最后取平均值以减少误差。
1.4 统计学分析
用IBM SPSS 22.0统计软件包进行分析。建立SPSS数据文件后,对照术后病理结果,先用两独立样本t检验分析高、低级别组3D-ASL各血流量指标与1H-MRS各代谢物指标,以P<0.05认为差异具有统计学意义。然后运用受试者工作特征曲线(ROC)对3D-ASL各血流量指标与1H-MRS各代谢物指标鉴别胶质瘤分级的可行性进行分析。最后运用逻辑回归分析法和ROC曲线得出3D-ASL、1H-MRS及3D-ASL+1H-MRS 3种方法在鉴别高、低级别胶质瘤中的临界值、敏感度、特异度,并绘制ROC曲线。
2 结果
2.1 高、低级别组脑胶质瘤脑血流量(CBF)灌注指标结果分析(图1,2)
本组31例高级别胶质瘤患者中:28例患者肿瘤内部灌注不均匀,肿瘤实质部分呈高或明显高血流灌注(图1A);3例呈低灌注。本组13例低级别胶质瘤患者中:11例患者肿瘤实质部分呈等或较低血流灌注(图2A);2例呈高灌注。高、低级别组肿瘤实质区最大脑血流量(TBFmax)平均值分别为:104.10±51.83、39.23±21.71,差异有统计学意义(t=-4.33,P=0.00)。高、低级别组肿瘤最大脑血流量/对侧正常灰质脑血流量(TBFmax/CBF1)平均值分别为5.40±2.90、1.89±1.19,差异有统计学意义(t=-5.85,P=0.00)。高、低级别组肿瘤最大脑血流量/对侧正常灰质脑血流量(TBFmax/ CBF2)平均值分别为2.13±1.14、0.79±0.40,差异有统计学意义(t=-4.11,P=0.00)。
2.2 高、低级别组脑胶质瘤1H-MRS代谢物结果分析
本组研究44例脑胶质瘤患者肿瘤实质部分Cho及Cho/Cr、Cho/NAA比值较对侧正常脑组织均不同程度升高,NAA、NAA/Cr、Cr值不同程度降低(图1B,C;图2B,C)。高、低级别组脑胶质瘤肿瘤实质区间比较:rNAA、rCr、Cho/Cr、Cho/NAA (P<0.05),差异有统计学意义,rCho、NAA/Cr (P>0.05),差异无明显统计学差异(表1)。本组资料中,低级别组13例患者中,1例出现Lac峰,未见lip峰;高级别组31例患者中,6例见Lac峰,14例见lip峰,5例同时具有Lac及lip峰。
2.3 3D-ASL与1H-MRS两种技术的比较
2.3.1 3D-ASL的ROC曲线分析结果
经ROC曲线分析发现TBFmax、rCBF1、rCBF2诊断高、低级别胶质瘤的AUC分别为0.916、0.906、0.919。TBFmax鉴别高、低级别组胶质瘤的临界值为54.44 (敏感度93.5%,特异度92.3%);rCBF1鉴别高、低级别组胶质瘤的临界值为2.40 (敏感度90.3%,特异度84.6%);rCBF2鉴别高、低级别组胶质瘤的临界值为1.15 (敏感度90.3%,特异度84.6%)。
2.3.21H-MRS的 ROC曲线分析结果
ROC曲线分析结果显示:肿瘤实质区rNAA、rCr、Cho/Cr、Cho/NAA在胶质瘤分级中的AUC分别为0.814、0.782、0.818、0.732,具有较高诊断分级价值;rCho、NAA/Cr在胶质瘤分级中的AUC<0.5,无诊断分级价值。rNAA诊断高、低级别组胶质瘤的临界值为0.26(敏感度54.8%,特异度100.0%);rCr鉴别高、低级别组胶质瘤的临界值为0.71(敏感度58.1%,特异度92.3%);Cho/Cr鉴别高、低级别组胶质瘤的临界值为3.69 (敏感度64.5%,特异度92.3%);Cho/NAA鉴别高、低级别组胶质瘤的临界值为5.23(敏感度51.6%,特异度92.3%)。
2.3.3 3D-ASL、1H-MRS及3D-ASL+1H-MRS 3种方法比较
经ROC曲线分析发现,含3个参数的3D-ASL (TBFmax、rCBF1、rCBF2) 鉴别胶质瘤高、低级别的AUC为0.923,当临界值为0.676时,其敏感度为90.3%,特异度为92.3%。含4个参数的1H-MRS (rNAA、rCr、Cho/Cr、Cho/NAA) 鉴别胶质瘤高、低级别的AUC为0.871,当临界值为0.81时,其敏感度为64.5%,特异度为92.3%。而含7个参数的3D-ASL+1H-MRS (TBFmax、rCBF1、rCBF2、rNAA、rCr、Cho/Cr、Cho/NAA) 的AUC为0.955,当临界值为0.73时,敏感度达87.1%,特异度达100%。
3 讨论
脑胶质瘤患者的治疗策略和预后与胶质瘤的病理级别关系密切。临床上对脑胶质瘤诊断分级最常用的影像学检查方法是MR增强扫描,但根据有无强化来判断脑胶质瘤的级别存在一定的局限性[5],且增强扫描需要注射对比剂,对于过敏体质或肾功能不全患者是禁忌证。ASL和MRS技术可以分别无创地研究脑血流灌注情况和脑组织的代谢情况,为胶质瘤的分级提供常规MR检查不能提供的信息。
ASL是一种无创的的灌注技术,可用于评估脑胶质瘤血供情况,进而帮助术前分级,多项研究证实其可取代DSC法对颅脑肿瘤进行内部微循环分析[6-8]。3D-ASL技术是一种全新的容积灌注成像方法,实现了全脑灌注成像,较传统的2D-ASL具有采集效率高,信噪比高,能够克服磁敏感伪影,灌注图像更均匀等优点,能更准确地反映脑胶质瘤血管生成状态。本组资料结果显示:高级别与低级别组脑胶质瘤患者3D-ASL灌注结果存在显著差异,高级别组的TBFmax、rCBF1、rCBF2均显著高于低级别胶质瘤组TBFmax、rCBF1、rCBF2,具有较高的分级诊断效能,同时具有较高的鉴别诊断敏感度和特异度。以上结果说明,3D-ASL不仅能准确评价脑胶质瘤的微循环灌注信息,而且能反映肿瘤的新生血管生成,定量研究高、低级别脑胶质瘤的血流灌注情况,更可靠地对脑胶质瘤的级别进行评价,这与国内外报道相一致[9-10]。本研究中有2例低级别脑胶质瘤病例肿瘤实质部分均呈明显高血流灌注,有研究认为肿瘤血流量的高估可能是肿瘤内存在血管分流的情况所致[7],也有文献表示,少突胶质细胞瘤1p19q杂合性联合缺失会导致低级别的少突胶质细胞瘤呈现高灌注的情况[11-12]。另有3例高级别患者肿瘤实质部分呈低血流灌注,有研究认为可能是肿瘤新生血管迂曲使信号到达延迟导致ASL对其CBF值低估[7,13]。以上情况的具体原因不明,之后会进一步研究。MRS能无创测定肿瘤及正常脑组织的代谢情况,提供传统影像技术无法提供的代谢信息[14],从而提高肿瘤分级准确性,更好地指导临床工作[15]。本研究对MRS相关参数进行两独立样本t检验及ROC曲线分析,结果显示:在高、低级别胶质瘤分级中,rNAA、rCr、Cho/Cr、Cho/NAA具有较高分级价值,而rCho、NAA/Cr无分级价值。此结果与国内外关于MRS的研究不尽相同。Server等[16]的研究结果显示:Cho/NAA、NAA/Cr可用于胶质瘤分级,而Cho/Cr无分级价值;Zeng等[17]及Caivano等[18]的研究结果均认为高、低级别胶质瘤之间的NAA/Cho、NAA/Cr、Cho/Cr均具有显著的统计学差异;国内姜亮等[19]的研究认为,rNAA、NAA/Cr 及NAA/Cho对高低级别胶质瘤具有分级意义,rCho、rCr、Cho/Cr无分级意义。分析原因:可能是不同研究1H-MRS扫描方法的选择不同,样本量不同、样本的病理类型不同,这些均可能产生结果上的差异。NAA主要存在于神经元内,被公认是神经元的内标志物[20],本研究中,高级别组rNAA明显低于低级别组,差异具有统计学意义,提示肿瘤级别越高,神经元破坏越严重,即NAA峰下降越明显[21]。Cho峰是肿瘤细胞增殖程度的标志物,Cho峰越高提示细胞增殖速度越快[22],而本研究中rCho在高、低级别胶质瘤分级中无统计学意义,查阅文献发现,有研究认为组织坏死严重的高级别胶质瘤,Cho也可以下降[23]。Cr主要反映组织能量代谢情况,本研究中高级别组rCr明显低于低级别组,差异具有统计学意义,此结果与其他学者研究结果不同[16-19],结合本组资料推测原因可能为:本研究样本中出现坏死的高级别胶质瘤样本量偏多,而恶性胶质瘤出现坏死时会导致Cr峰下降。lip峰的出现主要表示组织坏死[24],本研究中,lip峰均出现在高级别中,提示lip峰有助于胶质瘤的分级,这与Fountas等[25]的研究结果一致。Lac峰出现表示细胞不能有效进行有氧呼吸,本研究高级别组31例患者中14例见lip峰,低级别组13例患者中1例出现Lac峰,提示Lac峰的出现并不一定提示肿瘤为高级别,但在高级别胶质瘤中出现较多,这与一些学者研究结果相同[19,26]。

图1男,34 岁;左额叶间变性少枝星形胶质细胞瘤(Ⅲ级)。A:3D-ASL CBF图,肿瘤实质区可见斑片状高灌注,肿瘤中存在灌注不均匀现象;B、C:肿瘤实质区及对侧正常脑组织区定位图及相应谱线:肿瘤实质区,Cho峰显著升高,NAA峰和Cr峰明显降低,Cho/Cr 6.29、Cho/NAA 22.12、NAA/Cr 1.72;D:病理图片图2男,46岁;右额顶少枝星形胶质细胞瘤(Ⅱ级)。A:3D-ASL CBF图,肿瘤实质区呈等、低灌注;B、C:肿瘤实质区及对侧正常脑组织区定位图及相应谱线:肿瘤实质区,Cho峰升高,NAA峰和Cr峰降低,Cho/Cr 2.67、Cho/NAA 5.17、NAA/ Cr 0.54;D:病理图片Fig. 1Thirty-four years old man, a histologically verif i ed grade Ⅲ anaplastic astrocytomas in the left frontal lobe. A: 3D-ASL CBF Fig, Tumor parenchyma showed patchy high perfusion, the perfusion was uneven. B, C: The location map and the corresponding MRS lines of tumor parenchyma and contralateral normal brain tissue area: the Cho peak signif i cantly rose and the NAA, Cr peak declined signif i cantly in the tumor parenchyma, Cho/Cr 6.29, Cho/NAA 22.12, NAA/Cr 1.72. D: Pathological pictures.Fig. 2Forty-six years old man, a histologically verif i ed grade II oligodendroglioma in the right frontal-parietal lobe. A: 3D-ASL CBF Fig, Tumor parenchyma showed equal or low perfusion. B, C: The location map and the corresponding MRS lines of tumor parenchyma and contralateral normal brain tissue area:the Cho peak rose and the NAA, Cr peak declined in the tumor parenchyma, Cho/Cr 2.67, Cho/NAA 5.17, NAA/Cr 0.54 D: Pathological pictures.
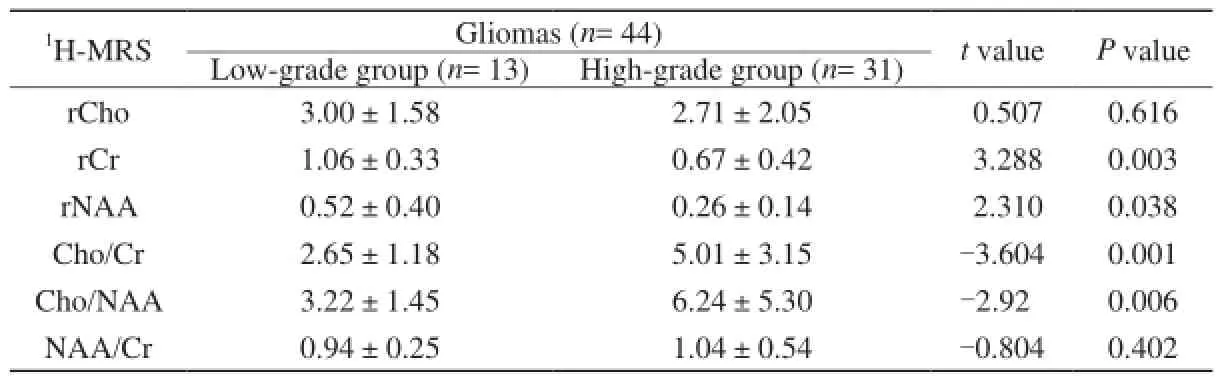
表1高、低级别组脑胶质瘤的肿瘤实质区1H-MRS代谢物比值的分析Tab. 1Comparison of1H-MRS metablites values in tumor parenchyma between the high-grade and low-grade groups of gliomas
目前,关于MRS和ASL对胶质瘤分级的诊断价值,单独研究的较多,而联合3D-ASL和1H-MRS对胶质瘤分级的诊断价值,研究的较少。本研究在单独分析3D-ASL和1H-MRS两种技术的基础上,并将两种技术所有具有分级意义的参数联合进行ROC曲线分析,结果显示:3D-ASL+1H-MRS的诊断效能最大(AUC为0.955),3D-ASL次之(AUC为0.923),而1H-MRS最小(AUC为0.871)。单独运用3D-ASL诊断胶质瘤级别,当临界值为0.676时,其敏感度及特异度均较高(分别为90.3%、92.3%)。单独运用1H-MRS诊断胶质瘤级别,当临界值为0.81时,其敏感度偏低(64.5%),特异度较高(92.3%)。而联合应用3D-ASL+1H-MRS诊断胶质瘤级别,当临界值为0.73时,敏感性达87.1%,特异性达100%。通过以上数据分析可知,3D-ASL较1H-MRS在诊断胶质瘤级别方面具有更高的诊断价值;而联合应用3D-ASL+1H-MRS诊断胶质瘤级别,较单独运用3D-ASL或1H-MRS具有更高的诊断价值,且可获得较高的敏感性和特异性,更有助于准确地对高、低级别胶质瘤进行分级。与3D-ASL技术相比,1H-MRS技术更易受技术本身(磁场稳定性等)、病变特点(部位、成分等)及患者配合情况等多种因素影响,这或许能解释本研究结果中3D-ASL较1H-MRS具有更高诊断价值,且敏感性及特异性均较高。本组资料中,有3例肿瘤环壁实性部分太薄、1例肿瘤强化实质区病变太小、1例肿瘤内出血的高级别胶质瘤病例,均未显示高级别胶质瘤特点的MRS谱线,但这些病例的3D-ASL灌注图像均显示为高灌注。由于MRS反映胶质瘤的代谢信息,对于一些3D-ASL未能准确分级的患者,MRS可通过代谢物的变化反映分级。本组资料中,有1例高级别胶质瘤患者,3D-ASL显示为低灌注,而MRS谱线中出现lip峰,提示肿瘤为高级别。观察本组资料还发现,低级别胶质瘤瘤周的MRS谱线多数正常,高级别胶质瘤瘤周的MRS谱线多数见异常,而3D-ASL瘤周未发现明确高灌注区,提示在反映胶质瘤瘤周组织情况方面,MRS较3D-ASL有优势,这与张玉琴等[13]的研究结果一致。总之,MRS和ASL在胶质瘤分级方面各有优势,联合应用可以明显提高分级准确性。
本研究还有一些不足:如未对胶质瘤瘤周区的灌注信息及生化信息进行研究;样本量不够大等。此后会加大样本量,再进一步深入研究。
综上所述,单独就3D-ASL和1H-MRS两种技术而言,3D-ASL具有更高诊断价值。而联合3D-ASL+1H-MRS两种技术诊断胶质瘤级别,可以进行优势互补,较单独运用3D-ASL或1H-MRS更有助于准确地对高、低级别胶质瘤进行分级。
[References]
[1] Jiang YG, Liu B, Zhou Q, et al. The treatment strategies and progress of intracranial glioma. Chin J Clinicians (Elect Ed), 2013, 7(14): 6245-6247.蒋宇钢, 刘博, 周倩, 等. 颅内胶质瘤的治疗策略及进展. 中华临床医师杂志(电子版), 2013, 7(14): 6245-6247.
[2] Louis DN, Ohgaki H, Wiestler OD, et al. The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol, 2007, 114(2): 97-109.
[3] Ma JL, Ai L. The application progess of magnetic resonance imaging in prognosis of patients with glioblastoma. Chin J Magn Reson Imaging, 2015, 6(5): 394-400.马洁玲, 艾林. MRI在胶质母细胞瘤患者预后的应用进展. 磁共振成象, 2015, 6(5): 394-400.
[4] Chen JL, Yang T. Application and development of magnetic resonance imaging in glioma. Chin J Magn Reson Imaging, 2014, 5(增刊): 62-67.程敬亮, 杨涛. 磁共振成像在脑胶质瘤中的应用及进展. 磁共振成象, 2014, 5(Suppl): 62-67.
[5] Goebell E, Fiehler J, Ding XQ, et al. Disarrangement of f i ber tracts and decline of neuronal density correlate in glioma patients-a combined diffusion tensor imaging and 1H-MR spectroscopy study. AJNR Am J Neuroradiol, 2006, 27(7): 1426-1431.
[6] Xiao HF, Lou X, Chen ZY, et al. A comparatiVe study of 3-dimensional arterial spin labeling and dynamic susceptibility contrastenhanced perfhsion weighted-imaging in neuroepithelial tumors grading. Funct Mol Med Imaging (Elect Ed), 2013, 2(2): 12-14.肖华锋, 娄昕, 陈志晔, 等. 三维动脉自旋标记与对比增强灌注成像在神经上皮肿瘤术前分级中的对照研究. 功能与分子医学影像学杂志(电子版), 2013, 2(2): 12-14.
[7] Jiang JJ, Zhao L, Zhang Yan, et al. Comparative analysis of arterial spin labeling and dynamic susceptibility contrast perfusion imaging for quantitative perfusion measurements of brain tumors. Int J Clin Exp Pathol, 2014, 7(6): 2790-2799.
[8] Warmuth C, Gunther M, Zimmer C. Quantification of blood flow in brain tumors: comparison of arterial spin labeling and dynamic susceptibility-weighted contrast-enhanced MR imaging. Radiology, 2003, 228(2): 523-532.
[9] Jiang JJ, Zhao LY, Yao YH, et al. Application of three-dimensional arterial spin labeling MR perfusion imaging in the pathology grading of astrocytoma before surgery. J Radiol Practice, 2014, 29(8): 896-900.江晶晶, 赵凌云, 姚义好, 等. 三维动脉自旋标记灌注成像在星形细胞瘤术前分级中的应用.放射学实践, 2014, 29(8): 896-900.
[10] Tourdias T, Rodrigo S, Oppenheim C, et al. Pulsed arterial spin labeling applications in brain tumors: practical review. J Neuroradiol, 2008, 35(2): 79-89.
[11] Whitmore RG, Krejza J, Kapoor GS, et al. Prediction of oligodendroglial tumor subtype and grade using perfusion weighted magnetic resonance imaging. J Neurosurg, 2007, 107(3): 600-609.
[12] Cha S, Tihan T, Crawford F, et al. Differentiation of low-grade oligodendroglio-mas from low-grade astrocytomas by using quantitative blood-volume measurements derived from dynamic susceptibility contrast-enhanced MR imaging. AJNR Am J Neuroradiol, 2005, 26(2): 266-273.
[13] Zhang YQ, Xu HD, Dong HB, et al. Preperative grading of gliomas using combined MR perfusion spectroscopy and diffusion tensor imaging. J Diagn Imaging Inter Radiol, 2015, 24(5): 380-384.张玉琴, 徐海东, 董海波, 等. 磁共振功能成像在胶质瘤术前分级评估中的价值. 影像诊断与介入放射学, 2015, 24(5): 380-384.
[14] Fu CY, Liu YH, Yang HK, et al. The application progress of MRS in the study of glioma metabolism. Chin J Neurosurg Dis Res, 2014, 13(2): 190-192.傅常宇, 刘耀华, 杨宏宽, 等. 磁共振波谱技术在胶质瘤代谢研究中的应用进展. 中华神经外科疾病研究杂志, 2014, 13(2): 190-192.
[15] Bulik M, Jancalek R,Vanicek J, et al. Potential of MR spectroscopy for assessment of glioma grading. Clin Neurol Neurosurg, 2013, 115(2): 146-153.
[16] Server A, Kulle B, Gadmar OB, et al. Measurements of diagnostic examination performance using quantitative apparent diffusion coeff i cient and proton MR spectroscopic imaging in the preoperative evaluation of tumor grade in cerebral gliomas. Eur J Radiol, 2011, 80(2): 462-470.
[17] Zeng Q, Liu H, Zhang K, et al. Noninvasive evaluation of cerebral glioma grade by using multivoxel 3D proton MR spectroscopy. Magn Reson Imaging, 2011, 29(1): 25-31.
[18] Caivano R, Lotumolo A, Rabasco P, et al. 3 Tesla magnetic resonance spectro-scopy: cerebral gliomas vs. metastatic brain tumors. Our experience and review of the literature. Int J Neurosci, 2013, 123(8): 537-543.
[19] Jiang L, Liu W, Xiao CY, et al. The diagnosis value of1H-MRS quantitative analysis in brain parenchyma glioma grading. Chin J Magn Reson Imaging, 2015, 6(1): 15-20.姜亮, 刘文, 肖朝勇, 等. 探讨1H-MRS定量分析在脑实质区胶质瘤分级中的诊断价值. 磁共振成像, 2015, 6(1): 15-20.
[20] Howe FA, Opstad KS.1H MR spectroscopy of brain tumors and masses. NMR Biomed, 2003, 16(16): 123-131.
[21] Yin H, Zhang J, Gao YG, et al. Application of magnetic resonance spectroscopy in diagnosis of intracranial lesions. J Pract Radiol, 2007, 23(6): 721-723.印弘, 张艰, 高元桂, 等. MRS在脑占位病变诊断中的应用. 实用放射学杂志, 2007, 23(6): 721-723.
[22] Wu YQ, Lin Q, lan YH, et al. Glioblastoma multi-mode MRI manifestations and pathological histology foundation. Chin J Magn Reson Imaging, 2013, 4(3): 196-200.吴裕强, 林祺, 兰玉华, 等. 胶质母细胞瘤多模式MRI表现及其病理组织学基础. 磁共振成像, 2013, 4(3): 196-200.
[23] Cheng LL, Anthony DC, Comite AR, et al. Quantification of microheterogeneity in glioblastoma multiforme with ex vivo highresolution magic-angle spinning (HRMAS) proton magnetic resonance spectroscopy. Neuro Oncol, 2000, 2(2): 87-95.
[24] Steffen-Smith EA, Shih JH, Hipp SJ, et a1. Proton magnetic resonance spectroscopy predicts survival in children with diffuse intrinsic pontine Glioma. J Neurooncol, 2011, 105(2): 365-373.
[25] Fountas KN, Kapsalaki EZ, Vogel RL, et al. Noninvasive histologic grading of solid astrocytomas using proton magnetic resonance spectroscopy. Stereotact Funct Neurosurg, 2004, 82(2-3): 90-97.
[26] Lin Q, Zhang Q, Chen DP, et al. Correlation investigate between grade of intratumoral susceptibility signals and relative quantitative of1H-MRS in patients with brain astrocytic tumours. Chin J Magn Reson Imaging, 2012, 3(2): 174-178.林祺, 张强, 陈东平, 等. 脑星形细胞瘤磁敏感效应级别与1H-MR波谱相对定量的相关性探讨. 磁共振成像, 2012, 3(2): 174-178.
Comparison of 3D-ASL and1H-MRS magnetic resonance imaging techniques for the preoperative grading of brain glioma
DONG Wei-min, QI Xu-hong, KANG Qun-feng, BI Dong-mei, YU Yang, MENG Fanqi, WEN Zhi-yong*
Department of Radiotherapy, State Grid Corporation of Beijing Electric Power Hospital, Beijing 100073, China
Objective:To investigate the value of three-dimensional arterial spin labeling (3D-ASL) MR perfusion imaging and1H-magnetic resonance spectroscopy (1H-MRS) metabolite in grading the cerebral gliomas.Materials and Methods:3D-ASL and1H-MRS imaging of total 44 patients with pathologically- proved gliomas were retrospectively analyzed. According to the 2007 World Health Organization (WHO) standards, the patients were divided into low-grade glioma group (gradeⅠ—Ⅱ, 13 cases) and high-grade glioma group (grade Ⅲ—Ⅳ, 31 cases), measuring and calculating the values or relative values of CBF and metabolites of the tumor parenchyma and corresponding contralateral tissue for statistical analysis.Results:In the 44 cases of glioma, 3D-ASL related parameters (TBFmax, rCBF1, rCBF2) and1H-MRS related parameters (rNAA, rCr, Cho/Cr, NAA/Cho) had statistically signif i cant differences in the low-grade and the high-grade glioma group (P<0.05), and1H-MRS parameters (rCho, NAA/Cr) had no statistically signif i cant differences between the two groups (P>0.05). By receiver operating characteristic curve (ROC) analysis, the AUC of TBFmax, rCBF1, rCBF2and rNAA, rCr, Cho/Cr, NAA/Cho was larger than 0.5 in glioma grades, while the AUC of 3D-ASL was 0.923 and the AUC of1H-MRS was 0.871, both were lesser than the AUC of 3D-ASL plus1H-MRS combination (0.955). The sensitivity and specif i city of combiningthe two technologies in differentiating glioma grades were 87.1% and 100% respectively. Conclusions: Separately analysising 3D-ASL and1H-MRS, 3D-ASL has a higher diagnostic value. combining the two technologies, which can complement each other, has a higher diagnostic value than 3D-ASL or1H-MRS in differentiating glioma grades.
Glioma; Spin labels; Magnetic resonance spectroscopy; Neoplasm grading
国家电网公司北京电力医院放射科,北京 100073
温智勇,E-mail:wenzhiyong@yahoo. com
2016-09-13
接受日期:2016-10-15
R445.2;R739.41
A
10.12015/issn.1674-8034.2016.11.005
董卫敏, 齐旭红, 康群凤, 等. 磁共振3D-ASL与1H-MRS对脑胶质瘤术前分级的对比研究. 磁共振成像, 2016, 7(11): 819-824.
*Correspondence to: Wen ZY, E-mail: wenzhiyong@yahoo.com
Received 13 Sep 2016, Accepted 15 Oct 2016

