平远慈橙皮黄酮类化合物的提取工艺探究
王楠 周凤书


摘 要 采用超声波辅助乙醇提取橙皮中黄酮类化合物,以硝酸铝显色法测定的黄酮类化合物总量为指标,探究平远慈橙皮黄酮类化合物的提取工艺。运用单因素实验研究溶剂pH、乙醇体积分数、提取温度、提取时间、料液比对黄酮类化合物提取率的影响,通过正交试验进一步优化提取工艺条件。结果表明:平远慈橙皮黄酮类化合物最佳提取工艺为乙醇体积分数50%,温度50 ℃,料液比1∶50,超声时间50 min。通过最佳工艺验证,此条件下平远慈橙皮黄酮类化合物提取率达到2.10%。该工艺简单可行,有较好的参考价值。
关键词 慈橙皮;黄酮类化合物;超声波;提取
中图分类号:TQ461 文献标志码:A 文章编号:1673-890X(2016)12--04
平远慈橙产于梅州市平远县,目前该县已有慈橙种植面积达6 667 hm2,挂果面积2 000 hm2,总产约2.6万t,是广东省最大的脐橙生产基地[1]。平远慈橙经检测,其中维生素C、维生素E、铁、锌、镁等5个指标远高于其他类脐橙,富含β-胡萝卜素、蛋白质、果胶以及黄酮类化合物等,享有“橙中之王”的美称。
黄酮类化合物(Flavonoids)又名生物类黄酮化合物(Bioflavoinoids),是植物在长期自然选择过程中产生的一些次级代谢产物,是许多中草药的有效成分。近年来,许多研究表明,黄酮类化合物具有消炎抗菌、清热解毒、镇静和利尿等作用,是活性氧的良好清除剂,尤其是抗自由基和抗癌防癌的作用[2-3],使对黄酮类化合物的研究进入了一个新阶段。黄酮类化合物安全、无毒,在医药、食品加工等方面已被广泛应用[4]。橘类黄酮具有的消炎抗过敏性使其在日用化工领域的应用前景日益广阔。据报道,国外已经把柑橘类黄酮添加在牙膏中用于治疗过敏性牙龈炎,效果较好。国外正在研究以类黄酮代替咖啡因和奎宁的新工艺,而在我国,把柑橘类黄酮作为食品添加剂的应用研究工作几乎为空白。我国拥有丰富的柑橘资源,深度开发柑橘类黄酮资源,尤其是在医药、食品和保健品领域中的应用,具有重大的经济效益和社会效益。
近年来,平远县以打造“慈心农业”为出发点,依托农业龙头企业延伸慈橙产业链、浓缩汁、橙肉、香精油和百分百鲜果汁等深加工产品不断面世,取得了巨大的经济效益[5]。同时,每年因慈橙深加工而产生大量的橙皮并未得到充分利用,造成了资源浪费。橙皮中含有大量有益的天然化合物,黄酮类化合物就是最重要的一类。当前,虽然柑橘类黄酮化合物的研究工作已取得一定进展,但还需解决一些现实问题。如尚缺少适合工业化生产的提取工艺参数;缺少快速、高效、简单的检测分析方法;对柑橘类黄酮化合物某些生理功能及其作用机理研究不深入等。
目前,提取黄酮类化合物的方法很多,如水浸提取法、索氏提取法、有机溶剂法等[6]。本研究采用超声波辅助法从慈橙皮中提取黄酮类化合物,研究乙醇溶液体积分数、提取时间、提取温度、料液比对黄酮类化合物提取率的影响。在单因素试验的基础上采用正交试验优化提取条件,为柑橘类果皮的有效利用及黄酮类化合物的开发提供参考。
1 材料与方法
1.1 实验材料
平远慈橙,采自广东省梅州市平原县农业科技示范基地。芦丁标准品(纯度98%)中国食品药品检定研究院;无水乙醇、硝酸铝、亚硝酸钠、氢氧化钠等均为国产分析纯。
1.2 实验方法
1.2.1 样品采集和预处理
采集新鲜慈橙剥下外皮,洗净后切成小块,50 ℃烘干至恒质量,粉碎,过40目筛子,于磨口瓶中密封干燥贮存。
1.2.2 黄酮类化合物标准曲线的绘制
精确称取干燥至质量恒定的芦丁标准品0.020 g,乙醇溶解,制成0.1 mg/mL的芦丁标准溶液。取标准液 0.0、1.0、2.0、4.0、6.0、8.0、10.0 mL分别置于50 mL容量瓶中,依次编号;各加入1.4 mL的5%亚硝酸钠摇匀,静置5 min;再加入1.4 mL的10%硝酸铝摇匀,静置5 min;加入1 mol/L氢氧化钠溶液10 mL ,摇匀显色,最后用乙醇定容至刻度。波长510 nm处测定吸光度。根据所得数据,绘制标准曲线,得出线性回归方程。
1.2.3 黄酮类化合物提取工艺流程
工艺流程:慈橙皮-预处理-超声波辅助提取-抽滤-酸化沉淀-过滤取沉淀物-干燥得粗黄酮类化合物。
1.2.4 优化平远慈橙中黄酮类化合物的纯化工艺
以乙醇为提取剂,采用超声波法提取黄酮类化合物,考察pH值对黄酮类化合物提取率的影响。各称取样品于7个锥形瓶,分别加入pH值4、5、6、7、8、9、10、11的50%乙醇水溶液。50 ℃下超声辅助提取60 min。仅不加原料试剂作为空白对照液,计算pH值对黄酮类化合物提取率的影响。
1.2.5 单因素实验优化平远慈橙中黄酮类化合物的提取工艺
根据标准曲线分别研究乙醇体积分数、提取温度、料液比(原料质量∶溶剂体积,g/mL)、提取时间对黄酮类化合物提取率的影响,仅不加原料试剂作为空白对照。
乙醇体积分数单因素试验:样品分别加入30%、40%、50%、60%、70%乙醇水溶液。温度50 ℃,超声波辅助循环提取60 min,计算乙醇浓度对黄酮类化合物提取率的影响。
温度单因素试验:样品加入浓度50%乙醇水溶液100 mL,分别在30、40、50、60、70 ℃温度下超声波辅助提取60 min,计算提取温度对黄酮类化合物提取率的影响。
超声时间单因素试验:样品用浓度50%乙醇水溶液溶解,料液比1∶50,温度50 ℃,超声辅助提取20、30、40、50、60min,计算提取时间对黄酮类化合物的提取率的影响。
料液比单因素试验:样品按料液比1∶10、1∶30、1∶50、1∶70,在50 ℃下超声辅助取60 min,计算醇溶剂与橙皮质量比对黄酮类化合物提取率的影响。
在波长510 nm处测定吸光度。按照吸光度-浓度标准曲线计算黄酮类化合物提取率。
提取液中黄铜类化合物得率(%)
式(1)中:V0为第一次定容后提取液的体积(mL);V1为从母液中量取的提取液体积(mL);V2为第二次定容后提取液的体积(mL);C为提取液中总黄酮浓度(μg/mL);M为称取橙皮质量(g)。
1.2.6 正交试验
为系统考察超声波辅助溶剂萃取法的工艺参数,根据单因素实验的结果,选用L9(34)正交试验,以测得的样品中总黄酮含量为考察指标,考察乙醇浓度%(A)、超声温度℃(B)、料液比(C)和超声时间min(D)对黄酮类化合物的提取率的影响[7]。正交试验因素与水平见表1。
1.2.7 最佳工艺验证实验
称取2.00 g橙皮样品5份,调节溶剂pH为10,在优选工艺条件下乙醇浓度为50%,温度50 ℃,料液比1∶50,超声时间50 min进行提取,按照黄酮类化合物的测定及得率的计算方法计算提取率及相对标准偏差[7]。
1.2.8 加标回收率实验
称取2.00 g橙皮样品5份,然后各加入含0.2 mg的芦丁标准溶液,在最佳提取工艺条件下进行提取实验,测量吸光度,并按下式计算加标回收率:
2 结果与分析
2.1 黄酮类化合物标准曲线
按1.2.2方法进行实验,将实验结果进行线性回归,实验结果见图1。得回归方程为C= 86.998A + 0.3881,R? = 0.9982说明在吸光度0.018~0.217,该方程的线性拟合程度较好。
2.2 平远慈橙黄酮类化合物的纯化工艺优化
黄酮类化合物分子结构中含有酚羟基,在碱性和中性条件下溶解度明显增大,而在酸性条件中则沉淀析出。随着溶液pH值的增加,溶解度增大,当pH10左右,提取率达到最大。见图2。
2.3 单因素试验对黄酮类化合物提取率的影响
2.3.1 乙醇浓度对黄酮类化合物的提取率的影响(见图3)
2.3.2 提取温度对黄酮类化合物的提取率的影响(见图4)
2.3.3 提取时间对黄酮类化合物的提取率的影响(见图5)
2.3.4 料液比对黄酮类化合物的提取率的影响(见图6)
上述单因素试验结果表明:最佳提取条件为乙醇浓度50%,温度50 ℃,料液比1∶50,超声时间50 min。
2.4 正交试验优选慈橙皮黄酮类化合物提取工艺
按极差R大小排列因素主次。由表可知,极差值反映的因子影响顺序:C(料液比)>B(温度)>A(乙醇浓度)>D(超声时间)。由正交实验得出最优水平实验方案为A2B1C3D3即乙醇浓度为50%,温度为50 ℃,料液比1∶50,超声时间70 min作为最佳工艺[8]。但由于提取时间对提取率的影响最小,且远远小于其他因素。故最佳实验方案为A2B1C3D1。
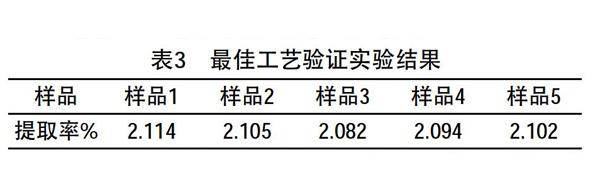
2.5 最佳工艺验证实验结果(见表3)
刘蓉、周正勇、罗南芳[9]等用超声波法提取塔罗科血橙皮黄酮类化合物,提取率为1.0213%。本实验进行各因素优化,按上述最佳工艺条件进行验证实验,通过检测计算得出平均提取率为2.10%,相对标准偏差RSD(Relative Standard Deviation)为0.58%。表明提取黄酮类化合物工艺稳定性好,适宜于生产应用。
2.6 加标回收率实验结果(见表4)
通过计算得出加标回收率平均值97.47%,RSD为1.31%(n=5),表明以芦丁为对照,经紫外分光光度法测定黄酮质量浓度的黄酮回收率高,说明本次实验所测数据准确、可靠。
3 结论
本实验采用超声波辅助溶剂法提取平远慈橙皮中黄酮类化合物,用硝酸铝显色法测定黄酮类化合物提取率。采用单因素实验验证,正交试验优化提取工艺条件。结果表明:平远慈橙皮中黄酮类化合物最佳提取工艺为乙醇浓度50%,温度50 ℃,料液比1∶50,超声时间50 min。通过最佳工艺验证,在此条件下平远慈橙皮中黄酮类化合物提取率为2.10%。
在优选的提取工艺条件下,验证实验RSD为0.58%。加标回收率实验RSD为1.31%、加标回收率平均值为97.47%。该工艺操作简便、成本低、收率高,具有良好的稳定性和重复性,可为平远慈橙皮黄酮类化合物的工业化生产提供参考。
参考文献
[1]刘碧林.平远慈橙产业的发展前景[J].现代园艺,2012(11).
[2]王光凤,王小晨,肖璘,等.柑橘黄酮川陈皮素的抗肿瘤作用研究[J].中草药,2007,38(11).
[3]Li R,Li J,Hu C M,et al.Therapeutic Effect of Hesperidin on Adjuvant Arthritis in Rats and its Mechanisms[J].Chinese Pharmacological Bulletin,2008,24(4).
[4]张胜帮,赵玲玲.黄酮类化合物的提取纯化研究进展[J].温州大学学报:自然科学版,2007(5).
[5]侯慧妮,罗娟娟,朱双玲.平远慈橙衍生“甜心产业”[N].梅州日报.2013-01-21(001).
[6]董宇.黄酮类化合物的提取方法研究及展望[J].人参研究,2009(4).
[7]田春莲,蒋凤开.茜草总黄酮提取工艺研究[J].食品科学,2011(24).
[8]樊瑞胜,陈平,刘岩,等.桔皮类黄酮乙醇提取工艺研究[J].哈尔滨商业大学学报:自然科学版,2006(4).
[9]刘蓉,周正勇,罗南芳,等.超声波法提取塔罗科血橙皮黄酮类化合物工艺优化[J].湖北农业科学,2013(17).
(责任编辑:刘昀)

