TaqMan荧光定量PCR快速检测锦鲤疱疹病毒方法的建立与应用
李涛 万译文 刘登望
摘要:本研究采用一步DNA提取法快速提取锦鲤组织样品中的DNA,利用针对锦鲤疱疹病毒(Koi herpesvirus,KHV)TK基因保守区设计的一对特异性引物、一条特异荧光探针,经反应体系优化,应用实时荧光定量PCR检测技术,通过对荧光信号的实时监测实现对KHV的定量检测。整个过程快速、简捷,操作简单,可对KHV进行快速有效的诊断,具有一定的应用价值。
关键词:锦鲤疱疹病毒;荧光定量PCR;TaqMan;一步法
中图分类号:S941.41+9文献标识号:A文章编号:1001-4942(2016)07-0125-04
锦鲤疱疹病毒病是由锦鲤疱疹病毒(Koi herpesvirus,KHV)引起的一种传染性疾病。KHV能够感染锦鲤、鲤鱼和剃刀鱼,其鱼苗、幼鱼、成鱼均可感染。锦鲤疱疹病毒病多发于春、秋季,潜伏期两周左右,鱼发病并出现症状24~48 h后开始死亡,2~4 d内死亡率可迅速达到80%~100%[1,2]。此病首先在以色列暴发,接着美国、欧洲(如英国、德国、比利时)及亚洲一些国家均有此病发生,给锦鲤和鲤鱼养殖业造成重大经济损失[3,4]。
锦鲤疱疹病毒颗粒呈球状,有囊膜,直径约170~230 nm,其核衣壳为对称十面体,直径为100~110 nm,该病毒由31种病毒多肽组成,遗传物质为双链DNA,基因组大小约为277 kb[5,6]。
目前锦鲤疱疹病毒病的检测方法有电镜检测、ELISA、普通PCR和荧光定量PCR等[7]。TaqMan荧光定量PCR是在PCR扩增时在加入一对引物的同时加入一种特异性荧光探针,该探针为一段寡聚核苷酸,两端分别标记一个报告荧光基团和一个淬灭荧光基团。探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5′→3′外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步[8~11]。
鉴于锦鲤疱疹病毒病对养殖业带来的危害,对其进行快速准确的检测具有重要意义。本研究通过比对两种不同的核酸提取方法,建立了基于TaqMan荧光定量PCR技术快速检测KHV的方法,以期为有效控制锦鲤疱疹病毒病的传播提供技术支持。
1材料与方法
1.1病毒株
KHV标准毒株VR1592购自北京中原公司。锦鲤细胞系(KF)、鲤春病毒血症病毒(SVCV)、传染性造血器官坏死病毒(IHNV)、病毒性出血性败血症病毒(VHSV)和鲤鱼疱疹病毒(CHV)核酸由湖南水产科学研究所馈赠。
1.2主要仪器和试剂
荧光定量PCR仪购自上海宏石医疗科技有限公司;通用一步法DNA提取液、柱式病毒基因组抽提试剂盒购自生工生物工程(上海)股份有限公司(简称上海生工);脱氧三磷酸核苷酸(dNTPs)、Taq DNA聚合酶购自普洛麦格生物技术有限公司(北京);三羟甲基氨基甲烷(Tris)、氯化钾(KCl)、氯化镁(MgCl2)、硫酸铵、甘油等购自西陇化工有限公司(广州)。
1.3引物设计
查找KHV相关基因并利用ClustalX2进行序列比对,最后选定TK基因的保守区设计引物和探针,使用引物设计软件Oligo7。正向引物F1:5′-GCTGGAGCGTCTGTCCT-3′;反向引物F2:5′-ATGGCCACCTTGGACTCTT-3′;TaqMan探针:FAM-5′-ACGCTGCATCGCCGTCAAGCAC-3′-BQ1,扩增长度为90 bp。经NCBI网站上的Primer-Blast分析本套引物具有KHV特异性。同时以KHV全长基因组序列(KJ627438)为模板合成含TK基因的质粒做为参考品。引物、探针及质粒皆由上海生工合成。
1.4TaqMan荧光定量PCR反应体系的优化
PCR反应体系(50 μL)包括Tris-HCl (pH 8.0) 10 mmol/L,KCl 50 mmol/L,dNTPs 30 mmol/L,MgCl2 5 mmol/L,Taq酶10 U,添加(NH4)2SO4 10 mmol/L和甘油3%增加扩增的特异性和稳定性。
引物和探针终浓度的筛选:利用0.05、0.1、0.2、0.4、0.8 μmol/L的引物终浓度和0.03、0.06、0.12、0.24、0.48 μmol/L的探针终浓度对样品进行扩增,筛选引物和探针的最佳浓度。
扩增程序如下:95℃ 5 min;95℃ 15 s,60℃ 30 s,共40个循环,收集荧光信号;4℃保温。
1.5病毒培养
将KHV 标准毒株VR1592 接种KF 细胞,待出现细胞病变收获病毒培养液(以下简称细胞毒)。
1.6DNA提取方法比较
KHV DNA分别用两种试剂盒提取并进行对比。
方法一:一步法,利用通用一步法DNA提取液。将约2 μL液体样品或固体组织研磨液(剪取约20 mg锦鲤腮腺组织,加入200 μL生理盐水,用玻璃匀浆器充分研磨得到组织研磨液)加入到50 μL提取液中,80℃加热5 min后,简短振荡混匀后取裂解物直接进行PCR。
方法二:柱提法,利用柱式病毒基因组抽提试剂盒。按照试剂盒说明书操作,经过蛋白酶K裂解、吸附柱收集、DNA洗脱等步骤,大约需要1 h。
1.7特异性试验
应用建立的荧光定量PCR方法同时对锦鲤疱疹病毒(KHV)、鲤春病毒血症病毒(SVCV)、传染性造血器官坏死病毒(IHNV)、病毒性出血性败血症病毒(VHSV)和鲤鱼疱疹病毒(CHV) DNA进行扩增,检测KHV引物和探针的特异性。
1.8敏感性试验
KHV质粒由上海生工合成后,然后按照下面的公式转换成质粒的拷贝数:每微升质粒拷贝数=(6.02×1023)×(ng/μL×10-9)/(DNA序列长度×660)。将质粒进行10 倍梯度稀释,检测该方法的敏感性。
1.9重复性试验
取3个批次细胞毒样本,用一步法提取DNA后进行荧光定量PCR检测。同一样本做3个平行检测。
1.10样品检测
应用建立的荧光定量PCR方法将30 份细胞培养物与攻毒鱼组织样本进行检测,同时利用普通PCR进行检测,比较荧光定量PCR方法的应用情况。
2结果与分析
2.1PCR反应体系的建立
最终确定引物、探针终浓度分别为0.1、0.06 μmol/L时能获得较理想的扩增结果,浓度增加扩增效果提高不明显,浓度降低则荧光信号较低。
最终的PCR反应体系(50 μL):Tris-HCl (pH 8.0) 10 mmol/L,KCl 50 mmol/L,(NH4)2SO4 10 mmol/L,甘油3%,dNTPs 30 mmol/L,MgCl2 5 mmol/L,Taq酶10 U,正、反向引物各0.1 μmol/L,荧光探针0.06 μmol/L。
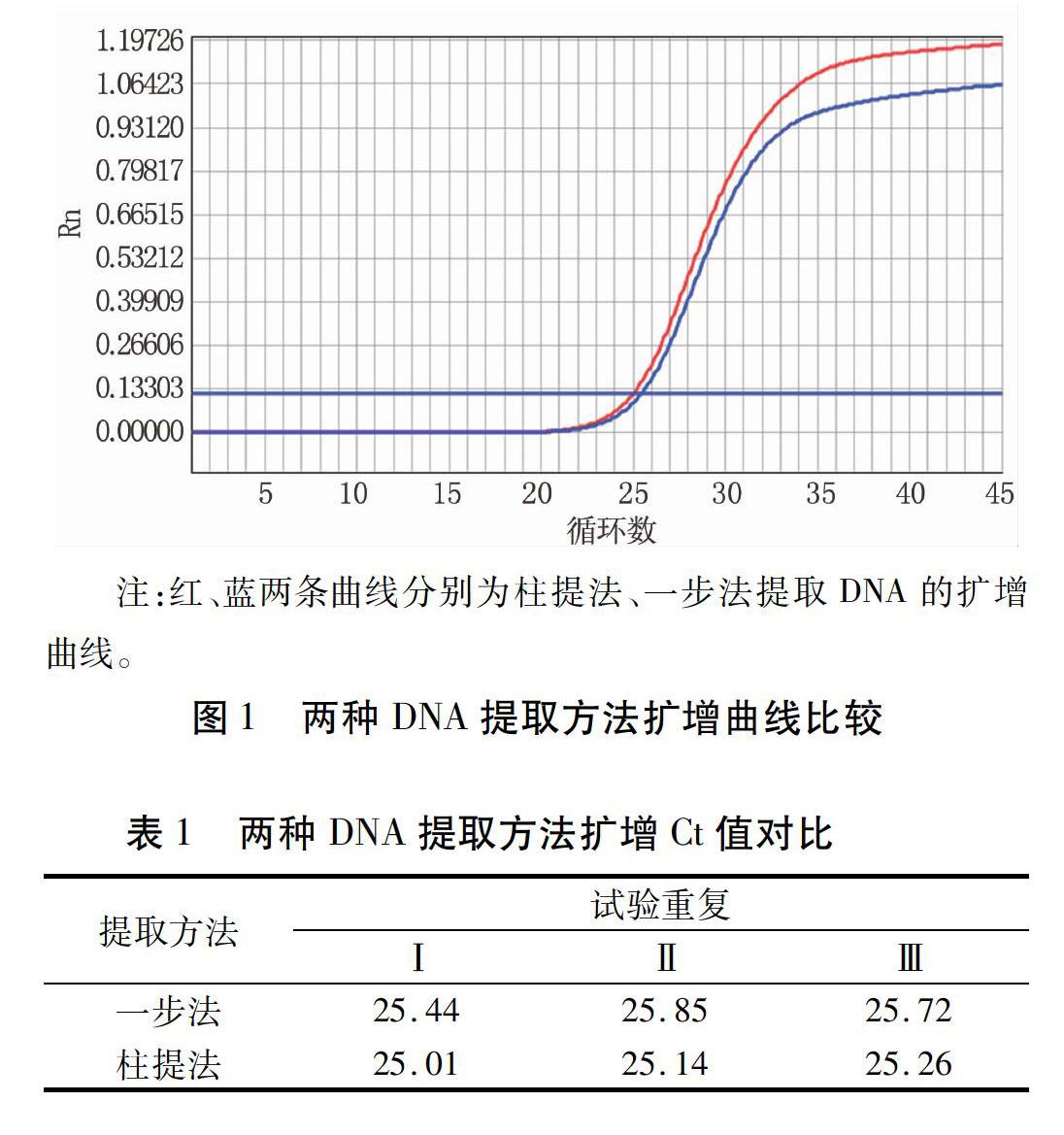
2.2两种DNA提取方法比较
对同一细胞毒运用两种方法提取DNA,并用荧光定量PCR方法重复检测3次。结果显示两种方法无明显差异(图1,表1),说明一步法可以提取代柱提法进行KHV DNA提取并进行荧光PCR检测。
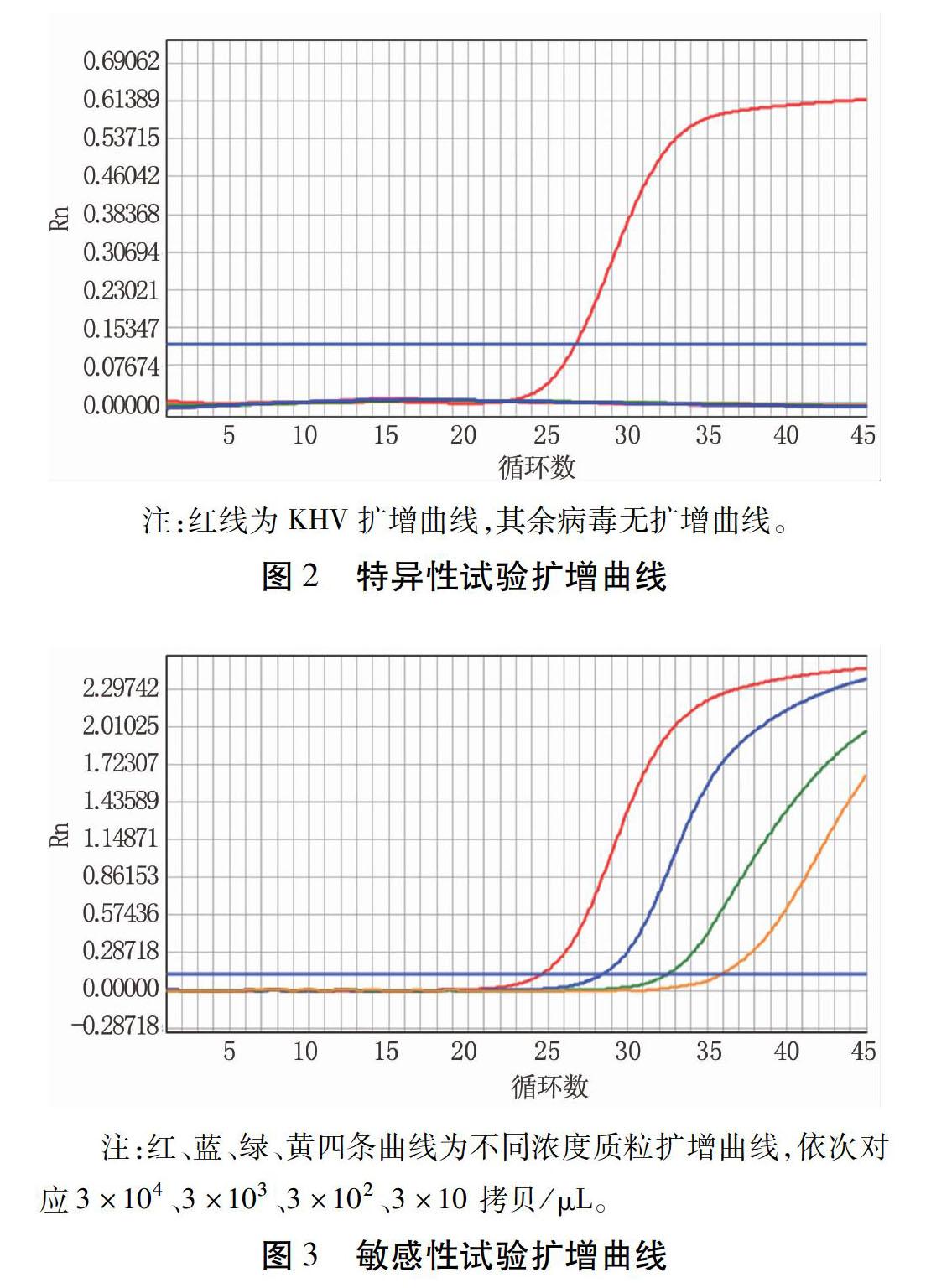
2.3特异性试验结果
应用建立的荧光定量PCR方法同时检测KHV、SVCV、IHNV、VHSV和CHV DNA,只有KHV有扩增曲线(图2),说明该方法具有良好的特异性。
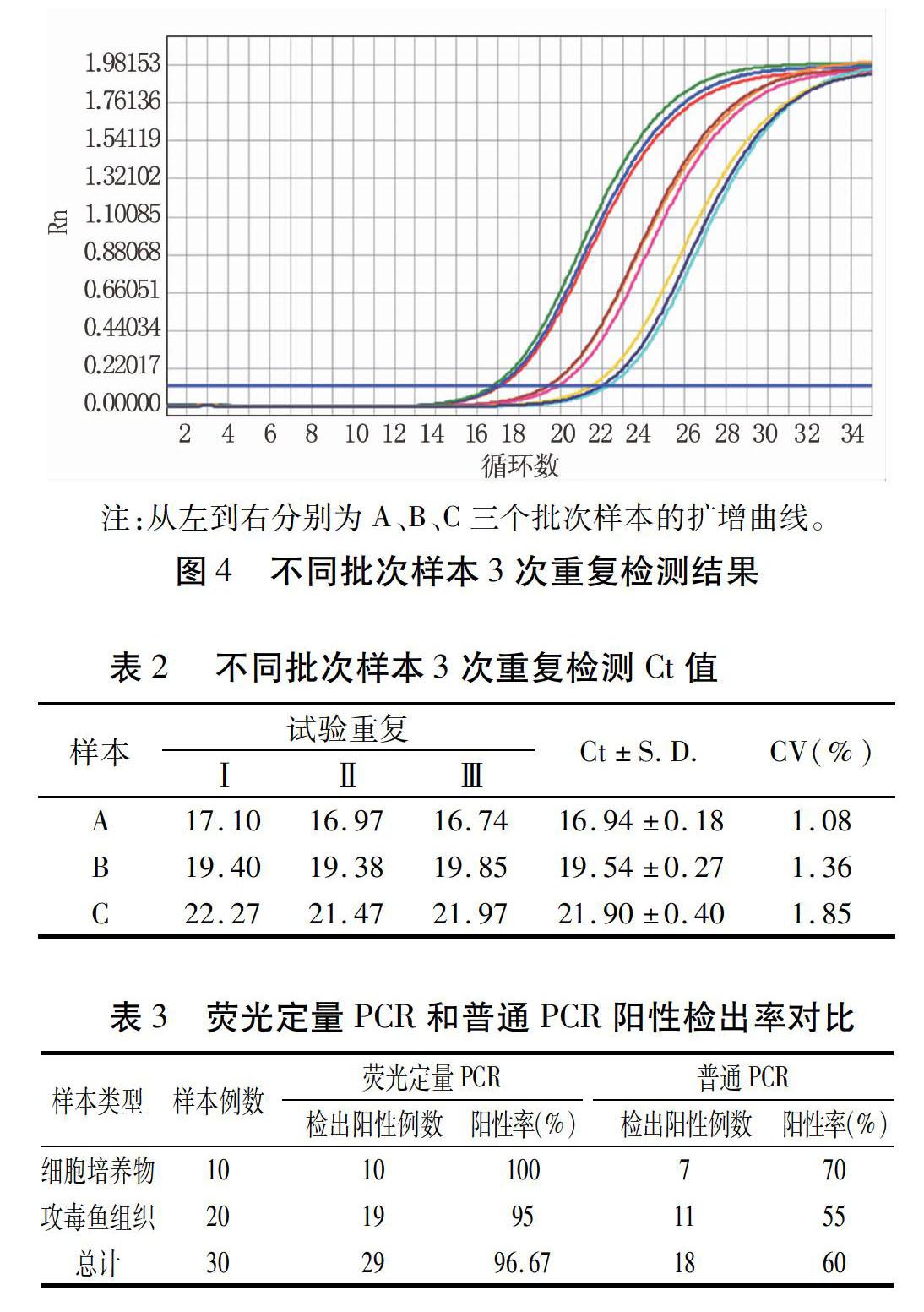
2.4敏感性试验结果
将KHV质粒进行10倍梯度稀释,共4个梯度,分别为3×104、3×103、3×102、3×10 拷贝/μL,最低检测限为30 拷贝/μL(图3)。以质粒浓度30 拷贝/μL为模板进行20次重复检测,检出率为95%,证明该方法检测KHV具有极高的灵敏度。
2.5重复性试验结果
3个批次细胞毒样本用一步法分别提取DNA后均分3次进行荧光PCR扩增,结果(图4,表2)显示该方法重复性较好,变异系数CV<2.00%。
2.6临床样品检测结果
采用建立的一步DNA提取法结合荧光定量PCR方法检测30份细胞培养物与攻毒鱼组织样本(表3),荧光定量PCR阳性检出率为96.67%(29/30),普通PCR阳性检出率为60%(18/30)。两种方法比较,荧光定量PCR方法检测KHV具有更高的灵敏度。
3讨论与结论
荧光定量PCR利用荧光信号的变化实时监测PCR扩增反应中每一个循环扩增产物量的变化,通过Ct值和标准曲线的关系对起始模板进行定量分析,简化了检测过程,重复性好、灵敏度高、特异性强、结果清晰,具有广泛用途[8~11]。
在其它利用荧光定量PCR方法检测锦鲤疱疹病毒的研究中,DNA提取方法大多采用商业试剂盒柱提法[3, 6]或经典CTAB法[12]。柱提法步骤繁多,耗时长;而经典CTAB法所用有机试剂酚、氯仿等可造成环境污染,对人体危害大。本研究选用的一步法,整个提取过程不包含去蛋白、去RNA及其它次生代谢物的过程,无需有机溶剂抽提,无需无水乙醇沉淀,简便、快捷,操作简单,只用一步(约5~10 min)即可得到用于 PCR 扩增的 DNA模板,且质量稳定可靠。结合优化的PCR反应体系,可对锦鲤疱疹病毒进行快速有效诊断,具有一定应用价值。
参考文献:
[1]陈爱平,江育林,钱冬,等. 锦鲤疱疹病毒病[J]. 中国水产,2010(11):58-59.
[2]朱霞,王好,李新伟,等. 锦鲤疱疹病毒病的研究进展[J]. 中国兽医科学,2011,41(1):106-110.
[3]张艳,孟庆峰,钱爱东,等. 锦鲤疱疹病毒荧光定量PCR检测方法的建立[J]. 吉林畜牧兽医,2010,31(4):11-14.
[4]刘宗晓,刘荭,江育林. 锦鲤疱疹病毒病的研究进展[J]. 检验检疫科学,2006,16(4):77-80.
[5]洪徐鹏. 鲤、鲫疱疹病毒病的诊断与防治措施[J]. 河北渔业,2013(1):39-40.
[6]袁海延,于慧,王好,等. 锦鲤疱疹病毒病的研究进展[J]. 中国兽药杂志,2015,49(5):62-65.
[7]孟庆峰,吕文雪,单晓枫,等. 锦鲤疱疹病毒TaqMan荧光定量PCR快速检测方法的建立及应用[J]. 吉林农业大学学报,2012,34(3):339-342,354.
[8]任广睦,刘季,王英元. 实时荧光定量PCR技术应用于核酸定量检测的研究进展及展望[J]. 山西医科大学学报,2006,37(9):973-976.
[9]Higuchi R, Fockler C, Dollinger G, et al. Kinetic PCR analysis: real-time monitoring of DNA amplification reactions[J]. Biotechnology, 1993, 11: 1026.
[10]Wall S J, Edward D R. Quantitative reverse transcription-polymerase chain reaction (RT-PCR): A comparison of prime-dropping, competitive , and real-time RT-PCRs[J]. Anal. Biochem., 2002, 300(2): 269-273.
[11]Felkin L E, Taegtmeyer A B, Barton P J. Real-time quantitative polymerase chain reaction in cardiac transplant research [J]. Methods Mol. Biol., 2006, 333: 305-330.
[12]范万红,刘荭,岳志芹,等. 锦鲤疱疹病毒实时荧光定量PCR检测方法的建立及应用[J]. 中国海洋大学学报(自然科学版),2007,37(5):785-788,722.

