芥菜型油菜中SK2型脱水蛋白的表达对大肠杆菌抗逆性的影响
孙雅慧, 罗桂花, 柴团耀,王慧春,徐进,3*
(1.青海师范大学 生命与地理科学学院, 青海 西宁 810008; 2.中国科学院大学 生命科学学院, 中国 北京 100049;
3.中国科学院热带植物资源可持续利用重点实验室, 中国科学院西双版纳热带植物园,云南 勐仑镇 666303)
芥菜型油菜中SK2型脱水蛋白的表达对大肠杆菌抗逆性的影响
孙雅慧1, 罗桂花1, 柴团耀2,王慧春1,徐进1,3*
(1.青海师范大学 生命与地理科学学院, 青海 西宁 810008; 2.中国科学院大学 生命科学学院, 中国 北京 100049;
3.中国科学院热带植物资源可持续利用重点实验室, 中国科学院西双版纳热带植物园,云南 勐仑镇 666303)
摘要:为了阐明印度芥菜脱水蛋白家族基因BjDHN2和BjDHN3对非生物逆境胁迫的耐受性,我们构建了原核表达载体pET30a-BjDHN2和pET30a-BjDHN3并转化大肠杆菌BL21。在低温、干旱和高盐环境中,与含有空载体对照菌株无BjDHN2和BjDHN3基因相比,重组菌中BjDHN2和BjDHN3蛋白的表达可以在一定程度上缓解寒、旱、盐胁迫对大肠杆菌生长所产生的抑制作用。结果表明,过表达BjDHN2和BjDHN3可提高大肠杆菌对寒、旱、盐等逆境胁迫的耐受性。
关键词:芥菜型油菜;脱水蛋白;大肠杆菌;胁迫耐受性
盐、寒、旱等环境胁迫是植物生长的主要限制因素,也一直是农业生产的大敌。长期以来人们投入极大精力研究改善作物抗逆性,但是进展缓慢[1]。因此,揭示植物抗逆的分子机制成为目前分子生物学研究的热点领域。在过去的20年间,很多与植物响应逆境应答相关的基因被克隆出来,并同时也对其功能进行了分析[2]。这些研究极大地丰富了我们对于植物在逆境胁迫下的基因调控表达规律的认识。在这些研究中脱水蛋白是一种重要的普遍被人们重视的响应逆境胁迫蛋白。近年来,在拟南芥和其他多种植物中对脱水蛋白的研究极大丰富了我们对其的认识。其中一些脱水蛋白在转基因植物中会表现出抗寒、抗旱或者抗盐的特性。但是这些研究仅仅是第一步,距离我们全面地了解脱水蛋白的生理生化以及分子机制,到最后改良作物的品质品性还相距甚远。
脱水蛋白(dehydrin)属于LEA(Late embryogenesis abundant protein)Ⅱ蛋白家族,最初,脱水蛋白是因为在种子成熟时期的脱水耐受的过程中起重要作用而被发现的[3,4]。之后的研究进一步表明,脱水蛋白广泛存在于细菌、藻类及高等植物的组织和器官中。在高等植物中,各种逆境胁迫,如高盐、低温和干旱以及外源激素ABA处理均可诱导脱水蛋白的表达[5]。已有的研究结果表明,脱水蛋白对各种逆境胁迫的响应是一个复杂的网络。脱水蛋白的主要功能被公认为,一是保护蛋白质结构并稳定蛋白质的功能;二是抗氧化活性;三是可以与金属离子结合而起作用[6]。但对高盐、低温、干旱等复杂的非生物因子的胁迫,脱水蛋白必定存在更多的功能和保护机制,在这方面,也已取得了一些结果。但是对于脱水蛋白是如何响应各种逆境信号,以及它对植物生长发育调节上的诸多环节仍不是很清楚,这直接阻碍了我们对植物抗逆性的认识。可以预见的是,进一步深入开展对脱水蛋白功能及其表达调控规律的研究,同时更加全面地了解植物抗逆反应的生理生化机制,必定会为人们未来更好地利用和开发新的抗逆品种提供理论上的基础及依据。本论文分析了芥菜型油菜2个脱水蛋白家族基因BjDHN2和BjDHN3原核表达对低温、盐和模拟干旱胁迫的耐受性,为深入探明这2个基因的功能,以及采用大肠杆菌原核表达系统对脱水蛋白进行筛选和功能验证的可行性提供理论依据。
1材料与方法
1.1细菌表达载体的构建及蛋白表达检测
前期研究中,我们通过RACE技术,获得了2个芥菜型油菜脱水蛋白BjDHN2和BjDHN3(GenBank accession DQ441470, DQ441471)。依据原核表达载体pET30a上的多克隆位点NcoI/SacI,构建pET30a-BjDHN2/3载体,转化大肠杆菌原核表达菌株BL21(DE3)。挑取已经过PCR和双酶切检测的阳性克隆,在5 mL Luria-Bertani (LB) (Kanr) 液体培养基中,37 ℃,220 r·min-1培养过夜。取未转化的菌株和转化空载体的菌株做对照。按1∶100的比例将菌液转移到20 mL LB(Kanr)液体培养基中,37 ℃,220 r·min-1培养3 h后,加入IPTG使其终浓度为1 mol·L-1,继续培养4 h;取菌液2 mL,8 000 r·min-1离心3 min,弃掉上清。然后加入样品溶解液,剧烈涡旋震荡混匀,后在沸水浴中煮15 min,在此期间将试管涡旋混匀1次;后12 000 r·min-1离心5 min,取上清进行SDS-PAGE检测[7]。
1.2原核表达抗性分析
将原核表达载体pET30a质粒转化BL21(DE3),作为外源基因插入pET30a中的重组菌的对照菌株。将对照菌和重组菌分别按1∶100的比例将菌液转移到20 mL LB(Kanr)液体培养基中,37 ℃,220 r·min-1培养3 h后,加入 异丙基-β-D-硫代吡喃半乳糖苷 (IPTG) 至终浓度为1 mol·L-1,继续培养至OD600=0.8,进行下列胁迫实验。
1.2.1抗寒性分析
上述菌液各取2 mL,置于4 ℃中。2 d后取出,接种在LB(Kanr)液体培养基中。37 ℃培养,间隔取样,并用紫外分光光度计测定OD600值,后根据结果绘制生长曲线。
1.2.2抗盐性、抗旱性分析
上述菌液各取2 mL,分别接种于含1 mol·L-1山梨醇、0.8 mol·L-1NaCl的液体LB(Kanr)培养基中(要注意的是,需保证培养物均起始于同样的OD600值)。37 ℃培养,间隔取样,每次1 mL。并用紫外分光光度计测定OD600值,后根据结果绘制生长曲线。
以上胁迫实验均重复3次以上。
2结果与分析
2.1原核表达载体的构建、转化及分子检测
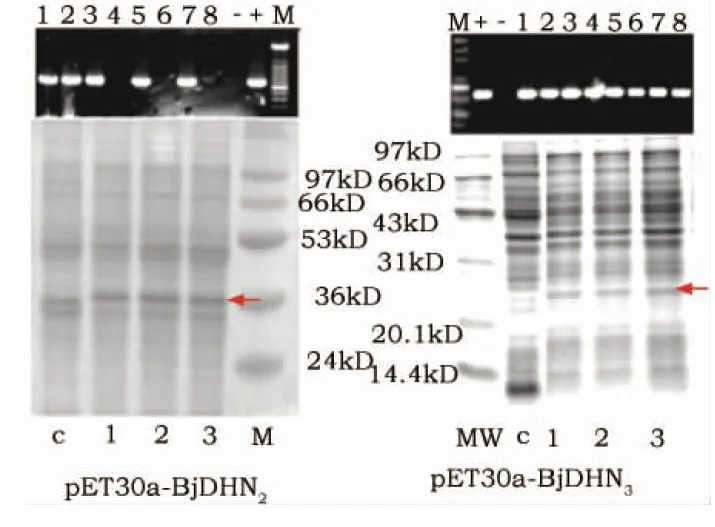
图1 BjDHN2和BjDHN3基因的原核表达Fig.1 Abiotic stress tolerances of transgenic E.coli 注: 细菌转化子的PCR检测和SDS-PAGE分析。Note:(A) colony-PCR (up) and SDS-PAGE (down). Expression of BjDHN2 or BjDHN3 protein in E. coli. M, marker; c, total protein extracts from E. coli with pET30a with Xgalisopropyl thiogalactoside (IPTG) inducing;1, 2, 3, total protein extracts from E. coli with recombinant plasmids with IPTG inducing.
由于植物的细胞内存在蛋白质间的相互作用,如果采用转化植物的方法,难以评价所导入的外源单一基因表达产物是否在提高细胞抗逆性上有直接贡献。为了初步研究BjDHN2和BjDHN3在逆境胁迫中的功能,首先我们构建了相应的原核表达载体pET30a-BjDHN2和pET30a-BjDHN3,并转化大肠杆菌BL21(DE3)。将双酶切鉴定和PCR检测的阳性克隆进行测序,用以确认基因序列以及转化子的准确性(图1)。之后将检测无误的阳性转化子进行12% SDS-PAGE分析。凝胶电泳结果显示,约36 kDa的BjDHN2和约26 kDa的BjDHN3的条带(图1中红色(网络版)箭头所示),这说明所转化的基因在细菌中得到了表达(图1)。随后菌液经100 ℃煮沸10 min后,表达的蛋白仍存在于上清液中,说明BjDHN2和BjDHN3均是热稳定的蛋白。2.2BjDHN2和BjDHN3基因的原核表达抗性分析
在确认了含pET30a-BjDHN2和pET30a-BjDHN3的重组菌可被诱导表达蛋白之后,我们进一步检测了所转化菌株的抗逆能力(图2A,B,C)。在一般情况下,当菌株被转移至高盐溶液、低温和脱水环境中时,其生长会受到一定的抑制。试想如果重组菌中所表达的外源蛋白能够起到抗逆保护的作用,那么将重组菌置于逆境胁迫的培养条件下时,其所呈现的生长抑制现象就会得到一定程度上的缓解。我们将IPTG诱导后的对照菌(含pET30a)和重组菌(含pET30a-BjDHN2以及pET30a-BjDHN3)分别接种于正常的和逆境胁迫的液体LB培养基中培养,然后根据培养时间和菌液浓度绘制生长曲线。

图2 BjDHN2和BjDHN3基因的抗性分析Fig.2 Growth of E. coli cells expressing BjDHN2 or BjDHN3 protein and the control cell under (A) low temperature, (B) 800 mol·L-1 NaCl, and (C) 1 mol·L-1 sorbitol stresses 注:A: 低温胁迫处理;B: 800 mol·L-1 NaCl处理;C: 1 mol·L-1 山梨醇处理Note:Each value represents an average of at least three independent measurements or replicates. Error bars indicate the standard deviations
在正常培养基中,对照菌和重组菌的生长状况基本一致,这一现象说明在重组菌中大量表达的蛋白并未对菌的生长产生不良影响。二者在经过约3 h左右的迟滞期后,进入对数生长期;培养12 h后进入平台期。但是对于在低温胁迫条件下转入空载体的对照菌来说,其生长速度明显降低,迟滞期延长至8 h,而且菌浓也降低。在同样的胁迫条件下,BjDHN2和BjDHN3重组菌的生长状况明显优于对照菌,迟滞期也分别比对照菌缩短3 h和4 h,且菌浓高于空载体对照菌。在对其进行了旱、盐胁迫条件下的实验后,也得到了相似的结果。将重组菌和对照菌转移至含有1 mol·L-1山梨醇或800 mol·L-1NaCl的LB培养基中,经IPTG诱导后发现,空载体对照菌的迟滞期分别延长至19.5 h和16 h。而BjDHN2和BjDHN3重组菌在1 mol·L-1山梨醇胁迫下的迟滞期分别约为6 h和10 h;在NaCl胁迫下的迟滞期分别约为15.5 h和17.5 h。以上实验结果表明,BjDHN2和BjDHN3的表达提高了转化菌抗渗透胁迫的能力,在不同程度上缓解了盐、寒、旱胁迫对细菌生长所产生的抑制作用,其中BjDHN3的抗寒能力略高于BjDHN2,而BjDHN2的抗旱能力稍高于BjDHN3。
3讨论与结论
寒、旱、盐和重金属污染等环境胁迫是限制植物生长发育的主要因素,也是农业生产面临的大敌。这些环境胁迫对植物的伤害通常表现为渗透胁迫、氧化胁迫以及离子伤害。而植物对其进行的应答机制又存在交叉对话或者处于同一个信号途径,有研究发现不同逆境导致的细胞渗透胁迫也具有许多相似性。因此,克隆植物体内多种水分胁迫相关蛋白基因并对其功能进行研究分析,对于改善作物抗逆性以及提高作物的产量具有深远的意义。
本论文分析了重金属超富集植物芥菜型油菜2个脱水蛋白家族基因BjDHN2和BjDHN3原核表达对低温、盐和模拟干旱胁迫的耐受性。BjDHN2和BjDHN3属于酸性蛋白(pI分别为4.93和5.5),均含有1个高度保守的S片段(SSSSSSS)和2个K片段(EKKGIMEKIKEKLPG),是属于SK2型家族的脱水蛋白。研究表明,所有的脱水蛋白均含有K片段,该片断形成兼性α螺旋,为脱水蛋白的亲脂性提供了结构基础,防止蛋白质和膜变性。之前有研究表明,脱水蛋白参与了细胞的渗透调节过程,从而与植物对盐、寒、旱胁迫的耐受性紧密相关[8]。脱水蛋白对细胞渗透调节的潜能可能与其在水分胁迫时的合成有关。Brini et al.[9]发现,不同抗性的小麦品种之间,DHN-5中S区段的磷酸化水平存在显著差异,可以作为小麦抗性种质筛选的标志。迄今为止,人们对脱水蛋白在植物抗性中的分子机制仍不完全了解。表达水平上的分析和蛋白体外研究揭示出5种脱水蛋白具有不同的功能。YnSKn型脱水蛋白是碱性或中性蛋白质,主要受干旱和ABA诱导表达,而对低温不起作用。体外结合实验表明,YnSKn型脱水蛋白能够与含酸性磷脂的脂质小泡相结合。而酸性或中性的YnKn、SKn和Kn型脱水蛋白则优先受到低温诱导。之前有研究表明,在水分缺失的情况下,高亲水性蛋白会普遍存在于真核和原核细胞中[10]。例如在缺水时,高等植物和大肠杆菌都可合成一种LEA类似蛋白-“亲水素”。这说明高等植物与大肠杆菌在一些对逆境胁迫应答的机制上具有相似性,当然那些抗逆相关基因也具有功能保守性和互补性。已有研究表明[11],LEA蛋白在真核细胞和原核生物中可能会采取相似的抗逆保护机制。另外一方面,大肠杆菌具有基因组小、遗传背景简单、生活周期短等特点,因此我们利用大肠杆菌表达体系,将高等植物的基因转入其中进行异源表达,不仅可以用来筛选高等植物抗逆的相关基因,同时也建立了一个用来鉴定逆境相关基因功能的良好系统[12]。所以为了研究BjDHN2和BjDHN3基因的功能,我们构建了原核表达载体pET30a-BjDHN2与pET30a-BjDHN3,并转化大肠杆菌BL21(DE3)。经过PCR检测和SDS-PAGE检测,证明已成功建立了原核表达体系之后,对其进行了原核表达抗性的分析。结果表明,在高盐、低温和干旱条件下,重组菌中因为BjDHN2和BjDHN3蛋白的表达能够在一定程度上缓解盐、寒、旱胁迫对菌生长所产生的抑制作用。在同等的胁迫条件下,重组菌的生长状况明显优于对照菌,迟滞期比对照菌缩短,且菌浓高于对照菌。说明BjDHN2和BjDHN3具有耐寒、旱、盐保护作用。同时也证明了采用大肠杆菌原核表达系统对抗逆相关蛋白进行筛选和功能验证的可行性。
植物在受到逆境胁迫时,会产生一系列应答机制。任何胁迫的次生胁迫都是渗透胁迫和氧化胁迫。因此,应答机制也就分为渗透调节和渗透保护。前者主要负责对于低水势的平衡,控制水分流动,防止细胞失水。如常见的几种无机离子、一些有机小分子溶质、氨基酸、小肽和蛋白质等,用以维持细胞的正常渗透压。后者主要作用在于对细胞内部结构的保护,如抗氧化保护酶、一些修复蛋白、运载蛋白和螯合蛋白,对逆境胁迫造成的伤害进行修复和解毒。脱水蛋白是植物体中一种重要的胁迫响应物质,其主要作用在于渗透保护。因为在渗透调节中,对细胞水势的影响最终是由渗透调节物质决定的。大量结果表明,胁迫产生后,植物营养器官中渗透调节物质会在短时间内有大量的增加,例如几种无机离子能在数小时内迅速达到最大浓度。一旦胁迫终止,渗透调节物质也会有所减少,如无机离子、甜菜碱、可溶性糖等。一些无机离子在胁迫前后浓度差异可达倍级甚至数量级的变化。而脱水蛋白在胁迫开始的短时间内不会很快达到最高浓度,一般是在胁迫后的3~4 d内达到最大值,并且在胁迫终止后不会很快的降低浓度。
通过对BjDHN2和BjDHN3的原核表达功能分析,我们认为,BjDHN2和BjDHN3可能做为渗透保护物质,防止细胞内水分流失,从而提高了植物对各种非生物胁迫的耐性。
参考文献
[1]Thomashow MF. Plant cold acclimation, Freezing tolerance genes and regulatory mechanisms[J]. Annu Rev Plant Physiol Plant Mol Biol, 1999, 50:571-599.
[2]Zhang Y, Li J, Yu F, et al. Cloning and expression analysis of SKn-type dehydrin gene from bean in response to heavy metals[J]. Mol Biotechnol, 2006, 32(3):205-218.
[3]Timothy J. Close, Dehydrins: emergence of a biochemical role of a family of plant dehydration proteins[J]. Plant Physiol, 1996, 97(4):795-803.
[4]Dure L Ⅲ. A repeating 11-mer amino acid motif and plant desiccation[J]. Plant J, 1993, 3(3):363-369.
[5]Lan Y, Cai D, Zheng Y. Expression in Escherichia coli of Three Different Soybean Late Embryogenesis Abundant (LEA) Genes to Investigate Enhanced Stress Tolerance[J]. J Integr Plant Biol, 2005, 47(5):613-621.
[6]Zhang L, Ohta A, Takagi M, et al. Expression of plant group 2 and group 3 lea genes in Saccharomyces cerevisiae revealed functional divergence among LEA proteins[J]. J Biochem, 2000, 127(4):611-616.
[7]Sambrook J, Russell D W. Molecular Cloning: A Laboratory Manual[M]. NY: Cold Spring Harbor Laboratory Press, Cold Spring Harbor, 2001:10-545.
[8]Swire-Clark G, A Marcotte, W R. The wheat LEA protein Em functions as an osmoprotective molecule in Saccahromyces cerevisiae[J]. Plant Molecular Biology, 1999, 39(1):117-128.
[9] Faïçal Brini, Moez Hanin, Imed Mezghani, et al. Berkowitz and Khaled Masmoudi. Overexpression of wheat Na+/H+antiporter TNHX1and H+-pyrophosphataseTVP1improve salt-and drought-stress tolerance inArabidopsisthalianaplants[J]. J Exp Bot, 2007, 58(2):301-308.
[10]Xu D, Duan X, Wang B. Expression of a late embryogenesis abundant protein gene HVA1, from barley confers tolerance to water deficit and salt stress in transgenic rice[J]. Plant Physiol, 1996, 110(1):249-257.
[11]Lan Y, Cai D, Zheng YZ. Expression in Escherichia coli of three different soybean late embryogenesis abundant (LEA) genes to investigate enhanced stress tolerance[J]. J Integr Plant Biol, 2005, 47(5):613-621.
[12]Gowrishankar J. Identification of osmoresponsive genes in Escherichia coli: Evidence for participation of potassium and praline transport systms in osmoregulation[J]. J Biochem, 1985, 164(1):434-445.
(编辑:邢国芳)
Expression ofBrassicajunceaSK2-type dehydrin gene enhances stress tolerance inEscherichiacoli
Sun Yahui1, Luo Guihua1, Chai Tuanyao2, Wang Huichun1,Xu Jin1,3*
(1.CollegeofLifeScienceandGeography,QinghaiNormalUniversity,Xining810008,China; 2.CollegeofBiologicalScience,UniversityofChineseAcademyofSciences,Beijing100049,China; 3.KeyLaboratoryofTropicalPlantResourcesandSustainableUse,XishuangbannaTropicalBotanicalGarden,ChineseAcademyofSciences,Menglun666303,China)
Abstract:To elucidate the contribution of BjDHN2/3 to abiotic stress tolerance, the prokaryotic expression vector pET30a-BjDHN2/3 was constructed and then transferred into E. coli strain BL21.Compared with control strain containing the empty vector without BjDHN2/3 gene, E. coli expressing the BjDHN2/3 show improved tolerance when exposed to cold, drought and NaCl. The results indicated the overexpressing BjDHN2/3 directly contributed to enhancing tolerance of transgenic E. coli under stress conditions.
Key words:Brassica juncea; Dehydrin; Escherichia coli; Stress tolerance
中图分类号:Q71
文献标识码:A
文章编号:1671-8151(2016)04-0257-05
作者简介:孙雅慧(1991-),女(汉),山西临汾人,硕士研究生,研究方向:植物分子生物学*通讯作者:徐进,研究员。Tel:0871-65140420,E-mail: xujin@xtbg.ac.cn
收稿日期:2015-10-29修回日期:2016-01-08

