PET乏氧显像在预测肿瘤乏氧及指导临床治疗中的应用进展
许飞 刘建军 黄钢 宋少莉
200127,上海交通大学医学院附属仁济医院核医学科
·综述·
PET乏氧显像在预测肿瘤乏氧及指导临床治疗中的应用进展
许飞 刘建军 黄钢 宋少莉
200127,上海交通大学医学院附属仁济医院核医学科
放射性核素标记的乏氧显像是评估肿瘤乏氧程度的重要方法,乏氧显像剂可以选择性地滞留于乏氧组织内,直观反映乏氧的部位和乏氧的程度,对肿瘤诊断、分期、疗效监测及预后评估等有指导意义,同时也为临床选择及调整肿瘤治疗方案提供了客观依据。笔者主要对肿瘤乏氧PET显像近年来在临床研究中的进展及与肿瘤乏氧相关的治疗进展进行综述。
肿瘤;正电子发射断层显像术;乏氧
Fund program:National Natural Science Foundation of China(NSFC8141708)
乏氧是实体瘤的一个重要生物学特征,肿瘤乏氧往往提示预后不良。处于乏氧状态的肿瘤可以产生一系列生理生化改变,刺激活性氧自由基的生成,从而促进缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)的产生,进一步使肿瘤表达更多有利于其进展和侵袭的基因,如血管内皮生长因子、细胞球蛋白和环氧合酶2等,促进肿瘤细胞的分裂、肿瘤间质血管的生成,并抑制肿瘤细胞凋亡,从而提高肿瘤侵袭转移的能力和对放化疗的耐受力[1]。放射性核素标记的乏氧显像能在活体水平上整体、无创地评价肿瘤的乏氧程度,在多种肿瘤诊断、分期、疗效监测及预后评估等方面有广阔的应用前景,也为临床选择及调整合理的肿瘤治疗方案提供了客观依据。本文就乏氧PET显像在肿瘤临床研究中的应用进展及与肿瘤乏氧相关的治疗进展进行综述。
1 肿瘤乏氧的定义与成因
大多数实体瘤存在乏氧区甚至缺氧区,通常将乏氧区定义为肿瘤组织内氧分压(pO2)≤10 mmHg的区域。氧分压低对正常细胞来说是有害的,而肿瘤细胞可以通过调节自身基因的表达,适应这种乏氧的环境[2]。
肿瘤乏氧的成因一般分为3种:①血液灌注不足所导致的急性乏氧,常见于短暂性的血管痉挛以及间质压力增高导致的血管受压;②肿瘤生长的速度与血管生成的速度不平衡,导致血管与肿瘤的距离超过氧分子的有效弥散距离;③放化疗引起的骨髓抑制以及肿瘤恶病质导致的贫血,使血液携氧能力下降。相比较而言,难以预测急性乏氧发生的部位及持续的时间,而慢性乏氧几乎都处于肿瘤的中心部位[3]。
2 肿瘤乏氧的诊断
目前诊断乏氧的方法可分成3种:①直接测定肿瘤内的氧浓度,如氧电极、磷光淬灭、电子顺磁共振等;②检测乏氧导致异常表达的胞内分子,如HIF-1α、骨桥蛋白等;③检测乏氧引起的生理学变化,如近红外光谱、光声成像、乏氧PET显像等[4]。诊断乏氧的金标准是极谱电极法,将微电极插入肿瘤内部,氧分子在铂电极上被还原,产生电势,而其与标准电极的电势差即可直接反映氧分子的含量,即肿瘤内部的氧供状态,每个电极所能涵盖的范围约50~100个细胞。这是一种有创的诊断方法,且只能反映局部的氧供情况,缺乏对肿瘤整体氧供状态的评估[5]。
利用放射性核素标记的乏氧显像剂在活体内对乏氧区进行动态显像,是评估肿瘤乏氧的常用方法。乏氧显像剂可以选择性地被乏氧组织摄取并滞留其中,而正常组织对其摄取较少。通常将乏氧显像剂分为硝基咪唑类(图1)和非硝基咪唑类,前者被细胞摄取后,其分子中的硝基(-NO2)在硝基还原酶的作用下被还原成羟胺基(-NHOH),当氧浓度正常时,该反应可逆,而在乏氧环境中,羟胺基多与胞内大分子结合,滞留于胞内[6]。常用的硝基咪唑类乏氧显像剂有18F-fluoromisonidazole(18FFMISO)、18F-fluoroazomycin arabinoside(18F-FAZA)、18F-fluoroerythronitroimidazole(18F-FETNIM)、18F-2-nitroimidazol-pentafluoropropyl acetamide(18F-EF5)、18F-2-nitroimidazol-trifluoropropyl acetamide(18F-EF3)等。而非硝基咪唑类乏氧显像剂如60Cu-labeled methylthiosemicarbazone(62Cu-ATSM)、 Iodine-124-labelled antibody chimeric G250(124I-cG250)等(图2)也是近年来研究的热点[7]。
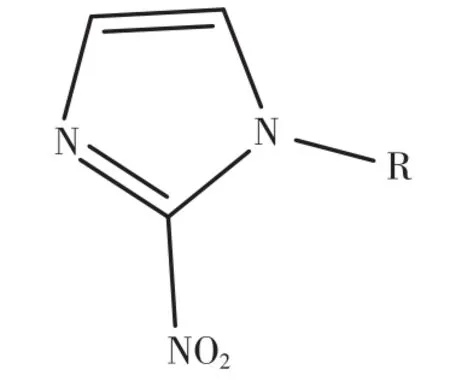
图1 硝基咪唑类乏氧显像剂的基本结构Fig.1 Structure of nitroimidazole hypoxia tracer
PET肿瘤乏氧显像相比其他肿瘤乏氧诊断方法具有以下优点:可根据不同的显像需求选择最适合的乏氧显像剂;所得图像分辨率高,组织结构清晰;能对肿瘤进行三维重建,对治疗计划的确定及实施有指导意义;可通过后续的计算对显像结果进行半定量及定量分析,便于病情评估;创伤小,易于被患者接受等[8]。
用于描述乏氧病灶摄取显像剂多少的指标包括SUV、肿瘤/血浆比值(the ratio of tumor to blood,T/ B)、肿瘤/肌肉比值(the ratio of tumor to muscle,T/ M)以及乏氧体积比。其中,乏氧体积比是PET图像中,T/B或T/M高于阈值(常为1.2~1.4)的像素所占的比例,乏氧体积比需要选取肿瘤确切边缘计算出的肿瘤体积作分母,而且会受到肿瘤坏死区大小的影响。
3 肿瘤乏氧PET显像常用的显像剂
18F-FMISO是应用最多的硝基咪唑类乏氧显像剂,从1986年至今,广泛的临床试验足以证明其可靠性。18F-FMISO脂溶性较高,可以快速在组织中扩散并穿过细胞膜;而由于脂溶性较高,18FFMISO在氧含量正常的组织及血液中清除较慢,对比度不佳,影响成像质量。另外,18F-FMISO在体内代谢较快,不利于后期成像[8]。
18F-FAZA是一类新型的硝基咪唑类乏氧显像剂,其脂溶性比18F-FMISO弱,因而灌注与清除的速度都比18F-FMISO快。乏氧组织与非乏氧组织对18F-FAZA的摄取量有明显的差异,对比度好,在非乏氧组织中清除快[9],显像更清晰。注射后2 h显像,18F-FAZA的T/M和T/B均高于18F-FMISO[10]。
18F-EF5是一种脂溶性较高的硝基咪唑类乏氧显像剂,其半衰期约7.5~10 h。18F-EF5经静脉注射后能快速分布于全身各个器官,对颅脑肿瘤的乏氧显像有特定的优势,有多个18F的标记位点,显像效果好。除此以外,18F-EF5性质非常稳定,也是目前研究的热门显像剂之一[4]。
Cu-ATSM(图3)是一类常用的非硝基咪唑类乏氧显像剂,不同的核素Cu有不同的半衰期。乏氧细胞对62Cu-ATSM的摄取量为氧含量正常细胞的3倍,与18F-FMISO相比,62Cu-ATSM在肿瘤组织内的浓集速度快,细胞摄取率高,且从正常氧合组织中清除的速率快。62Cu-ATSM成像所需的时间比硝基咪唑类乏氧显像剂短,注射后30 min即可进行显像,其合成也较简单,是一种极具潜力的PET肿瘤乏氧显像剂[7]。

图2 常用的硝基咪唑类乏氧显像剂 图中,18F-FETA:18F-fluoroetanidazole;18F-FENI:(18F-fluoro-1-(hydroxymethyl)-ethoxy)methyl-2-nitroimidazole;18F-FMISO:18F-fluoromisonidazole;18F-EF1:18F-2-nitroimidazol-unifluoropropyl acetamide;18F-FAZA:18F-fluoroazomycin arabinoside;18F-FETNIM:18F-fluoroerythronitroimidazole;18F-EF3:18F-2-nitroimidazol-trifluoropropyl acetamide;18F-HX4:18F-flortanidazole;18F-EF5:18F-2-nitroimidazol-pentafluoropropyl acetamide。Fig.2 Nitroimidazolehypoxia tracer grouped by parent radiosensitizers

图3 Cu-ATSM的结构Fig.3 Structure of Cu-labeled methylthiosemicarbazone
4 肿瘤乏氧PET显像在临床中的应用
Thomlinson和Gray[11]在首次发现恶性肿瘤中存在乏氧细胞与氧含量正常的细胞后,进一步的研究表明乏氧细胞对放化疗的抵抗力和耐受力明显高于氧含量正常的细胞,同时还发现,乏氧细胞修复辐射所致DNA损伤的速度变慢,DNA修复机制与细胞凋亡信号通路也发生改变,产生放疗抵抗的细胞表型[12]。因此,诊断肿瘤乏氧对预后的判断及后续的治疗方案的选择有重要的价值。
4.1 乏氧显像在头颈部肿瘤中的临床应用
头颈部肿瘤的乏氧显像是研究的重点,头颈部肿瘤原发部位多变、病理类型差别大,同时,头颈部重要器官比较集中,解剖关系复杂,乏氧显像对于头颈部肿瘤的评估有重要意义。近年来,国内外学者对乏氧显像在头颈部肿瘤中的临床应用的研究见表1。
4.2 乏氧显像在肺癌中的临床应用
肺癌是最常见的肺原发性恶性肿瘤,近年来,世界各国特别是工业发达国家肺癌的发病率和病死率均迅速上升,死于癌症的男性患者中肺癌已居首位。对于肺癌患者,尤其是对进展期肺癌患者而言,放化疗是必要的治疗手段,而肿瘤乏氧引起的放化疗抵抗给治疗带来了很多困难,及早判断肿瘤乏氧对于肺癌患者治疗方案的确定以及预后的判断有重要意义。近年来,国内外学者对乏氧显像在肺癌中的临床应用的研究见表2。

表1 乏氧显像在头颈部肿瘤中的临床应用Table 1 Clinical hypoxia studies with PET in head and neck cancer

表2 乏氧显像在肺癌中的临床应用Table 2 Clinical hypoxia studies with PET in lung cancer
4.3 乏氧显像在胶质瘤中的临床应用
胶质瘤是发生于神经外胚层的肿瘤,故亦称神经外胚层肿瘤或神经上皮肿瘤。神经胶质瘤的病程依其病理类型和所在部位长短不一,恶性程度高的和后颅窝肿瘤病程多较短,较良性的肿瘤或位于所谓静区的肿瘤病程多较长。乏氧显像对肿瘤恶性程度的判断有很高的价值,可以指导进一步的治疗。近年来,国内外学者对乏氧显像在胶质瘤中的临床应用的研究见表3。

表3 乏氧显像在胶质瘤中的临床应用Table 3 Clinical hypoxia studies with PET in glioblastoma
4.4 乏氧显像在宫颈癌中的临床应用
宫颈癌在世界各地都有发生,是人类最常见的恶性肿瘤之一,其发病率在女性生殖器官恶性肿瘤中占首位。放化疗是治疗宫颈癌的重要手段,及早判断肿瘤乏氧程度,选择合适的治疗方案,对患者的预后有很大帮助。近年来,国内外学者对乏氧显像在宫颈癌中的临床应用的研究见表4。

表4 乏氧显像在宫颈癌中的临床应用Table 4 Clinical hypoxia studies with PET in cervical cancer
4.5 乏氧显像在其他肿瘤中的临床应用
除了上述肿瘤外,尚有关于其他肿瘤乏氧显像的临床研究,如乳腺癌、间叶组织肿瘤、胰腺癌等。诸多PET乏氧显像临床研究表明:肿瘤乏氧程度与患者生存率呈负相关,原发灶乏氧程度高的患者局部控制率低,预后差;乏氧与肿瘤的复发和转移密切相关,乏氧程度越高的病灶,更易复发及转移[2]。近年来,国内外学者对乏氧显像在其他肿瘤中的临床应用的研究见表5。
综上,肿瘤乏氧PET显像对肿瘤是否乏氧及乏氧程度的轻重作出正确判断,对于评估病情、判断预后及制定合适的治疗方案都有指导作用。在乏氧肿瘤治疗的过程中,乏氧PET显像也是监测疗效、判断肿瘤转归的理想手段。但对于乏氧显像标准化的实施,仍需进行深入的研究。总之,肿瘤乏氧PET显像具有重要的临床应用价值和广阔的应用前景。
5 乏氧显像与乏氧肿瘤的治疗
肿瘤乏氧为治疗带来了很多困难,包括放疗抵抗、易复发和转移以及凋亡抑制等,在乏氧显像的帮助下,出现了很多新的治疗乏氧肿瘤的理念及治疗方案。
5.1 根据乏氧显像制定放疗计划
IMRT是根据肿瘤的解剖学形态及乏氧区域的分布精确调节放疗的剂量。肿瘤放疗前,通过PET乏氧显像对肿瘤进行评估,以明确乏氧区的体积大小以及精确定位,进一步制定详细的放疗计划。在治疗过程中,部分乏氧肿瘤可发生再氧化,乏氧显像是监测IMRT疗效的重要指标,也可根据乏氧显像结果及患者的个体情况,及时对放疗剂量及部位作适当的调整,加强对乏氧肿瘤的放疗剂量,尽可能减少对正常组织的电离损伤,使放疗效益最大化[37]。在非小细胞肺癌及头颈部肿瘤的治疗中,IMRT已有充分的临床应用[38-39]。
5.2 增加乏氧肿瘤细胞的氧供
Maier等[40]研究了不同氧供条件下肿瘤对18FFAZA的摄取情况,结果表明肿瘤对18F-FAZA的摄取与排泄均与氧供情况有关,减少供氧量时,肿瘤对18F-FAZA的摄取升高,而肌肉组织对18F-FAZA的清除则不受氧供条件的影响。PET乏氧显像可及时对肿瘤的乏氧程度作出评估,增加乏氧肿瘤细胞的氧供以改善乏氧肿瘤细胞的氧合状态,提高乏氧肿瘤对治疗的敏感性,改善预后。Cheng等[41]的研究也表明,增加肿瘤细胞的氧供可以抑制乏氧肿瘤的快速生长,改善肿瘤预后。
5.3 根据乏氧显像筛选出需要使用放射增敏剂的患者
对乏氧显像剂有较高摄取的肿瘤,可使用放射增敏剂增加乏氧肿瘤对放疗的敏感性,促进肿瘤再氧化,提高肿瘤的局部控制率。目前研究较多的放射增敏剂是米索硝唑,但其溶解性较差,治疗剂量的米索硝唑即可引起周围神经病变,这是限制临床试验推广的重要原因[42]。Overgaard等[12]的研究表明,新型放射增敏剂尼莫拉唑对于乏氧肿瘤的局部控制及远期预后都有帮助,尼莫拉唑有望成为乏氧肿瘤治疗的新热点。Hassan Metwally等[43]的研究表明尼莫拉唑联合加速放疗能改善头颈部乏氧肿瘤的预后。

表5 乏氧显像在其他肿瘤中的临床应用Table 5 Clinical hypoxia studies with PET in other tumours
5.4 根据乏氧显像筛选出需要使用乏氧细胞毒素的患者
乏氧是肿瘤治疗中的一大难题,但乏氧细胞毒素对乏氧细胞有靶向性的杀伤作用。对乏氧显像剂有较高摄取的肿瘤,除了常规的治疗手段以外,还可以联合使用乏氧细胞毒素,提高乏氧肿瘤的局部控制率,改善远期预后。替拉扎明是最早发现的乏氧细胞毒素,它在细胞内可被还原形成阴离子自由基,在O2存在下,可逆地氧化为无毒化合物,而在O2缺乏的细胞中,阴离子自由基则可进一步消除水,形成毒性更大的羟基自由基,从而干扰乏氧肿瘤细胞的胞内代谢[44]。临床试验已经表明替拉扎明联合放疗可改善头颈部肿瘤以及非小细胞肺癌患者的局部控制率及生存率[45-46]。
6 展望
肿瘤乏氧PET显像在实体瘤的诊断、治疗方案的指导、疗效的检测以及预后的评价等方面有其不可替代的优越性,随着国内外学者对乏氧显像剂及核医学技术的不断深入研究和拓展,肿瘤乏氧PET显像定会发挥越来越重要的作用。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 许飞负责论文撰写;刘建军、黄钢、宋少莉负责论文指导和审校。
[1]Hielscher A,Gerecht S.Hypoxia and free radicals:Role in tumor progression and the use of engineering-based platforms to address these relationships[J].Free Radic Biol Med,2015,79:281-291. DOI:10.1016/j.freeradbiomed.2014.09.015.
[2]Halmos GB,Bruine de Bruin L,Langendijk JA,et al.Head and neck tumor hypoxia imaging by18F-fluoroazomycin-arabinoside(18FFAZA)-PET:a review[J].Clin Nucl Med,2014,39(1):44-48. DOI:10.1097/RLU.0000000000000286.
[3]Padhani AR.Where are we with imaging oxygenation in human tumours?[J].Cancer Imaging,2005,5:128-130.DOI:10.1102/ 1470-7330.2005.0103.
[4]Vaupel P,Mayer A.The clinical importance of assessing tumor hypoxia:Relationship of tumor hypoxia to prognosis and therapeutic opportunities[J].Antioxid Redox Signal,2015,22(10):878-880. DOI:10.1089/ars.2014.6155.
[5]Carreau A,El Hafny-Rahbi B,Matejuk A,et al.Why is the partial oxygen pressure of human tissues a crucial parameter?Small molecules and hypoxia[J].J Cell Mol Med,2011,15(6):1239-1253.DOI:10.1111/j.1582-4934.2011.01258.x.
[6]Bourgeois M,Rajerison H,Guerard F,et al.Contribution of[64cu]-atsm pet in molecular imaging of tumour hypoxia compared to classical[18f]-miso—a selected review[J].Nucl Med Rev Cent East Eur, 2011,14(2):90-95.DOI:10.5603/NMR.2011.00022.
[7]Marcu LG,Harriss-Phillips WM,Filip SM.Hypoxia in head and neck cancer in theory and practice:A pet-based imaging approach [J/OL].Comput Math Methods Med,2014,2014:624642[2015-09-09].http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4158154. DOI:10.1155/2014/624642.
[8]Garcia C,Flamen P.Role of positron emission tomography in the management of head and neck cancer in the molecular therapy era [J].Curr Opin Oncol,2008,20(3):275-279.DOI:10.1097/CCO. 0b013e3282faa0cb.
[9]Kumar P,Ohkura K,Beiki D,et al.Synthesis of 1-beta-D-(5-deoxy-5-iodoarabinofuranosyl)-2-nitroimidazole(beta-IAZA):A novel marker of tissue hypoxia[J].Chem Pharm Bull(Tokyo),2003, 51(4):399-403.DOI:10.1248/cpb.51.399.
[10]Souvatzoglou M,Grosu AL,Röper B,et al.Tumour hypoxia imaging with[18F]FAZA PET in head and neck cancer patients:a pilot study[J].Eur J Nucl Med Mol Imaging,2007,34(10):1566-1575.DOI:10.1007/s00259-007-0424-3.
[11]Thomlinson RH,Gray LH.The histological structure of some human lung cancers and the possible implications for radiotherapy[J]. Br J Cancer,1955,9(4):539-549.
[12]Overgaard J,Hansen HS,Overgaard M,et al.A randomized doubleblind phase III study of nimorazole as a hypoxic radiosensitizer of primary radiotherapy in supraglottic larynx and pharynx carcinoma. Results of the Danish Head and Neck Cancer Study(DAHANCA)Protocol 5-85[J].Radiother Oncol,1998,46(2):135-146.DOI: 10.1016/S0167-8140(97)00220-X.
[13]Abolmaali N,Haase R,Koch A,et al.Two or four hour[18F]FMISOPET in HNSCC.When is the contrast best?[J].Nuklearmedizin, 2011,50(1):22-27.DOI:10.3413/nukmed-00328-10-07.
[14]Kikuchi M,Yamane T,Shinohara S,et al.18F-fluoromisonidazole positron emission tomography before treatment is a predictor of radiotherapy outcome and survival prognosis in patients with head and neck squamous cell carcinoma[J].Ann Nucl Med,2011,25(9):625-633.DOI:10.1007/s12149-011-0508-9.
[15]Yamane T,Kikuchi M,Shinohara S,et al.Reduction of[18F]fluoromisonidazole uptake after neoadjuvant chemotherapy for headand neck squamous cell carcinoma[J].Mol Imaging Biol,2011,13(2):227-231.DOI:10.1007/s11307-010-0365-2.
[16]Sato J,Kitagawa Y,Yamazaki Y,et al.18F-fluoromisonidazole PET uptake is correlated with hypoxia-inducible factor-1α expression in oral squamous cell carcinoma[J].J Nucl Med,2013,54(7):1060-1065.DOI:10.2967/jnumed.112.114355.
[17]Okamoto S,Shiga T,Uchiyama Y,et al.Lung uptake on I-131 therapy and short-term outcome in patients with lung metastasis from differentiated thyroid cancer[J].Ann Nucl Med,2014,28(2):81-87.DOI:10.1007/s12149-013-0781-x.
[18]Mortensen LS,Buus S,Nordsmark M,et al.Identifying hypoxia in human tumors:A correlation study between18F-FMISO PET and the Eppendorf oxygen-sensitive electrode[J].Acta Oncol,2010,49(7):934-940.DOI:10.3109/0284186X.2010.516274.
[19]Mortensen LS,Johansen J,Kallehauge J,et al.Faza PET/CT hypoxia imaging in patients with squamous cell carcinoma of the head and neck treated with radiotherapy:results from the DAHANCA 24 trial[J].Radiother Oncol,2012,105(1):14-20.DOI:10. 1016/j.radonc.2012.09.015.
[20]Minagawa Y,Shizukuishi K,Koike I,et al.Assessment of tumor hypoxia by62Cu-ATSM PET/CT as a predictor of response in head and neck cancer:a pilot study[J].Ann Nucl Med,2011,25(5):339-345.DOI:10.1007/s12149-011-0471-5.
[21]Vera P,Bohn P,Edet-Sanson A,et al.Simultaneous positron emission tomography(PET)assessment of metabolism with18F-fluoro-2-deoxy-d-glucose(FDG),proliferation with18F-fluoro-thymidine(FLT),and hypoxia with18fluoro-misonidazole(F-miso)before and during radiotherapy in patients with non-small-cell lung cancer(NSCLC):a pilot study[J].Radiother Oncol,2011,98(1):109-116.DOI:10.1016/j.radonc.2010.10.011.
[22]Thureau S,Chaumet-Riffaud P,Modzelewski R,et al.Interobserver agreement of qualitative analysis and tumor delineation of18F-fluoromisonidazole and 3′-deoxy-3′-18F-fluorothymidine PET images in lung cancer[J].J Nucl Med,2013,54(9):1543-1550.DOI:10. 2967/jnumed.112.118083.
[23]Bollineni VR,Kerner GS,Pruim J,et al.PET imaging of tumor hypoxia using18F-fluoroazomycin arabinoside in stage III-IV nonsmall cell lung cancer patients[J].J Nucl Med,2013,54(8):1175-1180.DOI:10.2967/jnumed.112.115014.
[24]Trinkaus ME,Blum R,Rischin D,et al.Imaging of hypoxia with18F-FAZA PET in patients with locally advanced non-small cell lung cancer treated with definitive chemoradiotherapy[J].J Med Imaging Radiat Oncol,2013,57(4):475-481.DOI:10.1111/ 1754-9485.12086.
[25]Hu M,Xing L,Mu D,et al.Hypoxia imaging with18F-fluoroerythronitroimidazole integrated PET/CT and immunohistochemical studies in non-small cell lung cancer[J].Clin Nucl Med,2013,38(8):591-596.DOI:10.1097/RLU.0b013e318279fd3d.
[26]Li L,Hu M,Zhu H,et al.Comparison of18F-Fluoroerythronitroimidazole and18f-fluorodeoxyglucose positron emission tomography and prognostic value in locally advanced non-small-cell lung cancer[J]. Clin Lung Cancer,2010,11(5):335-340.DOI:10.3816/CLC. 2010.n.042.
[27]Zegers CM,Van Elmpt W,Wierts R,et al.Hypoxia imaging with [18F]HX4 PET in NSCLC patients:defining optimal imaging parameters[J].Radiother Oncol,2013,109(1):58-64.DOI:10. 1016/j.radonc.2013.08.031.
[28]Shibahara I,Kumabe T,Kanamori M,et al.Imaging of hypoxic lesions in patients with gliomas by using positron emission tomography with 1-(2-[18F]fluoro-1-[hydroxymethyl]ethoxy)methyl-2-nitroimidazole,a new18F-labeled 2-nitroimidazole analog[J].J Neurosurg,2010,113(2):358-368.DOI:10.3171/2009.10.JNS09510.
[29]Beppu T,Terasaki K,Sasaki T,et al.Standardized uptake value in high uptake area on positron emission tomography with18F-FRP170 as a hypoxic cell tracer correlates with intratumoral Oxygen pressure in glioblastoma[J].Mol Imaging Biol,2014,16(1):127-135. DOI:10.1007/s11307-013-0670-7.
[30]Schuetz M,Schmid MP,Pötter R,et al.Evaluating repetitive18F-fluoroazomycin-arabinoside(18FAZA)PET in the setting of MRI guided adaptive radiotherapy in cervical cancer[J].Acta Oncol, 2010,49(7):941-947.DOI:10.3109/0284186X.2010.510145.
[31]Vercellino L,Groheux D,Thoury A,et al.Hypoxia imaging of uterine cervix carcinoma with18F-FETNIM PET/CT[J].Clin Nucl Med, 2012,37(11):1065-1068.DOI:10.1097/RLU.0b013e3182638e7e.
[32]Cheng J,Lei L,Xu J,et al.18F-fluoromisonidazole PET/CT:a potential tool for predicting primary endocrine therapy resistance in breast cancer[J].J Nucl Med,2013,54(3):333-340.DOI:10. 2967/jnumed.112.111963.
[33]Segard T,Robins PD,Yusoff IF,et al.Detection of hypoxia with18F-fluoromisonidazole(18F-FMISO)PET/CT in suspected or proven pancreatic cancer[J].Clin Nucl Med,2013,38(1):1-6.DOI:10. 1097/RLU.0b013e3182708777.
[34]Hugonnet F,Fournier L,Medioni J,et al.Metastatic renal cell carcinoma:relationship between initial metastasis hypoxia,change after 1 month′s sunitinib,and therapeutic response:an18F-fluoromisonidazole PET/CT study[J].J Nucl Med,2011,52(7):1048-1055.DOI:10.2967/jnumed.110.084517.
[35]Havelund BM,Holdgaard PC,Rafaelsen SR,et al.Tumour hypoxia imaging with18F-fluoroazomycinarabinofuranoside PET/CT in patients with locally advanced rectal cancer[J].Nucl Med Commun, 2013,34(2):155-161.DOI:10.1097/MNM.0b013e32835bd5bc.
[36]Yue J,Yang Y,Cabrera AR,et al.Measuring tumor hypoxia with18F-FETNIM PET in esophageal squamous cell carcinoma:a pilot clinical study[J].Dis Esophagus,2012,25(1):54-61.DOI:10. 1111/j.1442-2050.2011.01209.x.
[37]Staffurth J,Radiotherapy Development Board.A review of the clinical evidence for intensity-modulated radiotherapy[J].Clin Oncol(R Coll Radiol),2010,22(8):643-657.DOI:10.1016/j.clon. 2010.06.013.
[38]Welsh L,Panek R,McQuaid D,et al.Prospective,longitudinal, multi-modal functional imaging for radical chemo-IMRT treatment of locally advanced head and neck cancer:the INSIGHT study[J]. RadiatOncol,2015,10:112.DOI:10.1186/s13014-015-0415-7.
[39]Fleckenstein J,Kremp K,Kremp S,et al.IMRT and 3D conformalradiotherapy with or without elective nodal irradiation in locally advanced NSCLC:A direct comparison of PET-based treatment planning[J/OL].Strahlenther Onkol,2015[2015-09-09].http:// link.springer.com/article/10.1007%2Fs00066-015-0900-9.[published online ahead of print Oct 5,2015].DOI:10.1007/s00066-015-0900-9.
[40]Maier FC,Kneilling M,Reischl G,et al.Significant impact of different oxygen breathing conditions on noninvasive in vivo tumor-hypoxia imaging using[18F]-fluoro-azomycinarabino-furanoside([18F] FAZA)[J/OL].Radiat Oncol,2011,6:165[2015-09-09].http:// www.ro-journal.com/content/6/1/165.DOI:10.1186/1748-717X-6-165.
[41]Cheng Y,Cheng H,Jiang C,et al.Perfluorocarbon nanoparticles enhance reactive oxygen levels and tumour growth inhibition in photodynamic therapy[J/OL].Nat Commun,2015,6:8785[2015-09-09].http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4659941. DOI:10.1038/ncomms9785.
[42]Simpson JR,Bauer M,Perez CA,et al.Radiation therapy alone or combined with misonidazole in the treatment of locally advanced non-oat cell lung cancer:Report of an rtog prospective randomized trial[J].Int J Radiat Oncol Biol Phys,1989,16(6):1483-1491. DOI:10.1016/0360-3016(89)90953-X.
[43]Hassan Metwally MA,Ali R,Kuddu M,et al.IAEA-HypoX.A randomized multicenter study of the hypoxic radiosensitizer nimorazole concomitant with accelerated radiotherapy in head and neck squamous cell carcinoma[J].Radiother Oncol,2015,116(1):15-20. DOI:10.1016/j.radonc.2015.04.005.
[44]Zagorevskii D,Song M,Breneman C,et al.A mass spectrometry study of tirapazamine and its metabolites.insights into the mechanism of metabolic transformations and the characterization of reaction intermediates[J].J Am Soc Mass Spectrom,2003,14(8):881-892.DOI:10.1016/S1044-0305(03)00334-9.
[45]von Pawel J,von Roemeling R,Gatzemeier U,et al.Tirapazamine plus cisplatin versus cisplatin in advanced non-small-cell lung cancer:A report of the international CATAPULT I study group. Cisplatin and Tirapazamine in Subjects with Advanced Previously Untreated Non-Small-Cell Lung Tumors[J].J Clin Oncol,2000,18(6):1351-1359.
[46]Rischin D,Peters L,Fisher R,et al.Tirapazamine,Cisplatin,and Radiation versus Fluorouracil,Cisplatin,and Radiation in patients with locally advanced head and neck cancer:a randomized phaseⅡtrial of the Trans-Tasman Radiation Oncology Group(TROG 98. 02)[J].J Clin Oncol,2005,23(1):79-87.DOI:10.1200/JCO. 2005.01.072.
The application of hypoxia imaging with PET in predicting tumor hypoxia and guiding clinical therapy
Xu Fei,Liu Jianjun,Huang Gang,Song Shaoli
Department of Nuclear Medicine,Renji Hospital,School of Medicine,Shanghai Jiao Tong University, Shanghai 200127,China
Song Shaoli,Email:shaoli-song@163.com
Assessing tumor hypoxia with metabolic imaging is an attractive alternative.Hypoxia tracers bind selectively to hypoxic cells,using PET with specific radiopharmaceuticals could visualize hypoxia noninvasively.Hypoxia PET imaging is a valuable tool in assessing oxygenation levels in tumors for the purpose of tumor diagnosis and also as a prognostic indicator.Meanwhile,hypoxia imaging can quantify hypoxic tumor subvolumes for dose painting and personalized treatment planning and delivery. This review summarizes the published literature on clinical studies and the experimental treatment of tumor hypoxia.
Neoplasms;Positron-emission tomography;Hypoxia
宋少莉,Email:shaoli-song@163.com
10.3760/cma.j.issn.1673-4114.2016.01.008
国家自然科学基金(NSFC8141708)
2015-09-09)

