通络醒脑泡腾片对MID模型大鼠血液流变学, iNOS,VEGF及LDH—5的影响お
任香怡 胡勇 魏江平 付文君 徐世军�┩跤姥�


[摘要]考察通络醒脑泡腾片对多发脑梗死性痴呆(multiinfarct dementia,MID)模型大鼠血液流变学,iNOS,VEGF及LDH5影响。采用微血栓栓塞法制备MID大鼠模型,将造模成功大鼠50只随机分为模型对照组,甲磺酸双氢麦角毒碱片(喜得镇)组(07 mg·kg-1),通络醒脑泡腾片高、中、低剂量组(756,378,159 g·kg-1),另取10只假手术动物作为平行对照组,连续灌胃90 d。运用Morris水迷宫检测大鼠的学习记忆能力;腹主动脉取血测定不同切变率下的全血黏度和红细胞聚集指数;采用ELISA法测定血清iNOS和VEGF的含量;采用免疫组化和图像分析技术测定MID大鼠海马LDH5的表达。结果显示通络醒脑泡腾片能明显缩短MID模型大鼠的逃避潜伏期,增加逃逸平台进入次数,延长中环滞留时间,在1,5,30,200 S-14个切变率下,也能显著降低模型大鼠的全血黏度,红细胞聚集指数以及血清iNOS,VEGF含量和LDH5平均光密度,与模型对照组比较有统计学意义(P<005)。结果表明通络醒脑泡腾片能提高MID模型大鼠学习记忆能力,改善外周血液流变学,降低iNOS,VEGF的含量及海马LDH5表达,进而改善脑组织能量供应。
[关键词]通络醒脑泡腾片;多发脑梗死性痴呆;血液流变学;VEGF;iNOS;LDH5
多发脑梗死性痴呆(multiinfarct dementia,MID)是因血栓或栓塞性脑血管病引起闭塞,累及脑部重要功能区域导致认知功能障碍的临床综合征[1]。MID作为血管性痴呆最主要的类型[23],研究发现其多发梗塞灶形成与缺血后生化代谢[4]、血液流变学[5]异常密切相关,可通过影响炎症反应、血管新生、侧枝重建等代谢调控MID的病理进程。诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)[67]和血管内皮生长因子(vascular endothelial growth factor,VEGF)[89]作为脑缺血时脑内重要的调节因子,其表达能反映脑供血状态与血管功能,乳酸脱氢酶5(lactate dehydrogenase5,LDH5)作为糖酵解的关键酶,其活性变化是缺血性梗死是否进行性加重的判定指标[10]。课题组前期研究发现,通络醒脑泡腾片能促进突触素重塑[11]和胰岛素降解酶[12]表达,改善Aβ2535所致的神经功能障碍,也能调控Na+K+ATP酶[13]与CCO酶[14]改善慢性缺血损伤引起的脑能量代谢障碍,进而提高学习记忆能力。为进一步探讨通络醒脑泡腾片抗痴呆的可能作用机制,本文从血液流变学及血管功能角度研究其对微血栓栓塞致MID大鼠模型全血黏度,红细胞聚集指数,iNOS,VEGF及LDH5的影响。
1材料
11仪器WMT100Morris水迷宫、Y迷宫,成都泰盟科技有限公司;SA6000自动血流变测试仪,北京赛科希德科技发展有限公司;酶标仪,Thermo公司,型号Multiskan MK3;2015型转轮式切片机,德国徕卡(Leica)仪器有限公司;TSJⅡ型全自动封闭式组织脱水机和PHYⅢ型病理组织漂烘仪,常州市中威医疗仪器有限公司;BA200Digital数码三目摄像显微摄像系统,麦克奥迪实业集团有限公司;ImagePro Plus 60 图像分析系统,美国Media Cybernetics公司。
12药物与试剂通络醒脑泡腾片(规格12 g/片,45 g原生药/片),四川同道堂药业集团股份有限公司,批号20140215;甲磺酸双氢麦角毒碱片(喜得镇),天津华津制药有限公司,批号3H878T;血流变专用清洗液SAW,北京赛科希德科技发展有限公司,批号SAW20131201;加样清洗维护液SAWZ,北京赛科希德科技发展有限公司,批号SAWZ2014 0101;大鼠一氧化氮合酶(NOS)ELISA Kit,英国ABBEXA公司,货号abx53065;大鼠血管内皮生长因子(VEGF)ELISA Kit,英国ABBEXA公司,货号abx54630;乳酸脱氢酶抗体(LDH5)兔多克隆抗体,北京博奥森生物技术有限公司,批号bs1810R。
13动物SD大鼠(SPF级),全雄,体重280~320 g,由成都达硕实验动物有限公司提供,生产许可证SCXK(川)201324,实验场地为国家中医药管理局成都中医药大学中药药理三级实验室,编号TCM2032043。大鼠均在室温22~24 ℃,明暗周期12 h/12 h条件下,自由饮水摄食。
2方法与结果
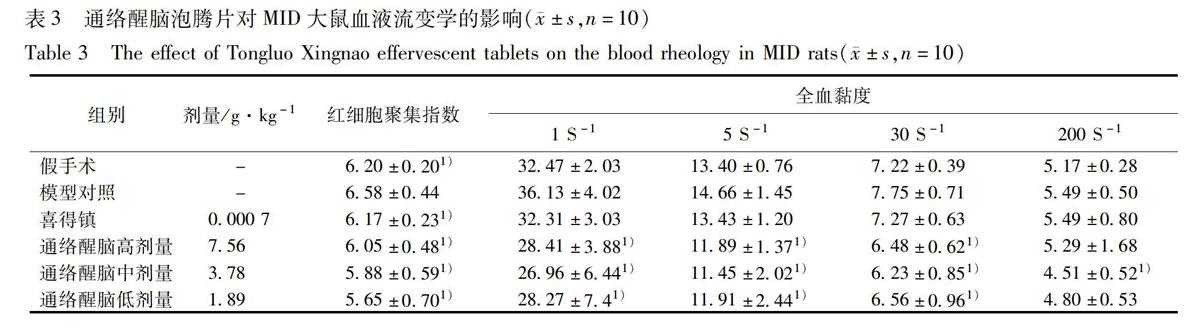
取健康SPF级SD大鼠,全雄,适应性喂养3 d后,Morris水迷宫实验筛选学习记忆良好者用于造模。按照文献[15]制备造模血栓,采用微血栓栓塞法制备MID大鼠模型[1]。假手术组动物仅注射生理盐水,其余步骤与模型动物相同。手术后动物连续3 d肌肉注射硫酸庆大霉素注射液每只03 mL。大鼠术后恢复10 d后,进行“Y”迷宫测试[16],评判手术对大鼠造成学习记忆损害,并筛选造模成功的大鼠50只,随机分为5组,即模型对照组,喜得镇组,通络醒脑泡腾片高、中、低剂量组,每组10只,另取10只假手术组大鼠为平行对照。分组及给药剂量见表1,假手术和模型对照组给予等体积生理盐水(001 mL·g-1),其余各组灌胃给予的相应药物每天1次,连续90 d。给药第86天开始水迷宫训练,第90天进行定向航行和空间探索测定,结果见表1,2。行为学测试完成后麻醉大鼠,腹主动脉取血,全自动血流变测试仪测定全血黏度和红细胞聚集指数;分离制备血清测定iNOS和VEGF含量,结果见表3,4。处死大鼠,无菌条件下快速分离海马,置于4%多聚甲醛中进行常规固定制片,切片,采用SP法进行免疫组织化学反应,具体方法参照说明书进行。采用 ImagePro Plus 60 图像分析系统进行图像分析并测定平均光密度(IA),结果见图1。
由表1可知,定向航行实验训练第1 天,各组之间的逃避潜伏期无显著差异;与模型对照组比较,训练第3天,通络醒脑低剂量组的逃避潜伏期显著缩短(P<005);训练第5 天,通络醒脑高、中、低剂量组的逃避潜伏期均显著缩短(P<005)。随着训练天数的延长,给药组均表现出不同程度上逃避潜伏期的缩短。
由表2可知,与假手术组比较,模型对照组大鼠逃逸平台进入次数显著减少,中环滞留时间显著缩短(P<005);与模型对照组比较,通络醒脑泡腾片组上述指标均明显增多或延长,尤以中低剂量组的程度最为明显(P<005)。
由表3 可知,与假手术组比较,模型对照组红细胞聚集指数升高,同时在1,5,30,200 S-14个切变率下全血黏度升高,给药后通络醒脑高、中、低剂量组均能显著降低全血黏度与红细胞聚集指数(P<005)。
由表4可知,与假手术组比较,模型对照组血清iNOS和VEGF含量显著增高(P<005);与模型对照组比较,通络醒脑高、中、低剂量组血清iNOS和VEGF含量显著降低。
由图1可知,LDH5主要表达于细胞浆、细胞膜,或间质,阳性表达呈浅黄色或棕黄色;与假手术组比较,模型对照组海马LDH5显著高表达,平均
光密度值显著增高(P<005);与模型对照组比较,通络醒脑泡腾片高、中剂量组LDH5表达显著低表达,平均光密度值显著降低(P<005)。
3讨论
生化代谢异常[5]、血液流变学异常[6, 1718]是脑缺血后小梗塞灶或微梗塞形成的重要体现,与MID病理发展密切相关。脑缺血后,血黏度[19]与红细胞聚集指数升高导致血流减慢,氧和营养转运障碍,引起脑组织缺氧。脑组织缺氧可直接增加LDH5活性催化还原产生乳酸以恢复代偿期脑损伤后神经元的功能[10],另外乳酸还可直接刺激内皮细胞产生VEGF[20]。高表达的VEGF可通过促进新生血管生成、侧枝循环重建恢复血流供应;调控AKT3表达影响线粒体能量代谢[21];或通过旁分泌作用于内皮细胞释放NO[22]负反馈调节VEGF。随着缺血缺氧的过度加重,血液流变学异常,乳酸堆积过量[23]引起VEGF异常升高,血管壁顺应性降低;继而NO调节失控导致血管功能障碍,影响葡萄糖向脑内转运最终造成或加剧MID的脑能量代谢障碍。因此生理状态下血液流变学、LDH5活性大小与VEGF,NO之间的相互调控保证了正常的血管功能与脑能量代谢供应。而iNOS作为脑缺血后期NO合成的主要限速酶,主导了迟发性进行性脑神经元损伤[24],其活性高低反映了脑梗塞损害的程度[25]。脑长期缺血,细胞外刺激物例如LPS[26]激活不同的信号通路[2728]可诱导iNOS表达,引起NO过度表达,进而调节自噬通路——蛋白质降解和细胞器退化的过程[29],或使蛋白酪氨酸磷酸酶S亚硝基化,阻断下游ERK1/2 通路的活化[30]加重神经毒性,或上调线粒体中促凋亡蛋白Bax表达,改变膜通透性,导致钙离子内流,使线粒体 DNA断裂[31],激活内多聚 ADP核糖合成酶[32],引起脑内储备能量大量耗竭,继而激活一系列损伤级联反应,最终导致学习记忆障碍。
本次实验研究表明,通络醒脑泡腾片能明显缩短MID模型大鼠的逃避潜伏期,增加逃逸平台进入次数,延长中环滞留时间,提示通络醒脑泡腾片具有改善MID模型学习记忆能力的作用。与假手术组比较,模型组红细胞聚集指数和全血黏度升高,血清iNOS和VEGF含量以及海马LDH5平均光密度亦显著增高(P<005),与文献[10,3335]报道一致,表明一定状态下机体存在着自动调节的保护性机制;同时通络醒脑泡腾片能显著降低模型组的全血黏度,红细胞聚集指数,血清iNOS和VEGF含量以及海马LDH5平均光密度(P<005),其中VEGF与LDH5之间呈现的正相关与文献理论[20]相符。综上所述,通络醒脑泡腾片改善MID模型大鼠学习记忆功能的作用机制与改善外周血液流变学和降低血清iNOS,VEGF的含量及LDH5表达,进而改善脑组织能量供应有关。
[参考文献]
[1]徐立, 林成仁, 刘建勋, 等 塞络通胶囊对多发梗死性痴呆大鼠认知功能障碍的干预作用[J]. 中国中药杂志, 2012, 37(19): 2943
[2]Jellinger K A The pathology of ischemicvascular dementia: an update[J]. J Neurol Sci, 2002(203/204): 153
[3]Hachinski V C, Lassen N A, Marshall J Multiinfarct dementia: a cause of mental deterioration in the elderly [J]. Lancet, 1974, 2:207
[4]Huang J L, Fu S T, Jiang Y Y, et al Protective effects of nicotiflorin on reducing memory dysfunction, energy metabolism failure and oxidative stress in multiinfarct dementia model rats [J]. Pharmacol Biochem Behav, 2007, 86(4): 741
[5]Zhang X, Wu B, Nie K, et al Effects of acupuncture on declined cerebral blood flow, impaired mitochondrial respiratory function and oxidative stress in multiinfarct dementia rats [J]. Lupus, 2000, 9(4): 311
[6]Jackman K, Iadecola C Neurovascular regulation in the ischemic brain[J]. Antioxid Redox Signal, 2015, 22(2): 149
[7]Dawson V L, Dawson T M Nitric oxide in neurodegeneration[J]. Prog Brain Res, 1998, 118: 215
[8]Lambrechts D, Carmeliet P VEGF at the neurovascular interface: therapeutic implications for motor neuron disease [J] Biochim Biophys Acta, 2006, 1762(11/12): 1109
[9]Rosenstein J M, Krum J M, Ruhrberg C VEGF in the nervous system[J]. Organogenesis, 2010, 6(2): 107
[10]胡珺, 陈芸芸, 邢东明, 等 脑缺血时乳酸的生成、转运、代谢和利用 [J]. 中国药理学通报, 2008, 24(3): 284
[11]张荫杰, 徐世军, 代渊, 等 通络醒脑泡腾片对痴呆大鼠突触素表达的影响[J]. 中药药理与临床, 2012, 28(3): 84
[12]张荫杰, 代渊, 胡勇, 等 通络醒脑泡腾片对AD大鼠学习记忆和海马胰岛素降解酶表达的影响[J]. 中国中药杂志, 2013, 38(17): 2863
[13]胡勇, 巨少华, 张荫杰, 等 通络醒脑泡腾片对大鼠慢性脑缺血致学习记忆功能损伤的影响 [J]. 中国中药杂志, 2014, 39(10): 1908
[14]任香怡, 胡勇, 魏江平, 等 通络醒脑泡腾片对VD模型大鼠海马细胞色素C 氧化酶表达的影响[J]. 中国中医基础医学杂志, 2015, 21(2): 159
[15]陈俊抛, 田时雨, 于薇薇, 等 多发性脑梗塞痴呆动物模型的研究 [J]. 中华神经科杂志, 1994, 3(5): 311
[16]Lai J, Hu M, Wang H, et al Montelukast targeting the cysteinyl leukotriene receptor 1 ameliorates Aβ142induced memory impairment and neuroinflammatory and apoptotic responses in mice [J]. Neuropharmacology, 2014, 79: 707
[17]Tachibana H, Meyer J S, Kitagawa Y, et al Effects of aging on cerebral blood flow in dementia [J]. J Am Geriatr Soc, 1984, 32(2): 114
[18]Kitagawa Y, Meyer J S, Tachibana H, et al CTCBF correlations of cognitive deficits in multiinfarct dementia [J]. Stroke, 1984, 15(6): 1000
[19]Noh H J, Seo S W, Jeong Y, et al Blood viscosity in subcortical vascular mild cognitive impairment with versus without cerebral amyloid burden [J]. J Stroke Cerebrovasc Dis, 2014, 23(5): 958
[20]Beckert S, Farrahi F, Aslam R S, et al Lactate stimulates endothelial cell migration[J]. Wound Repair Regen, 2006, 14(3): 321
[21]Wright G L, Maroulakou I G, Eldridge J, et al VEGF stimulation of mitochondrial biogenesis: requirement of AKT3 kinase [J] Faseb J, 2008, 22(9): 3264
[22]Maurer1 A, Chen Q, McPherson C, et al Changes in satiety hormones and expression of genes involved in glucose and lipid metabolism in rats weaned onto diets high in fibre or protein reflect susceptibility to increased fat mass in adulthood[J] J Physiol, 2009, 587(Pt 3): 679
[23]Rehncrona S Brain acidosis [J] Ann Emerg Med, 1985, 14(8): 770
[24]Iadecola C, Zhang F, Casey R, et al Inducible nitric oxide synthase gene expression in vascular cells after transient focal cerebral ischemia [J] Stroke, 1996, 27(8): 1373
[25]Zhang F, Casey R M, Ross M E, et al Aminoguanidine ameliorates and Larginine worsens brain damage from intraluminal middle cerebral artery occlusion[J] Stroke, 1996, 27(2): 317
[26]La Mura V, Pasarín M, RodriguezVilarrupla A, et al Liver sinusoidal endothelial dysfunction after LPS administration: a role for induciblenitric oxide synthase[J] J Hepatol, 2014, 61(6): 1321
[27]Gu S M, Park M H, Hwang C J, et al Bee venom ameliorates lipopolysaccharideinduced memory loss by preventing NFkappaB pathway [J] J Neuroinflammation, 2015, 12:124.
[28]Mo C, Wang L, Zhang J, et al The crosstalk between Nrf2 and AMPK signal pathways is important for the antiinflammatory effect of berberine in LPSstimulated macrophages and endotoxinshocked mice[J] Antioxid Redox Signal, 2014, 20(4): 574
[29]Mizushima N, Levine B, Cuervo A M, et al Autophagy fights disease through cellular selfdigestion [J] Nature, 2008, 451(7182): 1069
[30]Shi Z Q, Sunico C R, McKercher S R, et al Snitrosylated SHP2 contributes to NMDA receptormediated excitotoxicity in acute ischemic stroke [J]. Proc Natl Acad Sci, 2013, 110(8): 3137
[31]Mishra O P, Randis T, Ashraf Q M, et al Hypoxiainduced Bax and Bcl2 protein expression, caspase9 activation, DNA fragmentation, and lipid peroxidation in mitochondria of the cerebral cortex of newborn piglets: the role of nitric oxide[J]. Neuroscience, 2006, 141(3): 1339
[32]Zhang J, Dawson V L, Dawson T M, et al Nitric oxide activation of poly(ADPribose) synthetase in neurotoxicity[J]. Science, 1994, 263(5147): 687
[33]Walzl M A promising approach to the treatment of multiinfarct dementia[J]. Neurobiol Aging, 2000, 21(2): 283
[34]Tarkowski E, Issa R, Sjgren M, et al Increased intrathecal levels of the angiogenic factors VEGF and TGFbeta in Alzheimer′s disease and vascular dementia [J]. Neurobiol Aging, 2002, 23(2): 237
[35]Cai Z Y, Yan Y, Sun S Q, et al Minocycline attenuates cognitive impairment and restrains oxidative stress in the hippocampus of rats with chronic cerebral hypoperfusion[J]. Neurosci Bull, 2008, 24(5): 305
[责任编辑曹阳阳]

