高压静电场对小麦叶片保护酶系统及麦长管蚜种群动态的影响
曹 祝,李广雨,赫 娟,赵惠燕,MKDK Piyaratne,胡祖庆,胡想顺旱区作物逆境生物学国家重点实验室,西北农林科技大学植物保护学院,杨陵 712100
高压静电场对小麦叶片保护酶系统及麦长管蚜种群动态的影响
曹祝,李广雨,赫娟,赵惠燕*,MKDK Piyaratne,胡祖庆,胡想顺
旱区作物逆境生物学国家重点实验室,西北农林科技大学植物保护学院,杨陵712100
摘要:为明确高压静电场胁迫小麦种子对其叶片以及麦长管蚜Sitobion avenae Fabricius产生的影响。测定了小麦苗期叶片及麦长管蚜体内抗氧化酶(SOD,POD,CAT)的活性,并采用盆栽种群实验研究了麦长管蚜的种群动态。实验结果表明:(1)在未被麦长管蚜取食的小麦叶片中,SOD和POD活性最大值均出现于4 kV/cm处理组,且与对照组差异显著(P<0.05),CAT活性在未被取食的叶片中无显著差异(P>0.05);而被取食过的叶片中,4 kV/cm处理组的SOD和POD活性均显著低于对照组(P<0.05),而CAT活性结果显示4 kV/cm和6 kV/cm处理组均显著低于对照组(P<0.05)。(2)静电场处理组中麦长管蚜的SOD 和CAT活性均显著高于对照组(P<0.05),但POD活性均显著低于对照组(P<0.05)。(3)种群动态和逻辑斯蒂模型参数显示4 kV/cm处理组的小麦环境容纳量(K)最小。研究的创新点在于对影响麦长管蚜的介质(小麦)的抗氧化酶活性进行了测定,进一步明确了高压静电场对动植物的影响,说明了4 kV/cm是影响小麦和麦长管蚜的关键强度,为高压静电生态控蚜提供了新思路。
关键词:高压静电场(HVEF);抗氧化酶活性;麦长管蚜;种群动态
曹祝,李广雨,赫娟,赵惠燕,MKDK Piyaratne,胡祖庆,胡想顺.高压静电场对小麦叶片保护酶系统及麦长管蚜种群动态的影响.生态学报,2016,36 (4):1001-1009.
Cao Z,Li G Y,He J,Zhao H Y,Mkdk Piyaratne,Hu Z Q,Hu X S.Effects of high voltage electrostatic fields on protective enzyme activity in wheat plants and on the population dynamics of Sitobion avenae fabricius(hemiptera:aphididae).Acta Ecologica Sinica,2016,36(4):1001-1009.
自然界通常处于低压正静电场状态。地球上空的电离层对地面具有360 kV的正电位,地面附近的场强为130 V/m[1-2]。在这个巨大的天然静电场中,生物本身其电荷分布,排序以及运动都达到稳定并呈现一定的规律性[3]。若改变自然环境的静电场,必然会给生物带来一定的影响。高压静电场(HVEF)对种子的生物学效应研究是静电生物学领域研究最早的领域[4],关于静电场直接加于植物或者动物而带来的影响,已有研究表明,外加适当强度的静电场可以影响植物生长,促进种子萌发,促进愈伤组织细胞生长和根的分化及增强种子的抗冻害能力[5-6]。另外,高压静电场对昆虫的生长发育和行为学方面也会产生影响[7-11]。但关于高压静电场如何间接影响昆虫体内保护酶活性和种群动态的相关研究却鲜见报道。
麦长管蚜(Sitobion avenae Fabricius)是小麦上重要害虫之一,它可导致小麦籽粒灌浆不足,千粒重及品质下降,且可以传播黄矮病毒[12-14]。在实际生产中,为了杀灭麦长管蚜,通常采用喷施农药的方法,不仅污染环境,破坏生态平衡,也带来了农药残留等一系列危害。因此,寻找无污染的生态控蚜方法势在必行。
由于小麦与麦长管蚜经过长期的协同进化,已形成了较稳定的遗传适应性[15]。因此在面对外界胁迫时,不仅会在外在表现上有所差异,也会迫使体内细胞产生大量的活性氧自由基(ROS),如氢氧根负离子(OH-)、自由羟基(·OH)、过氧化氢(H2O2)、超氧物阴离子自由基(·O-2)、单线态氧(1O2)等[16-17]。HVEF作为一种刺激因子,在给植物的各项指标带来变化的同时,使其体内产生大量ROS,细胞中的保护酶系如超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等,它们协调作用有效清除这些自由基,防御着膜脂过氧化,进而维护活性氧的平衡[18-20]。本实验以麦长管蚜作为研究材料,探究高压静电场能否为生态控蚜提供新方法,通过测定小麦及麦长管蚜体内3种抗氧化酶活性(SOD,POD,CAT)的变化,并对麦长管蚜的种群数量动态和模型进行分析,明确HVEF对小麦及蚜虫的作用,为探索高压静电生态控蚜提供理论基础。
1 材料方法
1.1供试昆虫
供试麦长管蚜虫源为西北农林科技大学植物保护学院昆虫生态组实验室提供,该种群是在实验室((21±0.5)℃,(75±5)%RH,16∶8 LD)饲养的单克隆体系。寄主小麦品种为小偃22。
1.2供试植物及处理
选取大小一致且饱满干燥(干湿度均一)的小麦种子适量,分别在、4 kV/cm和6 kV/cm的静电场强下处理20 min,不处理组作为对照。将每个处理的小麦分为第一,第二,第三组,长至二叶期将第一组和第二组小麦接上单克隆系的麦长管蚜,待其产仔留下4头同龄初生若蚜。第一组每天记录其种群数量,用于种群数量测定;第二组长至成蚜后于-80℃冰冻保存;第三组不接麦蚜,其他条件相同。
1.3酶液制备
小麦叶片酶粗液的制备:取各HVEF处理的小麦苗期(大约出芽后25 d)叶片(包括被蚜虫取食过的和未被取食的叶片)鲜样(0.9 g)于预冷的研钵中,加入3.0 mL 0.05 mmol/L磷酸缓冲液(pH值7.8)及少量石英砂,冰浴下研磨成匀浆,于12000r/min,4℃冷冻离心15 min,上清液定容至9 mL,用于SOD、POD、CAT活性、及可溶性蛋白质含量的测定[21-22]。
麦长管蚜酶粗液的制备:将供试麦长管蚜置于预冷的组织匀浆器中,按照体重8 mL/g加入预冷的0.04 mol/L、pH值7.0的磷酸缓冲液,在冰浴条件下研磨匀浆,所得匀浆液以3500r/min,4℃离心10 min,其上清液即为待测的酶液。保存于-20℃备用[23]。
1.4仪器与试剂
主要仪器:植物电场发生器SCDC-II(中国浙江省);全功能酶标仪M200 Pro(瑞士);低温高速离心机ARANTI(美国);纯水仪;水浴锅等等。
试剂盒:BCA法蛋白质浓度测定试剂盒;超氧化物歧化酶WST-1法测定试剂盒;过氧化氢酶POD测定试剂盒(测植物);过氧化氢酶POD测定试剂盒(测组织);过氧化物酶CAT测定试剂盒。均购于南京建成有限公司。
1.5数据处理
试验数据用SPSS统计软件中的One-Way ANOVA方差分析,平均数采用Student-Newman-Keuls(SNK)法进行差异显著性检测。各处理间的显著性差异均设为P<0.05水平。
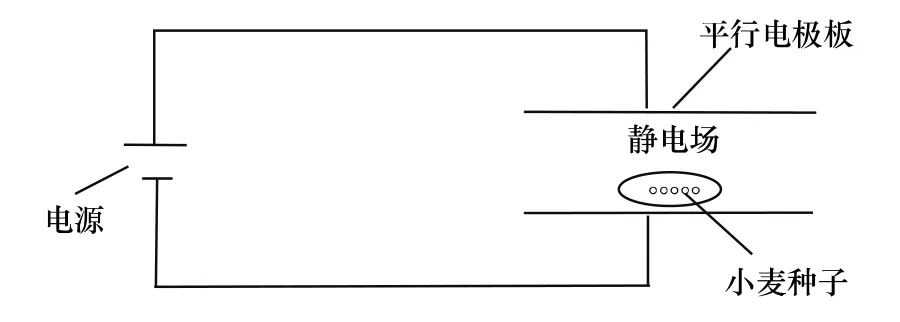
图1 装置示意图Fig.1Schematic diagram of the device
2 结果与分析
2.1经HVEF处理后的小麦被麦长管蚜取食前后体内抗氧化酶活性的变化
2.1.1小麦SOD活性的变化
由HVEF处理后的小麦被蚜虫取食前后其体内超氧化物歧化酶(SOD)活力变化结果可以看出(图2),在未被蚜虫取食的情况下,SOD活性最高值出现于4 kV/cm处理组(51.66 U),且与对照组(46.48 U)相比均有显著差异(P<0.05),增幅达到11.14%;在经过麦长管蚜取食以后,各处理组的SOD活性均与对照组(47.67 U)有显著差异(P<0.05),其中4 kV/cm处理组的SOD酶活性降为最低值(37.12 U),降幅达到22.13%。与被麦长管蚜取食过之前相比,降幅达到28.15%。这说明被蚜虫取食以后小麦叶片内部的抗氧化酶系统发生了较大变化。
2.1.2POD活性的变化
图3为小麦体内POD活性的变化,在被蚜虫取食之前,2 kV/cm和4 kV/cm处理组相比于对照组(56.91 U)显著升高(P<0.05),最大值出现于4 kV/cm处理组(73.12 U),升幅为28.48%;在右图中可以明显发现,被蚜虫取食过的叶片中4 kV/cm处理组中的POD活性降为最低(45.44 U),降幅为20.15%。与麦长管蚜取食之前相比,POD酶活性降幅达到37.86%,与其他组相比(CK:58.20 U;2 kV/cm:64.91 U;6 kV/cm:54.80 U)差异性显著(P<0.05)。此变化与图2中表现的结果类似,即4 kV/cm处理组小麦在被蚜虫取食之前有最高酶活性,而被取食以后酶活性却降为最低。

图2 经高压静电场(HVEF)(High Voltage Electrostatic Fields)处理后小麦体内SOD活性的变化Fig.2The change of SOD activity in wheat leaves after seeds exposed to High Voltage Electrostatic Fields(HVEF)a叶片未被蚜虫取食过,b叶片被蚜虫取食过的植株;图中数据为平均值±标准误,柱上不同字母表示不同浓度(0,2,4,6 kV/cm)HVEF处理下在0.05水平上存在显著差异(SNK检验,One-way ANOVA)

图3 经HVEF处理后小麦体内POD活性的变化(a未被蚜虫取食过,b被蚜虫取食过的植株)Fig.3The change of POD activity in wheat leaves after seeds exposed to HVEF(a.the undamaged plant;b.the damaged plant by aphid)
综合2.1.1的结果可以看出,4 kV/cm处理组最值得关注,在未被蚜虫取食的情况下SOD和POD酶活性为4组中最高值,而被蚜虫取食过以后其活性又降为最低。这个结果说明由于SOD和POD酶活性的升高,不同HVEF处理对小麦造成胁迫所产生的活性氧被清除;蚜虫取食植株以后,小麦体内的抗氧化酶系统被破坏,从而无法适当而准确地调控活性氧的动态平衡。
2.1.3CAT活性的变化
在被HVEF处理后小麦体内的CAT活性如图4所示。被麦长管蚜取食之前CAT活性稳定,各处理间没有显著性差异(P>0.05),表明高压静电对小麦叶片CAT活性没有影响。而被蚜虫取食以后4 kV/cm处理组(0.02160 U)和6 kV/cm(0.02508 U)处理组的CAT活性相对于对照组(0.04869 U)显著降低(P<0.05),降幅分别为对照组的55.64%,48.49%;与未被麦长管蚜取食时的小麦叶片相比,降幅分别达31.17%,35.79%。这也说明小麦叶片被蚜虫取食后,抗氧化酶系统被破坏。

图4 经HVEF处理后小麦体内CAT活性的变化(a未被蚜虫取食过,b被蚜虫取食过的植株)Fig.4The change of CAT activity in wheat leaves after the seeds exposed to HVEF(a.the undamaged plant;b.the damaged plant by aphid)
2.2取食HVEF处理的小麦后,麦长管蚜体内SOD,POD,CAT活性的变化
麦长管蚜取食不同剂量高压静电处理的小麦后,体内SOD活性(2 kV/cm:20.01 U;4 kV/cm:10.66 U; 6 kV/cm:13.89 U)显著高于对照组(6.12 U)(P<0.05),如图5所示。这表明HVEF的间接作用对蚜虫产生了一定的影响,因此蚜虫体内的超氧化物歧化酶做出应答,从而使多余的·O-2歧化产生H2O2。而4 kV/cm处理组的响应最弱,不能及时分解多余活性氧,导致4 kV/cm对蚜虫伤害最大。

图5 取食经HVEF处理的小麦其叶片后,麦长管蚜体内SOD,POD和CAT酶活性的变化Fig.5The change of SOD,POD and CAT activitities in aphid after feeding on the leaves(seeds treated by HVEF)
蚜虫体内POD的活性结果表明,所有处理组的POD活性(2 kV/cm:4.578 U;4 kV/cm:6.239 U;6 kV/ cm:5.248 U)都低于对照组(8.058 U)(图5),且差异显著(P<0.05),这表明蚜虫体内保护酶系统中POD活力和平衡受到破坏。

表1 麦长管蚜种群数量的逻辑斯蒂模型拟合Table1 The Logistic Growth Model for the population of S.avenae reared on the plant treated by HVEF(K:The maximum carrying capacity)
3 结论和讨论
静电场生物学效应已有不少研究。国内研究表明,22 kV/0.08 m高压静电场预处理种子15 min可以提高黄瓜种子的发芽率,生长势,适当强度的HVEF处理也可以提高老化水稻种子的萌发率[24-25]。高压静电场对昆虫生长发育也会产生影响,张海兰等人发现:在蚕种催青前期用适当强度的高压静电场处理,对蚕卵的孵化、蚁蚕生命力、幼虫发育经过及小蚕的生长均无不良影响,但能促进大蚕期的生长及茧层量的增加[7-8];国外的研究多是关于高压静电对昆虫行为学的影响,Philip L.Newland研究表明,电场强度为8—10 kV/m时85%的蟑螂个体都选择避免穿过电场。Jackson研究发现苍蝇(Musca domestica L.)在静电屏蔽的电场上行走时,电网屏蔽的电流的积累和家蝇行走的速度密切相关。Ozlem Sangun研究发现,在大鼠出生前后用静电场处理,其体内的氧化物质和抗氧化酶含量都有显著上升,经静电场处理后出生的大鼠生长受到抑制,发育期显著延迟[9-11]。但一般静电处理无法使作物基因突变,其原因在于,高压静电电压电晕放电的电场强度受其临界击穿场强的限制(E<10 kV/cm),这与使种子基因突变的强电离放电的场强相差甚远[26]。
在农业上,电场生物学效应的研究目的之一是查明环境电场的改变对作物的生长乃至经济产量有无促进作用,确定最佳的电场处理方式,诱发最大的生物学效应,从而开发出行之有效的农业物理新技术[27]。HVEF作为一种刺激因子对小麦种子造成了胁迫,并使其影响延伸至小麦幼苗中。国内早期研究已经证实,高压静电场处理小麦种子,会使其抗冻害能力增强,叶绿素含量增加,游离氨基酸和蛋白水解氨基酸含量有所变化,总N、P2O、Mo、Co、Cu、Zn、Mn和FeO也会显著升高[28];一定强度的静电场强处理小麦种子一段时间,会使其萌发时体内的ATP受到抑制[29]。因此这些变化打破了小麦体内本来的细胞微环境,而作为一种刺激因子使小麦产生大量ROS,包括超氧离子(O-2)、过氧化氢(H2O2)和氢氧根离子(OH-)。当正常生理状态下,机体产生的自由基和清除自由基的速率处于动态平衡的状态。但是,当自由基过多时,就会对生物体的蛋白质、脂质和DNA造成损伤,导致病变的发生。利用抗氧化酶来消除这些活性氧对于昆虫有机体维持正常的功能和代谢是必不可少的[30]。作为内源性保护酶,SOD负责催化O-2转变为H2O2,并在过氧化物酶(POD)和过氧化氢酶(CAT)的作用下将其分解为H2O和O2,消除胁迫产生的活性氧对细胞的伤害[31]。

图6 实验室不同HVEF强度处理下麦长管蚜的种群动态(每个点的值表示为平均值±标准误)Fig.6Population dynamics of S.avenae at different HVEF under laboratory conditions(Data in the figure are mean±SE)
本实验中,在未被蚜虫取食的小麦中,SOD和POD活性都随着HVEF的强度保持先增后降的趋势,在4 kV/cm处达到峰值。其原因可以用“阈值效应”来解释,电场和电磁场的阈值效应会导致有机体产生大量的自由基,4 kV/cm电场处理小麦种子带来的影响,可能是对蚜虫产生显著的生物效应的阈值强度。类似的研究结果也存在于土壤水分,光照强度和复合盐胁迫等其他环境胁迫之中。例如植物的光合生理活动并非在土壤水分充足时最活跃,而是在适度的水分亏缺范围之内最活跃,这一范围因植物种类及其生理过程不同而异[32-33]。而CAT活性较稳定,张光先等人报道高压静电场使得过氧化氢酶的稳定性增加[34],本实验中未被蚜虫取食的叶片中CAT活性保持在同一稳定水平,与前人研究结果一致。蚜虫取食以后保护酶活性趋势变为先降后增,在4 kV/cm处达到最低值,这也说明了4 kV/cm是影响最显著的强度,这极有可能是由于蚜虫的取食对小麦也会带来一种胁迫,当静电胁迫和蚜虫取食胁迫的共同作用产生的活性氧自由基达到小麦体内保护酶活性可以清除的极致时,就会使小麦保护酶系统崩溃,从而对小麦造成一定的伤害。
整个保护酶系统的防御能力的变化取决于这几种酶彼此协调的综合结果[35]。在处理组中蚜虫体内的SOD和CAT酶活性与对照相比有所升高,且呈现先降低后增高的趋势,也是在4 kV/cm处达到最低值,这说明4 kV/cm处理对蚜虫体内的SOD和CAT酶体系产生了强烈的破坏作用[36],因此无法催化O-2转变为H2O2,进而导致POD酶无法进一步起到清除自由基的作用,从而导致4 kV/cm处理对蚜虫的伤害最大,这与本试验中Logistic模型的结果相符合。
在生态学中,经典的Logistic模型广泛用于研究种群生长变化,它描述种群的个体增长率和种群的密度成线性关系,形式相对比较简练,模型中各个参数也有明确的生物学意义[37]。本实验结果也进一步证实了不利因素诱导都会使蚜虫表现出生长发育与繁殖以及行为的改变[12,38]。
通过测定HVEF对蚜虫和小麦带来的变化,可以发现小麦和麦长管蚜是相互作用相互影响的。因此合理把握HVEF处理小麦种子的强度,可以为高压静电生态控蚜提供新的思路。本实验结果经过田间试验检测和风险评估后,有可能成为一个简便且无污染的生态控蚜新方法,对保护生态平衡和减少污染有重要意义。
参考文献(References):
[1]高云飞,郑世民.高压静电场生物效应的产生机制.畜牧兽医科技信息,2014,(10):17-18.
[2]Carstensen E L.Biological effects of power frequency electric fields.Journal of Electrostatics,1997,39(3):157-174.
[3]Fernie K J,Reynolds S J.The effects of electromagnetic fields from power lines on Avian reproductive biology and physiology:a review.Journal of Toxicology and Environmental Health,Part B:Critical Reviews,2005,8(2):127-140.
[4]高伟娜,王贵学,吕江,黄俊丽,李剑,廖瑞金.高压静电场对水稻干湿种子生物学效应的影响.重庆大学学报:自然科学版,2006,29 (4):58-61.
[5]谢菊芳,廖贡献,张菁.高压静电场对植物细胞的影响.中南民族学院学报:自然科学版,2000,19(3):9-12.
[6]石贵玉,周巧劲,郭平生,刘灵.高压静电对烟草愈伤组织生长和根分化的效应.广西植物,2002,22(4):364-367.
[7]张海兰,赵博光,夏鲁青,徐建涛.高压静电场处理家蚕卵对蚕茧产量和质量的影响.蚕业科学,2006,32(2):260-263.
[8]张海兰,赵博光,夏鲁青,徐建涛.高压静电场处理家蚕卵对幼虫生长发育和饲料效率的影响.山东农业大学学报:自然科学版,2006,37(4):505-508.
[9]Newland P L,Hunt E,Sharkh S M,Hama N,Takahata M,Jackson C W.Static electric field detection and behavioural avoidance in cockroaches.Journal of Experimental Biology,2008,211(Pt 23):3682-3690.
[10]Jackson C,McGonigle D.Direct monitoring of the electrostatic charge of house-flies(Musca domestica L.)as they walk on a dielectric surface.Journal of Electrostatics 2005,63(6-10):803-808.
[11]Sangun O,Dundar B,Darici H,Comlekci S,Doguc D K,Celik S.The effects of long-term exposure to a 2450 MHz electromagnetic field on growth and pubertal development in female Wistar rats.Electromagnetic Biology and Medicine,2014,DOI:10.3109/15368378.2013.871619.
[12]张丽,周冬,杨杰,朱国平,赵惠燕,胡祖庆,胡想顺.UV-B胁迫小麦上麦长管蚜的生命表参数和取食行为.昆虫学报,2013,56(6): 665-670.
[13]He J,Zhao H Y,Cao Z,Monika W,Zhao H Y.Life Tableanalysis of the performance of aphid Sitobion avenae(Hemiptera:Aphididae)nymphs exposed to a static magnetic field.Archives of Biological Sciences,2013,65(4):1415-1422.
[14]He J,Zhao H Y,Zhao H Y,Monika W,Hu Z A,Hu X S.Effect of static magnetic fields(SMF)on the viability and fecundity of aphid Sitobion avenae(Homoptera:Aphididae)under laboratory conditions.Archives of Biological Sciences,2012,64(2):693-702.
[15]赵惠燕,李东鸿,张改生,张莉,胡祖庆,胡想顺,韩春霞.XZ系列杂种小麦对麦长管蚜抗性机制的研究.西北农林科技大学学报:自然科学版,2002,30(1):73-75.
[16]时忠杰,胡哲森,李荣生.水分胁迫与活性氧代谢.贵州大学学报:农业与生物科学版,2002,21(2):140-145.
[17]Jalee C A,Gopi R,Manivannan P,Panneerselvam R.Responses of antioxidant defense system of Catharanthus roseus(L.)G.Don.to paclobutrazol treatment under salinity.Acta Physiologiae Plantarum,2007,29(3):205-209.
[18]李明,王根轩.干旱胁迫对甘草幼苗保护酶活性及脂质过氧化作用的影响.生态学报,2002,22(4):503-507.
[19]Becana M,Dalton D A,Moran J F,Iturbe-Ormaetxe I,Matamoros M A,Rubio M C.Reactive oxygen species and antioxidants in legume nodules.Physiologia Plantarum,2000,109(4):372-381.
[20]Kanazawa S,Sano S,Koshiba T,Ushimaru T.Changes in antioxidative enzymes in cucumber cotyledons during natural senescence:comparison with those during dark-induced senescence.Physiologia Plantarum,2000,109(2):211-216.
[21]刘侯俊,李雪平,韩晓日,刘轶飞,芦俊俊.铁镉互作对水稻脂质过氧化及抗氧化酶活性的影响.应用生态学报,2013,24(8): 2179-2185.
[22]张智猛,宋文武,丁红,慈敦伟,康涛,宁堂原,戴良香.不同生育期花生渗透调节物质含量和抗氧化酶活性对土壤水分的响应.生态学报,2013,33(14):4257-4265.
[23]陈常理,韦茂兔,李明江,沈福泉,杨重卫,吕仲贤,郑许松,徐红星.温度对B型烟粉虱存活率和保护酶系的影响.浙江农业科学,2010,(4):853-854,857-857.
[24]张永明.高压静电场对黄瓜种子发芽率影响与机理研究.长江蔬菜,2008,(4):45-46.
[25]Wang G X,Huang J L,Gao W N,Lu J,Li J,Liao R J,Jaleel C A.The effect of high-voltage electrostatic field(HVEF)on aged rice(Oryza sativa L.)seeds vigor and lipid peroxidation of seedlings.Journal of Electrostatics,2009,67(5):759-764.
[26]熊建平,朱久运,马坚扬,陆霁.黄瓜高压静电育种机理的研究.生物磁学,2004,4(4):13-16.
[27]曹永军,习岗,宋清,杨初平.不同强度静电场长期处理对3种作物几种光合生理指标的影响.华南农业大学学报,2007,28(1):86-90.
[28]王淑慧,黎先栋,宋长铣.高压静电场处理小麦种子对幼苗生长和有关化学成分的影响.生物化学与生物物理进展,1991,18(5):392-393,399-399.
[29]陈刚才,陈德万.高压静电场对小麦种子萌发中ATP含量的影响(简报).西南大学学报:自然科学版,1993,15(1):67-67.
[30]Maevskaya S N,Nikolaeva M K.Response of antioxidant and osmoprotective systems of wheat seedlings to drought and rehydration.Russian Journal of Plant Physiology,2013,60(3):343-350.
[31]陈小霞,李磊,牛洪斌,尹钧.高温胁迫对不同小麦品种幼苗叶片中抗氧化酶活性的影响.河南农业科学,2008,(12):38-40,58-58.
[32]夏江宝,张光灿,孙景宽,刘霞.山杏叶片光合生理参数对土壤水分和光照强度的阈值效应.植物生态学报,2011,35(3):322-329.
[33]李士磊,霍鹏,高欢欢,冶婷,王亮,李卫华.复合盐胁迫对小麦萌发的影响及耐盐阈值的筛选.麦类作物学报,2012,32(2):260-264.
[34]张光先,张济龙,牟波佳.高压静电场对过氧化氢酶的稳定作用及机理研究.激光生物学报,2001,10(1):44-47.
[35]阎秀峰,李晶,祖元刚.干旱胁迫对红松幼苗保护酶活性及脂质过氧化作用的影响.生态学报,1999,19(6):850-854.
[36]张傲,赵惠燕.Zn2+胁迫对麦长管蚜种群生态遗传学的影响.西北农林科技大学学报:自然科学版,2009,37(11):131-137.
[37]邓明明,高欢欢,李丹,胡想顺,胡祖庆,赵惠燕.温度对麦长管蚜体色变化的影响.生态学报,2011,31(23):7203-7210.
[38]He J,Cao Z,Yang J,Zhao H Y,Pan W D.Effects of static electric fields on growth and development of wheat aphid Sitobion aveanae (Hemiptera:Aphididae)through multiple generations.Electromagnetic Biology and Medicine,2014,
Effects of high voltage electrostatic fields on protective enzyme activity in wheat plants and on the population dynamics of Sitobion avenae fabricius(hemiptera: aphididae)
CAO Zhu,LI Guangyu,HE Juan,ZHAO Huiyan*,MKDK Piyaratne,HU Zuqing,HU Xiangshun
State Key Laboratory of Crop Stress Biology in Arid Areas,Yangling 712100,China
Abstract:Sitobion avenae(Fabricius)(Homoptera:Aphididae)is one of the most common pests of wheat.It damages plants by ingesting sap from ears,stems,leaves,and other tender plant parts.It is also known to transmit viruses(e.g.,barley yellow dwarf virus)during feeding,thereby reducing wheat yield and quality.High voltage electrostatic fields (HVEF)are reported to influence a wide variety of biological and physical systems.For example,reports of several studies state that HVEF affected plant physiology such that the sprout rates of seeds were improved.Moreover,in agrophysics,electrostatic charging has been used to improve targeting and efficacy of agricultural sprays.Organisms showing aerobic metabolism face constant risk from reactive oxygen species(ROS),such as the superoxide radical(·O(-)2),hydroxyl radical (OH·)and hydrogen peroxide(H2O2).The function of protective enzymes includes avoidance of unwanted cellular cytotoxicity and oxidative damage by regulating the production of ROS.In order to explore the effects of HVEF on S.avenae and wheat plants,activities of protective(i.e.,anti-oxidative)enzymes such as superoxide dismutase(SOD),catalasebook=1002,ebook=114(CAT),and peroxidase(POD)were examined in wheat leaves and aphid individuals.To evaluate the impact of HVEF on the aphids more accurately,the population dynamics of S.avenae was also investigated.The results showed that the activities of anti-oxidative enzymes were affected by HVEF in both plants and aphids.In undamaged leaves,higher SOD and POD enzyme activities were observed after 4 kV/cm treatment,compared to the control group(P<0.05),but the CAT activities showed no significant change(P>0.05).In damaged leaves,SOD and POD activities of 4 kV/cm treatment were significantly lower than those of the control(P<0.05).CAT activity for treatments with 4 kV/cm and 6 kV/cm were significantly lower than those of the control(P<0.05).When compared with the control,SOD and CAT activities of S.avenae in all the treatment groups were significantly higher(P<0.05),while POD activities were significantly lower (P<0.05).The population dynamics and logistic model parameters showed that the 4 kV/cm treatment resulted in the lowest carrying capacity for S.avenae.Therefore,it is reasonable to conclude that 4 kV/cm is the key intensity for wheat and wheat aphids.In this research,the effects of HVEF on anti-oxidative enzyme activities in wheat were evaluated,and its impact on both animal and plant was further clarified.As is well known,chemical control is often used within an Integrated Pest Management(IPM)program in order to keep pest numbers below the economic threshold.However,farmers often blindly increase the quantity and frequency of insecticide usage to prevent pest damage.Our research showed that seed treatment with HVEF had a range of indirect effects on anti-oxidative enzymes in wheat plants,and on the population dynamics of S.avenae,thus it may provide a new tool for aphid control.Additional research is needed to assess its effects on wheat aphids under field conditions.After further risk assessments,we may find a new approach for ecological control of aphids with HVEF.
Key Words:high voltage electrostatic fields(HVEF);anti-oxidative enzymes;Sitobion avenae;population dynamics
*通讯作者
Corresponding author.E-mail:zhaohy@nwsuaf.edu.cn
收稿日期:2014-07-04;网络出版日期:2015-06-23
基金项目:国家自然科学基金项目(39970112,30470268);高等学校博士学科点专项科研基金(20130204110004)
DOI:10.5846/stxb201407041377

