IgA/C3对IgA肾病的辅助诊断价值
刘璐,陈铖,严苗
(武汉大学人民医院,武汉430060)
IgA/C3对IgA肾病的辅助诊断价值
刘璐,陈铖,严苗
(武汉大学人民医院,武汉430060)
目的 探讨IgA/C3对IgA肾病的辅助诊断价值。方法 选择IgA肾病患者87例(IgA肾病组),其他肾小球疾病患者30例(非IgA肾病组)。检测两组血清IgA、补体C3水平,计算IgA/C3,并分析IgA/C3对IgA肾病的辅助诊断价值。采用牛津分级标准(即MEST)评估IgA肾病患者的病情程度(≥3分为病情严重),分析IgA/C3与IgA肾病病理程度的关系。结果 IgA肾病组血清IgA水平及IgA/C3明显高于非IgA肾病组(P均<0.05),两组血清补体C3水平比较无统计学差异(P>0.05)。受试者工作特征(ROC)曲线分析显示,IgA诊断IgA肾病的曲线下面积(AUC)为0.807,敏感性为72%,特异性为88%;IgA/C3诊断IgA肾病的AUC为0.951,敏感性为93%,特异性为83%;IgA/C3诊断IgA肾病的敏感性高于IgA(P<0.05)。以IgA/C3ROC曲线的截断点为界,将IgA肾病患者分为IgA/C3≥1.66者55例、IgA/C3<1.66者32例;结果显示,IgA/C3≥1.66者MEST≥3分40例,IgA/C3<1.66者仅16例,二者比较P<0.05。结论 IgA/C3可用于辅助诊断IgA肾病,并可作为IgA肾病病理损伤程度的参考指标。
IgA肾病;免疫球蛋白A;补体C3
IgA肾病是目前发病率最高的一种原发性肾小球肾炎,其主要病理表现为肾小球系膜细胞和系膜基质增殖,伴有以IgA为主的免疫复合物沉积,常伴有补体C3沉积。以往认为,IgA肾病是一种良性疾病,但近年研究发现,5%~25%的患者在10年内可进展为慢性肾衰竭,25%~50%的患者在20年内进展为慢性肾衰竭[1~3]。目前,确诊IgA肾病只能通过肾组织穿刺活检术,但该项检查为有创检查,有一定的风险性。鉴于IgA肾病病理表现多伴有IgA为主的免疫复合物及补体C3沉积,有学者将IgA、补体C3作为诊断IgA肾病的血清学指标,但效果不甚理想。近年有研究发现,IgA/C3可作为诊断IgA肾病的指标,但目前其诊断价值存在争议。2013年1月~2015年3月,我们检测了IgA肾病患者血清IgA、补体C3水平,现对IgA/C3诊断IgA肾病的价值进行分析。
1 资料与方法
1.1 临床资料 选择同期我院收治的原发性IgA肾病患者87例(IgA肾病组),其他肾小球疾病30例(非IgA肾病组),其中膜性肾病20例、局灶节段性肾小球肾炎10例,均经肾穿刺活检组织病理学检查确诊。两组均排除过敏性紫癜或其他全身系统性疾病所致的肾小球疾病者,近6个月内使用过免疫抑制剂者,合并其他脏器损害者,免疫功能检查及病理资料不齐全者。IgA肾病组男45例、女42例,年龄(35.7±11.8)岁,24 h尿蛋白定量:<0.15 g 6例、≥0.15~<3.5 g 60例、≥3.5 g 21例;非IgA肾病组男18例、女12例,年龄(42.3±10.8)岁,24 h尿蛋白定量:<0.15 g 2例、≥0.15~<3.5 g 10例、≥3.5 g 18例。两组性别、年龄、24 h尿蛋白定量具有可比性。
1.2 血清IgA、补体C3检测 两组均于入院次日清晨空腹采集肘静脉血5 mL,离心分析血清。采用透射免疫比浊法检测血清IgA、补体C3。
1.3 IgA肾病病理程度评估 按2009年牛津分级标准评估IgA肾病病理程度。系膜细胞增殖积分(M):系膜细胞/系膜区<4个为0分、4~5个为1分、>5个为2分。毛细血管内增生性病变(E):肾小球毛细血管内细胞增殖致袢腔狭窄,无为0分、有为1分。肾小球节段硬化与粘连(S):任何不同程度的袢受累,不包括全肾小球受累或粘连,无为0分、有为1分。间质纤维化或小管萎缩(T):肾皮质小管萎缩或间质纤维化,≤25%为0分、>25%~50%为1分、>50%为2分。MEST为M+E+S+T之和。MEST≥3分表明IgA肾病病情严重。

2 结果
2.1 两组血清IgA、补体C3水平及IgA/C3比较 见表1。
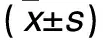
表1 两组血清IgA、补体C3水平及IgA/C3比较
注:与非IgA肾病组比较,*P<0.05。
2.2 IgA、IgA/C3诊断IgA肾病的效能比较 以IgA、IgA/C3鉴别IgA肾病和非IgA肾病,结果显示,IgA诊断IgA肾病的ROC曲线下面积(AUC)为0.807,截断点为2.09 g/L,敏感性为72%,特异性为88%;IgA/C3诊断IgA肾病的ROC AUC为0.951,截断点为1.66,敏感性为93%,特异性为83%。IgA/C3诊断IgA肾病的敏感性高于IgA(P<0.05)。
2.3 IgA/C3与IgA肾病病理程度的关系 以IgA/C3的截断点(1.66)为界,IgA肾病组IgA/C3≥1.66者55例,<1.66者32例。IgA/C3≥1.66者中MEST≥3分40例,<1.66者仅16例,二者比较P<0.05。
3 讨论
IgA肾病是一种免疫性疾病,以IgA为主的球蛋白沉积于系膜区为特征,其临床表现多样,以发作性肉眼血尿、无症状性血尿和(或)蛋白尿为主,偶有少数可表现为肾病综合征。光镜下病变类型多样,包括所有增生性肾小球肾炎的病理类型,如肾小球轻微病变、局灶节段性病变和系膜增生性病变等,严重时可表现为新月体性病变和硬化性病变等。研究发现,50%~70%的成人IgA肾病患者血清IgA水平升高[4]。异常多聚体IgA的合成是IgA肾病发生的基础。糖基化缺陷的IgA分子能够与Ⅳ型胶原纤维、层黏蛋白及纤维连接蛋白结合而发生非特异性反应,促进多种炎性因子与细胞因子释放,启动肾小球炎症反应,使得肾脏病变加重[5]。目前IgA肾病的诊断主要依靠肾组织穿刺活检组织病理检查,但无症状的单纯血尿和(或)蛋白尿者行肾穿刺活检的依从性差,且在基层医院难以开展。因此,寻找简单且易操作的血清免疫指标具有重要意义。目前已发现的IgA肾病标志物有半乳糖缺陷的IgA1分子、肽质量指纹图谱和铰链区O-多聚糖等[6,7],但相关检查操作复杂且费用较高,难以推广。
有研究发现,IgA肾病患者血清IgA水平明显升高,而补体C3水平明显下降,推测血清IgA、补体C3水平异常与IgA肾病发病有关[8];IgA肾病的病理学变化与IgA、补体C3的沉积有关[9]。因此,有学者将IgA、补体C3作为诊断IgA肾病的血清学指标,但效果不甚理想。Maeda等[10]研究发现,IgA/C3可用于辅助诊断IgA肾病的诊断,其诊断价值优于单独检测IgA和补体C3;IgA/C3不但能辅助诊断IgA肾病,还可作为判断IgA肾病预后的指标[11]。本研究发现,IgA肾病组血清IgA水平、IgA/C3较非IgA肾病组明显升高,而血清补体C3水平变化不大。说明IgA、IgA/C3可能对IgA肾病的诊断价值更大。ROC曲线分析显示,IgA/C3诊断IgA肾病的AUC高于单独检测IgA,且其诊断敏感性高于IgA单独检测。
目前肾脏病理改变严重程度的评价分级方法较多,如Hass分级、Lee分级及WHO分级。2009年由全球知名的肾脏病理学家及IgA肾病临床专家共同提出了一种新型分级方法,即牛津分级[12]。该分级方法筛选出可信的IgA肾病病理指标,如肾小球系膜细胞增殖、毛细血管内皮细胞增殖、节段肾小球硬化和肾小管萎缩/间质纤维化等,更加侧重重复性和判断预后的能力[13~16],目前已被全球大多肾病研究者所接受。本研究结果显示,IgA/C3≥1.66者中MEST≥3分比例明显高于IgA/C3<1.66者,表明IgA/C3可反映IgA肾病的病理严重程度。
综上所述,IgA/C3可用于辅助诊断IgA肾病,并可作为IgA肾病病理损伤程度的参考指标。由于本研究样本量较小,其结果的准确性还有待于大规模前瞻性随机对照研究进一步证实。
[1] Coppo R, D′Amico G. Factors predicting progression of IgA nephropathies[J]. J Nephrol, 2005,18(5):503-512.
[2] Schena FP. A retrospective analysis of the natural history of primary IgA nephropathy worldwide[J]. Am J Med, 1990,89(2):209-215.
[3] Coppo R. Pediatric IgA nephropathy: clinical and therapeutic perspectives[J]. Semin Nephrol, 2008,28(1):18-26.
[4] Yoshikawa N, Tanaka R, Iijima K. Pathophysiology and treatment of IgA nephropathy in children[J]. Pediatr Nephrol, 2001,16(5):446-457.
[5] van der Boog PJ, van Kooten C, de Fijter JW, et al. Role of macromolecular IgA in IgA nephropathy[J]. Kidney Int, 2005,67(3):813-821.
[6] Hwang VJ, Ulu A, van Hoorebeke J, et al. Biomarkers in IgA nephropathy[J]. Biomark Med, 2014,8(10):1263-1277.
[7] 高静,王涌,温新宇,等.肽质量指纹图谱鉴别诊断IgA肾病和非IgA肾病的可行性分析[J].南方医科大学学报,2011,31(8):1309-1313.
[8] Ishiguro C, Yaguchi Y, Funabiki K, et al. Serum IgA/C3 ratio may predict diagnosis and prognostic grading in patients with IgA nephropathy[J]. Nephron, 2002,91(4):755-758.
[9] 章晓炎,谢静远,王伟铭,等.补体C3系膜区沉积与低C3血症在IgA肾病中的意义[J].中华肾脏病杂志,2014,30(3):187-194.
[10] Maeda A,Gohda T, Funabiki K, et al. Significance of serum IgA levels and serum IgA/C3ratio in diagnotic analysis of patients with IgA nephropathy[J]. J Clin Lab Anal, 2003,17(3):73-76.
[11] Zhang J, Wang C, Tang Y, et al. Serum immunoglobin A/C3ratio predicts progression of immunoglobulin A nephropathy[J]. Nephrology (Carlton), 2013,18(2):125-131.
[12] Roberts IS, Cook HT, Troyanov S, et al. The Oxford classification of IgA nephropathy: pathology definitions, correlations, and reproducibility[J]. Kidney Int, 2009,76(5):546-556.
[13] Yoshikawa N, Tanaka R, Iijima K. Pathophysiology and treatment of IgA nephropathy in children[J]. Pediatr Nephrol, 2001,16(5):446-457.
[14] Wyatt RJ, Julian BA. IgA nephropathy[J]. N Engl J Med, 2013,368(25):2402-2414.
[15] 余英豪,郑智勇.IgA肾病分类的国际共识:2009牛津分类法介绍[J].临床与实验病理学杂志,2011,27(3):227-229.
[16] 曾玉纯,徐安平,付莎,等.牛津病理分类方法在IgA肾病中的临床应用研究[J].新医学,2013,44(10):689-693.
中华医学会临床研究专项基金资助项目(14050470584);中华医学会-施维亚基金资助项目(2014HX0026)。
陈铖(E-mail: chenchengcc2001@aliyun.com)
10.3969/j.issn.1002-266X.2016.24.037
R692.3
B
1002-266X(2016)24-0096-03
2015-07-14)

