胃癌组织Survivin、RHAMM表达及意义
李冬斌,许香梅,张伟,茹丽娜,郑志刚,刘津
(1 河北医科大学第二医院,石家庄050000;2 石家庄市第一医院;3 邯郸市中心医院)
胃癌组织Survivin、RHAMM表达及意义
李冬斌1,许香梅2,张伟3,茹丽娜4,郑志刚1,刘津2
(1 河北医科大学第二医院,石家庄050000;2 石家庄市第一医院;3 邯郸市中心医院)
目的 探讨Survivin、透明质酸受体介导的细胞游走受体(RHAMM)在胃癌发生、发展中的作用。方法 选择胃癌患者79例(观察组)、体检健康者120例(对照组),取观察组胃癌组织标本、对照组正常胃组织标本,采用免疫组化法检测两组组织标本中Survivin、RHAMM的表达,并分析Survivin、RHAMM表达与胃癌患者临床病理参数的关系及二者的相关性。结果 观察组Survivin、RHAMM阳性表达率分别为70.89%(56/79)、68.35%(54/79),对照组分别为9.17%(11/120)、2.50%(3/120);两组比较P均<0.05。胃癌组织中Survivin、RHAMM阳性表达与肿瘤直径、浸润深度、淋巴结转移及临床病理分期均有关(P均<0.05),与患者性别、年龄、组织分化程度均无关(P均>0.05)。 胃癌组织Survivin阳性表达与RHAMM阳性表达呈正相关(r=0.452,P<0.05)。结论 Survivin、RHAMM参与了胃癌的发生、发展及转移过程,其在胃癌组织中的表达可作为胃癌早期诊断、治疗及评估预后的指标之一。
胃癌;Survivin;透明质酸受体介导的细胞游走受体
胃癌的早期确诊率较低,多数患者就诊时已出现不同程度的淋巴结转移或远处转移[1]。因此,探寻胃癌的生物学标志物对其早期诊断具有重要意义[2]。Survivin是凋亡抑制蛋白(IAP)家族的新成员之一, 在人类许多的肿瘤组织中均有表达;透明质酸受体介导的细胞游走受体(RHAMM)是继CD44之后发现的一种可溶性透明质酸结合蛋白。近年来研究发现,RHAMM通过介导透明质酸对肿瘤细胞迁移的作用,参与多种肿瘤的发生、发展过程,与细胞增殖、迁移、信号转导、黏附、转移密切相关[3,4]。但目前国内外鲜见关于Survivin、RHAMM在胃癌组织中表达情况及二者关系的报道。本研究观察胃癌组织中Survivin、RHAMM的表达,并分析其与患者临床病理参数的关系,探讨二者在胃癌发生、发展中的作用。
1 资料与方法
1.1 临床资料 选择2012年2月~2014年2月河北医科大学第二医院胃肠外科收治的胃癌患者79例(观察组),均经术后组织病理检查明确诊断,术前均未接受过放化疗及其他药物治疗。其中男51例、女28例,年龄43~76(57.9±10.3)岁;TNM分期(2009年国际抗癌联盟分期标准):Ⅰ期9例,Ⅱ期23例,Ⅲ期36例,Ⅳ期11例;组织分化程度:低分化37例,中分化28例,高分化14例;伴有淋巴结转移51例。同期另选在该院体检健康者120例(对照组),男83例、女37例,年龄38~77(58.6±9.2)岁。两组性别、年龄具有可比性。本研究经医院医学伦理学委员会批准,患者及家属均知情同意。
1.2 Survivin、RHAMM表达检测 采用免疫组化法。观察组取手术切除的胃组织标本、对照组取胃镜活检胃组织标本,标本经甲醛固定,石蜡包埋,4 μm厚连续切片,二甲苯常规脱蜡,不同浓度梯度乙醇水化,3%双氧水阻断过氧化物酶,最后在pH 6.0的枸橼酸缓冲液中高温煮沸进行抗原修复。按照说明书常规行SP染色,DAB显色,苏木素复染。以已知阳性组织作为阳性对照,以PBS替代一抗作为阴性对照。Survivin、RHAMM阳性表达定位于细胞膜和(或)细胞质内,呈棕黄色颗粒[5]。随机计数5个高倍镜视野或1 000个细胞,根据染色强度和阳性细胞百分比综合计分。染色强度:不着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞百分比[6]:无阳性细胞为0分,阳性细胞≤10%为1分,>10%~≤50%为2分,>50%~≤80%为3分,>80%为4分。两项积分相乘≥6分为高表达、<6分为低表达。分析Survivin、RHAMM表达与胃癌患者临床病理参数的关系及二者表达的相关性。
1.3 统计学方法 采用SPSS19.0统计软件。计数资料以率表示,比较采用χ2检验。相关性分析采用Spearman相关分析法。P<0.05为差异有统计学意义。
2 结果
观察组Survivin、RHAMM阳性表达率分别为70.89%(56/79)、68.35%(54/79),对照组分别为9.17%(11/120)、2.50%(3/120),两组比较P均<0.05。胃癌组织Survivin、RHAMM阳性表达与患者性别、年龄、组织分化程度均无关(P>0.05),均与肿瘤体积、浸润深度、淋巴结转移、病理分期均有关(P均<0.05),见表1。Spearman相关分析显示,胃癌组织中Survivin阳性表达与RHAMM阳性表达呈正相关(r=0.452,P<0.05)。
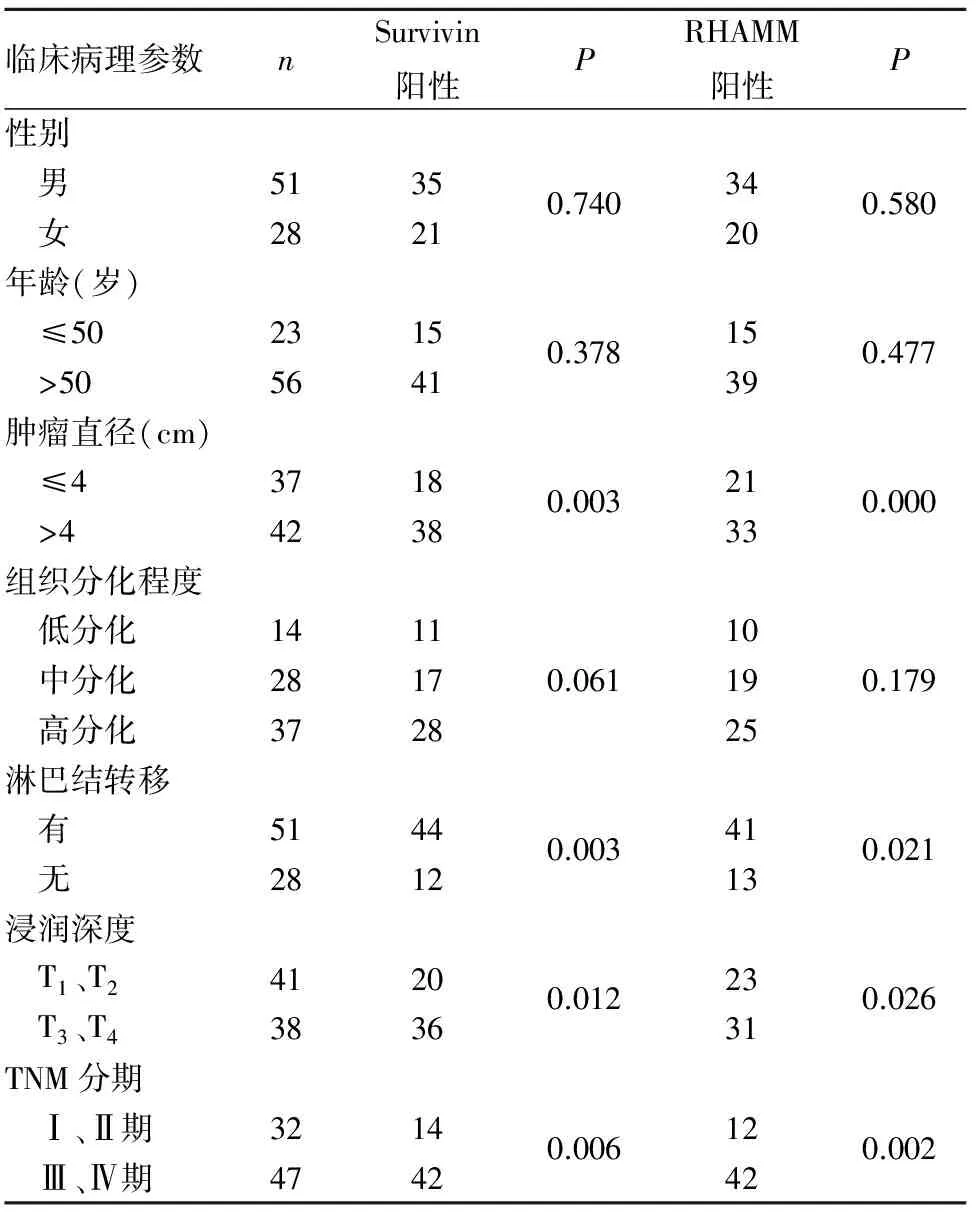
表1 胃癌组织中Survivin、RHAMM表达与患者临床病理参数的关系(例)
3 讨论
胃癌是多种基因共同作用的复杂生物学过程[7]。随着分子生物学技术的发展,胃癌的发生、发展及其转移的分子机制成为当前研究的热点。
Survivin是IAPs中结构较为独特的一员,具有抑制细胞凋亡、调节细胞周期和细胞分裂的功能[8]。Survivin参与抗凋亡的作用机制主要包括:通过抑制caspase-3、caspase-7等不同凋亡蛋白酶的活性以阻止凋亡信号来避免细胞凋亡;在细胞有丝分裂发生的前期与纺锤体的微管特异性结合,避免细胞周期G2/M期检测点对肿瘤细胞的监控,继而抵抗DNA损伤和突变所致的细胞凋亡,最终促进肿瘤细胞的异常分裂和增殖[9]。RHAMM作为透明质酸的促转移受体,主要分布在细胞膜的表面及细胞质和细胞核中。有研究显示,RHAMM在乳腺癌、结直肠癌等恶性肿瘤组织中均有不同程度表达,说明RHAMM参与了恶性肿瘤的发生及发展过程[10]。但目前关于二者在胃癌组织中表达的报道较少。
本研究结果显示,观察组Survivin、RHAMM阳性表达率明显高于对照组,说明Survivin、RHAMM可能均参与了胃癌的发生、发展过程,与其他相关研究[11~14]结果一致。本研究还发现,胃癌组织Survivin、RHAMM阳性表达与肿瘤大小、浸润深度、淋巴结转移及临床病理分期有关,与患者性别、年龄、组织分化程度无关;即肿瘤直径越大、浸润程度越深、临床病理分期越高,Survivin、RHAMM阳性表达率越高,伴有淋巴结转移者Survivin、RHAMM阳性表达率明显升高,与其他相关研究[15,16]结果一致。本研究结果显示,Survivin与RHAMM在胃癌组织中的阳性表达呈正相关,说明Survivin、RHAMM在胃癌的发生、发展过程中具有协同作用,但其具体机制仍需进一步深入研究。
综上所述,胃癌组织中Survivin、RHAMM表达升高,二者的表达变化参与胃癌的发生、发展及转移过程,二者可作为胃癌早期诊断、治疗及评估预后的指标之一。
[1] 刘剑,尚鑫,沙素梅,等.转录因子FOXP1在胃癌组织中的表达及意义[J].现代生物医学进展,2014,14(5):814-818.
[2] 廖毅,邓媛,傅建伟.胃癌分子机制的研究进展[J].中国肿瘤,2014,23(1):58-62.
[3] 张运贵,黄咏梅,张树民,等.E-cadherin、Survivin在胃癌及癌旁组织中的表达及临床意义研究[J].中华临床医师杂志(电子版),2013,7(19):8670-8674.
[4] Hatano H, Ogawa I, Shigeishi H, et al. Expression of receptor for hyaluronan-mediated motility (RHAMM) in ossifying fibromas[J]. Histol Histopathol, 2013,28(4):473-480.
[5] Yang L, Zhu H, Liu D, et al. Aspirin suppresses growth of human gastric carcinoma cell by inhibiting survivin expression[J]. J Biomed Res, 2011,25(4):246-253.
[6] Shinani M, Sangawa A, Yamao N, et al. Immunohistochemical expression of nuclear and cytoplasmic survivin in gastrointestinal carcinoma[J]. Int J Clin Exp Pathol, 2013,6(12):2919-2927.
[7] 曹晓静,赵莉,王志敏,等.胃癌Livin和Survivin表达及其与临床病理因素的相关性分析[J].河北医药,2013,35(3):327-329.
[8] 周露婷,王翠翠,景洪标,等.Survivin和Bcl-2蛋白在胃癌细胞中的表达及其与化疗药物耐药性关系的研究[J].现代肿瘤医学,2014,22(7):1627-1629.
[9] 范树养,池圣亮.Survivin在胃癌组织中的表达及其与生物学行为的关系[J].中国药物与临床,2012,12(10):1280-1281.
[10] Sankaran D, Pakala SB, Nair VS, et al. Mechanism of MTA1 protein overexpression-linked invasion: MTA1 regulation of hyaluronan-mediated motility receptor(HMMR) expression and function[J]. J Biol Chem, 2012,287(8):5483-5491.
[11] 孙延霞,石张镇,卢振霞,等.Survivin在胃癌组织中的表达及临床意义[J].中国实验诊断学,2012,16(5):844-846.
[12] 张涛.胃癌组织中CD44v6和RHAMM的表达及临床意义[J].重庆医科大学学报,2012,37(3):216-218.
[13] 仰丽丽,文剑.p21和Survivin在胃癌组织中的表达及临床意义[J].实用癌症杂志,2013,28(5):483-485.
[14] 王家银,关向宏,战雪梅.survivin在胃癌组织中的表达及临床意义[J].诊断病理学杂志,2004,11(1):38-39.
[15] 孙益红,汪学非,秦新裕,等.survivin在胃癌组织中的表达及其临床意义[J].中华胃肠外科杂志,2003, 6(3):191-194.
[16] 张涛.胃癌组织中CD44v6和RHAMM的表达及临床意义[J].重庆医科大学学报,2012,37(3):216-218.
河北省卫生厅指导计划项目(201000298)。
刘津(E-mail: liujin123123@126.com)
10.3969/j.issn.1002-266X.2016.28.018
R575.5
B
1002-266X(2016)28-0053-03
2016-04-26)

