126例贵州省少数民族老年非瓣膜性房颤患者血清炎性因子水平变化及意义
袁诚,李伟,朱代荣,潘本荣,江玮,蒙灼
(1普定县人民医院,贵州普定562100;2贵州医科大学)
126例贵州省少数民族老年非瓣膜性房颤患者血清炎性因子水平变化及意义
袁诚1,李伟2,朱代荣1,潘本荣1,江玮1,蒙灼1
(1普定县人民医院,贵州普定562100;2贵州医科大学)
目的 观察血清炎性因子在126例贵州省少数民族老年非瓣膜性房颤患者中的变化,并探讨其意义。方法 选取贵州省老年非瓣膜性房颤患者126例,其中阵发性房颤66例、持续性房颤60例;另外选取体检健康者60例。研究对象均于入院第2天清晨空腹抽取外周静脉血,采用免疫比浊法检测血清高敏C反应蛋白(hs-CRP),采用酶联免疫吸附法检测血清IL-6和TNF-α,采用超声心电图检查左心房内径(LAD),采用Logistic多元回归分析法分析非瓣膜性房颤发生的危险因素,分析血清hs-CRP、IL-6、TNF-α水平与LAD的相关性。结果 阵发性房颤和持续性房颤患者血清hs-CRP、IL-6、TNF-α水平及LAD均高于体检健康者(P均<<0.01)。Logistic多元回归分析显示,hs-CRP、IL-6、TNF-α、LAD是阵发性房颤、持续性房颤发生的危险因素(P均<0.05)。阵发性房颤患者血清hs-CRP、IL-6、TNF-α水平与LAD均呈正相关(r分别为0.402、0.652、0.458,P均<0.05),持续性房颤患者血清hs-CRP、IL-6、TNF-α水平与LAD均呈正相关(r分别为0.416、0.751、0.234,P均<0.05)。结论 贵州省少数民族老年非瓣膜性房颤患者血清炎症因子水平升高;炎症因子可能通过影响心房重构诱发房颤的发生。
心房颤动;非瓣膜性房颤;白介素6;高敏C反应蛋白;肿瘤坏死因子α;左心房内径
据统计,60~89岁老年人心房颤动(简称房颤)发病率达15.4%[1]。房颤包括非瓣膜性房颤和瓣膜性房颤,其中非瓣膜性房颤约占64%[2],且易伴发脑梗死,致残率、致死率高。研究发现,炎症因子与汉族老年非瓣膜性房颤发生、发展密切相关[3]。贵州省是少数民族大省,且少数民族群居性及基因相对单纯,目前炎症因子与少数民族非瓣膜性房颤发生、发展关系的报道较少。本研究观察血清炎性因子在126例贵州省老年非瓣膜性房颤中的变化,探讨其在房颤发生、发展中的作用。
1 资料与方法
1.1 临床资料 选取2013年9月~2015年2月贵州省普定县人民医院收治的少数民族老年非瓣膜性房颤患者126例(观察组),主要临床表现为心悸、胸闷、气短等,入院后均行心电图等检查以明确诊断。其中阵发性房颤66例,男38例、女28例,年龄(70.1±8.2)岁,BMI 23.8±2.1,高血压50例、冠心病6例、糖尿病10例,苗族22例、布依族20例、白族8例、土家族6例、傣族5例、彝族5例;病程均小于1周,近3天均有阵发性房颤发作,发作呈自限性,均自行转复。持续性房颤60例,男32例、女28例,年龄(70.1±7.9)岁,BMI 23.6±2.2,高血压46例、冠心病6例、糖尿病8例,苗族20例、布依族17例、白族8例、土家族6例、傣族5例、彝族4例;病程均大于1周,药物转复效果差,多数给予电转复。阵发性房颤、持续性房颤诊断均参照欧洲心脏协会制定的非瓣膜性房颤及其分型诊断标准。排除合并自身免疫性疾病及各种急慢性感染、风湿热、慢性肝病、肾病、恶性肿瘤、甲状腺功能亢进等患者。另外选取我院同期体检健康者60例为对照组,男35例、女25例,年龄(73.4±5.48)岁,BMI 23.67±2.25,苗族22例、布依族14例、白族7例、土家族7例、傣族6例、彝族4例。两组年龄、性别、民族、BMI均具有可比性。
1.2 血清炎症因子及左心房内径(LAD)检测 各组均于入院第2天清晨空腹抽取外周静脉血5 mL,离心分离血清,采用免疫比浊法测定高敏C-反应蛋白(hs-CRP),采用酶联免疫吸附法检测IL-6和TNF-α,采用超声心动图检查LAD。
1.3 非瓣膜性房颤危险因素及hs-CRP、IL-6、TNF-α与LAD的相关性分析 以是否出现阵发性房颤或持续性房颤为因变量,以血清hs-CRP、IL-6、TNF-α及LAD为自变量,采用Logistic多元回归分析法分析非瓣膜性房颤发生的危险因素。
2 结果
2.1 各组血清hs-CRP、IL-6、TNF-α水平及LAD比较 观察组阵发性房颤和持续性房颤患者血清hs-CRP、IL-6、TNF-α水平及LAD均高于对照组(P均<0.01)。见表1。

表1 各组血清hs-CRP、IL-6、TNF-α水平及LAD比较
注:与对照组比较,*P<0.01。
2.2 非瓣膜性房颤危险因素 Logistic多元回归分析显示,hs-CRP、IL-6、TNF-α、LAD是阵发性房颤、持续性房颤发生的危险因素(P均<0.05)。见表2、3。
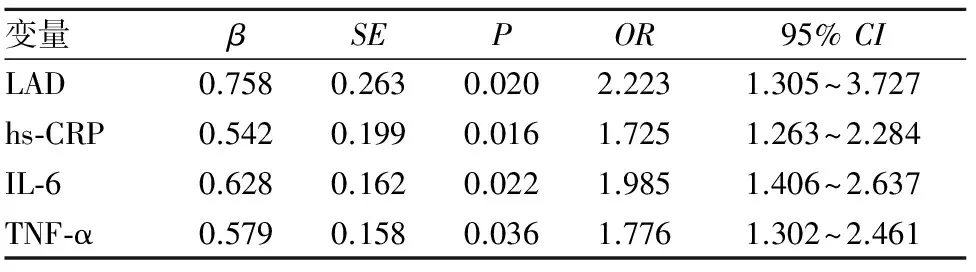
表2 阵发性房颤发生危险因素的Logistic多元回归分析结果
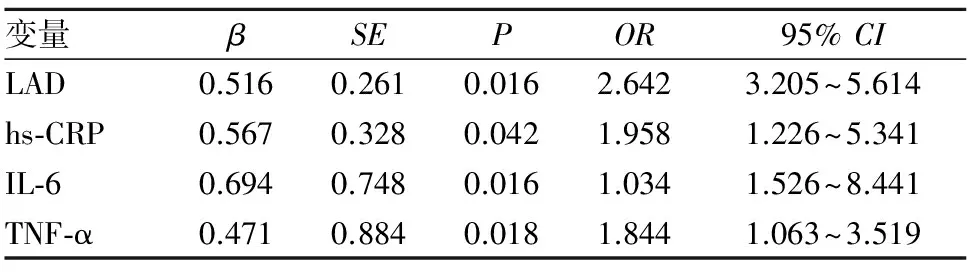
表3 持续性房颤发生危险因素的Logistic多元回归分析结果
2.3 相关性分析 阵发性房颤患者血清hs-CRP、IL-6、TNF-α水平与LAD均呈正相关(r分别为0.402、0.652、0.458,P均<0.05),持续性房颤患者血清hs-CRP、IL-6、TNF-α水平与LAD均呈正相关(r分别为0.416、0.751、0.234,P均<0.05)。
3 讨论
房颤是临床常见的心律失常之一,其中瓣膜性、非瓣膜性和孤立性房颤所占比例分别约为12.9%、65.2%和21.9%[4]。根据其发作特点分为阵发性房颤、持续性房颤及永久性房颤,其中阵发性房颤是指房颤发作持续时间<7天,一般<24 h,多为自限性;持续性房颤是指持续时间>7天的房颤,一般不能自行复律,药物复律的成功率较低,常需电复律。我国房颤的发病率约为0.61%[5],其中1/3为阵发性房颤,2/3为持续或永久性房颤。老年人发生房颤的概率较高,高血压、冠心病、心力衰竭、风湿性瓣膜病是其发生房颤的危险因素。目前多数研究认为,炎症因子参与房颤的发生、发展与复发[6~8],但研究对象多为汉族人群,对少数民族人群的报道较少。贵州省是少数民族聚集和人数较多省份,苗族、布依族、傣族、白族、土家族、彝族人数相对较多,其中苗族人数排在首位,这些少数民族有群居且不与外族通婚的习俗,基因相对单纯;且大部分居住在山区,经济条件相对差,卫生院诊疗水平落后,当地医院进行动态心电图、超声心动图等检查相对困难,且价格昂贵。需寻找一种简单易行、费用低廉的预测房颤发生、发展以及判断预后的方法。
hs-CRP是肝脏合成的一种急性蛋白,在健康人体中微量存在,当组织损伤、感染等情况下机体干细胞合成hs-CRP加速,血液hs-CRP水平升高,且血清hs-CRP水平与组织损伤程度呈正相关。研究显示,房颤的发生与hs-CRP水平有关,hs-CRP可作为房颤发生的独立危险因子,并可作为评估患者预后的指标[9,10]。hs-CRP参与房颤发生可能与其影响心房结构重构和电重构有关。血清hs-CRP水平升高可抑制细胞产生NO,导致心房细胞受损;促进心房肌间质纤维化;减少心房肌细胞线粒体DNA,导致恶性氧化应激循环。此外,在房颤发生过程中hs-CRP水平升高影响心房肌细胞膜功能,诱发持续性房颤发生[10,11]。IL-6是活化炎症细胞产生的促炎症因子,能够刺激细胞大量生成hs-CRP,同时促进纤维蛋白原的合成,加重炎症反应[12]。TNF-α属于炎症反应启动因子,能进一步促进IL-6合成,进而促进hs-CRP合成,引发一系列炎症反应。TNF-α通过与其受体TNFRⅠ和TNFRⅡ结合诱导金属蛋白酶释放、抑制基质蛋白酶释放,参与细胞外基质重塑,刺激胶原合成,促进心肌间质纤维化,引起心肌基础重构,破坏心肌间质胶原网络,导致纤维化组织传导不一致,诱发房颤[13,14]。此外,TNF过表达可下调层连蛋白40表达,进而缩短有效不应期,引发房颤。本研究观察组阵发性房颤和持续性房颤患者血清hs-CRP、IL-6、TNF-α水平均高于对照组,进一步说明hs-CRP、IL-6、TNF-α参与了房颤的发生;Logistic多元回归分析结果显示,hs-CRP、IL-6、TNF-α是阵发性房颤、持续性房颤发生的危险因素;上述结果与汉族人群研究结果相同[15,16]。
结构重构在房颤启动和维持过程中发挥关键作用,发生机制主要是心房纤维化,临床表现为心房扩大;大部分促发房颤的因素最终都能引起心房扩大及纤维化;心房扩大是房颤发生及发展的重要原因。LAD是反映心房大小的最常用指标。本研究观察组阵发性房颤及持续性房颤患者LAD均高于对照组;Logistic多元回归分析显示LAD是阵发性房颤、持续性房颤发生的危险因素,提示心房扩大参与了少数民族老年阵发性房颤和持续性房颤的发生。本研究中阵发性房颤和持续性房颤患者血清hs-CRP、
IL-6、TNF-α与LAD均呈正相关,与汉族人群研究结果相同[17];提示炎症因子可能通过影响心房重构、导致心房扩大,进而诱发房颤的发生。
综上所述,贵州省少数民族老年非瓣膜性房颤患者血清炎症因子水平升高,炎症因子可能通过影响心房重构诱发房颤的发生。
[1] 张丽琴,洪浪,赖珩莉.心房颤动的诊治进展[J].心血管病学进展,2013,34(1):145-149.
[2] 杜晓明,陈闯,秦炎寒,等.非瓣膜性房颤患者华法林应用调查分析[J].中国药学杂志,2015,50(22):2000-2003.
[3] 魏晓明.非瓣膜性老年房颤患者血清炎性因子水平[J].中国老年学杂志,2014,25(20):5683-5684.
[4] 张勇,杨宝峰.心房颤动发病机制研究进展[J].沈阳药科大学学报,2011(8):680-686.
[5] 杨进刚.心房颤动的诊断与药物治疗(中国专家共识)[J].心脑血管病防治,2008,8(4):215-217.
[6] 刘晓宇,沈玉祥.老年非瓣膜性心房颤动患者左心室功能受损程度与血清肿瘤坏死因子水平的关系[J].中华老年心脑血管病杂志,2013,15(1):89.
[7] 代艳伟,张博,张磊.老年心房颤动并发脑栓塞及抗凝治疗临床研究[J].中国实用医药,2013,8(5):33-34.
[8] 刘强,沈金龙,蒋超鹏,等.非瓣膜性房颤中医辨证分型与黏附分子表达关系的初步研究[J].中华中医药杂志,2014,29(3):947-949.
[9] 魏玲,孙林辉,李丽娟等.老年非瓣膜性心房颤动患者血清Ⅰ型及Ⅲ型前胶原肽及血管紧张素转换酶基因多态性[J].中国心脏起搏与心电生理杂志,2008,22(4):333-336.
[10] 杨杰孚,王华,许晓东,等.老年非瓣膜心脏病心房颤动患者血小板功能及血管性血友病因子的改变[J].中华老年医学杂志,2003,22(3):156-158.
[11] 马云青,吴冬科,郑泽琪,等.老年非瓣膜病性心房纤颤患者高凝状态的研究[J].江西医学院学报,2007,47(6):54-55,58.
[12] 徐军,缪东培,包知达,等.老年非瓣膜性心房纤颤的伴随疾病和节律控制的状况分析[J].医学研究生学报,2006,19(11):1013-1015.
[13] 种甲,杨杰孚.非瓣膜性心房颤动患者内皮和血小板功能及β受体阻滞剂干预的临床意义[J].中华老年医学杂志,2011,30(3):184-187.
[14] 郑堃,马丽霞,郭秀珍,等.血清CD40L、TNF-α、IL-1β水平与急性冠脉综合征继发室性心律失常的关系[J].山东医药,2015,55(41):45-46.
[15] 丁芳,黄振文,许爱国,等.急性冠脉综合征患者血清炎性标志物浓度变化及其临床意义[J].山东医药,2005,45(10):19-21.
[16] 罗薇,张晶,纪征.炎性反应因子与非瓣膜病性房颤高凝状态相关性分析[J].吉林医学,2015,36(5):905.
[17] 张庆文,苗懿德,苏琳,等.老年非瓣膜性心脏病并房颤患者血清炎性因子水平的研究[J].中国现代医学杂志,2014,24(7):60-63.
国家科技支撑计划项目(2013BAI09B01)。
李伟(E-mail: 42345378@qq.com)
10.3969/j.issn.1002-266X.2016.28.025
R541.7
B
1002-266X(2016)28-0070-03
2015-11-26)

