富硒茶多糖的分离纯化及抗氧化性研究
冯丽琴, 杨芙莲, 董文宾
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
富硒茶多糖的分离纯化及抗氧化性研究
冯丽琴, 杨芙莲, 董文宾
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
经过超滤、大孔树脂吸附柱、聚酰胺层析柱以及透析纯化了茶多糖,并采用紫外光谱扫描和红外光谱扫描初步鉴定茶多糖的结构,同时对茶多糖的抗氧化性能进行了研究.结果表明:纯化后的茶多糖含量由27.67%增加到81.86%;UV检测显示茶多糖在260~280 nm处有明显的吸收,表明茶多糖是一种糖蛋白;红外检测证实茶多糖具有多糖的特征吸收峰;茶多糖对DPPH自由基、超氧阴离子自由基和羟基自由基存在一定的清除作用,并且它的清除能力与浓度在一定范围内存在一定的量效关系,表明茶多糖具有较好的抗氧化能力,且纯品的抗氧化性比粗品的效果好.
茶多糖; 纯化; 结构; 抗氧化
0 引言
紫阳富硒茶产于陕西省紫阳县天然富硒区,是当今世界上首个通过科学鉴定,具有独特保健功效的优质绿茶.除了具备普通茶叶的功能性成分外,富硒茶最显著的特点就是富含硒元素,是一种补硒佳品[1].
茶多糖是一类与蛋白结合在一起的酸性糖蛋白[2].茶多糖的蛋白部分含约20种常见的氨基酸;糖的部分主要由阿拉伯糖、木糖、岩藻糖、葡萄糖、半乳糖等单糖组成;与多糖结合的矿质元素主要有镁、铁、锰以及少量的微量元素,如稀土元素.茶多糖具有提高免疫力、降血脂、降血糖、抗辐射、抗凝血,抗血栓等功效[3,4].
茶多糖是一种重要的生物活性物质[5],本实验主要研究了茶多糖的抗氧化活性,为富硒茶的研究提供理论依据.
1 材料与方法
1.1 材料与试剂
富硒茶,陕西省安康市紫阳县盘龙天然富硒绿茶有限公司;AB-8大孔树脂、聚酰胺,Pharmacia公司;葡萄糖标准品,美国Sigma公司.
三氯甲烷、无水乙醇、95%乙醇、VC 、1,1-二苯基-2-苦基肼(1,1-d ipheny 1-2-picryl-hydrazyl,DPPH)、铁氰化钾[K3Fe(CN)6]、三氯乙酸(TCA)、邻苯三酚、盐酸、水杨酸,均为分析纯.
1.2 主要仪器与设备
紫外分光光度计,尤尼柯(上海)仪器有限公司;超滤机,上海新拓分析仪器科技有限公司;真空旋转蒸发仪,西安安泰仪器科技有限公司;超声波清洗仪,郑州长城科工贸有限公司;傅立叶红外光谱分析仪,德国布鲁克Bruker公司.
1.3 方法
1.3.1 富硒茶多糖的制备
以水为溶剂,采用超声波辅助法提取,过滤取滤液,减压浓缩,加乙醇使乙醇含量达到80%,4 ℃静置48 h,离心,所得即为粗多糖.将粗茶多糖溶于去离子水,过孔径为50KD超滤膜除去蛋白质和核酸等生物大分子,上AB-8大孔树脂层析柱,以去离子水为洗脱液洗脱.大孔树脂洗脱液浓缩过聚酰胺层析柱,去离子水洗脱,浓缩洗脱液,加95%乙醇使其含量分别达到80%,4 ℃静置48 h,离心取沉淀,将沉淀依次用无水乙醇、丙酮和正丁醇分别洗涤3次,然后用透析袋透析48 h,真空冷冻干燥,即得茶多糖样品.
1.3.2 茶多糖紫外光谱分析
称取多糖样品10 mg,置于100 mL容量瓶,加双蒸水溶解并稀释至刻度,摇匀,在190~700 nm波长区间进行扫描[6].
1.3.3 茶多糖红外光谱分析
称取茶多糖样品1 mg,与100 mg的KBr混匀研磨后压片,采用红外光谱仪扫描分析,波长范围为4 000~400 cm-1,初步确定多糖的结构[7].
1.3.4 富硒茶多糖体外抗氧化性分析
(1)DPPH自由基清除率的测定
将茶多糖样品分别配制成0.2、0.4、0.8、1.0和2.0 mg/mL的浓度,每个待测样品溶液均与0.01 mmol/L的DPPH溶液混匀,室温下反应30 min后,在517 nm波长下测定其吸光度,用同体积的无水甲醇代替样品溶液作为空白对照,采用VC作为阳性对照[8].按公式(1)计算其清除率:
清除率(%)=(1-A1/A2)×100
(1)
式(1)中:A1-待测样品溶液吸光值;A2-空白对照溶液吸光值.
每个试验重复3次,结果取平均值.
(2)超氧阴离子自由基清除率的测定[9]
将茶多糖样品分别配制成0.2、0.4、0.8、1.0和2.0 mg/mL的浓度,依次加入1 mL 0.078 mol/LNBT,1 mL 0.468 mol/L NaOH,最后加入0.4 mL 的0.06 mol/L PMS溶液,室温摇匀,后静置5 min,于560 nm波长处测定吸光度.用蒸馏水作阴性对照,VC作阳性对照.按公式(1)计算其清除率.
(3)羟自由基清除作用的测定[10]
将茶多糖样品分别配制为0.2、0.4、0.8、1.0和2.0 mg/mL的浓度于试管中,依次加入1.5 mL 反应液[含0.1 mmol/L EDTA、0.1 mmol/L FeCl3和2.8 mmol/L DR 的磷酸盐缓冲液(pH7.4)],0.35 mL H2O2(20 mmol/L),37 ℃恒温水浴作用40 min 后,终止反应,于532 nm 波长处测定吸光度,蒸馏水为阴性对照,VC为阳性对照,按公式(1)计算其清除率.
2 结果与讨论
2.1 富硒茶多糖的讨论
取10 g富硒茶叶,料液比1∶35,超声波功率200 W,提取温度70 ℃,提取时间35 min的条件下得到粗茶多糖2.413 g,得率为24.13%,含量为27.67%.经超滤膜、AB-8大孔树脂、聚酰胺、透析后的茶多糖纯度可达到81.86%.
2.2 紫外光谱分析
紫外光谱分析结果如图1所示.在200 nm左右多糖样品有明显的吸收,此处为多糖的特征吸收峰.在260~280 nm处,样品有明显的吸收峰,表明样品含蛋白质,所以此多糖样品含糖蛋白.
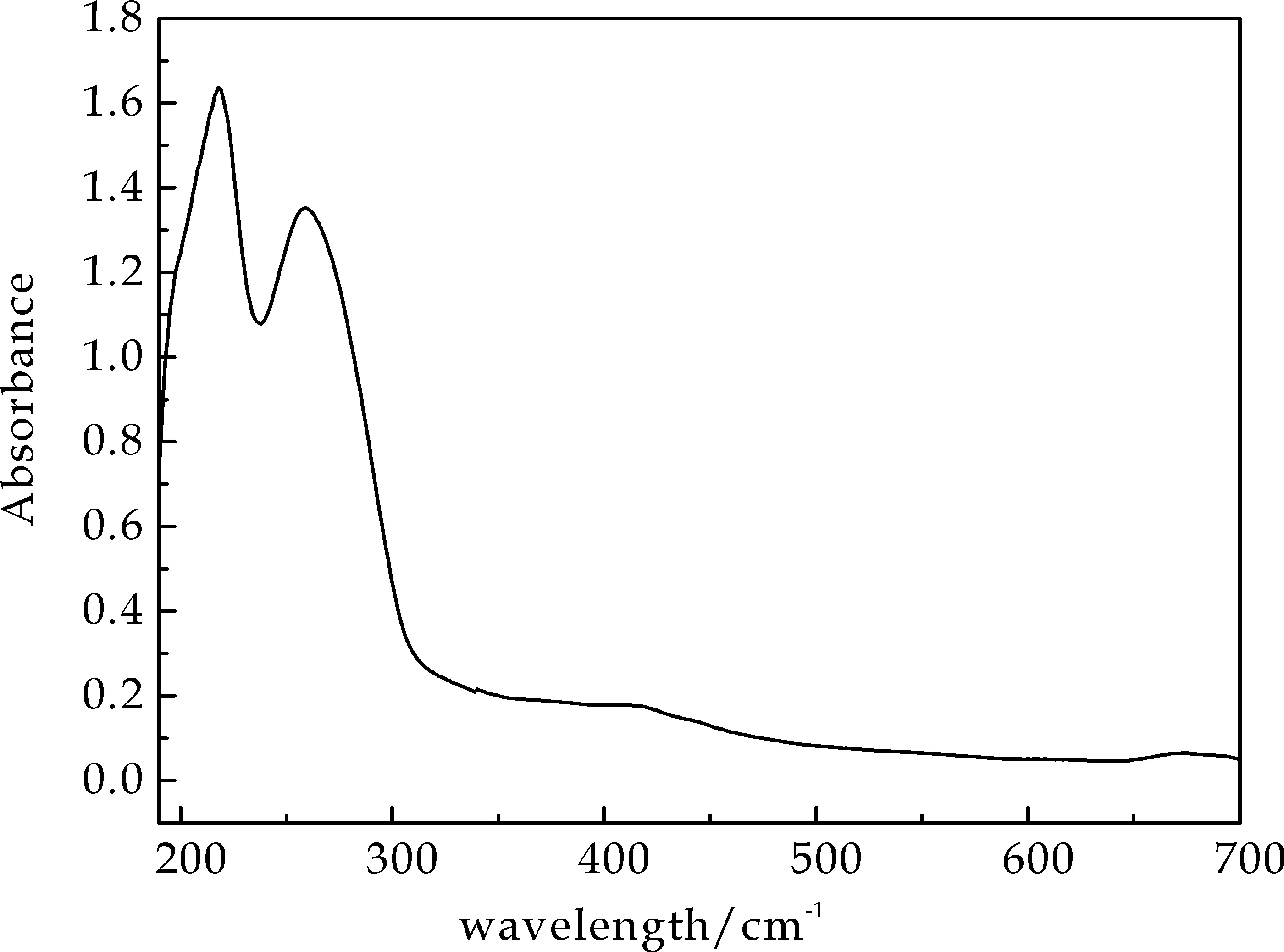
图1 茶多糖的紫外光谱
2.3 红外光谱分析
红外光谱分析结果如图2所示.茶多糖具有典型的多糖吸收峰3 403 cm-1、2 926 cm-1、1 642 cm-1、1 415 cm-1、1 321 cm-1[11].其中,3 403 cm-1处的吸收峰主要是由多糖的配糖体羟基缔合引起的伸缩振动,由于羟基形成氢键缔合后,O-H键拉长,偶极距增大,所以在3 403 cm-1处表现强而宽的峰;2 926 cm-1处的吸收是由碳键的伸缩振动引起的,强度相对较弱; 1 415 cm-1处的吸收峰位C-H弯曲振动.1 321 cm-1的吸收峰表示-COOH中的O-H变角振动和C-O-C的非对称;1 114 cm-1处的峰为分子中C-O键的伸缩振动,是碳氧键伸缩振动的特征,799 cm-1处的吸收峰表明,茶多糖具有吡喃糖环的骨架结构.
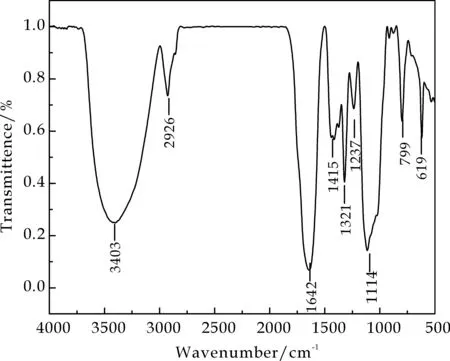
图2 茶多糖粗多糖的红外光谱
2.4 抗氧化性的测定
2.4.1 DPPH 自由基清除率的测定
DPPH自由基是一种很稳定的以氮为中心的自由基,其孤对电子在517 nm 波长附近有强吸收,当有自由基清除剂存在时,孤对电子被配对,吸收消失或减弱.因此通过测定吸收减弱的程度,来评价抗氧化剂的抗氧化活性[12].如图3 所示,茶多糖有显著的清除DPPH自由基的能力,且随着质量浓度的升高其清除能力增强.茶多糖样品浓度为2.0 mg/mL时,粗品的清除率为22.89%,纯品的清除率为27.21%.
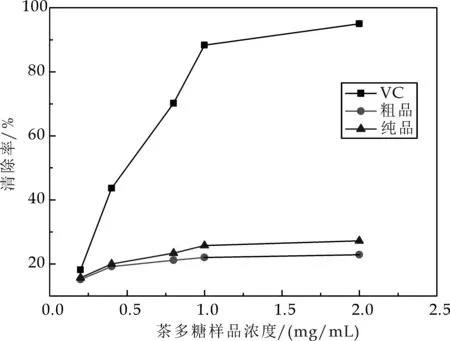
图3 茶多糖样品对DPPH的清除能力
2.4.2 超氧阴离子清除能力的测定
由超氧阴离子自由基分解而成的单线态氧和羟自由基具有使DNA的单股链断裂的功能[13,14].由图4可知,茶多糖对超氧阴离子自由基有很好的清除作用,在茶多糖样品浓度为2.0 mg/mL时,粗品的清除率为36.01%,纯品的清除率为41.35%.

图4 茶多糖样品对超氧阴离子的清除能力
2.4.3 羟基自由基的清除能力测定
羟基自由基具有超强的氧化能力[15],因此对羟自由基清除率的检测也是抗氧化剂抗氧化活性的指标之一[16].由图5可知,茶多糖对羟自由基有很好清除作用,并且随着质量浓度和纯度增强,清除能力增强.在茶多糖样品浓度为2.0 mg/mL时,粗品的清除率为25.22%,纯品的清除率为28.73%.
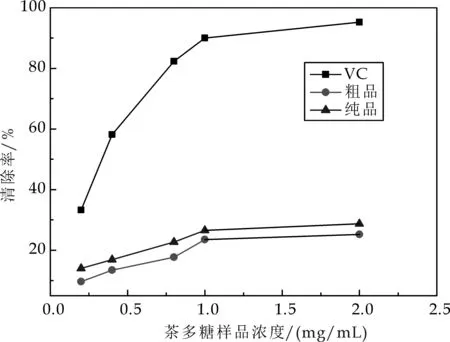
图5 茶多糖样品对羟基自由基的清除能力
3 结论
以富硒茶为原料,水为溶剂,超声波辅助法提取茶多糖,粗品经超滤膜、AB-8大孔树脂吸附、聚酰胺及透析处理可得到纯度较高的多糖.从紫外光谱分析,茶多糖样品含有蛋白质,为糖蛋白.红外光谱显示茶多糖具有明显的糖环特征吸收峰,表明茶多糖结构中存在-OH,C=O,C-O-C等官能团,并具有吡喃糖环的骨架结构.抗氧化性实验表明,紫阳富硒茶多糖具有一定的抗氧化能力,且在一定范围内抗氧化能力与浓度有一定的量效关系.
[1] 李永菊.浅谈富硒茶的保健作用[J].茶叶通报,2009,31(1):18-20.
[2] 易凤英,刘素纯,李佳莲.茶多糖的提取方法及生理功能研究[J].安徽农业科学,2010,38(6):2 911-2 913.
[3] 谢明勇,聂少平.茶叶多糖的研究进展[J].食品与生物技术学报,2006,25(2):107-115.
[4] 张跃林,朱纯玉.紫阳富硒茶对糖尿病模型大鼠血糖作用的影响[J].当代医学,2009,15(28):155.
[5] 陈朝银,叶 燕.普洱茶多糖的提取工艺及抗氧化活性研究[J].食品研究与开发,2008,29(4):13-16.
[6] 金征宇,顾正彪.碳水化合物-原理与应用[M].北京:化学工业出版社,2008:108-284.
[7] 闫景坤.抗氧化新型冬虫夏草胞外多糖的制备、结构与溶液特征研究[D].深圳:华南理工大学,2010.
[8] Caradador Martinez A,Loarca Pina G,Oomal B D.Antioxidant activity in common beans (phaseolus vulgaris L.)[J].J Agri & Food Chen,2002,50(24):6 975-6 980.
[9] 孟繁磊,张 敏.刺五加多糖的提取及其抗氧化性[J].吉林大学学报,2005,45(3):683-686.
[10] Nagal T,Myoda T,Nagashima T.Antioxidative activities of water extract and ethanol extract from field horsetail (tsukushi) equisetum arvense L[J].Food Chemistry,2005,91(3):389-394.
[11] 朱彩萍,张 民,张声华.枸杞多糖的组成及结构分析[J].中草药,2006,37(6):872-874.
[12] Siddhuraju P,Becker K.The antioxidant and free radical scavenging activities of processed cowpea (vigna unguiculata (L.) walp) seed extracts[J].Food Chemistry,2007,101(1): 10-19.
[13] Baydar N G,Ozkan G,Yasar S.Evaluation of the antiradical and antioxidant potential of grape extracts[J].Food Control, 2007,18:1 131-1 136.
[14] 罗祖友,严奉伟,薛照辉,等.藤茶多糖的抗氧化作用研究[J].食品科学,2004,25(11):291-294.
[15] 全吉淑,尹学哲,金泽武道.茶多糖抗氧化作用的研究[J].中药材,2007,30(9):1 116-1 118.
[16] 何传波,汤风霞.微波辅助提取铁观音茶多糖及其抗氧化活性研究[J].集美大学学报,2009,14(3):251-255.
【责任编辑:蒋亚儒】
Purification and antioxidant activities of polysaccharides from selenium enriched tea
FENG Li-qin, YANG Fu-lian, DONG Wen-bin
(School of Food and Biological Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China)
Tea polysaccharides were purified by ultrafiltration,macroporous resin adsorption column,polyamide column chromatography and dialysis.The structure of polysaccharide was preliminary analysised with UV and IR spectrum.The antioxidant properties of tea polysaccharides were studied.The result showed that the purity of tea polysaccharide increased from 27.67% to 81.86% after purification. Tea polysaccharide has a significant absorption peak in the wavelength of 260 ~280 nm,which indicates that tea polysaccharide was a kind of glycoprotein.Characterization of tea polysaccharide by FT-IR analysis showed the typical absorption of polysaccharide.The antioxidant experiments showed that the DPPH radical,the superoxide anion free radical and hydroxyl free radical could be eliminated by tea polysaccharide.In a certain range,there was a certain effect relationship between the concentration and the scavenging ability.
tea polysaccharide; purification; structure; anti-oxidation
2016-05-02
陕西省科技厅科技统筹创新工程计划项目(2013KTZB02-01-04); 西安市技术转移促进工程项目(CXY1434-3); 陕西省教育厅产业化培育计划项目(14JF002)
冯丽琴(1991-),女,江西鹰潭人,在读硕士研究生,研究方向:食品新材料制备与分析检测技术
1000-5811(2016)05-0133-04
TS218
A

