柠檬酸改性酒糟对重金属镉的吸附性能
董颖博 林 海 王 亮
(1北京科技大学环境工程系,北京 100083)(2北京科技大学工业典型污染物资源化处理北京市重点实验室,北京 100083)
柠檬酸改性酒糟对重金属镉的吸附性能
董颖博1,2林海1,2王亮1
(1北京科技大学环境工程系,北京100083)
(2北京科技大学工业典型污染物资源化处理北京市重点实验室,北京100083)
摘要:通过柠檬酸对酒糟改性后制备出改性酒糟,系统研究了改性酒糟对水溶液中重金属Cd的吸附性能.研究发现,质量浓度0.5%的柠檬酸改性酒糟对Cd(2+)的吸附量由改性前的4.09 mg /g提高到9.13 mg /g;酒糟改性后比表面积增大,微孔容积增加,且电负性增强.红外光谱分析表明,经过柠檬酸改性后酒糟有效官能团数目增多.改性酒糟对Cd(2+)的吸附量随pH值的升高先增加后略有降低,在2 h时达到吸附平衡,吸附饱和后随震荡时间的延长,Cd(2+)析出量很小.当pH值为6、初始Cd浓度为100 mg /L、改性酒糟投加量为10 g /L、吸附120 min时,改性酒糟对Cd(2+)的去除率达到91.50%,吸附量为9.15 mg /g.吸附等温线研究表明,Langmuir模型能更好地描述改性酒糟对Cd(2+)的吸附过程.
关键词:重金属;改性酒糟;镉离子;吸附性能
引用本文:董颖博,林海,王亮.柠檬酸改性酒糟对重金属镉的吸附性能[J].东南大学学报(自然科学版),2016,46(1) : 165-170.DOI: 10.
镉作为一种工业原料和催化剂,被广泛地应用于各个行业中.近年来,随着电镀工业、冶金工业、化工业、电子业和核工业等领域的快速发展,水环境中的镉污染日益严重,许多国家已将镉列为控制的污染物之一[1-2].在工业生产中,镉释放到水体中的主要途径包括采矿、冶炼、化学工业、肥料制造、冶炼厂废水、垃圾堆的冲刷和溶解等.重金属镉离子不具有生物降解性,在生物体内易于蓄积,具有毒性和致癌性,给人类健康和周围环境造成了巨大威胁[3].
目前,含镉废水的处理常用方法有化学沉淀法、离子交换法、膜分离法、生物修复法、吸附法等[4-6].化学法药剂消耗量大、运行成本高,药剂使用后难以回收利用,易产生二次污染.离子交换法除镉效率高、无二次污染,但树脂价格昂贵、设备投资成本高、再生频繁.膜分离法处理效率高,可回收部分镉,但膜组件设计困难、膜孔易堵塞、投资和运行成本均较高,难以大规模应用.生物修复法能耗少、成本低、无二次污染,但微生物的生长繁殖需要适宜环境条件,且修复周期长.而吸附法是一种操作简单且经济有效的去除废水中重金属的方法,国内外学者围绕寻找和开发高效而低廉的镉吸附材料做了广泛的研究.生物质材料对重金属有天然的亲和力,可用于净化浓度范围较广的重金属废水以及混合的金属离子废水,近些年有学者利用稻壳、玉米芯、甘蔗渣、柚子皮等吸附废水中的重金属离子[7-9].
啤酒糟是啤酒工业的主要副产品,我国啤酒糟年产量超过1 000万t,具有原料易得、成本低、操作简单等优点,但目前用酒糟处理含重金属镉离子废水的研究较少.另外,通常采用对生物质材料改性的手段进一步提高其吸附性能,柠檬酸处理生物质材料可增加吸附剂微孔和酸性官能团的数量,有利于对金属阳离子的吸附.基于此,本文采用酒糟作为研究对象,通过柠檬酸改性进一步提高其吸附重金属镉离子的性能,重点研究了改性酒糟在不同条件下对水中重金属镉的吸附性能.
1 试验材料与方法
1.1试验材料
试验酒糟由北京某酒厂提供,为啤酒酒糟.样品采集后,立即风干,置于型号DHG-9053A的恒温鼓风干燥箱中,在80℃下烘至恒重,将材料磨碎后过1.40 mm筛,装入聚乙烯袋中,放入干燥器中备用.对试验用啤酒糟进行了成分测定,测试得出其主要成分为粗蛋白16.52%、纤维素37.39%、半纤维素28.54%、脂肪6.47%、灰分4.56%.
试验用水为配制的模拟废水,用CdCl2配制一定浓度的Cd2+溶液,用0.10 mol/L的HNO3或NaOH调节溶液pH值.试验所用药剂均为分析纯.
1.2试验方法
1)改性酒糟的制备
采用柠檬酸对酒糟进行改性,具体步骤如下:分别配制100 mL质量浓度为0.25%,0.50%,0.75%,1.0%的柠檬酸溶液置于250 mL锥形瓶中,接着分别取5.0 g酒糟加入上述4个锥形瓶中,然后放置在型号HZQ-C的恒温空气浴振荡器中,在30℃、150 r/min下振荡4 h,过滤弃上清液,然后用去离子水冲洗所得固体改性酒糟至洗液pH值不变后,在80℃下烘干至恒重,储存备用.
2)比表面积和孔径分布测试试验
采用V-Sorb X4800型氮吸附分析仪对柠檬酸改性前后酒糟的比表面积和孔径进行分析测试.
3) Zeta电位测试试验
在室温下,分别称取0.10 g原酒糟和柠檬酸改性酒糟于100 mL浓度为0.001 mol/L KCl溶液中,采用超声波分散样品,用HCl和KOH的稀溶液调整pH值,然后采用Zeta Plus型Zeta电位仪对改性前后的酒糟进行Zeta电位测定.
4)傅里叶红外光谱分析
红外光谱分析采用Nicolet Nexus 670型傅里叶红外光谱分析仪(美国),测试范围为400~4 000 cm-1.制样方法采用压片法,称取1~2 mg干燥粉末样品的原酒糟和改性酒糟与100~200 mg纯KBr粉末置于红外压片模具中,压成透明薄片,即可进行测定.
5)不同条件下改性酒糟对Cd2+的吸附试验
采用单因素试验方法分别考察溶液pH值、吸附时间、初始Cd2+浓度、吸附材料投加量4个因素对改性酒糟吸附Cd2+效果的影响.具体步骤如下: 取100 mL含一系列浓度的Cd2+溶液,置于250 mL锥形瓶中,用HNO3或NaOH调节溶液的不同pH值,分别投加一定量的改性酒糟,然后置于型号HZQ-C的恒温空气浴振荡器中在25℃、140 r/min条件下恒温振荡不同时间,每个试验设置3个平行对照组.吸附反应结束后用G3砂芯漏斗进行抽滤,取滤液,测定滤液中剩余Cd2+浓度,试验数据取平均值.
1.3评价指标
采用型号TAS-990AFG的原子吸收分光光度计测定溶液中Cd2+浓度,改性酒糟对水溶液中镉离子的吸附效果采用吸附量及去除率2个指标衡量,分别按下式进行计算:式中,qt为吸附容量,mg /g; r为去除率,%; C0为初始镉离子浓度,mg /L; C1为剩余镉离子浓度
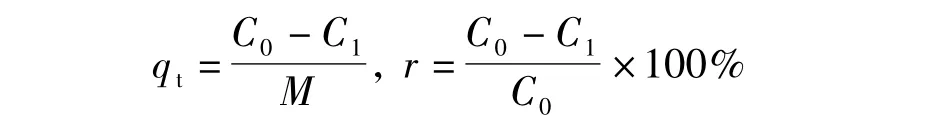
,mg /L; M为吸附材料投加量,g /L.
2 结果与讨论
2.1酒糟经柠檬酸改性前后的吸附效果对比
分别采用质量浓度为0.25%,0.50%,0.75%,1.00%柠檬酸对酒糟进行改性,然后采用不同改性酒糟样品在模拟含Cd2+废水中进行静态吸附试验,并与改性前酒糟的吸附效果进行了对比.吸附试验条件为25℃,初始Cd2+浓度为100 mg/L,溶液pH值为6,吸附材料投加量为10 g/L,振荡2 h,试验结果如表1所示.

表1 不同浓度柠檬酸改性酒糟对Cd2+的吸附效果
从表1可以看出,酒糟经不同质量浓度柠檬酸改性后,对Cd2+的吸附效果均有所提高.酒糟改性前对Cd2+的吸附量为4.09 mg/g,0.25%和0.50%柠檬酸改性酒糟对Cd2+的吸附量分别为7.62,9.13 mg/g,相比原酒糟吸附效果有所提高.提高改性剂柠檬酸的质量浓度至0.75%,1.00%后,改性酒糟对Cd2+的吸附量比0.50%柠檬酸改性酒糟的效果略微有提高.综合考虑吸附效果和改性剂用量,选择质量浓度0.50%柠檬酸改性酒糟进行后续研究.
2.2比表面积及孔径分布
分别测定了原酒糟和改性酒糟的比表面积、总体积(孔容)及孔径分布,结果如表2所示.可以看出,原酒糟的比表面积为0.285 m2/g,改性后其比表面积达到了1.539 m2/g,是改性前的5.4倍;孔径测试结果表明,酒糟改性后总孔容积为0.035 cm3/g,比原酒糟略有提高,但微孔容积却提高很多,微孔容积所占比例由改性前的5.3%提高至12.8%,表明了柠檬酸改性使得酒糟的孔隙更加发达,形成了很多新的微孔,从而增大了其比表面积,也为重金属离子提供了更多的吸附位点,有利于其吸附.
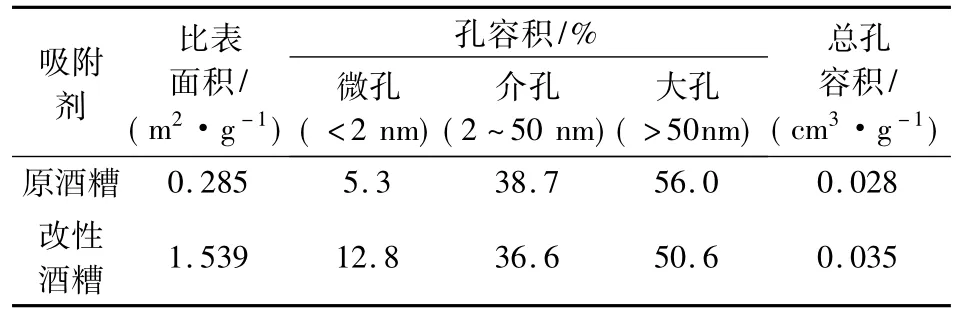
表2 改性前后酒糟的比表面积和孔径分布
2.3 Zeta电位
Zeta电位表示颗粒之间相互排斥或吸引力的强度,从而反映材料的带电情况及其吸附能力[10].对改性前后的酒糟进行Zeta电位测定,结果如图1所示.可以发现,酒糟及改性酒糟在水溶液中均带负电,从而能够以静电引力的方式吸附带正电的Cd2+;此外,二者电负性随着pH值的升高而增强,从而使吸附量也随pH的升高而增大,这从pH值影响试验中可以得到验证.酒糟改性后的电负性强于改性前,这说明改性处理使酒糟表面负电荷增多,有利于对Cd2+的吸附.
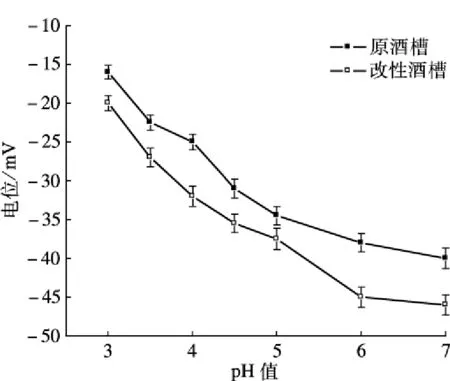
图1 酒糟改性前后的Zeta电位
2.4红外光谱分析
图2为柠檬酸改性啤酒糟前后的红外光谱图.由图中可知,原酒糟在3 418 cm-1处为羟基(—OH)峰,在2 925 cm-1和2 856 cm-1处分别为—CH2的不对称伸缩振动吸收峰和脂肪—CH2的对称伸缩振动吸收峰,在1 638 cm-1处出现的峰是以二聚体存在的羧酸和结合在酮或醛上的羰基(CO )伸缩振动的吸收峰,这种键在纤维素和木质素等聚合物中是常见的.
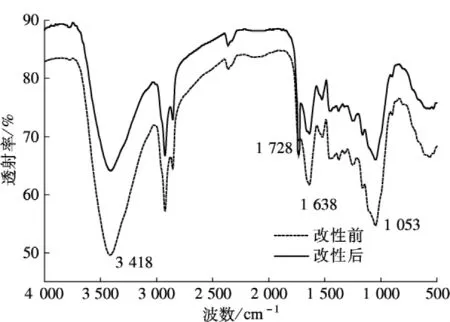
图2 酒糟改性前后的红外光谱图
柠檬酸改性后的酒糟除了在1 638 cm-1处出现峰外,又在1 728 cm-1出现了峰强的增加,此处为羧酸单体的CO羰基伸缩振动,说明在柠檬酸改性后酒糟羧基基团增加;另外3 418 cm-1的峰强变弱,证明其羟基发生了反应,而C—O一级羟基在1 053 cm-1的峰强变弱也说明了改性反应的发生[11].以上分析表明,经改性处理后的酒糟其表面基团组成与性质发生了明显变化,而此种变化有利于提升吸附剂的吸附能力.
2.5 pH值对Cd2+去除效果的影响
pH值是影响吸附的主要因素之一,它通过影响吸附材料的活性位点及重金属离子的化学形态从而影响吸附效果.考虑到在碱性溶液中Cd2+易形成沉淀,故考察溶液pH值在3~7之间变化.在25℃、初始Cd2+浓度为100 mg /L、振荡2 h的条件下,改性酒糟对Cd2+的去除效果见图3.

图3 pH值对改性酒糟去除Cd2+的影响
由图3可看出,在pH值为3~7之间时,随着pH值的升高改性酒糟对Cd2+的去除率及吸附量先增加后略有降低,Cd2+去除率稳定在85%以上.当pH值升到6时,二者分别达到91.50%,9.15 mg /g;其后继续增大溶液pH值,去除率及吸附量略微有下降.分析原因为:当pH值较低时,溶液中的氢离子浓度很大,这些氢离子会与溶液中的Cd2+产生竞争吸附,争夺吸附活性位点,占据吸附位点的氢离子,相同电荷之间的斥力作用阻碍Cd2+的靠近,从而使得吸附容量较低[12];当pH逐渐增加到6时,酸度大大降低,溶液中的氢离子浓度也变得很小,同时与Cd2+的竞争吸附作用也变弱,这时有更多的吸附位点空出来提供给Cd2+离子,从而使得吸附容量迅速上升;当pH值继续升高时,溶液中的氢离子浓度已经远小于Cd2+离子,其与Cd2+的竞争吸附作用可以忽略不计,绝大多数的活性吸附位点都已被Cd2+占据,故继续增加pH值,吸附剂的吸附容量增长不明显[13].
2.6吸附时间对Cd2+去除效果的影响
吸附剂与吸附质的接触时间也是影响吸附的重要因素[14].在Cd2+浓度为100 mg /L、pH值为6、温度为25℃、转速为140 r/min的条件下,考察吸附时间对吸附材料去除Cd2+的影响,结果如图4所示.
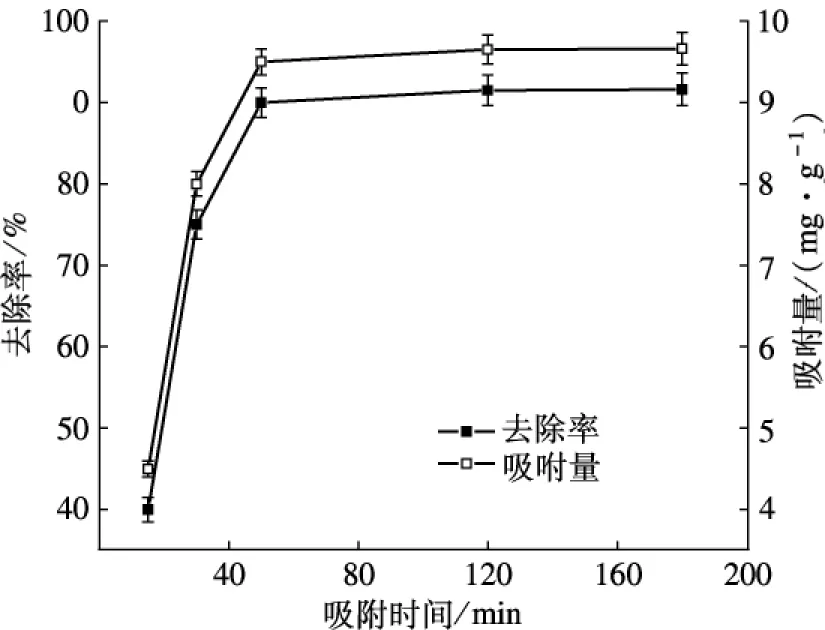
图4 吸附时间对改性酒糟去除Cd2+的影响
由图4可见,在吸附开始的30 min内,吸附速率很快,吸附量迅速增加,改性酒糟对Cd2+的吸附量增加到7.50 mg /g,Cd2+去除率为75%;在30~120 min时间内,改性酒糟对Cd2+的吸附量随吸附时间的延长缓慢增加,吸附速率下降;当吸附时间超过120 min后,吸附量变化不大,吸附逐渐趋向平衡,达到吸附饱和,Cd2+去除率也逐渐稳定;当吸附时间超过120 min后,去除率一直稳定在91.5%左右,吸附量维持在9.15 mg /g.吸附开始时吸附速率较快,随着时间的增长吸附速率下降直至吸附反应达到饱和.这可能是因为吸附反应开始时,吸附材料表面有较充足的活性吸附位点,随着吸附反应的进行,活性位点逐渐被占据而使反应达到平衡[15].
2.7初始Cd2+浓度的影响及吸附等温线
一般情况下,吸附剂对重金属离子的吸附量会随重金属离子浓度的增大而增大,最后达到一个稳定值.根据实际废水中Cd2+浓度的变化范围,研究Cd2+浓度在50~250 mg /L之间变化.当pH值为6、吸附剂投加量为10 g/L、吸附时间为2 h、温度为25℃时,改性酒糟对Cd2+的吸附规律如图5所示.
由图5可见,随着初始Cd2+浓度的增加,改性酒糟对Cd2+去除率不断下降,而吸附量却不断上升,最高增加至21.25 mg /g.这是因为相对于一定量的吸附剂,Cd2+浓度较低时,吸附材料表面活性位点随着Cd2+浓度的增大而逐渐被占据直至达到吸附平衡,故吸附量便会相应增大;而吸附材料表面活性位点的数量与Cd2+数量之比相对较大,故去除率较高.在实际废水处理中可以经过多级串联方式使出水Cd2+达到排放标准.

图5 镉初始浓度对改性酒糟去除Cd2+的影响
对试验数据进行Langmuir和Freundlich吸附等温线拟合,等温吸附常数见表3.可以看出,改性酒糟吸附Cd2+更加符合Langmuir等温线方程,其相关系数R2达到0.990,表明该吸附过程为单层吸附.
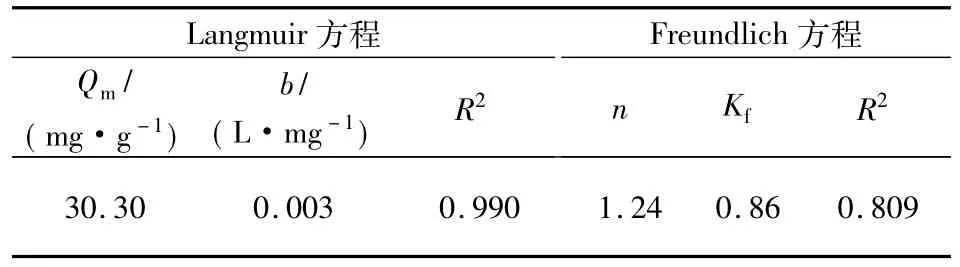
表3 改性酒糟对Cd2+的等温吸附常数
2.8投加量对Cd2+去除效果的影响
一般来说,随吸附材料投加量的增大,重金属离子去除率也将增大,但当吸附材料投加量增大到一定水平时,重金属离子去除率将稳定不变或者降低.在Cd2+初始浓度为100 mg/L、pH值为6、温度为25℃、吸附时间为2 h、转速为140 r/min的条件下,考察改性酒糟投加量对去除Cd2+效果的影响,结果如图6所示.由图可见,随着改性酒糟投加量的增加,Cd2+去除率呈先增加后保持稳定的趋势.在投加量为10 g/L时Cd2+去除率已达到91.50%,继续增加改性酒糟投加量,Cd2+去除率变化不大.吸附量随着吸附材料投加量的增加却不断降低,从9.15 mg/g降至4.60 mg/g.分析原因为:对于一定量的重金属离子来说,吸附剂投加量越多,可提供的吸附活性位点也越多,因此去除率就随之增高;但当金属离子浓度一定时,单位吸附剂表面上吸附的金属离子量的减少会导致吸附剂对金属离子的吸附量减小.

图6 吸附材料投加量对改性酒糟去除Cd2+的影响
酒糟作为生物质材料,灰分、氮、硫含量均较低,其SO2,NOx和灰尘的排放量比化石燃料要小得多,同时在生命周期内可实现CO2的零排放[16],因此,将吸附饱和的酒糟进行焚烧处理,可同时富集回收金属.
2.9改性酒糟对Cd2+的吸附稳定性
当材料吸附饱和后,被吸附离子是否溶出及溶出的量可用于表征材料对离子的吸附稳定性[15].为了研究改性酒糟对镉离子的吸附稳定性,将吸附时间120 min后已达到吸附饱和的改性酒糟过滤,用去离子水清洗4次,然后将滤出的改性酒糟全部转移到一定体积的去离子水中,在140 r/min、25℃条件下恒温震荡,每隔一段时间取溶液测其中Cd2+含量,Cd2+析出量随时间的变化数据如表4所示.结果表明,对Cd2+吸附饱和的改性酒糟随着震荡,Cd2+会有所析出,且随着震荡时间的延长,Cd2+析出量呈略微增加趋势.在震荡时间60~120 min内,Cd2+析出量保持在0.8 mg /g,变化不明显,说明该改性吸附材料对Cd2+吸附稳定性较好.

表4 Cd2+析出量随震荡时间的变化结果
3 结论
1)酒糟经柠檬酸改性后,对水溶液中Cd2+的吸附效果大大提高,比表面积增大,微孔容积增加,且改性酒糟的Zeta电位的电负性比未改性前有所增强,均有利于其对溶液中Cd2+的吸附.
2)改性酒糟对Cd2+的吸附量随pH值的升高先增加后略有降低,在pH值为5~7范围内,Cd2+去除率稳定在85%以上;改性酒糟对Cd2+的吸附在120 min时达到平衡.在pH值为6、初始Cd浓度为100 mg/L、改性酒糟投加量为10 g/L、吸附时间120 min时,改性酒糟对Cd2+的去除率达到91.50%,吸附量为9.15 mg/g.
3)改性酒糟具有较好的吸附稳定性,吸附Cd2+饱和后随震荡时间的延长,Cd2+析出量很少.
参考文献(References)
[1]Baghban E,Mehrabani-Zeinabad A,Moheb A.The effects of operational parameters on the electrochemical removal of cadmium ion from dilute aqueous solutions [J].Hydrometallurgy,2014,149: 97-105.
[2]刘丽君.水环境中镉污染处理的研究进展[J].环境科学与管理,2012,37(6) : 124-127.DOI: 10.3969/ j.issn.1673-1212.2012.06.032.Liu Lijun.Cadmium pollution treatment in water environment research progress[J].Environmental Science &Management,2012,37(6) : 124-127.DOI: 10.3969/j.issn.1673-1212.2012.06.032.(in Chinese)
[3]张继国,王艳,苏玲,等.木质素-聚乙烯亚胺的合成及对Cu2+离子的吸附性能[J].功能材料,2014,45(8) : 8143-8147.DOI: 10.3969/j.issn.1001-9731.2014.08.031.Zhang Jiguo,Wang Yan,Su Ling,et al.Preparation of lignin-polyethylene mine and its sorption properties for Cu2+ion[J].Journal of Functional Materials,2014,45(8) : 8143-8147.DOI: 10.3969/j.issn.1001-9731.2014.08.031.(in Chinese)
[4]Xu M,Hadi P,Chen G,et al.Removal of cadmium ions from wastewater using innovative electronic wastederived material[J].Journal of Hazardous Materials,2014,273: 118-123.DOI: 10.1016/j.jhazmat.2014.03.037.
[5]Wong C W,Barford J P,Chen G,et al.Kinetics and equilibrium studies for the removal of cadmium ions by ion exchange resin[J].Journal of Environmental Chemical Engineering,2014,2(1) : 698-707.
[6]Gabaldón C,Marzal P.Cadmium and copper removal by a granular activated carbon in laboratory column systems[J].Separation Science&Technology,2000,35 (7) : 1039-1053.
[7]Naiya T K,Bhattacharya A K,Mandal S,et al.The sorption of lead (Ⅱ) ions on rice husk ash[J].Journal of Hazardous Materials,2009,163(2/3) : 1254-1264.DOI: 10.1016/j.jhazmat.2008.07.119.
[8]陈惠雨,严素定,揭武,等.改性玉米芯对含铜废水的吸附特性[J].工业用水与废水,2013,44(1) : 54 -57.DOI: 10.3969/j.issn.1009-2455.2013.01.015.Chen Huiyu,Yan Suding,Jie Wu,et al.Treatment of copper-containing wastewater by modified corncobs[J].Industrial Water&Wastewater,2013,44(1) : 54 -57.DOI: 10.3969/j.issn.1009-2455.2013.01.015.(in Chinese)
[9]Pereira F V,Gurgel L V A,Gil L F.Removal of Zn2+from aqueous single metal solutions and electroplating wastewater with wood sawdust and sugarcane bagasse modified with EDTA dianhydride (EDTAD)[J].Journal of Hazardous Materials,2010,176(1/2/3) : 856-863.DOI: 10.1016/j.jhazmat.2009.11.115.
[10]王浩宇,苏本生,黄丹,等.好氧污泥颗粒化过程中Zeta电位与EPS的变化特性[J].环境科学,2012,33(5) : 1614-1620.Wang Haoyu,Su Bensheng,Huang Dan,et al.Profiles of Zeta potential and EPS in granulation process of aerobic sludge[J].Environmental Science,2012,33 (5) : 1614-1620.(in Chinese)
[11]党子建,黄惠华.荸荠皮渣改性产物作为重金属吸附剂的研究[J].现代食品科技,2013,29(8) : 1837-1842,1836.Dang Zijian,Huang Huihua.Characterization of modified peel dreg cellulose of Chinese water chestnut as heavy metal ion sorption agent[J].Modern Food Science&Technology,2013,29(8) : 1837-1842,1836.(in Chinese)
[12]Zheng L,Dang Z,Yi X,et al.Equilibrium and kinetic studies of adsorption of Cd (Ⅱ) from aqueous solution using modified corn stalk[J].Journal of Hazardous Materials,2010,176(1/2/3) : 650-656.DOI: 10.1016/j.jhazmat.2009.11.081.
[13]Zheng L,Zhu C,Dang Z,et al.Preparation of cellulose derived from corn stalk and its application for cadmium ion adsorption from aqueous solution[J].Carbohydrate Polymers,2012,90 (2 ) : 1008-1015.DOI: 10.1016/j.carbpol.2012.06.035.
[14]Wang C Y,Gong Q,Zhao Y,et al.Stability and hydrogen adsorption of metal-organic frameworks prepared via different catalyst doping methods[J].Journal of Catalysis,2014,318: 128-142.
[15]Siswoyo E,Mihara Y,Tanaka S.Determination of key components and adsorption capacity of a low cost adsorbent based on sludge of drinking water treatment plant to adsorb cadmium ion in water[J].Applied Clay Science,2014,97-98(8) : 146-152.
[16]于娟,章明川,沈轶,等.生物质热解特性的热重分析[J].上海交通大学学报,2002,36(10) : 1475-1478.Yu Juan,Zhang Mingchuan,Shen Yi,et al.Thermogravimetric analysis of pyrolysis characteristics of biomass[J].Journal of Shanghai Jiaotong University,2002,36(10) : 1475-1478.(in Chinese)
Adsorption properties of distillers' grains modified by citric acid on heavy metal Cd (Ⅱ)
Dong Yingbo1,2Lin Hai1,2Wang Liang1
(1Department of Environmental Engineering,University of Science and Technology Beijing,Beijing 100083,China)
(2Beijing Key Laboratory of Resource-oriented Treatment of Industrial Pollutants,University of Science and Technology Beijing,Beijing 100083,China)
Abstract:The modified distiller grain (MDG) was prepared by using citric acid and the adsorption property of MDG on the heavy metal cadmium ions in aqueous solution was investigated.The results show that the adsorption capacity of the distiller grain modified by the citric acid with the concentration of 0.5% on the cadmium ions increases from 4.09 mg/g before modification to 9.13 mg/g.The specific surface area,micropore volume and the electro-negativity of MDG increase after modification.Infrared spectrum analyses indicate that the number of effective groups of the distiller grain modified by citric acid increase.The adsorption quantity of cadmium ions increases at first and then slightly decreases with the increasing of pH value,reaching adsorption equilibrium after 2 h.After adsorption saturation,the dissolved quantity of cadmium ions is very small with the prolonging of time.When the pH value is 6,the initial concentration of cadmium ions is100 mg/L,the MDG dosage is 10 g/L,and the adsorption time is 120 min,the removal rate and adsorption quantity of cadmium ions by MDG can reach 91.50% and 9.15 mg/g,respectively.Results of adsorption isotherm show that the Langmuir model can well describe the adsorption process of MDG on the cadmium ions well.
Key words:heavy metal; modified distillers' grains; cadmium ions;adsorption properties
基金项目:国家水体污染控制与治理科技重大专项资助项目(2015ZX07205003)、中央高校基本科研业务费专项资金资助项目(FRF-TP-15-040A2).
收稿日期:2015-06-10.
作者简介:董颖博(1983—),女,副教授;林海(联系人),男,博士,教授,博士生导师,linhai@ ces.ustb.edu.cn.
DOI:10.3969/j.issn.1001-0505.2016.01.027
中图分类号:X703.1
文献标志码:A
文章编号:1001-0505(2016) 01-0165-06

