羊膜移植于角膜基质内的转归及其影响因素
李 娜,赵 敏
(1.青海大学附属医院眼科,青海西宁 810001;2.重庆医科大学第一附属医院,重庆 400016)
羊膜移植于角膜基质内的转归及其影响因素
李 娜1,赵 敏2
(1.青海大学附属医院眼科,青海西宁 810001;2.重庆医科大学第一附属医院,重庆 400016)
目的 研究羊膜移植于角膜基质内的转归并探讨其影响因素。方法 取15只新西兰大白兔,将二氯三苯胺荧光素(dichlorotriazinyl aminofluoresclin,DTAF)标记的羊膜埋植于角膜基质内。术后进行临床观察,并于4、8、13、17、22周取材做HE染色观察组织病理学改变,激光共聚焦显微镜检查追踪羊膜踪迹,以及22周取材做角膜透射电镜检查,观察超微结构。结果 HE染色术后4周可见多层均质红染的羊膜组织弯曲排列,结构保留完整,基底膜和实质层未溶解。术后8周,羊膜组织仍呈均质红染的条状结构,实质层较完整。术后13周羊膜形态渐显模糊,但仍呈条带状,少量角膜细胞聚集在羊膜周围。术后17周明显可见碎片状的羊膜组织。术后22周角膜基质内存留小片状羊膜组织。激光共聚焦显微镜发现羊膜在角膜基质内可以存留22周以上。术后22周角膜透射电镜可见整合于角膜基质中的羊膜基质胶原纤维成分较不规则,羊膜周围角膜基质超微结构无明显改变。结论 羊膜移植于角膜基质内存留时间可长达22周以上,羊膜可以融合于角膜组织中,作为替代材料为行角膜移植手术争取了时间。
羊膜移植;角膜;转归
羊膜在眼科领域中作为组织材料被广泛应用,尤其在治疗角膜溃疡[1]、急性眼表损伤[2]中,羊膜作为生物膜起着非常重要的作用,不仅填补角膜缺损、重建眼表结构、防止角膜穿孔,而且可以抑制纤维瘢痕形成、避免排斥反应的发生。但是,关于羊膜移植于角膜后的生物学行为以及转归问题一直是人们争论的焦点。传统研究认为羊膜移植于眼组织后的转归为羊膜排斥、羊膜溶解或羊膜脱落。目前,有个别临床研究报道羊膜移植于角膜基质内可以与宿主长时间共存、发生融合[3],但是并未从超微结构角度对羊膜移植于角膜基质内的生物学行为进行研究。因此,本实验建立动物模型,长期追踪羊膜在角膜基质内的转归,希望能够更好地指导临床工作。本实验用二氯三苯胺荧光素(dichlorotriazinyl aminofluoresc1in,DTAF)标记羊膜,然后将DTAF标记的羊膜填入兔角膜基质中,在激光共聚焦显微镜下追踪羊膜踪迹[4]。
1 材料与方法
1.1 实验动物 随机选择新西兰大白兔15只(重庆医科大学实验动物中心提供),雌雄不分,体质量2.0 ~2.5kg,实验前用裂隙灯检查排除眼部疾病,选择双眼作为实验眼,符合相关原则。
1.2 羊膜的准备 ①羊膜的制备及保存。新鲜羊膜在制备时需要对取羊膜的个体做血清学检查,排除肝炎病毒(HBV、HCV),梅毒及艾滋病毒(HIV)等感染,待孕妇行剖宫产后获得胎盘,将胎盘冲洗干净,钝性分离羊膜和绒毛膜,将羊膜浸泡于抗生素生理盐水(含庆大霉素1×106U/L、两性霉素B 2.5mg/L)20 min后,上皮面朝上,平铺于硝酸纤维滤纸上,剪成3.5cm×3.5cm小块。放入消毒纯甘油瓶中4℃冰箱保存[5-6]。②DTAF标记羊膜。将保存羊膜用平衡盐液浸泡20min制作大小约3mm×6mm矩形羊膜植片,然后将植片完全浸泡于DTAF溶液中1min,取出染色后的羊膜用PBS溶液浸泡冲洗。DTAF标记后的羊膜15min内使用。
1.3 手术方法 速眠新Ⅱ0.20mL/kg肌肉注射,盐酸奥布比卡因眼表面麻醉。常规消毒铺巾开睑。在12∶00方位,向后分离角膜缘处球结膜,在角膜缘后界约1mm部位用剃须刀做一个长约4mm横形切口,分离至角膜缘,用虹膜复位器在角膜基质内钝性分离大小约为3mm×6mm的角膜囊袋,裁取相应大小的羊膜填入囊袋中,尽量将羊膜铺平。手术后每日滴氧氟沙星滴眼液3次,连续使用7d后停药。
1.4 术后观察指标 ①临床观察。术后每日用手持式裂隙灯观察羊膜情况、眼表分泌物、结膜充血水肿及角膜混浊、新生血管等情况。②组织病理、激光共聚焦显微镜及透射电镜观察。术后4、8、13、17、22周5个时间点,每个时间点空气栓塞致死3只动物。取术区角膜组织,常规病理制片,其他新鲜术区组织立即包埋于OCT中进行冰冻切片(厚度为8μm),碘化丙啶(propidium iodide,PI)(Sigma,美国)复染角膜组织的细胞核,激光共聚焦显微镜检查,术后22周术区角膜组织标本固定于20g/L戊二醛中送透射电镜检查。
2 结果
2.1 羊膜移植于角膜基质内的术后临床观察 角膜于术后1周内无混浊,结膜无明显充血、水肿,眼表无分泌物,肉眼明显看见角膜组织内有黄色致密的条状组织,为手术时埋藏的羊膜,羊膜溶解现象不明显,颜色与移植前无明显改变。术后4周条状的黄色致密组织颜色变浅,形状略显不规则。随时间推移,角膜组织内黄色痕迹颜色逐渐变淡,角膜透明度提高,眼表光滑,但至观察结束时,浅黄色痕迹仍然存在,通过肉眼和裂隙灯检查无法准确判断其性质(图1)。
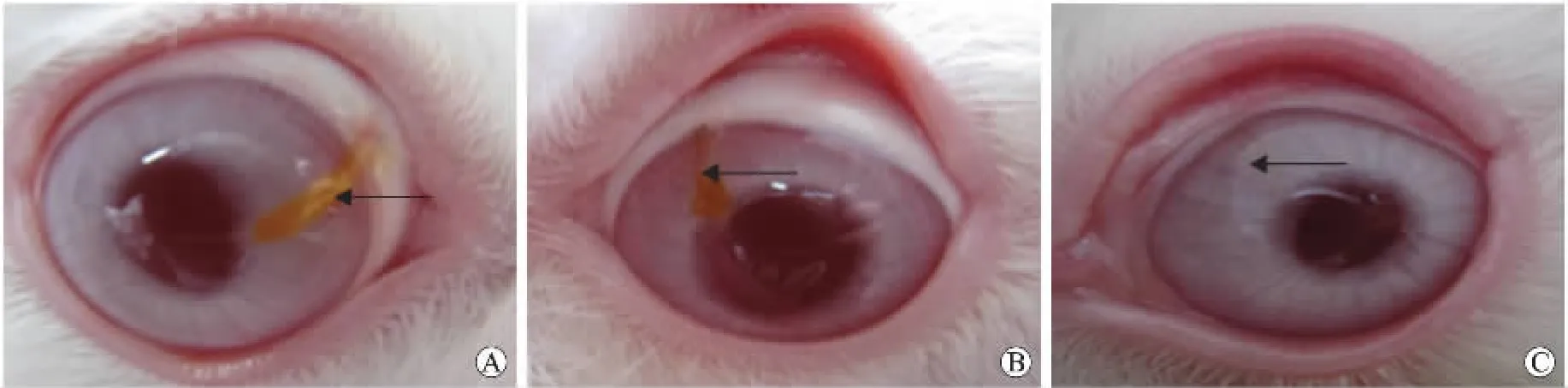
图1 羊膜移植于角膜基质内的术后临床观察结果Fig.1Clinical observation after amniotic membrane transplantation into corneal stroma
2.2 羊膜移植术后角膜HE染色的病理观察结果术后4周可见多层均质红染的羊膜组织弯曲排列,结构保留完整,基底膜和实质层未溶解。HE染色显示上皮细胞胞核和胞质均质红染,提示胞核崩解,细胞已死亡,羊膜周围包被有少量角膜细胞及排列整齐的基质胶原纤维。术后8周,羊膜组织仍呈均质红染的条状结构,实质层较完整。术后13周羊膜形态渐显模糊,但仍呈条带状,少量角膜细胞聚集在羊膜周围。术后17周明显可见碎片状的羊膜组织。术后22周角膜基质内存留小片状羊膜组织(图2)。整个观察过程中羊膜周围无炎症细胞侵润,角膜厚度稳定,基质胶原纤维排列整齐,角膜内皮细胞层及后弹力层均无明显改变。病理切片显示最表层结构是角膜上皮细胞,第2层是前弹力层,第3层是基质,第4层是羊膜,其后依次为角膜基质层,后弹力层及内皮层。
2.3 羊膜组织在激光共聚焦显微镜检查下的荧光变化 DTAF荧光标记的羊膜发出黄绿色荧光,PI荧光标记的角膜细胞核表现为红色荧光。术后4周在红色荧光背景中明显看见一弯曲、厚度不均的黄绿色荧光条带,荧光强度大体一致,其他观察时间点切片中,角膜基质中均可看见黄绿色的荧光条带,荧光强度较前减弱,周围角膜基质中无黄绿色荧光渗漏(图3)。
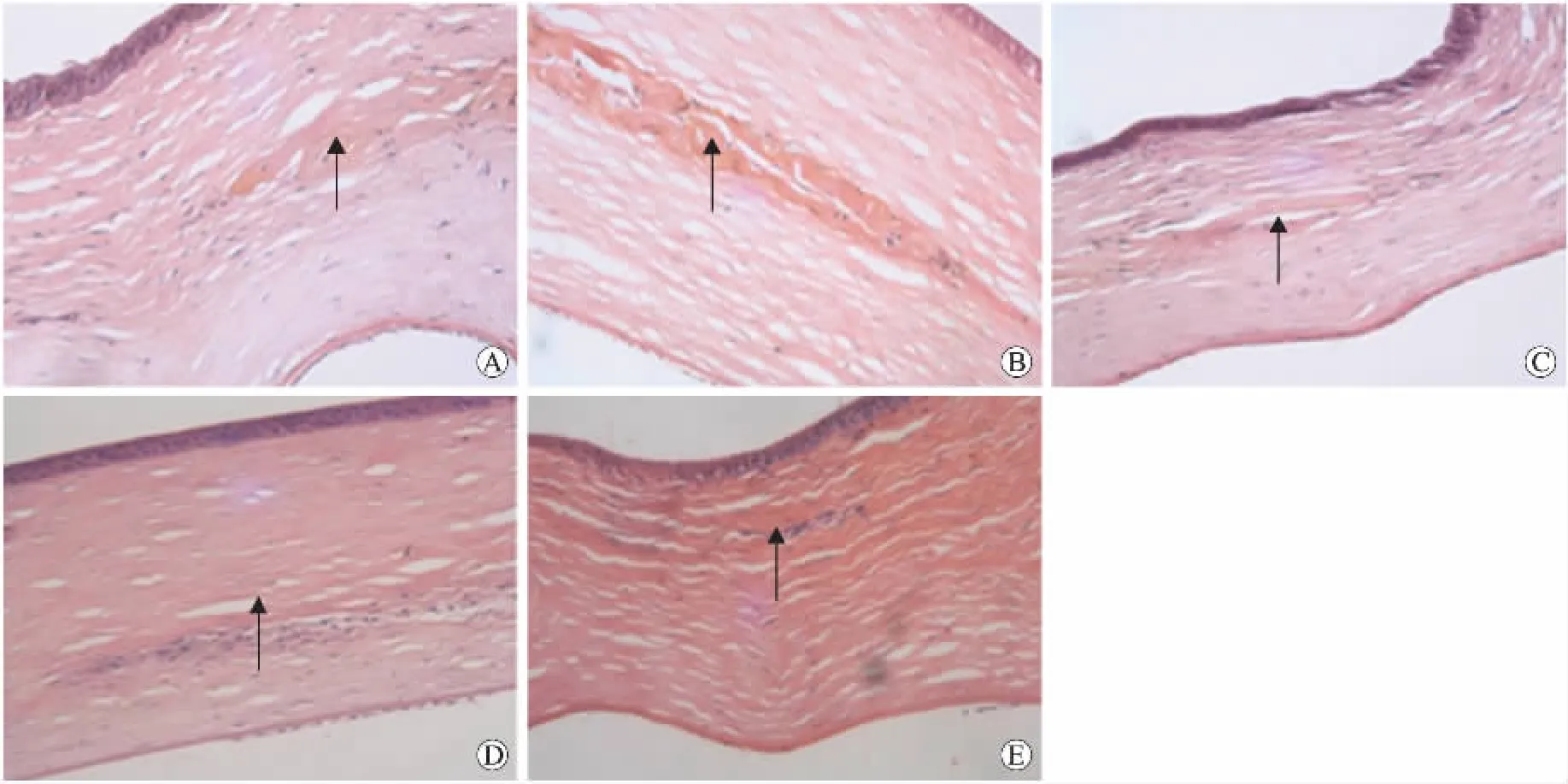
图2 羊膜移植术后角膜HE染色的病理观察结果Fig.2Pathological results of HE staining of cornea observed after amniotic membrane transplantation(×200)
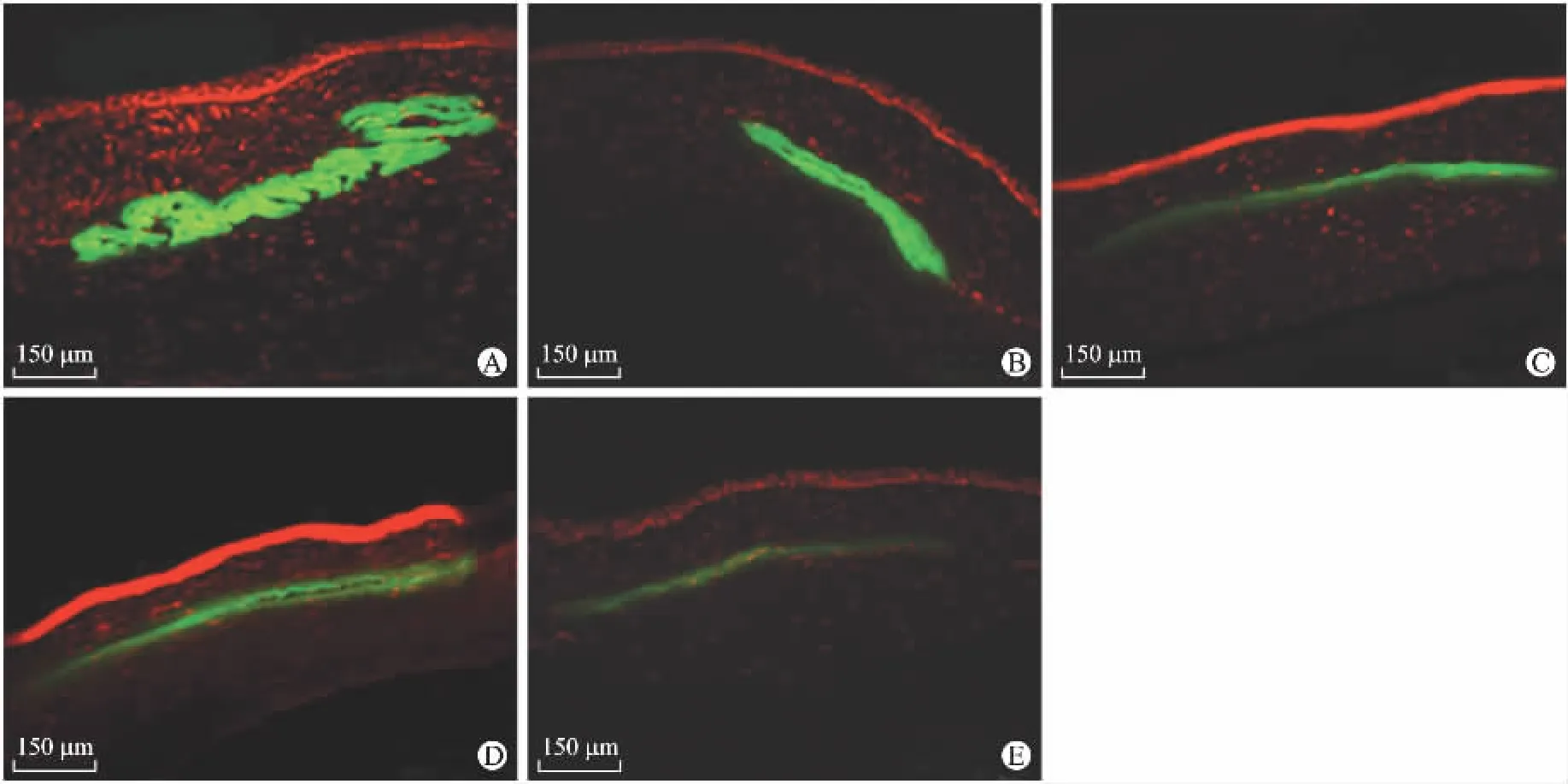
图3 羊膜组织在激光共聚焦显微镜检查下的荧光变化Fig.3Fluorescence changes of amniotic membrane under the laser confocal microscope(Scale bar=150μm)
2.4 角膜基质内羊膜组织的透射电镜检查 术后22周可见角膜基质成纤维细胞排列大体整齐,整合于角膜基质中的羊膜基质胶原纤维成分较不规则,羊膜周围角膜基质超微结构无明显改变。角膜上皮基底细胞与角膜前基质连接紧密,形成桥粒或半桥粒连接(图4)。
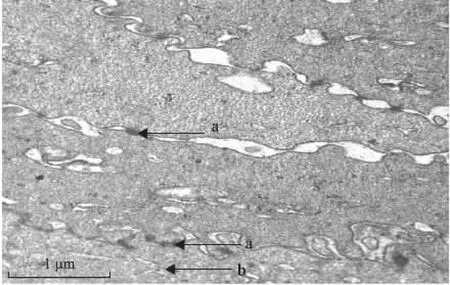
图4 羊膜移植术后22周时透射电镜下的变化Fig.4TEM of the AM and cornea changes at week 22after surgery(Scale bar=1μm)
3 讨论
3.1 DTAF追踪羊膜踪迹 本实验的主要目的之一是追踪羊膜踪迹,研究羊膜能否长期存留于角膜基质内,所以我们采用DTAF荧光染料标记羊膜。DTAF是一种比病理组织、透射电子显微镜更为精确的方法用来追踪羊膜。DTAF是一种荧光染料,在激光共聚焦显微镜下呈黄绿色荧光,在生理状态下以共价键的方式特异性的结合于胶原组织。因此,它可以精确地对活体组织进行荧光标记,并且这种荧光可以在自然状态下保持长达一年时间不悴灭[4]。激光共聚焦显微镜观察发现羊膜在角膜基质内可以存留22周以上。
3.2 羊膜移植于角膜基质内的转归 本实验将羊膜埋藏到角膜基质内观察羊膜与受体之间的相互作用。病理切片发现羊膜术后13周内结构基本完整,周围被排列规则的角膜基质与少量角膜细胞包围;术后17周羊膜部分溶解,局部可见碎片状的淡红色疏松羊膜组织;术后22周小片状的羊膜组织两端嵌在规则排列的胶原纤维间,成为角膜基质层的一部分。整个观察过程中均无炎症反应,局部无纤维组织增生,角膜层次结构清晰。激光共聚焦检查证实羊膜在基质内存留时间长达22周以上。同时,透射电子显微镜发现整合在角膜基质内的羊膜及其周围角膜基质结构未发生明显改变。所以,我们认为羊膜埋藏到角膜基质内后,部分羊膜缓慢发生溶解,而剩余羊膜与角膜组织融为一体,成为角膜结构的一部分,长时间存留,即羊膜与角膜组织间发生融合。羊膜是否能够在角膜中存留更长时间,还需进一步研究。
3.3 影响羊膜转归的相关因素
①移植部位。相关研究报道羊膜溶解速度与移植部位有关。WANG等[7]发现同种异体移植的鼠羊膜上皮细胞7d在结膜内失去活力,21d在角膜中消失,在前房内存活8周,甚至更长,表明羊膜细胞存活时间与宿主免疫原性程度有关。GRIS等[8]对2位药物治疗无效的神经性角膜溃疡患者进行羊膜嵌入术,发现第1位患者,角膜无炎症反应和新生血管,羊膜缓慢被吸收,羊膜移植术后3个月,仍可见羊膜碎片,病变角膜组织中无炎症反应;第2位患者,角膜组织中有新生血管和大量炎症细胞,羊膜完全被吸收。
羊膜透明无血管、神经和淋巴管抗原性极低,移植后不发生排斥反应[9]。相关研究报道,羊膜移植体内后抑制角膜上皮IL-1β的表达,减少炎症反应及移植排斥作用,具有良好的组织相容性[10]。并且角膜自身情况对羊膜眼表移植后的转归有极其重要的影响。正常角膜既无血管也无淋巴组织,所以角膜移植是所有器官移植中成功率最高的手术。组织病理切片发现,羊膜周围的角膜基质既无炎症细胞浸润,也无新生血管生长,这充分说明了部分羊膜可以长期存在于相对正常的角膜基质环境中,并不会引起角膜发生排斥反应。
②移植方式。羊膜移植术分为羊膜遮盖术、嵌入术和填充术,不同手术方式影响羊膜转归。SIPPEL等[11]提出羊膜遮盖术是将羊膜整个覆盖于角巩膜区域的表面,羊膜植片上皮面朝上,紧贴角膜上皮,在植片边缘,连带其下覆盖的结膜,一起固定缝合于浅层巩膜。羊膜植片的转归是通常在半个月内发生脱落。羊膜嵌入术是将羊膜植片修剪为略大于缺损区,上皮面朝上,植片边缘固定在创缘周围角膜[11]。羊膜植片通常发生自溶。本实验采用的是羊膜填充术,将羊膜植入角膜囊袋内,填充角膜基质,虽然肉眼及裂隙灯检查未准确观察到羊膜的转归,但术后各时间点组织病理切片、激光共聚焦显微镜和透射电子显微镜均证实了随着时间的延长羊膜整合于基质中。这说明,手术方式对羊膜转归起到了重要的作用。
3.4 羊膜填充术的应用前景 羊膜移植于角膜基质内后,与角膜组织融合,能够修补角膜缺损,成为角膜基质重建的材料之一。角膜移植术是最终治疗角膜溃疡或穿孔的方法,但由于供体材料来源困难,术后排斥反应等并发症多,所以可以利用羊膜层间充填或联合部分板层角膜移植治疗角膜溃疡及穿孔,并且减轻角膜炎瘢痕化程度和新生血管形成。该术式中层间羊膜作为一种生物瓣,层间填充,作为基质替代物,提供胶原组织,能够封闭角膜穿孔,促进基质愈合,可使角膜逐渐透明,恢复一定视力,但不能完全透明。角膜层间羊膜植入还可以治疗大泡性角膜病变[12-13]。本手术可减轻角膜水肿,改善眼部刺激症状,解除病痛;不影响再次行以增视为目的的穿透角膜移植手术,对贫穷、落后及角膜供体匮乏的地区而言是治疗此病的有效方法。
[1]黄祖恩.多层羊膜移植术治疗深层蚕食性角膜溃疡[J].中国医药指南,2013,11(10):137-138.
[2]CLARE G,SULEMAN H,BUNCE C,et al.Amniotic membrane transplantation for acute ocular burns[J].Cochrane Database Syst Rev,2012,9(9):262-269.
[3]程燕,吴洁,高伟,等.共焦显微镜观察真菌性角膜溃疡多层羊膜移植术后的转归[J].眼科新进展,2012,32(10):972-975.
[4]CONNON CJ,NAKAMURA T,QUANTOCK AJ,et al.The persistence of transplanted amniotic membrane in corneal stroma[J].Am J Ophthalmol,2006,141(1):190-192.
[5]李克.羊膜在眼科的应用进展[J].河北医学,2012,18(5):680- 682.
[6]宋学英,杨慧春,齐绍文,等.早期羊膜移植治疗眼表烧伤[J].实用医药杂志,2012,29(1):26-27.
[7]WANG M,YOSHIDA A,KAWASHIMA H,et al.Immunogenicity and antigenicity of allogeneic amniotic epithelial transplants grafted to the cornea,conjunctiva,and anterior chamber [J].Invest Ophthalmol Vis Sci,2006,47(4):1522-1532.
[8]GRIS O,WOLLEY-DOD C,GUELL JL,et al.Histologic findings after amniotic membrane graft in the human cornea[J].Ophthalmology,2002,109(3):508-512.
[9]LAI JY,LUE SJ,CHENG HY,et al.Effect of matrix nanostructure on the functionality ofcarbodiimide cross-linked amniotic membranes as limbal epithelial cell scaffolds[J].J Biomed Nanotechnol,2013,9(12):2048-2062.
[10]李彬斌,周清,姚敏,等.人羊膜上皮细胞培养液抑制角膜炎症的实验研究[J].器官移植,2013,4(1):12-18.
[11]SIPPEL KC,MA JJ,FOSTER CS.Amniotic membrane surgery [J].Curr Opin Ophthalmol,2001,12(4):269-281.
[12]王超庆,李燕飞,程秀春,等.角膜基质针刺联合羊膜移植术治疗大泡性角膜病变[J].国际眼科杂志,2014,14(6):1127-1129.
[13]张瑞帆,刘治容.角膜上皮下羊膜移植术联合绷带式角膜接触镜治疗大泡性角膜病变疗效分析[J].实用医院临床杂志,2014,11(4):116-118.
(编辑 韩维栋)(编辑 韩维栋)
Outcome and influencing factors of amniotic membrane transplanted into corneal stroma
LI Na1,ZHAO Min2
(1.Department of Ophthalmology,the Affiliated Hospital of Qinghai University,Xining 810001;2.the First Affiliated Hospital,Chongqing Medical University,Chongqing 400016,China)
Objective To investigate the turnover and factors influencing amniotic membrane transplantation into corneal stroma.Methods Amniotic membrane stained with dichlorotriazinyl aminofluoresclin(DTAF)was implanted into the corneal stroma of 15 New Zealand white rabbits.After transplantation,we observed the clinical changes.The tissue samples from grafted area were observed with HE staining and laser confocal microscope to trace amniotic membrane at 4,8,13,17 and22 week after surgery.And the tissue samples at week22 after surgery from grafted area were also observed by transmission electron microscopy.Results After 4 weeks of operation,amniotic membrane tissue bent with visible multi-layer homogeneous red dye.The structure remained intact;basement membrane and stroma were no dissolved.After 8 weeks,amniotic tissue was a strip structure of homogeneous red dye,and the substance layer was complete.After 13 weeks,amniotic membrane morphology appeared fuzzy,but still took the shape of strips;a small number of corneal cells accumulated around the amniotic membrane.At 17 weeks after operation,fragmented amnion was evident.At 22 weeks after operation,small pieces of amnion tissue remained in the corneal stroma.Laser scanning confocal microscopy revealed that amniotic membrane could retain for over 22 weeks in the corneal stroma.After 22 weeks,amnion stroma collagen fibers that were integrated into the corneal stroma were irregular.Corneal stromal ultrastructure surrounding the amniotic membrane did not obviously change.Conclusion Retention time of amniotic membrane transplanted into corneal stroma can be as long as over 22 weeks and amniotic membrane can be merged into the corneal tissue as a substitute,which wins time for corneal transplantation operation.
amniotic membrane transplantation;cornea;turnover
R772.2
A
10.7652/jdyxb201602018
2015-08-07
2015-12-04
重庆市科学基金资助(No.2003-23)Supported by Chongqing Science and Technology Commission(No.2003-23)
赵敏.E-mail:minzhao2002@yahoo.com.cn
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160124.1900.010.html(2016-01-24)

