染色体短期培养法的改良及在白血病患者染色体核型分析中的应用
张鹏宇,张龙进,罗 静,陈社平,蒙欣,田 玮,张王刚,周伏玲
(西安交通大学第二附属医院血液内科,陕西西安 710004)
染色体短期培养法的改良及在白血病患者染色体核型分析中的应用
张鹏宇,张龙进,罗 静,陈社平,蒙欣,田 玮,张王刚,周伏玲
(西安交通大学第二附属医院血液内科,陕西西安 710004)
目的 改良骨髓染色体短期培养法并对130例白血病患者进行染色体核型分析。方法 通过单因子梯度实验,对影响骨髓染色体短期培养法的秋水仙素浓度、作用时间、低渗时间等主要因素进行优化,并在改良基础上,进行了3因素3水平正交实验优化骨髓染色体制备体系,进一步对我院130例白血病患者进行了染色体核型分析。结果 秋水仙素浓度、秋水仙素作用时间、低渗时间等因素都有适宜的范围,过高或过低都会影响染色体制备成功率,正交实验结果表明骨髓染色体制备的最适体系为秋水仙素质量浓度0.07μg/mL,作用时间80min,低渗时间35min。通过改良的染色体短期培养法对130例白血病患者进行了染色体核型分析,染色体制备成功率达到了97.69%,异常核型检出率为82.3%。结论 0.07μg/mL秋水仙素作用80min,低渗时间35min的改良骨髓染色体制备体系值得临床推广。
正交设计;骨髓;染色体核型;染色体制备方法;白血病;染色体短期培养;秋水仙素
染色体核型分析对血液系统疾病的辅助诊断、治疗、预后判断及发病机制的探讨具有不可替代的重要意义,是对传统的血液和骨髓涂片形态学检查的重要补充[1-2]。然而,白血病骨髓染色体的成功制备是血液病细胞遗传学研究中的一个难题,因染色体标本制备步骤众多,易受多种因素的影响,因此,稳定获得形态良好、长度适宜、分散较好以及足量的中期分裂相染色体是我院血液科染色体室面临的重大挑战[3-4]。我们通过研究多因素多水平的正交实验设计方法改进了传统染色体制备过程,提高了染色体制备成功率,建立了适合我院染色体室白血病骨髓染色体的制备方法,并对130例白血病患者进行了染色体核型分析。
1 材料与方法
1.1 主要试剂 小牛血清购自杭州四季青公司,谷氨酰胺、秋水仙素及Giemsa染液均购自Sigma公司,RPMI 1640细胞培养基购自Gibco公司。
1.2 研究对象 选取2014年1月~10月在西安交通大学第二附属医院血液内科门诊及住院患者130例,男性患者79例,女性患者51例,年龄13~83岁,中位年龄为48岁。病例均经结合临床及MICM分析(M:骨髓细胞形态学;I:细胞免疫学;C:细胞遗传学;M:分子生物学),并根据张之南等[5]主编的《血液病诊断及疗效标准》进行诊断,初诊标本慢性粒细胞白血病(CML)53例,复查CML 4例,CML骨髓移植术后1例,急性非淋巴细胞白血病(AML)55例,AML骨髓移植术后1例,急性淋巴细胞白血病(ALL)14例,慢性淋巴细胞白血病(CLL)2例。
1.3 骨髓标本采集 分别抽取骨髓液3mL,收集于肝素钠抗凝管。
1.4 单因素实验 选取21例初诊白血病患者,其中CML 15例,AML 4例,ALL 2例。每例患者根据传统染色体制备方法,经有核细胞计数,按2×106/mL细胞密度接种到5mL RPMl 1640培养基中,接种6瓶,培养过夜。设立秋水仙素梯度质量浓度依次为0.04、0.07、0.10、0.13、0.16、0.19μg/mL,按照数字1~6号标记好,保持秋水仙素作用时间为70min及低渗时间为25min不变,经过3次固定、R显带后镜下进行染色体分裂相数量统计。
同样,保持秋水仙素质量浓度0.07μg/mL、低渗时间为25min不变,设立秋水仙素作用时间梯度(10、30、50、70、90、110min);保持秋水仙素质量浓度0.07μg/mL、秋水仙素作用时间为70min不变,设立低渗时间梯度(5、25、45、65、85、105min),经过3次固定、R显带后镜下进行染色体分裂相数量统计。
1.5 正交设计实验 根据单因素实验结果,选取1例初发的CML患者的骨髓标本,进行正交实验。在单因素实验结果的基础上,设计三因素三水平的正交实验表,进行9次不同组合的实验,实验重复3次,选取染色体制备成功率高的组合作为染色体短期培养法的优化体系。
1.6 染色体核型分析与评价标准 按《人类细胞遗传学国际命名体制(ISCN 1995)》进行描述。至少2个细胞有同样的染色体增加或结构重排,或者3个细胞有同样的染色体丢失,方可确认为一个异常克隆。染色体制备成功率换算公式为:染色体制备成功率=可供分析分裂相数量/分裂相总数,制备成功率越高,则说明制备染色体的条件越好[3]。
1.7 统计学方法 应用SPSS 19.0统计软件进行统计学处理。单因素实验结果进行χ2检验,正交实验结果应用极差分析法。P<0.05为差异有统计学意义。
2 结果
2.1 单因素实验结果 单因素实验结果如表1所示。6组秋水仙素不同浓度组中,0.07μg/mL(第2组)组的染色体制备成功率最高为77.50%;与0.19 μg/mL(第6组)相比,差异有统计学意义(χ2=5.04,P<0.05);但与0.04、0.1、0.13、0.16μg/mL(第1、3、4、5组)相比差异无统计学意义(P>0.05);这表明秋水仙素作用的质量浓度不宜超过0.16μg/mL。
秋水仙素作用不同时间的实验中,70min时(第4组)染色体制备成功率最高为72.09%,与第1组(10min)相比,差异有统计学意义(χ2=5.03,P<0.05;但与30、50、90、110min(第2、3、5、6组)相比差异无统计学意义(P>0.05);这表明秋水仙素的作用时间最少应大于10min。
不同低渗时间的实验中,45min(第3组)时染色体制备成功率最高为76.84%;与5min(第1组)相比,差异有统计学意义(χ2=8.34,P<0.01);与85 min(第5组)相比,差异有统计学意义(χ2=5.65,P<0.05);但与第2、4组相比差异无统计学意义(P>0.05)。这表明低渗时间对染色体的制备成功率影响明显,其时间应控制在25~60min之间。
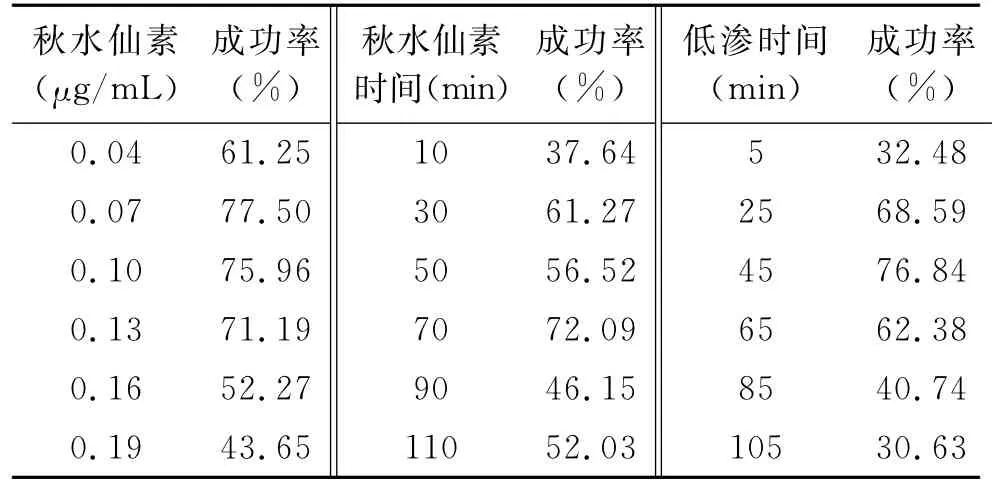
表1 染色体制备单因素实验结果Tab.1 Result of single factor experiment for chromosome preparation
2.2 正交设计实验结果 根据单因素的实验结果即获得较高染色体制备成功率的秋水仙素质量浓度不宜超过0.16μg/mL、作用时间应大于10min、低渗时间应控制在25~60min。故分别以3因素的最佳水平为中心向下及向上各扩大一个水平进行正交实验的设计,具体设计方案见表2。3次重复实验的平均成功率的正交设计实验结果(表3)显示,通过正交极差分析表明处理组合6的染色体制备成功率最高,为最佳水平组合。因此,选取组合6作为染色体短期培养法的最优条件,即秋水仙素浓度0.07μg/mL、作用时间80min、低渗时间35min。

表2 正交设计的因素与水平Tab.2 Factors and levels of orthogonal design

表3 正交实验设计L9(33)Tab.3 Orthogonal design L9(33)of the amplification system
2.3 白血病病例分析 利用前期实验获得的改良的染色体短期培养法(秋水仙素质量浓度0.07μg/mL、作用时间80min、低渗时间35min),将本组130例骨髓标本实验培养并分析,结果制备失败了3例,成功了127例,染色体制备成功率为97.69%(表4)。124例初诊标本中,104例检出异常核型,其中53例CML标本中51例发现异常,异常检出率96.2%;55 例AML标本44例发现异常,异常检出率80.0%;14 例ALL标本9例发现异常,异常检出率64.3%;2例CLL均未见明显异常。复诊标本中4例CML标本3例发现异常,2例骨髓移植后的标本未见明显异常。
我院血液实验室目前发现白血病染色体核型异常类型主要有25种,t(9;22)、t(8;21)、t(15;17)和inv(16)是最常见类型,占所有异常总数的69.2%;+8、+ph是较为常见的继发性改变,而其余t(1;9;22)、t(1;5)、t(1;19)、t(2;14)、t(3;11)、+4、t(4;11)、t(5;9)、t(7;11)、del(9q)、del(12q)、dic(13;14)、del(14q)、+19、add(19q)、del(19q)、+22、多倍体异常和复杂异常等19种异常都是较为少见的异常,仅占所有异常总数的30.8%。
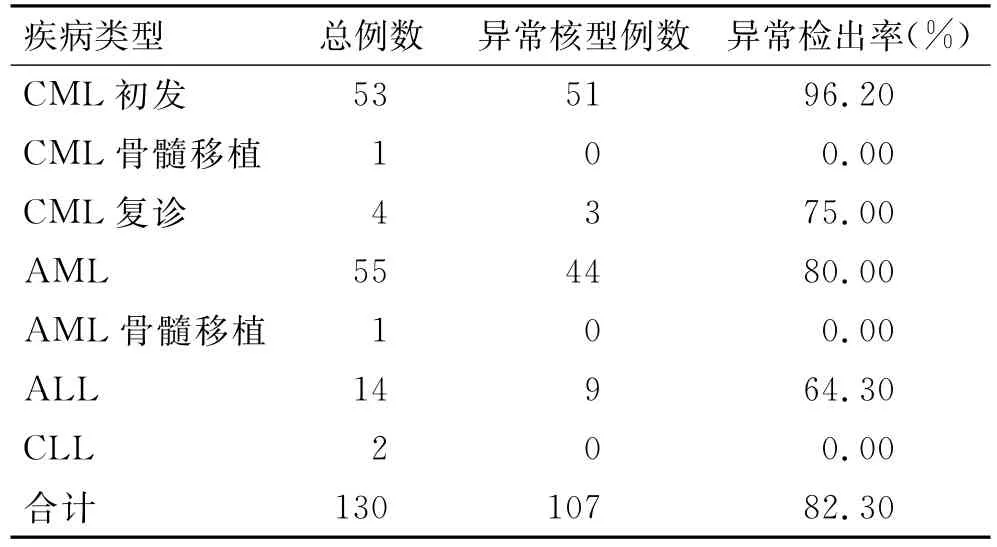
表4 130例白血病患者染色体核型分析结果Tab.4 Result of chromosome karyotype analysis of 130leukemia patients
3 讨论
骨髓染色体的制备方法主要有直接法、短期培养法和同步化法[6],其各有优缺点。然而,目前国内外学者认为短期培养法能很好揭示更多的染色体异常[3],并且能够符合临床上需要快速、简洁和稳定的要求,因此大多数医院都采用短期培养法进行染色体检查。3种染色体制备方法均包括细胞收获、低渗、固定、制片和染色等步骤。在细胞收获过程中,秋水仙素浓度与作用时间一直都是争论的焦点:秋水仙素能阻留中期分裂象,同时也会使染色体浓缩;若终浓度过高或处理时间过长,分裂象虽然有所增加,但染色体长度却反而缩短,以致带纹减少。故在制备过程中,各实验室应根据自身实验条件找出适合的秋水仙素浓度及作用时间,以达到最佳的制备效果。应用低渗液处理细胞,可使染色体分散;低渗时间过长,会导致染色体丢失,使染色体过分肿胀,造成形态结构模糊影响显带;低渗时间过短,则会导致染色体分散不佳。而固定、制片和染色过程的影响因素相对较小,实验条件易于控制。因此,该研究采用了单因子梯度实验和正交设计实验,研究了短期培养法中秋水仙素浓度、秋水仙素作用时间及低渗时间。
该实验发现在单因子梯度实验中,其他条件不变,随着秋水仙素浓度和低渗时间的增大,染色体制备成功率从逐渐变高到逐渐变低,表明秋水仙素浓度和低渗时间过低或过高都会影响染色体制备成功率,而随着秋水仙素作用时间的延长,染色体制备成功率高低起伏不定。宋兰林等[3]同时应用直接法、即刻低渗法、短期培养法和同步化4种方法对48例白血病患者制备其骨髓染色体,其染色体制备成功率为93.75%;其中单独应用短期培养法的染色体制备成功率为89.58%。本研究从单因子梯度实验中选取染色体制备成功率最高的条件进行正交实验设计,通过直观分析和正交极差分析,本研究认为短期培养法的最适体系为秋水仙素浓度0.07μg/mL,秋水仙素作用时间80min,低渗时间35min。并通过选择的最优体系,分析了130例白血病标本,其仅有3例标本制备失败,成功率达到了97.69%,且124例初诊白血病标本104例检出异常核型,异常检出率高,进一步证明了改良后的染色体短期培养法能够提高染色体制备成功率。当然,不同地区实验室间在制备染色体的方法学上较难保持一致,而不同细胞类型的染色体对相关变量依赖程度也存在差异,在具体实施过程中,染色体标本制备过程必须结合本实验室的自身条件,定期进行染色体室内质控,才能够长期有效保持染色体标本制备质量的稳定性[7-9]。
白血病是一类发生在骨髓中的造血干细胞异常的克隆性恶性疾病,其中大多数患者伴随着染色体改变,而由染色体改变引起的融合基因、原癌基因的点突变、癌基因的扩增以及抑癌基因的失活与白血病发病息息相关。因此,由最初的FAB分型发展为MICM分型,最能反映白血病疾病的本质[10-11]。白血病染色体核型异常的类型主要有数目异常和结构异常[12],其异常有助于白血病的诊断和鉴别诊断。对于收集的130份白血病染色体核型类型中,与FAB亚型相关的特异性染色体异常主要有t(9;22)、t(8;21)、t (15;17)和inv(16),主要存在于CML、M2、M3和M4中;值得注意的是t(9;22)也可见于ALL、ANLL及个别的MDS、真性红细胞增多症、骨髓纤维化、淋巴瘤等疾病中;7%的M4及个别的M1也会出现t (8;21),因此对疾病的诊断仍需结合临床症状。t(4;11)常见于2%~6%的ALL中。自1979年VAN DEN BERGHE首次报道t(4;11)急淋以来,迄今文献报道了不到600例,而研究表明其具有独特的临床、血液学和预后特点,因而构成一种独特的临床、细胞遗传学亚型[13-14]。在本研究的14份ALL中,发现了2 例t(4;11),其临床资料有待整理。染色体改变是影响白血病预后的独立因素[15]。根据染色体异常将白血病的预后危险程度分为:高危即-5、-7、5q-、3q-异常、亚二倍体、近单倍体、t(9;22)、t(4;11)、t(1;19)、t (8;14),复合染色体异常;中危即染色体正常、+8、+21、+22、47-50的超二倍体以及低危即(t(8;21)、t (15;17)、inv(16)、t(12;21)、染色体数目>50的超二倍体[16]。而本实验发现的白血病染色体核型异常类型主要有25种,利于预后危险程度划分,在白血病诊断、治疗及预后判断中具有重要的临床意义。
[1]MULLER S,O’BRIEN PCM,FERGUSON-SMITH MA,et al.Crossspecies colour segmenting:a novel tool in human karyotyping analysis[J].Cytometry,1998,33(4):445-452.
[2]BARBOUTI A,JOHANSSON B,HOGLUND M,et al.Multicolor COBRA-FISH analysis of chronic myeloid leukemia reveals novel cryptic balanced translocations during disease progression[J].Gene Chromosome Canc,2002,35(2):127-37.
[3]宋兰林,刘晓力,周淑芸.白血病骨髓染色体制备法评估[J].中国优生与遗传杂志,2002,10(5):40-42.
[4]CLAUSSEN U,MICHEL S,MÜHLIG P,et al.Demystifying chromosome preparation and the implications for the concept of chromosome condensation during mitosis[J].Cytogenet Genome Res,2002,98(2-3):136-146.
[5]张之南,沈悌.血液病诊断及疗效标准[M].3版.北京:科学出版社,2007:103-139.
[6]薛志科,薛永权,林宝爵.骨髓直接培养法、短期培养法和同步化法在白血病染色体分析中的比较[J].中华血液学杂志,1993,10(2):102-103.
[7]DENG W,TSAO SW,LUCAS JN,et al.A new method for improving metaphase chromosome spreading[J].Cytometry,2003,51(1):46-51.
[8]HENEGARIU O,HEEREMA NA,WRIGHT LL,et al.Improvements in cytogenetic slide preparation controlled chromosomesp reading,chemical ageing and gradual denaturing[J].Cytometry,2001,43(2):101-109.
[9]HLISCS R,MUHLIG P,CLAUSSEN U.The spreading of metaphases is a slow process which leads to a stretching of chromosomes[J].Cytogenet Cell Genet,1997,76(3-4):167-171.
[10]MRóZEK K,HARPER DP,APLAN PD.Cytogenetics and molecular genetics of acute lymphoblastic leukemia[J].Hematol Oncol Clin North Am,2009,23(5):991-1010.
[11]BENCH AJ,ERBER WN,SCOTT MA.Molecular genetic analysis of haematological malignancies:I.Acute leukaemias and myeloproliferative disorders[J].Clin Lab Haematol,2005,27(3):148-171.
[12]PEDERSON-BJERGAARD J,ROWLEY JD.The balanced and the unbalanced chromosome aberrations of acute myeloid leukemia may develop in different ways and may contribute differently to malignant transformation[J].Blood,1994,83 (10):2780-2786.
[13]JOHANSSON B,MOORMAN AV,HASS OA,et al.Hematologic malignancies with t(4;11)(q21;q23)—a cytogenetic,morphologic,immunophenotypic and clinical study of 183 cases.European 11q23 Workshop participants[J].Leukemia,1998,12(5):779-787.
[14]过宇,薛永权,谢新,等.染色体t(4;11)急性淋巴细胞白血病-10例临床和实验室分析[J].中华血液学杂志,2000,21(2):71-73.
[15]VARDIMAN JW,THIELE J,ARBER DA,et al.The 2008 revision of the World Health Organization(WHO)classification of myeloid neoplasms and acute leukemia:rationale and important changes[J].Blood,2009,114(5):937-951.
[16]MICHALOVA K,ZEMANOVA Z,BREZINOVA J.Multicolor fluorescence in situ hybridization(mFISH)[J].Cas Lek Cesk,2001,140(4):99-103.
(编辑 国 荣)
Application of improved chromosome short-term culture method in the chromosome karyotype analysis of leukemia patients
ZHANG Peng-yu,ZHANG Long-jin,LUO Jing,CHEN She-ping,MENG Xin,TIAN Wei,ZHANG Wang-gang,ZHOU Fu-ling
(Department of Hematology,the Second Affiliated Hospital of Xi’an Jiaotong University,Xi’an 710004,China)
Objective To make the chromosome karyotype analysis of 130 patients with leukemia by using the improved chromosome short-term culture method.Methods We optimized the main factors with a single factor gradient experiment in short-term culture of bone marrow chromosome,including colchicines concentration,duration of action of colchicines,and hypotonic time.On this basis,we conducted the three-factors and three-level orthogonal experiment to achieve improved bone marrow chromosome preparation system,which was later applied in 130 patients with leukemia in our hospital.Results The orthogonal experiment results showed that the optimum conditions were colchicines concentration of 0.07μg/mL,colchicines action time of 80 min,and hypotonic time of 35 min during the preparation of the bone marrow chromosome.Using this method,the chromosome preparation success rate reached 97.69%and the detection rate of abnormal karyotype reached 82.3%in the chromosome karyotype analysis.Conclusion Bone marrow chromosome preparation system with colchicines concentration of 0.07μg/mL and colchicines action time of 80 min,and hypotonic time of 35 min is worthy of clinical promotion.
orthogonal design;bone marrow;chromosome karyotype analysis;chromosome preparation method;leukemia;chromosome short-term culture;colchicines
R733.7
A
10.7652/jdyxb201602029
2015-02-26
2015-06-28
西安交通大学第二附属医院新技术新疗法资助项目(No.09-016)、国家自然科学基金资助项目(No.81270597)和2011年中央高校基本科研业务费专项资金资助项目(No.0602-08143041)Supported by the New Technology Funds of the Second Affiliated Hospital of Xi’an Jiaotong University(No.09-016),the National Natural Science Foundation of China(No.81270597)and the Fundamental Research Funds for the Central Universities(No.0602-08143041)
张鹏宇.E-mail:zhangpengyu2004@126.com
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160202.1634.020.html(2016-02-02)

