外源GSH对盐胁迫下番茄幼苗生长及抗逆生理指标的影响
周 艳,刘慧英,王 松,张健伟,莘冰茹
(1 石河子大学 农学院园艺系,新疆石河子 832003;2 新疆生产建设兵团特色果蔬栽培生理与种资资源利用重点实验室, 新疆石河子 832003)
外源GSH对盐胁迫下番茄幼苗生长及抗逆生理指标的影响
周艳1,2,刘慧英1,2*,王松1,2,张健伟1,2,莘冰茹1,2
(1 石河子大学 农学院园艺系,新疆石河子 832003;2 新疆生产建设兵团特色果蔬栽培生理与种资资源利用重点实验室, 新疆石河子 832003)
摘要:采用营养液栽培法,研究外源谷胱甘肽(GSH)对NaCl胁迫下番茄幼苗生长、根系活力、电解质渗透率和丙二醛(MDA)、脯氨酸(Pro)、可溶性糖含量以及超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性的影响,为利用外源物质减轻盐胁迫伤害提供理论依据。结果显示:(1)NaCl胁迫显著抑制了番茄幼苗的生长、根系活力和SOD、POD、CAT活性,提高了电解质渗透率及MDA、Pro、可溶性糖含量;(2)外源喷施GSH能够诱导NaCl胁迫下番茄幼苗叶片抗氧化酶SOD、POD、CAT活性上调,电解质渗透率及MDA含量下降,Pro和可溶性糖含量恢复至对照水平;(3)外源喷施还原型谷胱甘肽抑制剂(BSO)使NaCl胁迫下番茄幼苗的根系活力以及抗氧化酶SOD、POD、CAT活性下降,脯氨酸含量提高;(4)喷施GSH可诱导BSO和NaCl共处理番茄植株的根系活力、SOD、POD、CAT活性提高,MDA和Pro含量降低。研究表明,外源GSH可通过提高促进盐胁迫下番茄幼苗植株渗透调节能力及清除活性氧的酶促系统的防御能力、降低细胞膜脂过氧化程度、保护膜结构的完整性,从而有效缓解NaCl胁迫对番茄幼苗生长的抑制,提高其耐盐性。
关键词:番茄;谷胱甘肽;NaCl胁迫;生长;生理指标
目前,土壤盐渍化已成为设施农业生产的主要限制性因素和可持续发展的严重障碍。盐胁迫是限制作物生长和产量的最严重的环境因子之一。盐胁迫所引起的失水亏缺和离子毒害通过干扰生理过程,特别是光合作用而导致植株生长受到抑制。近年来,通过使用外源物质来缓解盐胁迫对作物的伤害已成为一种有效克服土壤盐渍化的途径。
谷胱甘肽(GSH) 是植物中含量丰富的含巯基的低分子肽,是机体内重要的水溶性抗氧化物质,在抗氧化和对氧化还原(redox)敏感的信号传导的调节中起着关键性作用。近年来的研究表明,GSH能调节器官内硫的分布,同时是还原性硫的主要储存形式[1]。GSH可以调节防御基因的表达[2]。GSH还是结合过量重金属的植物螯合肽的前体物质[3-4];GSH水平的高低与植物对各种生物和非生物环境胁迫的忍耐能力密切相关[5]。植物细胞中GSH库受到严格的稳态调控,当植物细胞感知调节氧化还原平衡的GSH库高度稳态遭到破坏,则积极进行细胞或基因表达的适应性改变[6-7]。但目前GSH参与调控植物耐盐性上的研究依然十分有限。本试验以番茄幼苗为材料,通过对NaCl胁迫下番茄幼苗叶片喷施GSH(还原型谷胱甘肽)和BSO(还原型谷胱甘肽抑制剂),以探讨外源GSH对NaCl胁迫下番茄植株生长和一些抗逆生理生化指标的影响,为利用外源物质减轻盐胁迫伤害提供理论依据。
1材料和方法
1.1试验材料与试验设计
试验在石河子大学农学院试验站进行。以番茄(LycopersiconesculentumMill.)品种‘中蔬4号’为试材。种子催芽后播种于草炭和蛭石(2∶1,V/V )混合而成的基质中。待四叶一心时,挑选形态长势整齐一致的番茄幼苗移入带泡沫盖板的12 L水桶中,装入10 L用去离子水配制的Hoagland 营养液(pH 6.2)。待幼苗长至六叶一心时进行不同处理,其中NaCl于处理时直接加入营养液中,GSH和BSO以叶片喷施的方式于每日9:00喷施。试验期间营养液全天通气。
试验设置6个处理:(1)不喷施GSH不加NaCl,叶片喷施蒸馏水(CK);(2)加入100 mmol·L-1NaCl和叶面喷施蒸馏水(NaCl);(3)叶面喷施5 mmol·L-1GSH(GSH);(4)添加100 mmol·L-1NaCl和叶片喷施5 mmol·L-1GSH(NG);(5)添加100 mmol·L-1NaCl和叶片喷施1 mmol·L-1BSO(NB);(6)添加100 mmol·L-1NaCl和叶片喷施1 mmol·L-1BSO、5 mmol·L-1GSH(NBG)。试验采取随机区组设计,重复3次,每个处理2桶,每桶5株。处理后10 d取样进行相关生理指标的测定。
1.2测定指标与方法
1.2.1生长指标处理10 d后,测量幼苗株高(从子叶到生长点的高度)、茎粗、叶长、叶宽;分别取幼苗地上部和地下部,用清水冲洗表面杂物,再用去离子水冲洗干净,擦干水分后,分别称鲜样质量,105 ℃杀青 15 min,75 ℃烘至恒重,称干样质量。
1.2.2生理指标根系活力测定采用TTC法[8];叶片电解质渗透率的测定采用电导法,使用DSJ-1数字式电导仪测定;脯氨酸含量测定采用茚三酮比色法[9];可溶性糖含量测定采用蒽酮比色法[10];MDA含量采用硫代巴比妥酸法[11];SOD活性测定参照文献[12]的方法,POD和CAT活性测定参照文献[13]的方法。
1.3数据分析
采用Excel 2007和 SPSS16.0 对所得数据进行处理和差异显著性检验(Duncan′s 法)。
2结果与分析
2.1外源GSH对NaCl胁迫下番茄幼苗生长的影响
表1显示,GSH处理番茄幼苗的叶长、叶宽、株高、茎粗以及地上干、鲜重和地下干、鲜重等生长指标均比对照(CK)不同程度增加,但仅叶长和地下干重达到显著水平;NaCl处理番茄幼苗的生长指标均比CK显著降低,降幅为23.3%~37.8%,植株生长受到显著抑制;与NaCl处理相比,NG处理植株各生长指标均不同程度提高(4.8%~17.8%),且株高和地下干重的增幅达到显著水平,但仍显著低于对照;NB处理致使NaCl胁迫下植株的各项生长指标均有所下降,但都未达显著水平,但仍显著低于对照;NBG处理各指标则较NB处理不同程度提高,而较NG处理不同程度降低,但仅植株株高升降幅度达到显著水平(表1)。以上结果说明NaCl抑制了番茄幼苗的生长,BSO促进了NaCl的胁迫效应;外源GSH能缓解NaCl对番茄幼苗生长的抑制作用。
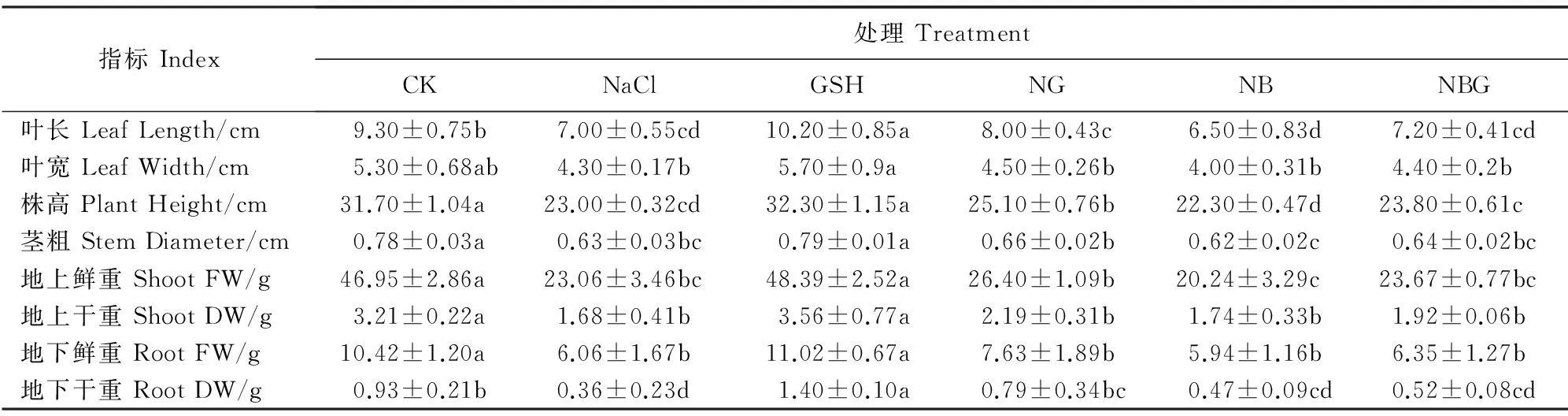
表1 外源GSH对NaCl胁迫下番茄幼苗生长指标的影响
注:CK.不喷施GSH不加NaCl,叶片喷施蒸馏水;NaCl.加入100 mmol·L-1NaCl和叶面喷施蒸馏水;GSH.叶面喷施5 mmol·L-1GSH;NG.添加100 mmol·L-1NaCl和叶片喷施5 mmol·L-1GSH;NB.添加100 mmol·L-1NaCl和叶片喷施1 mmol·L-1BSO;NBG.添加100 mmol·L-1NaCl和叶片喷施1 mmol·L-1BSO、5 mmol·L-1GSH。同行不同小写字母表示处理间在0.05水平显著性差异。下同。
Note:CK.Foliar spraying with water only;NaCl.Adding 100 mmol·L-1NaCl and foliar spraying with water;GSH.Foliar spraying with 5 mmol·L-1GSH;NG.Adding 100 mmol·L-1NaCl and foliar spraying with 5 mmol·L-1GSH;NB.Adding 100 mmol·L-1NaCl and foliar spraying with 1 mmol·L-1BSO;NBG.Adding 100 mmol·L-1NaCl,foliar spraying with 1 mmol·L-1BSO and 5 mmol·L-1GSH;Different letters in the same row indicate significant difference among treatments at the 0.05 level;The same as below.
2.2外源GSH对NaCl胁迫下番茄幼苗根系活力的影响
根系活力能反映根系吸收水肥的能力,其强度高低可在一定程度上反映植株的生长能力。由图1可以看出,与CK相比,番茄幼苗根系活力在GSH处理下显著提高6.8%,而在NaCl处理下显著降低93.8%;与NaCl处理相比,NG处理番茄幼苗的根系活力显著提高48.1%,NB处理则显著下降49.5%,但两者均显著低于对照;而NBG处理的根系活力较NB处理显著增加,仍显著低于NG处理和CK。可见,番茄幼苗的根系活力在NaCl胁迫下受到显著抑制,BSO则进一步加剧了NaCl的胁迫效应;外源GSH能够有效缓解NaCl胁迫对番茄幼苗根系活力的抑制作用,但不能完全恢复至对照水平。
2.3外源GSH对NaCl胁迫下番茄幼苗电解质渗透率和丙二醛(MDA)含量的影响
2.3.1电解质渗透率逆境首先影响细胞膜,造成膜透性的改变或丧失,电解质渗透率的测定常作为植物膜透性和抗性研究的一个重要的生理指标。由图2可以看出,与CK相比,番茄叶片的电解质渗透率在单独NaCl胁迫下显著增加,而在单独喷施GSH处理下显著降低;喷施GSH显著降低了NaCl胁迫下番茄叶片的电解质渗透率,且与CK无显著差异;喷施BSO进一步增加了NaCl 胁迫下番茄叶片的电解质渗透率,但与NaCl处理差异未达到显著水平;GSH 处理番茄幼苗叶片的电解质渗透率则比NB处理显著降低,比NG处理稍低。以上结果说明NaCl胁迫使番茄幼苗膜系统受到了损伤,BSO加剧了NaCl胁迫;外源GSH保护了番茄幼苗的膜结构。
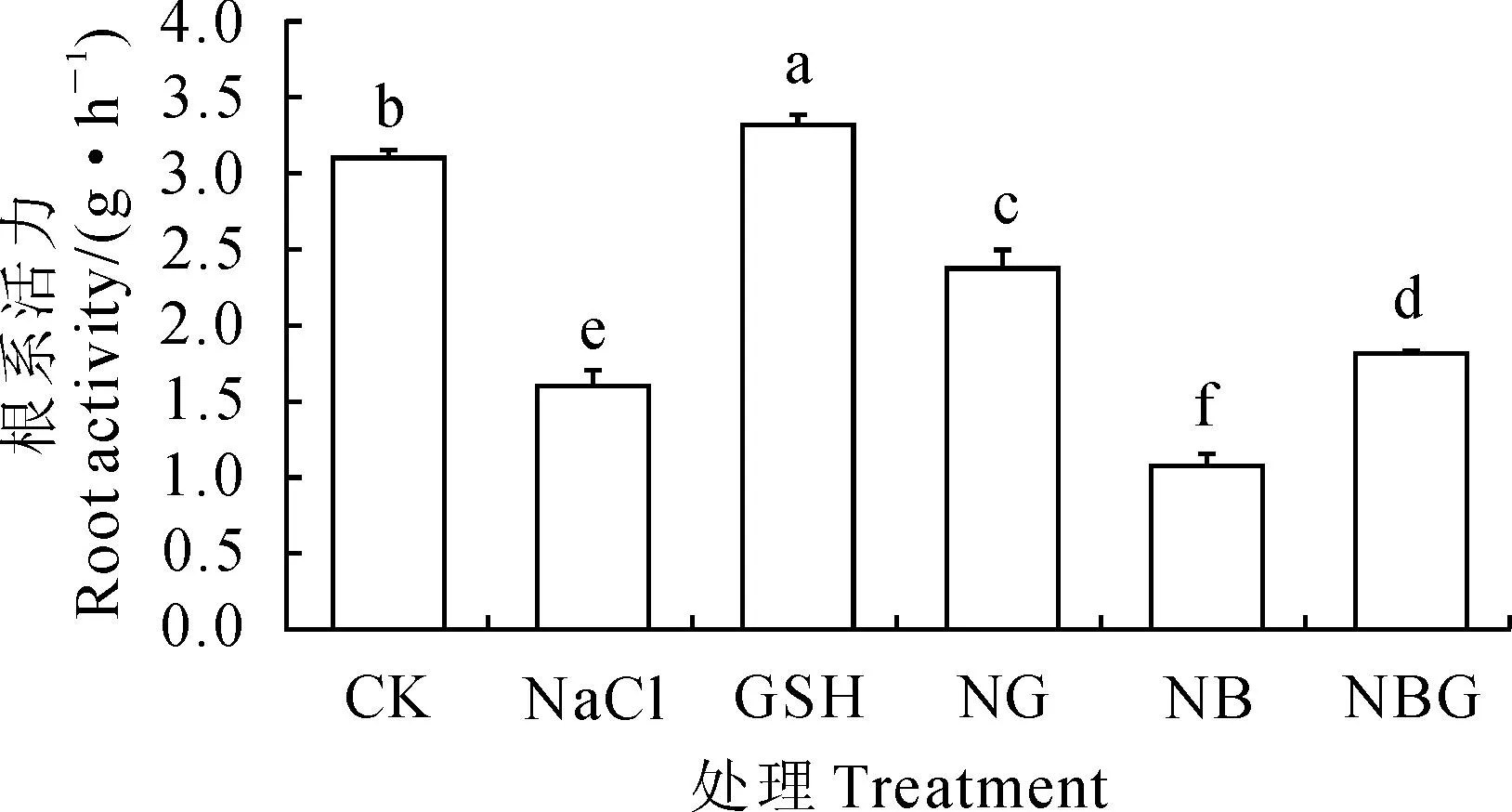
图1 外源GSH对盐胁迫下番茄幼苗根系活力的影响
2.3.2MDA含量MDA是膜脂质过氧化的产物,可用MDA含量代表膜脂质过氧化的程度。由图2可以看出,与对照相比,NaCl胁迫下番茄叶片的MDA含量显著提高;叶片分别喷施GSH 和BSO均显著降低了NaCl 胁迫下番茄叶片的MDA含量,NG和NB两个处理间存在显著差异;NBG处理的番茄幼苗叶片的MDA含量较NB处理显著降低,且降低至与NG处理间存在显著差异;与对照(CK)相比,只喷施GSH对MDA含量无显著影响。可见,NaCl胁迫番茄幼苗膜脂过氧化程度加剧,外源GSH减轻了番茄幼苗的膜脂过氧化程度。
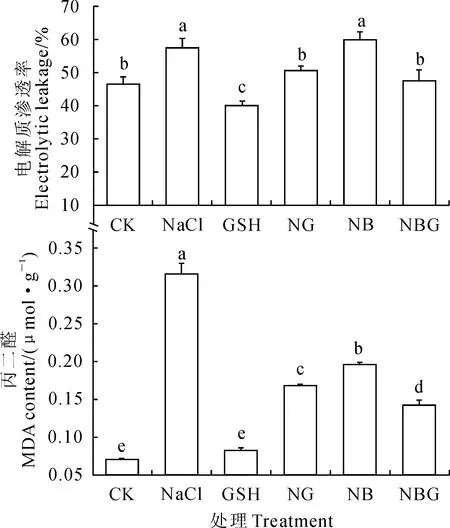
图2 外源GSH对盐胁迫下番茄幼苗叶片电解质
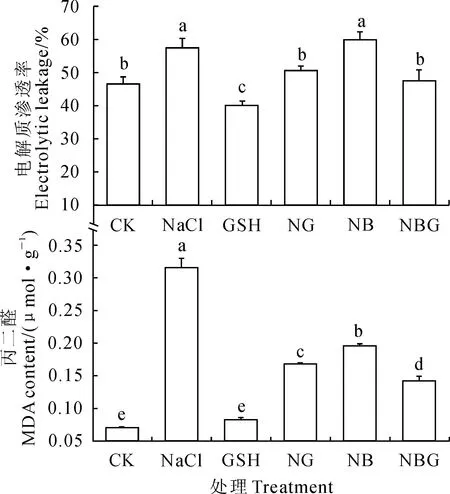
图3 外源GSH对盐胁迫下番茄幼苗叶片脯氨酸和
2.4外源GSH对NaCl胁迫下番茄叶片脯氨酸含量和可溶性糖含量的影响
2.4.1脯氨酸(Pro)含量脯氨酸作为一种重要的渗透调节物质,一般情况下,植物体内游离脯氨酸的含量不高,但在植物受到逆境胁迫时,游离脯氨酸的含量明显增加,脯氨酸增加有利于阻止细胞质及阻止脱水,可缓解对膜系统的伤害。由图3可以看出,与对照相比,盐胁迫下番茄叶片的脯氨酸含量显著增加;叶片喷施GSH 后,NaCl 胁迫下番茄叶片的脯氨酸含量较NaCl处理显著降低;喷施BSO后,NaCl胁迫下番茄叶片的脯氨酸含量较NaCl处理显著增加;植株在胁迫下施用BSO再喷施GSH后(NBG处理)叶片的脯氨酸含量较NaCl胁迫下喷施BSO(NB)处理显著降低,且降低至与NG处理间有显著差异;与对照(CK)相比,只喷施GSH降低了叶片脯氨酸含量并存在显著差异。以上说明NaCl胁迫使脯氨酸含量增加,BSO加剧了NaCl的胁迫作用;外源GSH缓解了NaCl对番茄幼苗的伤害。
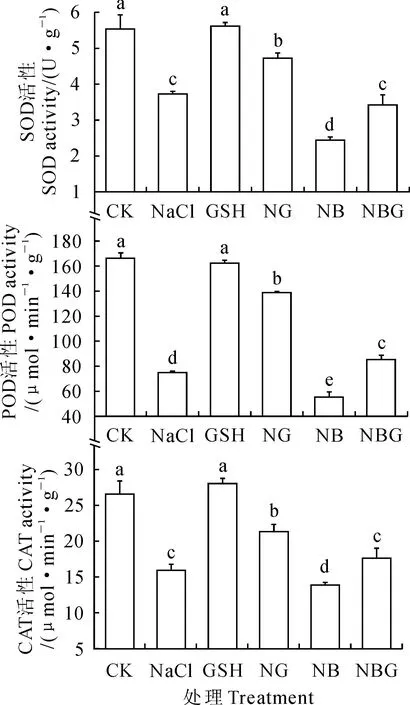
图4外源GSH对盐胁迫下番茄幼苗抗氧化酶活性的影响
2.4.2可溶性糖含量可溶性糖是植株体内的主要渗透调节物质,在逆境胁迫下其量增加,使植株更易于维持正常的膨压,保证植株各种代谢的正常进行。由图3可以看出,与对照相比,NaCl胁迫下番茄叶片的可溶性糖含量显著增加;叶片喷施GSH 后显著降低了NaCl 胁迫下番茄叶片的可溶性含量;喷施BSO后增加了NaCl胁迫下番茄叶片的可溶性糖含量,与NaCl处理间达到显著差异;NBG处理的番茄叶片的可溶性糖含量则较NB处理显著降低;与对照(CK)相比,只喷施GSH对叶片可溶性糖含量无显著影响。以上说明NaCl胁迫使番茄叶片的渗透调节物质增加,BSO加剧了NaCl胁迫程度;外源GSH抑制了NaCl对番茄幼苗的胁迫作用。
2.5外源GSH对NaCl胁迫下番茄幼苗叶片抗氧化酶活性的影响
由图4可以看出,与对照相比,NaCl胁迫下SOD、POD和CAT 3种抗氧化酶的活性均显著降低。叶片喷施GSH则显著提高了NaCl 胁迫下SOD、POD、CAT的活性;喷施BSO显著降低了NaCl胁迫下番茄幼苗叶片的SOD、POD、CAT活性;NBG处理的SOD、POD、CAT活性较NB处理显著提高,且提高至与NaCl 处理无显著差异水平;与非胁迫条件(CK)相比,喷施GSH对SOD、POD、CAT的活性无显著影响。可见,NaCl胁迫使番茄幼苗受到氧化损伤,BSO加剧了NaCl的胁迫程度;外源GSH缓解了NaCl胁迫对番茄幼苗的抑制作用,但不能缓解至对照水平。
3讨论
植物耐盐性是一个受多种因素影响,较复杂的综合性状。植物生长过程对盐胁迫非常敏感,因此生长形态指标可作为评估盐胁迫程度和植物耐盐能力的可靠标准[14-15]。目前已有大量研究表明盐胁迫会严重影响植物的生长发育,造成植物的生物量积累减少[16]。盐胁迫会抑制植物的根系生长,植物的根系对逆境胁迫信号最为敏感,且会产生相应的生理反应,导致植物根系活力下降,从而影响其对水分和营养的吸收,进而影响整个植株的正常生长[17]。本研究中,NaCl胁迫显著降低了番茄幼苗的根系活力和抑制了番茄幼苗的生长,而外源喷施GSH显著提高了NaCl 胁迫下幼苗株高、地下干重和根系活力,说明其可有效缓解NaCl胁迫对番茄幼苗生长的抑制作用和提高幼苗盐适应性。此外,外源喷施谷胱甘肽合成抑制剂BSO 虽对NaCl 胁迫下番茄幼苗的生长无显著影响,但进一步显著降低了根系活力,而NB处理后再喷施GSH(NBG处理)则较NB处理显著提高了植株株高和根系活力,亦说明外源GSH能使NaCl胁迫下植株仍保持较强的吸水吸肥能力而提高盐适应性。
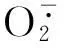
渗透调节是植物对逆境的一种适应性反应,大量实验表明,逆境会诱导参与渗透调节的基因表达,主动积累渗透调节物质,提高细胞液浓度,降低水势,使细胞能从外界吸水,维持植株正常生长[22]。一些研究表明盐胁迫下脯氨酸积累的多少可以作为植物耐盐性强弱的一个指标,而另有研究结果表明脯氨酸积累似乎只是胁迫的结果,与耐盐性之间缺少相关性[23]。逆境下可溶性糖含量的增加可能是由于淀粉等糖类的分解,以及光合产物形成过程中直接转向相对低分子质量的物质[24]。本研究中,番茄幼苗叶片的脯氨酸和可溶性糖含量在NaCl胁迫下显著提高,并在盐胁迫下叶片喷施BSO后进一步提高,这应该是植物在逆境下的一种适应性反应;叶片喷施GSH分别显著降低了NaCl胁迫下和NB处理下的番茄幼苗叶片的脯氨酸和可溶性糖含量,说明外源GSH能够缓解和减弱NaCl逆境对番茄幼苗的胁迫程度,因而渗透调节物质含量降低。
值得注意的是,BSO是谷胱甘肽合成抑制剂,在本试验中,其未对NaCl胁迫下番茄幼苗植株的各项生长指标产生显著影响,但显著下调了NaCl胁迫下幼苗根系活力和叶片SOD、POD、CAT活性,上调了叶片脯氨酸和可溶性糖含量。此研究结果与外源BSO处理使Cd胁迫下东南景天氧化胁迫加剧和生长受抑的研究结果不同[25],推测这可能与本试验喷施BSO的浓度、作用时间以及NaCl胁迫因子和胁迫强度等有关,从而导致生理指标的变化已先于形态生长指标表现出来。具体原因还有待进一步研究。
综上所述,外源GSH可以诱导增强盐胁迫下番茄幼苗植株渗透调节能力和提高清除活性氧的酶促系统的防御能力,从而降低幼苗受到的氧化胁迫和减弱膜脂过氧化程度、保护膜结构,从而有效缓解NaCl胁迫对番茄幼苗生长的抑制作用,最终提高幼苗的盐适应性。
参考文献:
[1]闫慧芳,毛培胜,夏方山.植物抗氧化剂谷胱甘肽研究进展[J].草地学报,2013,(3):428-434.
YAN H F,MAO P S,XIA F S.Antioxidant Glutathione(Review)[J].ActaAgrestiaSinica,2013,(3):428-434.
[2]王玮玮,唐亮,周文龙,等.谷胱甘肽生物合成及代谢相关酶的研究进展[J].中国生物工程杂志,2014,34(7):89-95.
WANG W W,Tang L,ZHOU W L,etal.Progress in the biosynthesis and metabolism of glutathione [J].ChinaBiotechnology2014,34(7):89-95.
[3]COBBETT,C.,Goldsbrough,P.Phytochelatins and metallothioneins:roles in heavy metal detoxification and homeostasis [J].Annu.Rev.PlantBiol.2002,53:159-182.
[4]YADAV S K.Heavy metal toxicity in plants:an overview on the role of glu-tathione and phytochelatins in heavy metal stress tolerance of plants[J].SouthAfricanJ.Bot. 2012,76:167-179.
[5]陈坤明,宫海军,王锁民.植物谷胱甘肽代谢与环境胁迫[J].西北植物学报,2004,24(6):1 119-1 130.
CHENG K M,KONG H J,WANG S M.Glutathione metabolism and environmental stresses in plants[J].ActaBotanicaBoreali-OccidentaliaSinica,2004,24(6):1 119-1 130.
[6]NOCTOR G,ANA-CAROLINA M A,Jouanin L,etal.Glutathione:biosynthesis,metabolismand relationship to stress tolerance explored in transformed plants[J].J.Exp.Bot.,1988,49:623-647.
[7]NOCTOR G,FOYER G H.Ascorbate and glutathione:keeping active oxygen under control[J].Ann.Rev.PlantPhysi.&PlantMol.Bio.,1998,49:249-279
[8]李酉开.土壤农业化学常规分析方法[M].北京:科学出版社,1983.
[9]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000:89-92.
[10]赵可夫.植物抗盐生理[M].北京:中国科学技术出版社,1993.
[11]HERTH R L,PACKER L.Photoperoxidation in isolated chloroplasts I kinetics and stoichiometry of fatty acid peroxidation[J].Arch.Biochem.Biophys.,1986,125:189-198.
[12]GIANNOPLTIS C N,RIES S K.Purification and quantitative relationship with water soluble protein in seedling[J].PlantPhysiology,1997,59:315-318.
[13]曾韶西,王以柔,刘鸿先.低温下黄瓜幼苗子叶硫氢基(SH)含量变化与膜脂过氧化[J].植物学报,1991,33(1):50-54.
ZENG Z X,WANG Y R,LIU H S.The change of the sulfhydryl group and the preoxidation of membrane lipids in the cotyledons of cucumber seedlings under low temperature[J].ActaBotonicaSinica,1991,33(1):50-54.
[14]DHINDSA R S,PLUMBDHINDSA P,THORPE T A.Leaf senescence correlated with increase levels of memebrane permeability and lipid peroxidation and decrease levels dismutase and catalase[J].JournalofExperimentalBotany,1982,32:91-101.
[15]杨志莹,赵兰勇,徐宗大.盐胁迫对玫瑰生长和生理特性的影响[J].应用生态学报,2011,22(8):1 993-1 998.
YANG Z Y,ZHAO L Y,XU Z D.Impacts of salt stress on the growth and physiological characteristics ofRosarugosa[J].ChineseJournalofAppliedEcology,2011,22(8):1 993-1 998.
[16]张新平.盐胁迫对番茄幼苗生长发育的影响研究[J].安徽农业科学,2007,35(19):5 713-5 714,5 752.
ZHANG X P.Effects of salt stress on seedling growth development of tomato[J].JournalofAnhuiAgri.Sci,2007,35(19):5 713-5 714,5 752.
[17]张飞,梁燕.番茄对盐胁迫的反应及其耐盐性鉴定的研究进展[J].长江蔬菜,2011,(4):1-4.
[18]KANAZAWA S,SANO S,KOSHIBA T,etal.Changes in antioxidative in cucumber cotyledons during natural senescence comparison with those during dark-induced senescence[J].PhysiolPlant,2000,109(2):211-216.
[19]单长卷,付远志,彭贝贝.盐胁迫下谷胱甘肽对玉米幼苗根系抗氧化能力的影响[J].灌溉排水学报,2015,34(10):56-59.
[20]马彦霞,张国斌,颉建明,等.外源谷胱甘肽对自毒作用下辣椒幼苗叶片活性氧清除系统的影响[J].西北植物学报,2009,29(7):1 380-1 386.
MA Y X,ZHANG G B,JIE J M,etal.Effects of glutathione on active oxygen scavenging system in leaves of pepper seedlings under autotoxicity[J].ActaBotanicaBoreali-OccidentaliaSinica,2009,29(7):1 380-1 386.
[21]丁继军,刘柿良,等.外源AsA、GSH对Cd胁迫下石竹幼苗生长的影响[J].应用生态学报,2014,25(2):419-426.
DING J J,LIU S L,etal.Effects of exogenous AsA and GSH on the growth of Dianthus seedlings exposed to Cd.[J].ChineseJournalofAppliedEcology,2014,25(2):419-426.
[22]彭程.盐胁迫对植物的影响及植物耐盐研究进展[J].山东商业职业技术学院学报,2014,14(2):123-128.
PENG C.Advances in research on effects of salt stress on plant and adaptive mechanism of the plant to salinity[J].JournalofShandongInstituteofCommerceandTechnology,2014,14(2):123-128.
[23]LIU L.Techniques for preventing edible burdock from browning [J].FoodandMachinery,1997,1:27-28.
[24]刘爱荣,张远兵,钟泽华,等.盐胁迫对彩叶草生长和渗透调节物质积累的影响[J].草业学报,2013,22(2):211-218.
LIU A R,ZHANG Y B,ZHONG Z H,etal.Effects of salt stress on the growth and osmotica accumulation ofColeusblumei[J].ActaPrataculturaeSinica,2013,22(2):211-218.
[25]金晓芬.镉超积累植物东南景天谷胱甘肽代谢特征及比较蛋白质组学研究[D].杭州:浙江大学,2008.
(编辑:裴阿卫)
Effect of Exogenous GSH on Tomato Seedlings Growth and Physiological Indexes of Resistance Stress under Salt Stress
ZHOU Yan1,2,LIU Huiying1,2*,WANG Song1,2,ZHANG Jianwei1,2,XIN Bingru1,2
(1 Department of Horticulture,College of Agronomy,Shihezi University,Shihezi,Xinjiang 832003,China;2 Key Laboratory of Special fruits and vegetables Cultivation Physiology and Germplasm Resources Utilization of Xinjiang Production and Contruction Crops,Shihezi,Xinjiang 832003,China)
Abstract:Hydroponic experiments were conducted to investigate the effects of exogenous GSH on plant growth and root activity,as well as electrolytic leakage rate,the contents of lipid peroxidation (MDA),proline (Pro) and soluble sugar and the activities of superoxide dismutase(SOD),peroxidase(POD) and catalase(CAT) in leaves of tomato seedlings under NaCl stress.The result shows that:1)NaCl stress significantly inhibited the growth and root activity of tomato seedlings and decreased the activities of SOD,POD and CAT,and increased electrolyte leakage rate and the contents of MDA,proline (Pro) and soluble sugar in leaves of tomato seedlings.2)The application of exogenous GSH induced the up-regulation of POD,SOD and CAT activities,decreased the electrolyte leakage rate and MDA contents,and returned the contents of proline and soluble sugar to control level in leaves of NaCl-stressed tomato seedlings.3)The application of exogenous BSO decreased root activity and POD,SOD and CAT activities,and increased proline contents in leaves of tomato seedlings under NaCl stress.4)Spraying GSH increased the root activity and SOD,POD and CAT activities,decreased the contents of MDA and Pro in combined stressed (NaCl and BSO) plants.These results suggested that GSH alleviated salt-induced growth inhabitation and enhanced salt-tolerance by promoting the osmotic adjustment capacity and the defense ability of antioxidant enzyme system to decrease membrane lipid peroxidation and protect the integrity of membrane structure in tomato seedlings under NaCl stress.
Key words:tomato;GSH;NaCl stress;growth;physiological indexes
中图分类号:Q945.78
文献标志码:A
作者简介:周艳(1991-),女,在读硕士研究生,主要从事蔬菜学研究。E-mail:286138826@qq.com*通信作者:刘慧英,教授,主要从事蔬菜生理生化设施园艺研究。E-mail:hyliuok@aliyun.com
基金项目:国家自然科学基金(31160391,31360478);国家星火重点项目(2015GA891008);兵团国际合作项目(2014BC002)
收稿日期:2015-12-17;修改稿收到日期:2016-03-09
文章编号:1000-4025(2016)03-0515-06
doi:10.7606/j.issn.1000-4025.2016.03.0515

