青蒿乙素、青蒿酸和东莨菪内酯三组分对青蒿素在疟疾小鼠体内药动学行为的影响
张超 仇峰 李静 王满元 龚慕辛
100069 北京,首都医科大学中医药学院[张超(硕士研究生)、仇峰、李静、王满元、龚慕辛]
·论著·
青蒿乙素、青蒿酸和东莨菪内酯三组分对青蒿素在疟疾小鼠体内药动学行为的影响
张超仇峰李静王满元龚慕辛
100069北京,首都医科大学中医药学院[张超(硕士研究生)、仇峰、李静、王满元、龚慕辛]
【摘要】目的探究青蒿乙素、青蒿酸和东莨菪内酯三组分在疟疾小鼠体内对青蒿素抗疟增效作用在药物动力学方面可能的影响及其规律,为开发新型基于青蒿素类抗疟药的联合治疗方案药物奠定基础。方法分别对疟疾小鼠灌胃给予青蒿素(100 mg/kg)和青蒿素、青蒿酸、青蒿乙素和东莨菪内酯联用(每种组分各100 mg/kg),于给药后不同时间点采集血浆,样品经液-液萃取后,采用HPLC-MS/MS法测定药物浓度。结果与青蒿素单用比较,青蒿素、青蒿乙素、青蒿酸和东莨菪内酯联用组青蒿素的最大血药浓度由924 ng/mL 增加到1065 ng/mL,AUC((0-t))(1893 h×ng/mL)明显高于青蒿素单用组(661 h×ng/mL),半衰期延长,血浆清除率下降了65%。结论青蒿乙素、青蒿酸和东莨菪内酯可显著影响青蒿素的药物动力学行为。
【关键词】青蒿素;青蒿;协同增效组分;药物动力学;小鼠疟疾模型
近年来,艾滋病、结核和疟疾被WHO列为对人类健康威胁最为严重的三大传染病。根据WHO 2015年世界疟疾报告,全球大约32亿人面临疟疾风险,2015年仍有约2.14亿疟疾新病例,死亡大约43.8万人[1]。长期以来,药物治疗是人类抗击疟疾的主要方法和有效途径。当前,青蒿素类药物发挥着挽救疟疾患者生命的重要作用。2003年版《国际药典》中收载的青蒿素类药物有:蒿甲醚原料、注射液,青蒿素原料、片剂、胶囊,蒿乙醚原料、注射液,双氢青蒿素原料、片剂,青蒿琥酯原料、片剂。为提高青蒿素类药物的临床疗效,降低疟原虫再燃率,延缓耐药性的产生,WHO目前推荐基于青蒿素类抗疟药的联合治疗方案(artemisinin-based combination therapies,ACTs),分别为蒿甲醚+本芴醇、青蒿琥酯+阿莫地喹、青蒿琥酯+甲氟喹、青蒿琥酯+磺胺多辛(周效磺胺)/乙胺嘧啶以及双氢青蒿素+哌喹[2],这些ACTs组合均为青蒿素类药物与一种已产生耐药性的抗疟药联合应用的组合。作为一类自2001年开始就广泛使用的疟疾治疗方案,目前ACTs的耐药现状不容乐观,柬埔寨与泰国的边境地区、缅甸和越南等地已经确诊出现了恶性疟原虫对青蒿素类药物耐药[3]。这种耐药性虽然没有导致青蒿素类药物治疗的彻底失败,但却减缓了从患者血液中清除恶性疟原虫的速度。WHO认为,在青蒿素耐药性传播到高感染地区之前,遏制或消除耐药性的机会其实十分有限[1]。前期发现:青蒿中含量较高的青蒿酸、青蒿乙素和东莨菪内酯对青蒿素的抗疟药效有明显的增效作用(该药物组合简称青蒿四组分,青蒿乙素、青蒿酸和东莨菪内酯三组分单用或伍用没有观察到明显抗疟活性)[4]。本课题组针对“以1∶1∶1∶1质量比配伍时青蒿四组分体系中青蒿素增效4倍的现象”开展了系列研究。前期研究结果提示,青蒿素属于难溶易吸收药物,虽不能完全排除药效环节的增效作用,但青蒿素四组分体系的增效现象很可能是通过代谢环节实现的,无抗疟活性的天然组分可以增强青蒿素的药效。临床和基础研究证实,疟疾感染会导致宿主下调肝药酶CYP450的表达,导致药物首过代谢减少[5]。为了进一步深入探究青蒿四组分体系的增效机制,开展了青蒿多组分体系在约氏疟原虫(plasmodium yoelii)感染小鼠体内药物动力学特征的研究,为发展新的抗青蒿素耐药治疗策略提供参考。
1材料与方法
1.1仪器
6410型三重四级杆串联质谱仪(美国Agilent科技有限公司);低温冷冻离心机(Sigma公司,3K15);涡旋混合器(天津药典标准仪器厂,2H-2);十万分之一电子天平(赛多利斯科学仪器有限公司,BT25S)。
1.2药品与试剂
青蒿素、青蒿乙素和青蒿酸(均为本实验室自制,经检测纯度均大于98.4%);东莨菪内酯(日本东京化成工业株式会社,纯度为98%);内标物丁螺环酮(Sigma公司,批号BCBL7606V,纯度为99.3%)。
色谱级甲醇(Fisher公司,批号140098);色谱级乙腈(Fisher公司,批号124984);色谱级甲酸(Sigma公司,批号0001394882);甲基叔丁基醚(天津市福晨化学试剂厂,批号20150120);吐温-80(天津市化学试剂六厂分厂,批号20110520);羧甲基纤维素钠(北京凤礼精求商贸有限责任公司,批号20130307)。
1.3实验动物
SPF级健康ICR小鼠,雄性,体质量(20±2) g,购于北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2012-0001。
1.4色谱-质谱条件
色谱条件:色谱柱为Agilent Zorbax XDB-C18柱(50 mm×2.1 mm,3.5 μm);流动相为0.1%甲酸水溶液(A)-乙腈(B),采用梯度洗脱,0~1分钟,5% B相;1~1.1分钟,5%~10% B相;1.1~5分钟,10%~95% B相;5~6分钟,95% B相;6~6.1分钟,95%~5% B相;6.1~10分钟,5% B相;流速0.3 mL/min;柱温30 ℃;进样量10 μL。
质谱条件:采用ESI电离源,MRM检测模式,青蒿素、青蒿乙素和东莨菪内酯采用正离子电离模式,青蒿酸采用负离子电离模式。离子喷雾电压为4.0 kV,加热毛细管温度300 ℃,辅助加热气压为30 psi,雾化气压为30 psi,青蒿素、青蒿乙素、青蒿酸、东莨菪内酯和内标丁螺环酮的解簇电压(DP)分别为100 V、120 V、130 V、120 V、100 V;碰撞能量(CE)分别为9 eV、10 eV、3 eV、25 eV、40 eV;用于定量分析的离子对分别为:283.2→247.1,249.1→189.1,232.8→232.8,193.0→133.0,386.3→122.1。
1.5实验方案和样品采集
取SPF级健康ICR小鼠96只,小鼠腹腔接种1×107个被疟原虫寄生的红细胞,接种3天后(当小鼠疟疾感染率达到20%时),随机分为2大组:即青蒿素单用组(100 mg/kg)、青蒿素+青蒿酸+青蒿乙素+东莨菪内酯联用组(每种组分各100 mg/kg),每只小鼠按照所在药物组别灌胃给药。每大组再分为8小组(每一组为一个取样时间点所需动物),每个时间点随机选取6只小鼠摘眼球取血。给药前禁食12小时,自由饮水,给药后5分钟、15分钟、30分钟、1小时、2小时、5小时、8小时和12小时摘眼球取血300 μL,收集血液样品于预冷肝素化离心管,立即摇匀置于冰上,3000 rpm、4 ℃离心10分钟,取上清血浆样品于1.5 mL离心管中,-80℃保存备用。采用LC-MS/MS法测定血浆中相关成分的浓度。

表1 采用LC-MS/MS法测定ICR小鼠血浆中青蒿素、青蒿乙素、青蒿酸和
1.6血浆样品处理
取血浆样品50 μL,依次加入甲醇-水(20:80,v/v)混合溶液10 μL、内标溶液(100 ng/mL丁螺环酮)10 μL、0.1%的甲酸溶液10 μL和甲基叔丁基醚(MTBE)400 μL,涡旋混合1分钟,3500 rpm离心10分钟,取上清液300 μL,氮气吹干,残留物加入乙腈-水(1:1,v/v)混合溶液100 μL溶解,涡旋混合1分钟,以LC-MS/MS法进行测定。
2结果
2.1青蒿素、青蒿乙素、青蒿酸、东莨菪内酯在小鼠体内的LC-MS/MS方法学验证
血浆中的内源性杂质不干扰青蒿素、青蒿乙素、青蒿酸、东莨菪内酯的测定,青蒿素、青蒿乙素、青蒿酸、东莨菪内酯和内标丁螺环酮的保留时间分别为6.91分钟、6.68分钟、7.59分钟、5.20分钟和5.32分钟;以药物浓度(C)为横坐标(X),对照品峰面积与内标峰面积比值为纵坐标(Y),用加权(1/C2)最小二乘法进行线性回归,得到回归方程,见表1;青蒿素、青蒿乙素、青蒿酸和东莨菪内酯的低、中、高三个浓度日内及日间精密度RSD均<15%(n=6);青蒿素、青蒿乙素、青蒿酸、东莨菪内酯经历3个冷冻解冻循环、于-80 ℃冰箱冷冻30天、于20 ℃放置24小时后稳定性良好;青蒿素的回收率在89.5%~99.3%,青蒿乙素的回收率在86.9%~99.0%,青蒿酸的回收率在93.4%~99.3%,东莨菪内酯的回收率在85.2%~91.6%。样品处理方法符合规定,可用于血浆样品中青蒿素、青蒿乙素、青蒿酸、东莨菪内酯的分析测定。
2.2青蒿素单用及四组分联用在疟疾小鼠体内药动学研究
2.2.1青蒿素单用及四组分联用在疟疾小鼠体内青蒿素的血药浓度-时间曲线及药物动力学参数青蒿素单用及四组分联用在疟疾小鼠体内青蒿素的血药浓度-时间曲线见图1,采用WinNonlin软件计算药动学参数,结果见表2。
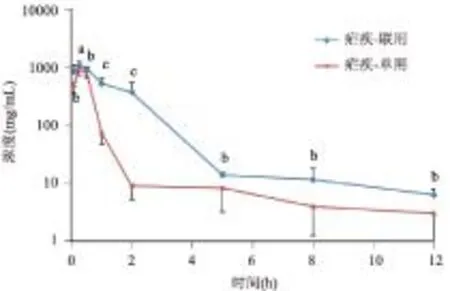
注:无显著性差异(aP>0.05);显著性差异(bP<0.05);极显著性差异(cP<0.01)

图1 青蒿素单用及四组分联用在疟疾小鼠体内
与青蒿素单用相比,四组分联用后疟疾小鼠体内青蒿素的血药浓度增大,半衰期延长,Cmax升高,Vd、CL降低,生物利用度是青蒿素单用的2.86倍。
2.2.2疟疾小鼠体内青蒿乙素、青蒿酸、东莨菪内酯的药物动力学参数疟疾小鼠灌胃给予青蒿素、青蒿乙素、青蒿酸、东莨菪内酯组合物后青蒿乙素、青蒿酸、东莨菪内酯的药代动力学参数见表3。

表3 四组分联用在疟疾小鼠体内青蒿乙素、
3讨论
青蒿素是含过氧桥的倍半萜内酯类化合物,分子结构中缺少共轭体系,采用常规紫外检测器难以达到定量分析生物样品的目的。本实验采用液相色谱串联质谱法(LC-MS/MS)建立了青蒿素、青蒿乙素、青蒿酸、东莨菪内酯在疟疾小鼠血浆中药物浓度的测定方法,同时为了提高分析方法的准确性,减少实验误差,选择丁螺环酮作为内标,避免了在样品处理及进样过程中带来的误差。在摸索青蒿酸的质谱条件中发现,当给予较大碰撞能量时,青蒿酸母离子全部成为碎片,没有特征子离子,而采用较小碰撞能量时,只有母离子,没有碎片离子,故最终采用较小碰撞能量,只检测母离子进行药物浓度测定。本实验比较了乙腈沉淀蛋白法、甲醇沉淀蛋白法、甲基叔丁基醚萃取法和二氯甲烷萃取法的提取效果。结果发现采用沉淀蛋白法处理样品检测不到青蒿素,采用液-液萃取法处理样品四种组分均可被检测到,且甲基叔丁基醚的提取率高于二氯甲烷的提取率,故实验最终采用甲基叔丁基醚萃取法处理样品。
无有效抗疟药对实现全球控制疟疾将是一场灾难,一旦疟原虫对目前的ACTs产生耐药性,有可能导致与疟疾有关的死亡人数大幅攀升。由于没有其他抗疟药能具有ACTs的药效和依从性,近期的疟疾控制工作仍然面临很大的不确定性,发展新型疟疾治疗药物具有现实紧迫性。另一方面,由于受到经济发展状况以及传统习俗的影响,青蒿素的不合理使用仍在继续。非洲多地的疟疾患者由于种种原因很难获得ACTs药物,致使这些疟疾高发区的患者还在使用基于青蒿原植物开发的号称对疟疾有预防和治疗作用的植物药[6-7]。WHO认为这些植物药中青蒿素的含量远远低于疟疾治疗的有效剂量,可能会促进疟原虫发展青蒿素的耐药性[8]。但是,多年来这个问题并没有解决,现实中仍然在使用这些青蒿植物制剂。如何能够更合理地使用天然青蒿素,延缓或避免青蒿素类药物的抗药性问题,应该得到更多的关注和研究。
课题组前期探讨了青蒿乙素、青蒿酸和东莨菪内酯三组分对正常小鼠体内青蒿素药动学行为的影响。综合分析正常和疟疾小鼠模型的结果,表明正常和疟疾小鼠灌胃给予100 mg/kg青蒿素后,正常小鼠体内青蒿素的血药浓度大于疟疾小鼠体内青蒿素浓度,正常小鼠组青蒿素的Cmax、AUC(0-t)均略高于疟疾小鼠组,达峰时间相同;正常和疟疾小鼠灌胃四组分后,正常小鼠体内青蒿素的浓度大于疟疾小鼠体内青蒿素浓度,正常小鼠组青蒿素的Cmax、AUC(0-t)均略高于疟疾小鼠组,达峰时间滞后。表明青蒿素单体相同剂量单次给药,在正常和疟疾小鼠的药物动力学存在差异。一般认为,疟疾感染会导致青蒿素类药物的代谢减少,体内血药浓度相对增高[5]。本次实验的结果提示,除代谢环节以外,青蒿素的体内过程同时也受其他环节的影响,比如蛋白结合过程等。前期课题组研究表明与青蒿素单独作用相比,四组分联用对牛血清白蛋白的猝灭常数和结合常数均增大,青蒿素体内蛋白存贮及转运发生改变,影响青蒿素的药物动力学行为[9]。
鉴于青蒿素类药物耐药性发展的严峻形势,研究人员应高度重视新型抗疟药物和治疗策略的研究。笔者认为通过深入研究青蒿“以1∶1∶1∶1质量比配伍时青蒿四组分体系中青蒿素增效4倍的现象”,有助于发展新的抗疟策略,能够为合理应用青蒿植物制剂,发展低耐药性天然ACTs组分药物奠定基础。本实验结果显示,与青蒿素单用比较,青蒿素、青蒿乙素、青蒿酸和东莨菪内酯联用组青蒿素在约氏疟原虫感染小鼠体内的最大血药浓度由924 ng/mL增加到1065 ng/mL,AUC(0-t)(1893 h×ng/mL)明显高于青蒿素单用组(661 h×ng/mL),半衰期延长,血浆清除率下降了65%,确证了青蒿素天然协同组分通过改变其药物动力学性质来提高抗疟作用的学术观点,提示了天然组分干预青蒿素的体内过程是一种可行的增效策略。
参考文献
[1]World Health Organization. World Malaria Report 2015 [R].Geneva:WHO,2015.
[2]World Health Organization. Guidelines for the treatment of malaria(Third edition)[R]. Geneva:WHO,2015.
[3]赵绍敏,王满元. 恶性疟原虫对青蒿素类药物产生耐药性的全球现状和基础研究[J]. 中国寄生虫学与寄生虫病杂志,2014,32(5):81-85.
[4]纪晓光,孙雅洁,王京燕,等.青蒿化学成分及其与青蒿素伍用对鼠疟的药效学研究[J]. 寄生虫与昆虫学报,2008,15(4):198-201.
[5]De-Oliveira AC,Da-Matta AC,Paumgartten FJ. Plasmodium berghei (ANKA):infection induces CYP2A5 and 2E1 while depressing other CYP isoforms in the mouse liver[J]. Experimental Parasitology,2006,113(4):256-261.
[6]Weathers PJ,Arsenault PR,Covello PS,et al. Artemisinin production in Artemisia annua:studies in planta and results of a novel delivery method for treating malaria and other neglected diseases [J]. Phytochemistry Reviews,2011,10(2):173-183.
[7]Abolaji AO,Eteng MU,Ebong PE,et al. A safety assessment of the antimalarial herb Artemisia annua during pregnancy in wistar rats [J]. Phytotherapy Research,2013,27(5):647-654.
[8]World Health Organization. WHO position Statement: effectiveness of non-pharmaceutical forms of Artemisia annua L. against malaria [R].Geneva:WHO,2012.
[9]王满元,张超,李静,等. 青蒿截疟组合物与牛血清白蛋白的相互作用[J]. 高等学校化学学报,2014,35(2):309-313.
(本文编辑: 董历华)
The effects of arteannuin B,arteannuic acid and scopoletinon pharmacokinetics of artemisinin in mice infected by Plasmodium yoelii
ZHANGChao,QIUFeng,LIJing,etal.
SchoolofTraditionalChineseMedicine,CapitalMedicalUniversity,Beijing100069,China
【Abstract】ObjectiveTo explore the antimalaria synergistic effects of arteannuin B, arteannuic acid and scopoletin on the pharmacokinetics of artemisinin in mice infected by Plasmodium yoelii. MethodMice infected by Plasmodium yoelii were given artemisinin or a combination of artemisinin、arteannuin B、arteannuic acid and scopoletin. Blood samples were collected at different time intervals and extracted by liquid-liquid extraction. The contents in plasma were detected by HPLC-MS/MS method. ResultsCompared to single artemisinin group, the C(max) of the combination group was increased from 924 ng/mL to 1065 ng/mL,AUC((0-t))(1893 h×ng/mL), and the maximum plasma concentration was significantly higher than that of single artemisinin group (661 h×ng/mL), the biological half life was extended, and the CLtot was reduced at a proportion of 65%. ConclutionArteannuin B、arteannuic acid and scopoletin can obviously affect pharmacokinetic of artemisinin in mice infected by Plasmodium yoelii.
【Key words】Artemisinin;Artemisia annua L.;Synergistic components;Pharmacokinetic;Mouse model of malaria
(收稿日期:2016-02-29)
Corresponding author:WANG Man-yuan, E-mail: wangmyjun@163.com;GONG Mu-xin,gongmuxin@126.com
【中图分类号】R285.5
【文献标识码】A
doi:10.3969/j.issn.1674-1749.2016.04.003
作者简介:张超(1986- ),女,2012年在读硕士研究生。研究方向:中药药物动力学研究。E-mail:13426423780@163.com通讯作者:王满元(1976- ),博士,副教授,硕士生导师。研究方向:中药药物动力学研究。E-mail: wangmyjun@163.com;龚慕辛(1968- ),女,博士,教授,博士生导师。研究方向:中药药物动力学研究。E-mail: gongmuxin@126.com
基金项目:国家自然科学基金(81573682,81102752);北京市自然科学基金(2112010)
——青蒿素

