不同浓度水杨酸对西瓜幼苗抗冷性的诱导效应
张永吉+李爱民+徐中友+张云虹+苏芃+张瑛+祁建波+张永泰


摘要: 以早佳“8424”西瓜幼苗为试验材料,低温处理前分别喷施0、0.25、0.5、1.0、2.0 mmol/L 5个浓度的水杨酸(SA),研究SA对西瓜幼苗抗冷性的影响。结果表明,叶面喷施SA能有效提高西瓜苗抗冷性,SA能降低西瓜幼苗的冷害指数,显著提高西瓜幼苗叶片超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶 (CAT)活性,增加脯氨酸(Pro)含量,有效减缓丙二醛(MDA)积累,促进可溶性蛋白含量积累。其中以1 mmol/L浓度缓解西瓜冷害效果最好。
关键词: 西瓜幼苗;水杨酸(SA);抗冷性;生理生化
中图分类号: S651.01 文献标志码: A 文章编号:1002-1302(2016)03-0183-02
西瓜属喜温耐热的经济作物,素有“夏季水果之王”的美称。早佳8424是长三角地区主要西瓜供应品种之一,其果瓤脆嫩、味甜多汁,栽培面积很大,在江苏省常作保护地早春栽培。西瓜最适宜生长温度为20~30 ℃,最低、最高生长温度分别为18、35 ℃[1],早春保护地栽培时经常受到0 ℃以上的低温伤害,虽然持续时间不长,但给种植户带来的经济损失却很大,常造成西瓜出苗不齐、死苗等问题,而且对花芽分化、生长发育和产量等造成不同程度的影响。水杨酸(SA)是普遍存在于高等植物体内的内源生长调节物质[2-3],在植物的抗冷性中,被认为是一种内源信号分子[4],它可以通过抑制膜脂过氧化来维持膜完整性[5]。在茄子[6]、西葫芦[7]、番茄[8]等蔬菜作物上的研究已经证实,SA可以提高植物的抗冷性,但不同作物适宜使用浓度不一致。于锡宏等研究表明,300~400 mg/L SA可以缓解番茄冷害[8]。刘伟等研究发现,2 mmol/L SA是预防黄瓜低温危害的最适浓度[9]。目前西瓜上应用SA预防低温伤害的最适浓度未见报道。本试验以早佳8424西瓜为试验材料,研究了西瓜苗期施用不同浓度SA后对冷害及生理指标的影响,旨在为进一步合理利用SA化学调控解决西瓜设施生产中的低温冷害问题提供理论依据。
1 材料与方法
1.1 试验材料
供试西瓜品种为早佳8424,2014年1月11日购于浙江勿忘农种业股份有限公司。RXZ-1000型智能人工气候箱,水杨酸为国产分析纯。
1.2 试验方法
参照李爱民等的方法[10] (略有改动),于2014年2月24日在江苏里下河地区农业科学研究所进行田间试验。选取籽粒饱满、大小一致的种子集中浸种催芽后播于50孔的穴盘内,每穴1株,正常光温管理,平均温度为25 ℃(白)/15 ℃(夜),光照度为600 μmol/(m2·s)。2014年5月3日,待西瓜幼苗长到3叶1心期时,选择长势一致、无病虫害、健壮的植株进行5个浓度的SA处理,分别为0、0.25、0.5、1.0、2.0 mmol/L,每个浓度处理50株,均匀喷布叶面,浓度为0的处理喷蒸馏水。间隔24 h连续喷施2次后放于人工气候箱中,温度设定为10 ℃(昼)/5 ℃(夜),光照度为200 μmol/(m2·s),光暗各12 h。以25 ℃常温苗为对照(CK),各处理重复3次,低温胁迫3 d后测定各指标。
1.3 测定内容与方法
参照许勇等的方法[11] 计算冷害指数,调查西瓜幼苗在低温胁迫下的伤害情况,并统计冷害指数。冷害指数计算公式如下:冷害指数=∑(各级株数×级数)/总株数。采用李合生的方法[12]测定生理指标。采用氮蓝四唑(NBT)光还原法测定超氧化物歧化酶(SOD)活性;采用愈创木酚比色法测定过氧化物酶(POD)活性;采用紫外吸收法测定过氧化氢酶(CAT)活性;采用硫代巴比妥酸比色法测定丙二醛(MDA)含量;采用水合茚三酮显色法测定脯氨酸含量;采用考马斯亮蓝法测定可溶性蛋白含量;采用SPAD-502叶绿素仪测定叶片SPAD值。
1.4 数据分析
采用DPS、Excel软件统计分析数据。
2 结果与分析
2.1 SA对低温胁迫下西瓜幼苗冷害指数、叶片SPAD值的影响
低温胁迫前对西瓜幼苗喷施0、0.25、0.5、1.0、2.0 mmol/L 5种不同浓度的SA溶液,经低温处理3 d后,其冷害指数分别为0.684、0.623、0.552、0.240、0.350,除 0.25 mmol/L SA处理后冷害指数与0 mmol/L处理差异不显著外,其他处理均极显著低于0 mmol/L。随着SA浓度的增加,西瓜幼苗的冷害指数逐渐减小,1.0 mmol/L SA处理下西瓜幼苗冷害指数最低,2.0 mmol/L SA处理下西瓜幼苗冷害指数开始变大,表明SA对西瓜苗情的低温伤害有缓解作用,采用叶面喷施SA可以有效提高西瓜幼苗的耐冷性,以1.0 mmol/L SA浓度最佳。
由于叶片SPAD值与叶绿素含量呈极显著相关,常用SPAD值来代表叶绿素的相对含量。低温胁迫3 d后,西瓜幼苗SPAD值都有所降低,没有喷施SA的低温处理SPAD值下降最多。1.0 mmol/L SA处理的西瓜幼苗低温胁迫后其SPAD值仍与常温CK接近,表明其低温伤害最小(表1)。
2.2 SA对低温胁迫下西瓜幼苗叶片SOD、POD、CAT活性的影响
由表2可见,低温处理3 d后,西瓜幼苗叶片CAT活性呈上升趋势,随着浓度的增加,CAT的活性越大。0.5、1.0、2.0 mmol/L 3种浓度低温处理下西瓜幼苗叶片CAT活性都极显著高于对照和未喷施SA的低温处理,由此可见,SA处理增强了西瓜叶片CAT活性。同常温对照处理相比,所有低温处理后的西瓜叶片SOD活性都呈现不同程度的上升;进行不同浓度SA低温处理后,较没有喷施SA相比,西瓜叶片内SOD活性都有所提高,其中1.0、0.25 mmol/L 2个浓度处理下SOD活性提高最多。低温处理后,西瓜幼苗叶片POD酶活性升高,极显著高于常温对照,表明冷害胁迫刺激后,西瓜体内POD快速积累,提高呼吸作用、光合作用等反应提高抗冷性。与不喷施SA的低温处理相比,SA处理均能提高叶片内POD活性,其中1.0 mmol/L SA处理下POD活性提高最多。
2.3 SA对低温胁迫下西瓜幼苗脯氨酸、丙二醛、可溶性蛋白的影响
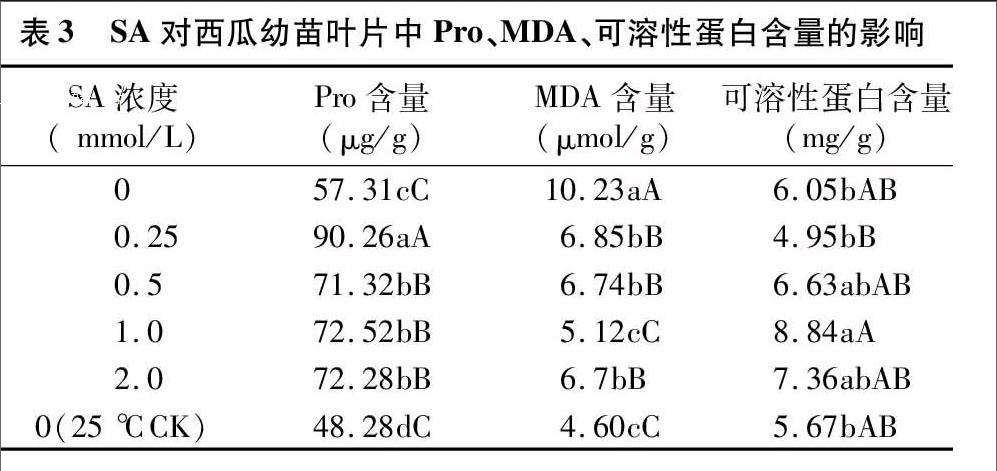
如表3显示,低温处理促进了西瓜叶片内脯氨酸(Pro)含量的积累,各处理均极显著高于常温对照。SA有助于西瓜幼苗Pro的增加,从而在一定程度上保护细胞膜的结构。MDA是膜脂过氧化产物,经过低温胁迫后西瓜幼苗体内的MDA含量有所增加。与0 mmol/L处理相比,喷施SA可以缓解植株体内MDA积累,其含量极显著低于0 mmol/L处理,特别在1.0 mmol/L下达到最低,说明 1.0 mmol/L SA对缓解膜脂过氧化效果显著。除0.25 mmol/L SA处理外,低温胁迫下,西瓜幼苗可溶性蛋白含量变化均表现出增高趋势,喷施SA处理西瓜幼苗可溶性蛋白含量明显高于未经SA处理过的植株,1.0 mmol/L SA处理显著高于0处理和CK。表明低温处理后,SA可以调节西瓜幼苗主动积累可溶性蛋白降低渗透势。
3 结论与讨论
低温胁迫有利于植物体内自由基的产生,可以引起膜脂过氧化作用,这时植物体内清除过剩自由基的酶保护系统会启动,酶的活性增高。水杨酸(SA)在植物的抗寒性中,被认为是植物在胁迫反应中产生的一种信号分子,它可以通过抑制膜脂过氧化来维持膜完整性[5],从而可以有效地保护植株免受伤害。SOD、POD、CAT是植物体内清除活性氧的重要细胞保护酶类,这3种保护酶是植物抗寒性鉴定的重要指标之一,它们协同作用,清除膜脂过氧化产生的中间产物。SOD是植物抗氧化系统的第一道防线,它可以使歧化反应中产生的活性氧转化成H2O2,然后通过POD、CAT等将H2O2转化为H2O、O2,从而有效阻止 O-2 · 和H2O2相互作用对细胞膜产生更大伤害[13]。本研究结果表明,经过SA喷施与低温处理后,西瓜幼苗SOD、POD、CAT 3种保护酶相比没有喷施SA的CK有明显提高。低温试验中,1.0 mmol/L SA处理后西瓜幼苗内SOD、POD活性达到最大,说明1.0 mmol/L SA浓度可以有效增强西瓜抗逆性。脯氨酸(Pro)广泛存在于植物体内,主要是作为渗透调节物质、蛋白质分子的保护物质以及活性氧的清除剂等发挥作用,从而起到抗寒作用。Kornyeyev等认为,在低温胁迫下Pro的累计能力与品种的抗寒能力呈正相关[14]。马淑英等认为,在低温胁迫下Pro的累积能力与品种的抗寒性呈负相关[15]。本试验中,低温后Pro含量明显增加,这和于锡宏等和耿广东等的研究结果[6,8]一致。MDA是膜脂过氧化的产物,其含量高低可以反映出膜脂过氧化的程度。本试验中,SA处理的西瓜幼苗的MDA积累量显著较低,且在1.0 mmol/L的浓度下达到最低,说明SA处理后低温胁迫对西瓜幼苗叶片的细胞膜伤害较轻,保持了膜的稳定性,增强了西瓜幼苗的抗冷性。低温可以促使可溶性蛋白这种植物渗透调节物质含量增加,以增强细胞膜的稳定性。随着SA浓度的增加,西瓜幼苗体内的可溶性蛋白含量逐渐增加,在1.0 mmol/L 诱导下其值达到最大。综合考虑各项指标,笔者认为,西瓜幼苗预防低温伤害适宜的水杨酸浓度应当选择 1.0 mmol/L。
参考文献:
[1]Korkmaz A,Dufault R J. Developmental consequences of cold temperature stress at transplanting on seedling and field growth aad yield. Ⅰ. Watermelon[J]. Journal of the American Society for Horticultural Science,2001,126(4):404-409.
[2]谢玉英. 水杨酸与植物抗逆性的关系[J]. 生物学杂志,2007,24(4):12-15,20.
[3]Pal M,Kovacs V,Vida G,et al. Changes induced by powdery mildew in the salicylic acid and polyamine contents and the antioxidant enzyme activities of wheat lines[J]. European Journal of Plant Pathology,2013,135(1):35-47.
[4]Gaffney T,Friedrich L,Vernooij B,et al. Requirement of salicylic-acid for the induction of systemic acquired-resistance[J]. Science,1993,261(5122):754-756.
[5]李国婧,周 燮. 水杨酸与植物抗非生物胁迫[J]. 植物学通报,2001,18(3):295-302.
[6]耿广东,程智慧,李建设,等. 水杨酸对茄子幼苗抗寒性的影响[J]. 西北农林科技大学学报:自然科学版,2002,30(6):101-103.
[7]徐伟慧,周兰娟,王志刚. 外源水杨酸缓解西葫芦幼苗低温胁迫的效应[J]. 浙江农业学报,2013,25(4):764-767.
[8]于锡宏,蒋欣梅,刁 艳,等. 脱落酸、水杨酸和氯化钙对番茄幼苗抗冷性的影响[J]. 东北农业大学学报,2010,41(5):42-46.
[9]刘 伟,艾希珍,梁文娟,等. 低温弱光下水杨酸对黄瓜幼苗光合作用及抗氧化酶活性的影响[J]. 应用生态学报,2009,20(2):441-445.
[10]李爱民,张永泰,熊 飞,等. 低温弱光对西瓜幼苗生理特性的影响[J]. 扬州大学学报:农业与生命科学版,2012,33(2):78-82,94.
[11]许 勇,王永健,张 峰,等. 西瓜幼苗耐低温研究初报[J]. 华北农学报,1997,12(2):94-97.
[12]李合生.植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000:260-261.
[13]Stevens K J,Kim S Y,Adhikari S,et al. Effects of triclosan on seed germination and seedling development of three wetland plants:Sesbania herbacea,Eclipta prostrate and Bidens frondosa[J]. Environmental Toxicology and Chemistry,2009,28(12):2598-2609.
[14]Kornyeyev D,Logan B A,Payton P,et al. Enhanced photochemical light utilization and decreased chilling-induced photoinhibition of photosystem Ⅱ in cotton overexpressing genes encoding chloroplast-targeted antioxidant enzymes[J]. Physiologia Plantarum,2001,113(3):323-331.
[15]马淑英,尹田夫,宋海星,等. 低温对不同耐冷大豆萌发种子游离脯氨酸变化的影响[J]. 吉林农业科学,1998(4):90-92.

