阿坝地区狼毒内生放线菌多样性及抗菌活性
廖敏,张波,范中菡,陈熊春蕊,张小平*
(1.四川农业大学资源学院,四川 成都 611130;2.绵阳师范学院生命科学与技术学院,四川 绵阳 621000)
阿坝地区狼毒内生放线菌多样性及抗菌活性
廖敏1,2,张波1,范中菡1,陈熊春蕊1,张小平1*
(1.四川农业大学资源学院,四川 成都 611130;2.绵阳师范学院生命科学与技术学院,四川 绵阳 621000)
摘要:通过可培养方法以四川省阿坝地区药用植物狼毒为研究对象,探究其内生放线菌多样性及抗菌活性,为开发新型生物活性物质提供依据。结果如下,1)多种因素决定了狼毒内生放线菌分离数量,其中土壤有机质与其相关系数为0.86,在0.05水平相关性显著。2)高氏一号培养基分离52株内生放线菌,占总数30.4%;植株不同部位分离内生放线菌结果为根部>茎部>叶部>花部。3)16S rDNA-RFLP将供试菌株分成11个遗传群,代表菌株系统发育分析表明,供试菌株以链霉菌属为主,其余菌株包括诺卡氏菌属、北里孢菌属、克里布所菌属。4)对代表菌株NRPS、PKS基因分析共获得4个PKS基因和2个NRPS基因;大部分代表菌株对3种病原真菌有抗菌活性,菌株SCAUEⅢD11-1效果最好。综上,狼毒内生放线菌分离结果受多因素影响,具有较丰富的多样性;功能基因筛选及抗菌活性结果揭示出阿坝地区狼毒内生放线菌具有潜在的运用价值。
关键词:狼毒;内生放线菌;多样性;功能基因;抗菌活性;系统发育
狼毒(Stellerachamaejasme)是一种多年生草本植物,有逐水祛痰、破积杀虫之用,临床可用于治疗水肿腹胀,慢性气管炎等[1]。四川省阿坝地区以高原和山谷为主,资源优势明显,作为药材资源之一的狼毒,在该区域的分布也较为广泛。近几年随着人们对狼毒药用价值的开发与利用,对其进行的研究也越来越多。庄果等[2]采用不同方法和温度制备炮制品研究辅料和温度对狼毒成分的影响,结果表明辅料和温度对狼毒成分的影响都较大;王灿坚等[3]采用RP- HPLC法测定狼毒中狼毒乙素和岩大戟内酯B的含量发现该方法可用于狼毒药材的质量控制。目前,大多有关狼毒的研究主要停留于对其内在成分的测定与发掘,其微环境的探究基本没有涉及。
内生放线菌是植物微生态系统重要组成部分,药用植物内生放线菌多样性丰富,能产生天然活性物质[4]。研究内生放线菌群落结构,挖掘其功能基因及抗菌活性已逐渐成为从资源到实践的必要途径。张波等[5]运用变性梯度凝胶电泳分析了花苜蓿(Medicagoruthenica)内生放线菌的多样性和群落结构;姚晓玲等[6]对喜树(Camptothecaacuminata)种子内生放线菌进行分离鉴定,并从中筛选到新型活性化合物产生菌,能为发掘新活性化合物提供有价值的实验材料。Zhao等[7]对攀西高原药用植物内生放线菌功能基因及抗菌活性研究表明,分离的内生放线菌抗菌活性与PKS、NRPS功能基因扩增结果有一定联系,且表现出广谱抗菌活性,蕴含潜在价值的天然活性物质。本文以采自四川省阿坝地区药用植物狼毒分离的内生放线菌作为研究对象,探究其种群多样性、系统发育、功能基因及抗菌活性,为获取有价值野生药用植物内生放线菌资源提供依据。
1材料与方法
1.1实验材料
本研究于2013年6月中旬从四川省阿坝地区6个不同地点采集狼毒植株样品。每个采样点采集3株健康植株,植株相距5~10 m,并采集适量根际土,植株生长海拔及具体地理位置见表1。为防止样品污染,采集后对样品进行简单处理:首先去除植株根表土壤,然后乙醇擦拭植株有切口部位并对切口进行蜡封。将处理后的样品装入无菌塑料袋,带回四川农业大学微生物实验室进行放线菌分离。根际土风干后进行理化性质测定[8],结果见表2。

表1 采集狼毒样品的地理情况
1.2内生放线菌分离
选择5种培养基用于狼毒内生放线菌分离,所用琼脂量均为1.8%。5种培养基分别为:Ⅰ、精氨酸培养基(精氨酸1 g,ZnSO40.001 g,甘油12.5 g,MnSO40.001 g,MgSO40.5 g,FeSO40.01 g,CuSO40.001 g,K2HPO41 g,琼脂18 g,蒸馏水定容至1 L,pH=7.2);Ⅱ、克氏合成1号培养基(K2HPO41 g,MgCO30.3 g,NaCl 0.2 g,KNO31 g,FeSO40.01 g,CaCO30.5 g,葡萄糖20 g,琼脂18 g,蒸馏水定容至1 L,pH=7.2~7.4);Ⅲ、改良脯氨酸培养基(脯氨酸5 g,琼脂18 g,蒸馏水定容至1 L);Ⅳ、腐植酸培养基(腐植酸1 g,NaOH 1 g,Na2HPO40.5 g,KCl 1.7 g,MgSO40.05 g,FeSO40.01 g,CaCl21 g,琼脂18 g,蒸馏水定容至1 L);Ⅴ、高氏一号培养基(可溶性淀粉20 g,MgSO40.5 g,FeSO40.01 g,K2HPO40.5 g,NaCl 0.5 g,KNO31 g,琼脂18 g,蒸馏水定容至1 L)。为了抑制真菌和细菌生长,使用终浓度为50 μg/mL的抑菌剂:萘啶酮酸和K2Cr2O7。

表2 土样基本理化性质
将样品根茎叶花分离后,用0.1% Tween 20清洗30 s,无菌水冲洗3次;75%乙醇浸泡5 min,无菌水冲洗3次;2% NaClO2浸泡5 min,无菌水冲洗3次;10% NaHCO3漂洗10 min[9]。样品处理后置于铺有无菌滤纸的无菌培养皿,吸干植物组织表面水分。同时取最后一次清洗样品的无菌水300 μL均匀涂布于5种培养基,28℃培养30 d,观察有无菌落长出以验证分离放线菌为内生。捣碎样品并均匀涂布于培养基,28℃培养30 d。分离纯化培养基采用ISP4[可溶性淀粉10 g,(NH4)2SO44 g,CaCO32 g,MgSO42 g,K2HPO42 g,琼脂18 g,蒸馏水定容至1 L,pH=7.0~7.5]。实验分离所得内生放线菌统一编码为SCAUE(四川农业大学内生放线菌)&培养基编号&植物编号&植株部位&菌株自然序号。其中植株部位根、茎、叶、花分别用r、s、l和f表示。
1.316S rDNA RFLP分析
放线菌提取DNA使用细菌基因组DNA提取试剂盒(购自上海生工),PCR扩增采用引物为8-27f(5′-CCGTCGACGAGCTCAGAGTTTGATCCTGGCTCAG-3′)[10]和 1523-1504r(5′-CCCGGGTACCAAGCTTAAGGAGGTGATCCAGCCGCA-3′)[10]。反应体系(50 μL):master Mix (购自上海生工)25 μL,引物(10 μmol/L)各1 μL,模板DNA 1 μL,ddH2O补足50 μL。PCR程序[11]:94℃预变性5 min,94℃变性1 min,56℃退火1 min,72℃延伸2 min,变性到延伸循环30次,72℃延伸10 min,最后4℃保存。完成PCR后,1%琼脂糖凝胶电泳检测,电泳100 V,15 min。
选用限制性内切酶HaeⅢ和HhaⅠ对PCR产物进行酶切,反应体系(10 μL):10×Buffer 1 μL,内切酶(10 U/μL)各0.5 μL,PCR产物 5 μL,ddH2O补足至10 μL。该体系充分混匀后,37℃ 8~16 h反应,之后使用2.5%琼脂糖凝胶,100 V水平电泳4 h。电泳完成后成像仪照相并保存。采用Excel、NTSYS等软件对酶切图谱进行分析处理,运用非加权平均法(UPGMA)进行聚类分析并构建树状图谱[12]。
1.4功能基因扩增
PKSI扩增引物为PKS-I-A(5′-GCSATGGAYCCSCARCARCGSVT-3′)、PKS-I-B(5′-GTSCCSGTSCCRTGSSCYTCSAC-3′);PKSII扩增引物为PKS-II-A(5′-TSGCSTGCTTGGAYGCSATC-3′)、PKS-II-B(5′-TGGAANCCGCCGAABCCGCT-3′);NRPS扩增引物为NRPS-A(5′-GCSTACSYSATSTACACSTCSGG-3′)、NRPS-B(5′-SASGTCVCCSGTSCGCTAS-3′)[7]。PKS及NRPS扩增:1)反应体系(30 μL):15 μL 2×PCR Mix,1 μLPKS-I-A/PKS-I-B(10 pmol)或PKS-II-A/PKS-II-B(10 pmol)或NRPS-A/NRPS-B(10 pmol),2 μL DNA,无菌水补足至30 μL[7]。2)反应程序:94℃预变性5 min(NRPS为4 min),94℃变性1 min(NRPS为30 s),60℃退火1 min,72℃延伸2 min,35个循环,72℃延伸10 min,1%琼脂糖凝胶电泳检测产物大小[13]。
1.5抗菌活性检测
选取11株狼毒内生放线菌采用对峙生长法进行抗菌活性检测[14],病原真菌包括:西瓜枯萎病原真菌尖孢镰刀菌(Fusariumoxysporum)、黄瓜炭疽病原真菌瓜类刺盘孢菌(Colletotrichumorbiculare)和玉米弯孢病原真菌月状弯孢菌(Curvularialunata),3种植物致病真菌均由四川农业大学植物病理实验室提供。
1.6菌株测序及构建系统发育树
通过限制性酶切多态分析,选择代表菌株进行测序。测序结果用Blast程序从GenBank公共数据库中获得相似性较高相关菌株16S rDNA基因序列。采用Clustal X软件进行多序列比对,结合Neighbor-joining方法在Mega 5.0中构建系统发育树[15-16]。
2结果与分析
2.1各因素对狼毒内生放线菌分离的影响

图1 不同培养基及植株不同部位分离内生放线菌数量比较Fig.1 Comparison of isolated endophytic actionbacteria with different culture media in different plant tissues
研究结果表明,采样地海拔、土壤有机质、土壤pH与土壤水分都不同程度影响狼毒内生放线菌的分离结果。其中,采样地海拔与土壤pH对内生放线菌分离数量呈不显著负相关,而土壤水分与土壤有机质对其呈正相关,后者相关系数为0.86,在0.05水平相关性显著。
5种培养基对狼毒内生放线菌分离情况差异较大。图1显示,高氏一号培养基分离到52株内生放线菌,占总数30.4%,而精氨酸培养基分离放线菌数量最少,仅占总数9.9%。植株不同部位分离内生放线菌差异也较大,狼毒根、茎、叶、花都分离到内生放线菌,根部分离数量最多,占总数40.4%,茎部其次,花部最少,分离到12株。
2.2狼毒内生放线菌RFLP分析
通过形态鉴定从171株狼毒内生放线菌中筛选37株进行酶切聚类。HhaⅠ/HaeⅢ酶切综合聚类如图2所示,供试菌株在67%相似度水平聚在一起,在82%相似度水平可分为 11个遗传类型。其中1,2遗传类型占主导地位,分别包含9和14株内生放线菌,合计占总数62.2%。1遗传类型内生放线菌主要分离自腐植酸培养基,来源于狼毒的根、茎、叶、花;而2遗传类型内生放线菌50%分离自高氏一号,71.4%来源于狼毒根部。
2.3功能基因及抗菌活性分析
11株代表菌株共得到4个PKS基因片段,占总数36.3%,而NPRS基因片段只有2个,占18.2%。4个PKS基因中1个为PKSⅡ,3个为PKSⅠ,PKSⅠ基因条带在1400 bp左右(图3),而PKSⅡ与NRPS基因片段大小相似,约为750 bp。结合系统发育分析,具有功能基因的菌株主要为链霉菌属(Streptomyces)与克里布所菌属(Kribbella)。
对11株代表菌株的抗菌活性测定显示,90.9%对病原真菌有不同程度抑制(表3),体现较广的抗菌谱。抗菌圈测定结果表明不同内生放线菌对不同病原真菌拮抗效果存在差异,对西瓜枯萎病原真菌(F.oxysporum)、玉米弯孢病原真菌有抑制效果的菌株皆占总数63.6%,而抑制黄瓜炭疽病原真菌的放线菌仅3株。另外,菌株SCAUEⅢD1l-1对3种病原真菌都有抑制效果,抑菌率达100%,而菌株SCAUEⅢA1l-1抑菌率为0。
2.4狼毒内生放线菌系统发育
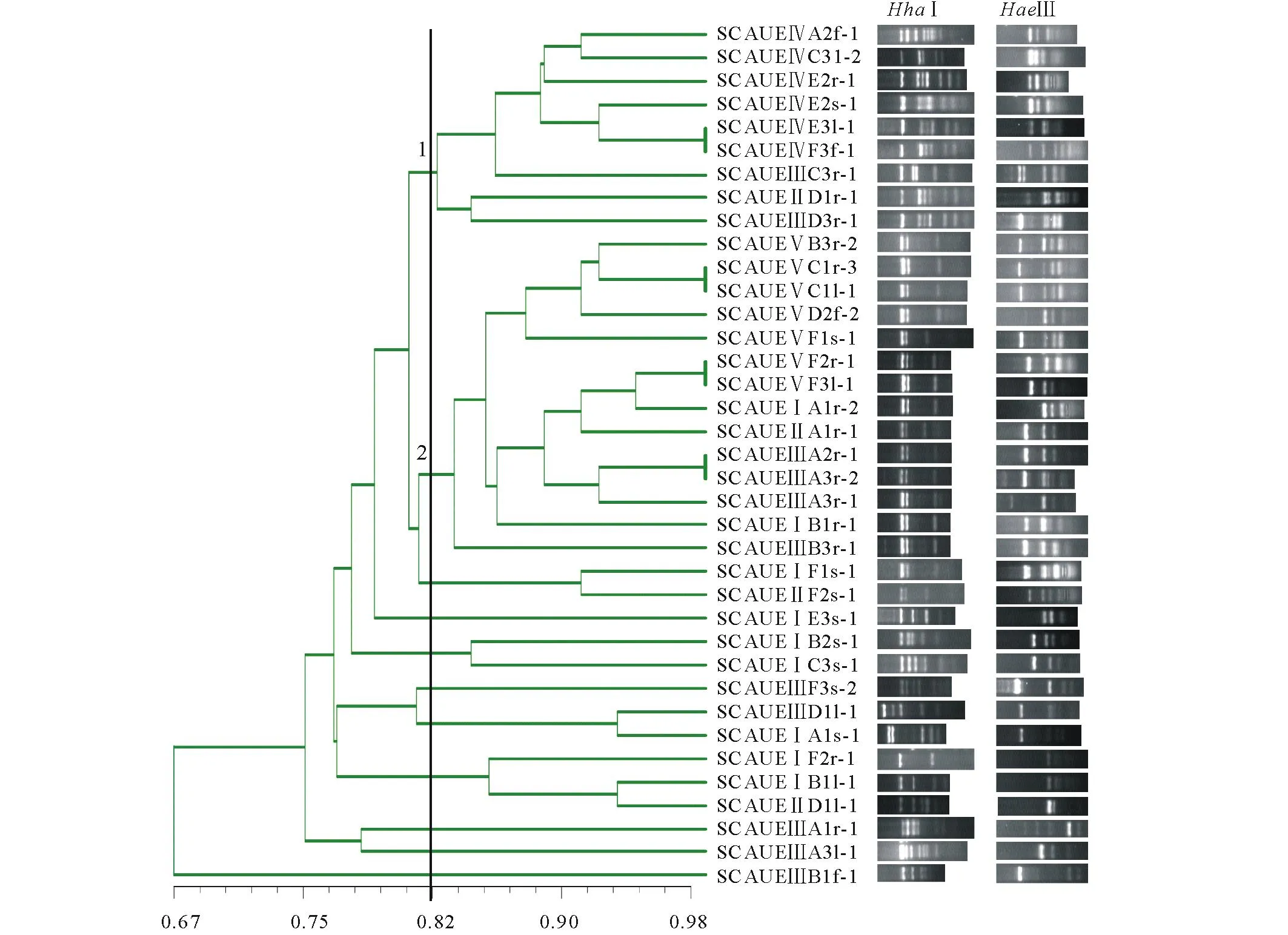
图2 内生放线菌HaeⅢ/HhaⅠ酶切综合聚类图Fig.2 Integrated clustering diagram for HaeⅢ/HhaⅠdigestion of endophytic actionbacteria 聚类图中编号1、2为主要遗传类型群,HhaⅠ与HaeⅢ为2种限制性内切酶,下方为酶切图谱。The major genetic types in the clustering diagram were numbered 1 and 2. HhaⅠand HaeⅢ were restricted enzymes used in the study, and below were restriction patterns.
从11 个遗传类群各选取1株代表菌株进行测序,系统发育分析发现,11株内生放线菌大致聚为4簇(图4)。供试菌株包括链霉菌属、诺卡氏菌属(Nocardia)、克里布所菌属和北里孢菌属(Kitasatospora)。其中,链霉菌属为明显优势种属,占63.6%。结合RFLP 聚类及系统发育分析,狼毒内生放线菌具有较丰富的多样性,SCAUEⅢA1r-1与SCAUEⅢA1l-1为北里孢菌属,明显远离其他菌属放线菌。

图3 代表菌株 PKSⅠ扩增电泳图Fig.3 Electrophoretogram of PKSⅠamplication of representative strains M:Marker; a,b,c:扩增产物Amplification products.
3讨论
采样地海拔、土壤有机质、土壤pH与土壤水分会影响内生放线菌分离数量[17-18]。各因子间存在必然关系:海拔不仅反映采样地垂直高度变化,还影响其他因子的变动。海拔越高,温度越低,植被覆盖率减小,因此土壤质地发生变化;土壤质地将影响土壤有机质、土壤pH与土壤水分等因子。本研究除土壤有机质与内生放线菌分离数量呈显著正相关,其余因子与内生放线菌分离数量相关性不显著。土壤有机质能为微生物生长繁殖提供适宜条件, 丰富的有机质很大程度上增加微生物的数量[19]。土壤水分较高的环境更吸引微生物进入, 从而增加微生物的数量,尽管这与本研究结果一致,但相关系数不到0.1。而海拔与土壤pH对菌株分离数量呈不显著负相关。海拔作为放线菌分离影响因素之一,较大程度影响着分离结果,土壤pH亦然,可本研究中二者与内生放线菌分离数量相关系数R都较小。传统培养方法尽管能分离获得一些放线菌,但因其不能完全模拟植物内生环境[20]而导致分离结果与实际存在偏差,可培养手段分离的放线菌并不能准确反映自然环境下放线菌生长情况,因此R值偏小。从高海拔、土壤偏酸或偏碱环境下生长的植株组织分离的放线菌数量相对较少,但此环境往往可能分离到稀有菌株,甚至新种。因此,为更多分离出内生放线菌,可选用多种培养基模拟内生放线菌的自然生长环境[21]。
内生放线菌不仅受植株生长区域的影响,还受培养环境、组织类型等因素影响。本研究根据培养基化学成分的差异选择了5种培养基,统计发现,不同培养基分离所得放线菌数量差异较大。高氏一号培养基,配方简单,却分离到较多放线菌,而精氨酸培养基化学成分最丰富,还含有Zn2+、Mn2+等微量元素,分离效果最差。综合分析表明,生长于营养丰富培养基的放线菌生命力可能不如寡营养培养基生长的放线菌。在不断分离纯化菌株过程中,一些放线菌由于不能适应骤变的生长环境而死亡[22-23]。植物内生放线菌具有稳定的生存空间,能在植物体内生存繁殖,普遍分布于植物根、茎、叶等器官或组织。相关研究表明,植物内生放线菌在不同器官或组织的分布存在明显差异。本研究中,狼毒内生放线菌分布特点为:根>茎>叶>花,结果与赵珂等[24]的研究一致。而田新莉等[25]对87种中草药内生放线菌的研究却发现地上部分离内生放线菌明显多于地下部。可见内生放线菌在植物体内的分布并不固定,会随外界或自身一些条件改变而变化,这种变化可能基于某些发生机制[26]。

表3 狼毒内生放线菌代表菌株抗菌活性
注: +++为抑菌圈>10 mm; ++为5~10 mm; +为1~5 mm;-表示无抑制作用。
Note: +++,width of growth inhibition zone >10 mm; ++,5~10 mm; +,1~5 mm;-,without inhibition.

图4 狼毒内生放线菌代表菌株系统发育分析Fig.4 Phylogenetic analysis of representive endophytic actinomycetes in S. chamaejasme Streptomyces:链霉菌属;Nocardia:诺卡氏菌属;Kribbella:克里布所菌属;Kitasatospora:北里孢菌属;Morchella:外缘真菌羊肚菌属;括号内序号为菌株登录号。The serial numbers in the brackets were accession numbers of the strains.
放线菌中链霉菌属是各种天然产物的重要来源,可产生丰富代谢物[27]。抗菌活性研究显示,抑制效果明显的代表菌株70%为链霉菌属。狼毒内生放线菌对不同病原真菌抑制程度不同,可见这些放线菌产生抑制病原真菌的化合物较为丰富,而非单一[28]。结合功能基因与抗菌活性研究不难发现,扩增出功能基因片段的菌株对病原真菌都有抑制效果,SCAUEⅣA2f-1对玉米弯孢病原菌抑菌圈直径大于10 mm;而SCAUEⅢD1l-1未扩增出功能基因片段,却对3种病原真菌皆有明显抑制,可见功能基因与抗菌活性并非绝对关系。这与Zhao等[7]研究发现一致,可能是由于抗菌活性物质并非PKS与NRPS基因合成,或者说某些功能基因合成的化合物并不作用于病原真菌。
采用多种酶切对放线菌DNA进行切割,结果存在差异。相关研究表明采用两种不同限制性内切酶对放线菌DNA进行研究,可实现属一级的鉴定水平[29]。本研究综合HhaⅠ/HaeⅢ效果较好,减少DNA呈现的片段重复性,增强其特异性[30]。11株代表菌株系统发育分析,63.6%为链霉菌属,可见链霉菌属在放线菌中的绝对优势。链霉菌可产生有价值的次生代谢产物,如链霉素[31-32],这些生物活性物质经开发可广泛运用于医学。同时,狼毒内生放线菌中还包括诺卡氏菌属等,有较为广阔的研究前景,揭示出狼毒内生放线菌资源的丰富性。
4结论
初步研究发现,狼毒内生放线菌群落结构受多因素影响,包括土壤有机质、土壤水分、海拔及土壤pH,其中土壤有机质与内生放线菌分离数量呈显著正相关。分离培养基的选择及植株分离部位都会影响内生放线菌的分离结果:寡营养型培养基优于富营养型培养基,植株不同分离部位而言,根部分离内生放线菌数量最多,花部最少。综合RFLP 聚类图及系统发育树,狼毒内生放线菌可分为11组遗传群,多样性较丰富,测序结果显示链霉菌属为优势菌群。代表菌株功能基因及抗菌活性研究表明,小部分放线菌存在PKS和NRPS基因片段,11株放线菌有较广的抗菌谱,但功能基因与抗菌活性无必然关联。综上可见,狼毒在阿坝地区生长较为普遍,对其内生放线菌的探索对今后开发新型生物活性物质有较为积极地影响与借鉴。
References:
[1]Tian S Y, Mei Q X. Overview of research on traditional Chinese medicineStellerachamaejasme. Lishizhen Medicine and Materia Medica Research, 2012, 23(5): 1316-1317.
[2]Zhuang G, Li J S, Cai B C. Study on HPLC chromatograms of different processedEuphorbiaebracteolataproducts and content change of three chemical components. China Journal of Chinese Materia Medica, 2013, 38(10): 1526-1530.
[3]Wang C J, Jiang Y Q, Bi F J,etal. RP-HPLC determination of 2,4-dihydroxy-6-methoxy-3-methylacetophenone and jolkinoli-de B inEuphorbiaebracteolataradix. Chinese Journal of Pharmaceutical Analysis, 2011, 31(5): 839-842.
[4]Zheng Y K, Liu K, Xiong Z J,etal. Research progress on biodiversity of endophytic actinobacteria in medicinal plants and their bioactive substances. Chinese Traditional and Herbal Drugs, 2014, 45(14): 2089-2099.
[5]Zhang B, Li X L, Jiang H M,etal. Diversity and community structure of the endophytic actinomycetes isolated fromMedicagoruthenia. Acta Prataculturae Sinica, 2013, 22(5): 113-119.
[6]Yao X L, Kang Q J, Xiong S Z,etal. Isolation and identification of endophytic actinomycetes from the seeds ofCamptothecaacuminataDecne. and isolation of antimicrobial substances from those endophytic actinomycetes. Microbiology China, 2014, 41(6): 1109-1120.
[7]Zhao K, Penttinen P, Guan T,etal. The diversity and anti-microbial activity of endophytic actinomycetes isolated from medicinal plants in Panxi Plateau, China. Current Microbiology, 2011, 62(1): 182-190.
[8]Lu R K. Methods of Soil Agricultural Chemical Analysis[G]. Beijing: Chinese Agricultural Press, 1999.
[9]Ruan J S, Liu Z H, Liang L R. Study and Application of Actinomycetes[G]. Beijing: Science Press, 1990: 251-321.
[10]Heuer H, Krsek M, Baker P,etal. Analysis of actinomycete communities by specific amplification of genes encoding 16S rRNA and gel-electrophoretic separation in denaturing gradients. Applied and Environmental Microbiology, 1997, 63(8): 3233-3241.
[11]Zhao K. Study on Diversity and Antibiotic Activity of Endophytic and Rhizospheric Actinomycetes from Medicinal Plants in Panxi Region[D]. Yaan: Sichuan Agricultural University, 2010.
[12]Li X L, Yuan H M, Qi S S,etal. Isolation and genetic diversity of the endophytic actinomycetes fromSalviamiltiorrhizaBge. andPolygonatumsibiricumRed. Microbiology China, 2010, 37(9): 1341-1346.
[13]Ren D, Zhang B, Zhang X P,etal. Inheritance in endophytic fungi fromMeliatoosendanand diversity of genes ofPKSandNRPS. Chinese Traditional and Herbal Drugs, 2014, 45(10): 1461-1467.
[14]Cao L, You Z Q, Tan H,etal. Isolation and characterization of endophyticStreptomycesstrains from surface-sterilized tomato (Lycopersiconesculentum) roots. Letters in Applied Microbiology, 2004, 39(5): 425-430.
[15]Tamura K, Dudley J, Nei M. MEGA4: molecular evolutionary genetics analysis (MEGA) software version 4.0. Molecular Biology and Evolution, 2007, 24(8): 1596-1599.
[16]Tamura K, Peterson D, Peterson N,etal. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Molecular Biology and Evolution, 2011, 28(10): 2731-2739.
[17]Gu A X, Fan Y M, Wu H Q,etal. Relationship between the number of three main microorganisms and the soil environment of degraded grassland on the north slope of the Tianshan Mountains. Acta Prataculturae Sinica, 2010, 19(2): 116-123.
[18]Wang C T, Long R J, Wang G X,etal. Relationship between plant communities, characters, soil physical and chemical properties, and soil microbiology in alpine meadows. Acta Prataculturae Sinica, 2010, 19(6): 25-34.
[19]Xi J Q, Yang Z H, Guo S J,etal. The correlation between soil physical and chemical properties and soil microbes in different types ofNitrariadune. Acta Prataculturae Sinica, 2015, 24(6): 64-74.
[20]Chen M, Li X L, Li Q,etal. Isolation and diversity of endophytic actinomycetes fromMeliatoosendan. Microbiology China, 2014, 42(2): 264-271.
[21]Tang Y L, Wang R, Hong K. Isolation and environmental adaptation of endophytic actinomycetes inAcanthusilicifoliusof different mangrove. Microbiology China, 2012, 39(1): 25-32.
[22]Tan H M, Cao L X, He Z F,etal. Isolation of endophytic actinomycetes from different cultivars of tomato and their activities againstRalstoniasolanacearuminvitro. World Journal of Microbiology and Biotechnology, 2006, 22(12): 1275-1280.
[23]Si M R, Xue Q H, Lai H X. Studies on selection of the isolation medium for actinomycetes and inhibition methods to miscellaneous microorganism. Microbiology China, 2004, 31(2): 61-65.
[24]Zhao K, Xu K, Chen Q,etal. The genetic diversity and antibiotic activity of endophytic actinomycetes from medicinal plants in Sichuan. Journal of Sichuan Agricultural University, 2011, 29(2): 225-229.
[25]Tian X L, Zhong L, Cheng Q X,etal. Isolation of endophytic actinomycetes from 87 Chinese medicinal plants and summary of its possible rule. Chinese Journal of Antibiotics, 2010, 35(9): 659-662.
[26]Yuan Z L, Zhang C L, Lin F C. Recent advances on physiological and molecular basis of fungal endophyte plant interactions. Acta Ecologica Sinica, 2008, 28(9): 4430-4439.
[27]Berdy J. Are actinomycetes exhausted as a source of secondary metabolites. In: Debabov V, Dudnik Y, Danlienko V. Proceedings of the 9th International Symposium on the Biology of Actinomycetes[C]. Moscow, Russia: All-Russia Scientific Research Institute for Genetics and Selection of Industrial Microorganisms, 1995: 13-14.
[28]Bascom-Slack C A, Cong M, Moore E,etal. Multiple, novel biologically active endophytic actinomycetes isolated from upper amazonian rainforests. Microbial Ecology, 2009, 58(2): 374-383.
[29]Zhang H T, Jin Y, Yu X J,etal. 16S rDNA-RFLP analysis of actinomycetes associated with marine spongeHymeniacidonperleve. Acta Microbiologica Sinica, 2005, 45(6): 12-15.
[30]Meng X F, Long X H, Kang J,etal. Isolation and identification of endogenic nitrogen-fixing bacteria in the roots of Jerusalem artichoke (Helianthustuberosus). Acta Prataculturae Sinica, 2011, 20(6): 157-163.
[31]Wu W L, Duan S R, Li W J,etal. Isolation and identification of three actinomycete strains with strong insecticidal activity for armyworm. Acta Microbiologica Sinica, 2004, 44(5): 567-570.
[32]Kieser T, Bibb J, Buttner J. Practical Streptomyces[M]. Genetics Norwich: John Innes Foundation, 2000.
参考文献:
[1]田素英, 梅全喜. 狼毒类中药的研究概述. 时珍国医国药, 2012, 23(5): 1316-1317.
[2]庄果, 李俊松, 蔡宝昌. 狼毒(月腺大戟)不同炮制品的HPLC图谱及狼毒乙素、狼毒丙素、岩大戟内酯B的含量变化研究. 中国中药杂志, 2013, 38(10): 1526-1530.
[3]王灿坚, 江英桥, 毕福钧, 等. RP-HPLC法测定狼毒中狼毒乙素和岩大戟内酯B的含量. 药物分析杂志, 2011, 31(5): 839-842.
[4]郑有坤, 刘凯, 熊子君, 等. 药用植物内生放线菌多样性及天然活性物质研究进展. 中草药, 2014, 45(14): 2089-2099.
[5]张波, 李小林, 江华明, 等. 花苜蓿内生放线菌多样性及群落结构. 草业学报, 2013, 22(5): 113-119.
[6]姚晓玲, 康前进, 熊顺子, 等. 喜树种子内生放线菌的分离鉴定及抗菌活性物质初分离. 微生物学通报, 2014, 41(6): 1109-1120.
[8]鲁如坤. 土壤农业化学分析方法[G]. 北京: 中国农业科技出版社, 1999.
[9]阮继生, 刘志恒, 梁丽糯. 放线菌研究及应用[G]. 北京: 科学出版社, 1990: 251-321.
[11]赵珂. 攀西地区药用植物内生及根际放线菌的多样性与抗菌活性研究[D]. 雅安: 四川农业大学, 2010.
[12]李小林, 袁红梅, 戚珊珊, 等. 丹参、黄精内生放线菌的分离及遗传多样性分析. 微生物学通报, 2010, 37(9): 1341-1346.
[13]任丹, 张波, 张小平, 等. 川楝内生真菌的遗传及PKS、NRPS基因的多样性. 中草药, 2014, 45(10): 1461-1467.
[17]顾爱星, 范燕敏, 武红旗, 等. 天山北坡退化草地土壤环境与微生物数量的关系. 草业学报, 2010, 19(2): 116-123.
[18]王长庭, 龙瑞军, 王根绪, 等. 高寒草甸群落地表植被特征与土壤理化性状、土壤微生物之间的相关性研究. 草业学报, 2010, 19(6): 25-34.
[19]席军强, 杨自辉, 郭树江, 等. 不同类型白刺沙丘土壤理化性状与微生物相关性研究. 草业学报, 2015, 24(6): 64-74.
[20]陈萌, 李小林, 李强, 等. 川楝内生放线菌的分离及多样性研究. 微生物学通报, 2014, 42(2): 264-271.
[21]唐依莉, 王蓉, 洪葵. 不同红树林地区老鼠簕内生放线菌的分离及其环境适应性. 微生物学通报, 2012, 39(1): 25-32.
[23]司美茹, 薛泉宏, 来航线. 放线菌分离培养基筛选及杂菌抑制方法研究. 微生物学通报, 2004, 31(2): 61-65.
[24]赵珂, 徐宽, 陈强, 等. 几种野生药用植物内生放线菌的遗传多样性及抗菌活性. 四川农业大学学报, 2011, 29(2): 225-229.
[25]田新莉, 钟莉, 成秋香, 等. 从87种中草药植物中分离内生放线菌及其规律的初探. 中国抗生素杂志, 2010, 35(9): 659-662.
[26]袁志林, 章初龙, 林福呈. 植物与内生真菌互作的生理与分子机制研究进展. 生态学报, 2008, 28(9): 4430-4439.
[29]张海涛, 靳艳, 虞星炬, 等. 16S rDNA-RFLP分析繁茂膜海绵可培养放线菌的多样性. 微生物学报, 2005, 45(6): 12-15.
[30]孟宪法, 隆小华, 康健, 等. 菊芋内生固氮菌分离、鉴定及特性研究. 草业学报, 2011, 20(6): 157-163.
[31]吴文龙, 段淑蓉, 李文均, 等. 三株杀粘虫放线菌的分类鉴定. 微生物学报, 2004, 44(5): 567-570.
Diversity and anti-microbial activity of endophytic actinomycetes isolated fromStellerachamaejasmesampled in Aba, Sichuan
LIAO Min1,2, ZHANG Bo1, FAN Zhong-Han1, CHEN XIONG Chun-Rui1, ZHANG Xiao-Ping1*
1.DepartmentofMicrobiology,CollegeofResources,SichuanAgriculturalUniversity,Chengdu611130,China;2.CollegeofLifeScienceandBiotechnology,MianyangNormalUniversity,Mianyang621000,China
Abstract:In order to develop new biologically active substances in medicinal plants, an isolation and culture method was employed to investigate the taxonomic diversity and anti-microbial activities of endophytic actinomycetes isolated from Stellera chamaejasme sampled in Aba, Sichuan. It was found that the number of isolates was affected by many factors, especially organic matter content which was significantly positively correlated with the isolate number (P<0.05, r=0.86). Fifty two isolates were obtained on Gauze No.1 growth medium, accounting for 30.4% of total isolations. The numbers of isolates decreased in the following order: root, stem, leaf and flower. Analysis using 16S rDNA-RFLP divided these isolated strains into 11 clusters and further phylogenic analysis classified representative strains as genera Streptomyces, Nocardia, Kitasatospora and Kribbella, respectively, with Streptomyces being predominant. PKS (4) and NRPS (2) genes were detected in the study and most of representative strains had antibiotic activity towards the pathogenic fungal strains, with SCAUEⅢD11-1 being most potent. It is concluded that behavior of isolates of endophytic actinomycetes from S. chamaejasme is affected by many factors with resulting diversity of expression. Functional genes and antibiotic activity indicated endophytic actinomycetes from S. chamaejasme sampled in Aba had potential medicinal value.
Key words:Stellera chamaejasme; endophytic actinomycetes; diversity; functional genes; antibiotic activity; phylogenetic analysis
*通信作者
Corresponding author. E-mail:zhangxiaopingphd@126.com
作者简介:廖敏(1979-),女,四川绵阳人,在读博士。 E-mail: esweetlm@163.com
基金项目:国家 863 计划(2013AA102802-05)资助。
收稿日期:2015-05-19;改回日期:2015-08-25
DOI:10.11686/cyxb2015262
http://cyxb.lzu.edu.cn
廖敏,张波,范中菡,陈熊春蕊,张小平. 阿坝地区狼毒内生放线菌多样性及抗菌活性. 草业学报, 2016, 25(3): 43-51.
LIAO Min, ZHANG Bo, FAN Zhong-Han, CHEN XIONG Chun-Rui, ZHANG Xiao-Ping. Diversity and anti-microbial activity of endophytic actinomycetes isolated fromStellerachamaejasmesampled in Aba, Sichuan. Acta Prataculturae Sinica, 2016, 25(3): 43-51.

