大豆素对湘中黑牛育肥牛胴体性能和肉品质的影响
许兰娇 包淋斌 赵向辉 王灿宇 瞿明仁*
欧阳克蕙1 熊小文1 祝远魁2
(1.江西农业大学江西省动物营养重点实验室,饲料工程研究中心,南昌330045;
2.湖南天华实业有限公司,娄底417100)
大豆素对湘中黑牛育肥牛胴体性能和肉品质的影响
许兰娇1包淋斌1赵向辉1王灿宇1瞿明仁1*
欧阳克蕙1熊小文1祝远魁2
(1.江西农业大学江西省动物营养重点实验室,饲料工程研究中心,南昌330045;
2.湖南天华实业有限公司,娄底417100)
摘要:本试验旨在研究饲粮添加大豆素对湘中黑牛育肥牛胴体性能和肉品质的影响。选择14头健康、体重[(450±20) kg]相近、2岁左右阉割湘中黑牛,随机分成2组,每组7头,对照组饲喂基础饲粮,试验组饲喂基础饲粮+500 mg/kg大豆素。试验期为120 d。结果表明:与对照组相比,1)添加大豆素对宰前活重、热胴体重、屠宰率无显著影响(P>0.05),胴体的脂肪含量、背膘厚有降低趋势,但差异不显著(P>0.05);2)添加大豆素显著提高了背最长肌的粗脂肪含量及大理石花纹评分(P<0.05),分别提高了8.34%、1.93分,并显著降低了排酸24 h肌肉的pH和水分含量(P<0.05),显著增加了肌肉的红度值(P<0.05);3)添加大豆素显著降低了血清中葡萄糖、尿素氮、甘油三酯、总胆固醇、非酯化脂肪酸、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇的浓度(P<0.05);4)添加大豆素分别显著提高和降低了背最长肌的异柠檬酸脱氢酶活性和葡萄糖-6-磷酸脱氢酶活性(P<0.05)。结果提示,饲粮添加大豆素能够影响育肥牛的脂类代谢,促进肌肉脂肪沉积,改善牛肉的大理石花纹和品质。
关键词:大豆素;湘中黑牛;肉品质;肌肉脂肪;胴体性能
随着人们生活水平的提高,对牛肉的品质要求越来越高,肌肉脂肪(intramuscular fat,IMF)含量是影响肉质的关键因素,显著影响其风味、多汁性和嫩度,决定牛肉大理石花纹的丰富程度[1]。如何提高牛肉中肌肉脂肪含量和肉品质也是当前研究的热点之一。大豆素(daidzein,Dai)属于植物雌激素,存在于大豆、苜蓿等饲料中[2-3]。研究发现,大豆素具有雌激素样作用、抗氧化作用、免疫调控功能和保健功能。在实际应用中具有剂量小、见效快、毒性低等优点,因此,是一种具有非常重要开发应用价值的新型饲料添加剂。大豆素可能会影响肉牛的脂类代谢、大理石花纹及肉品质。目前尚未见大豆素影响胴体性能和肉品质的报道,因此本研究对此进行探讨,旨在为提高牛肉品质提供技术支撑。
1材料与方法
1.1试验牛选择、分组及基础饲粮组成
选择14头选择健康、体重[(450±20) kg]相近、2岁左右阉割湘中黑牛,随机分为对照组和试验组。对照组饲喂基础饲粮;试验组在基础饲粮中添加500 mg/kg大豆素(购于陕西慈缘生物技术有限公司,大豆素含量>98%),配料时将大豆素加入精饲料中混合均匀。基础饲粮组成及营养水平见表1。

表1 基础饲粮组成及营养水平(风干基础)
1)每千克预混料含有 One kg of premix contained the following:VA 250 000 IU,VD330 000 IU,VE 800 IU,Cu 1 g,Fe 5 g,Mn 4 g,Zn 3 g,Se 10 mg,I 50 mg,Co 10 mg。
2)计算值 Calculated values。
1.2饲养管理
饲养试验于国家肉牛产业技术体系湖南涟源试验站进行,预试期10 d,正试期120 d。试验牛采用小栏散养,通风采光一致,自由采食和饮水。07:00和16:00分2次饲喂。
1.3屠宰、排酸、分割及样品采集
饲养试验结束后,所有试验牛均在湖南天华牧业有限公司的屠宰厂进行称重与屠宰。屠宰前禁食24 h,保证充足饮水和休息。按照《牛屠宰操作规程》(GB/T 19477—2004)进行屠宰。屠宰后,立即采集20 mL颈动脉血,室温凝固,3 000 r/min,4 ℃冷冻离心20 min分离血清,保存于-80 ℃超低温冰箱以备血清生化指标测定。
宰后30 min内对胴体进行称重,采集左侧胴体第12~13肋间背最长肌肉样,平均分成2.54 cm厚的2份,其中一份肉样用封口袋保存于-20 ℃冰箱中冷冻保存,以备测定肌肉中的化学成分;另一份肉样置于4 ℃排酸间排酸24 h后测定肉色、剪切力、滴水损失、pH等肉品质指标。
胴体在4 ℃排酸间排酸24 h,然后取左半边胴体分割出肉、骨、脂肪(皮下脂肪)及其他组织(如结缔组织),计算屠宰率,脂肪、肌肉、骨含量。
1.4测定指标与方法
1.4.1背膘厚和眼肌面积的测定
使用游标卡尺测定两侧胴体的第12~13肋处背膘厚,然后用4点背膘厚数据计算平均值。取左侧胴体第12~13肋骨处背最长肌,用透明硫酸纸绘下眼肌横断面图形,然后用莱卡QWIN软件计算出眼肌面积。
1.4.2肉pH的测定
取左侧胴体第 12~13肋间背最长肌肉样,在宰后45 min和24 h 2个时间点用Mettler Toledo Delta 320 pH计的金属探头直接插入肉样中心直接测定肌肉pH,每个肉样在3个不同位置测定pH,最后取平均值进行统计分析。测完后肉样置于0~4 ℃冰箱保存,用于其他指标测定。
1.4.3肉色和大理石花纹评分
取第12~13肋间背最长肌肉样,利用WSC-S测色色差计测量宰后24 h肉样肉色,包括亮度(L*)、红度(a*)和黄度(b*)值。每个肉样取3个不同部位测量,最后取平均值。使用日本大理石花纹评分板对第12~13肋背最长肌进行大理石花纹评分,大理石花纹评分板有12个级别分值,8~12分为丰富,5~7分为适中,3~4分为平均,2分为少量及1分为微量。
1.4.4肌肉剪切力的测定
将在0~4 ℃熟化24 h后的背最长肌肉块(3 cm×4 cm×5 cm)在室温下放置1 h后,使用保鲜膜将肉样包好,将温度计插入肌肉中心部位,再置于80 ℃恒温水浴中加热至肌肉中心温度达70 ℃时立即取出肉样,室温冷却至中心温度达20 ℃左右时,沿肌纤维方向切取标准样条(1 cm×3 cm)。使用Warner-Bratzler剪切仪(C-LM4)测量剪切肉样所需的剪切力。每个肉样切取6个标准样品测量,取其平均值。
1.4.5肌肉常规养分测定
将左侧胴体第12~13肋骨处背最长肌50 g左右肉样,剔除可见脂肪、肌腱及表面结缔组织,绞碎置于65 ℃烘箱制成风干样品,按照AOAC(1990)方法测定水分、粗脂肪含量[4]。使用凯氏定氮法测定肌肉粗蛋白质含量。所有测定值均为鲜重基础。
1.4.6血清生化指标测定
使用日本协和公司生产的分析试剂盒测定血清甘油三酯、总胆固醇、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)和尿素氮浓度;使用德国豪迈公司生产的试剂盒测定血清葡萄糖浓度;使用四川迈克公司生产的试剂盒测定糖化血清蛋白浓度;使用南京建成生物工程研究所的试剂盒测定血清中非酯化脂肪酸(NEFA)浓度。试验在南昌大学一附院采用立式AU5421全自动生化分析仪(Backman-Kelt,美国)进行测定,方法按说明书上进行测定。
1.4.7肌肉内脂类合成酶活性测定
样品背最长肌从-80 ℃取出,在37 ℃下解冻,取100 mg组织样品加1 000 mL生理盐水,混匀离心,去除上清液。使用苏州科铭生物科技有限公司葡萄糖-6-磷酸脱氢酶(G6PDH)测定试剂盒(测红细胞)(比色法)、苹果酸脱氢酶(MDH)测定试剂盒(测血清)(紫外比色法)、异柠檬酸脱氢酶(ICDH)测定试剂盒(比色法)测定这3种酶的活性。葡萄糖-6-磷酸脱氢酶和异柠檬酸脱氢酶酶活性定义:每毫克蛋白质每分钟产生1 nmol还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)为1个活力单位。苹果酸脱氢酶酶活性定义为:每毫克蛋白质每分钟消耗1 nmol烟酰胺腺嘌呤二核苷酸(NADH)为1个活力单位。
1.5数据处理与统计分析
采用Excel对所有数据进行初步整理,使用SPSS 17.0统计软件对数据进行单因素方差分析(one-way ANOVA),结果用平均值表示,P<0.05为差异显著。
2结果与分析
2.1胴体性能指标
由表2可见,与对照组相比,试验组胴体的脂肪含量(32.04% vs. 28.62%,P=0.054)和背膘厚(3.39 cm vs. 2.85 cm,P=0.055)有降低的趋势,但差异不显著(P>0.05),显著增加骨含量(P<0.05)。添加大豆素对宰前活重、热胴体重和屠宰率及胴体的肌肉含量和眼肌面积均无显著影响(P>0.05)。
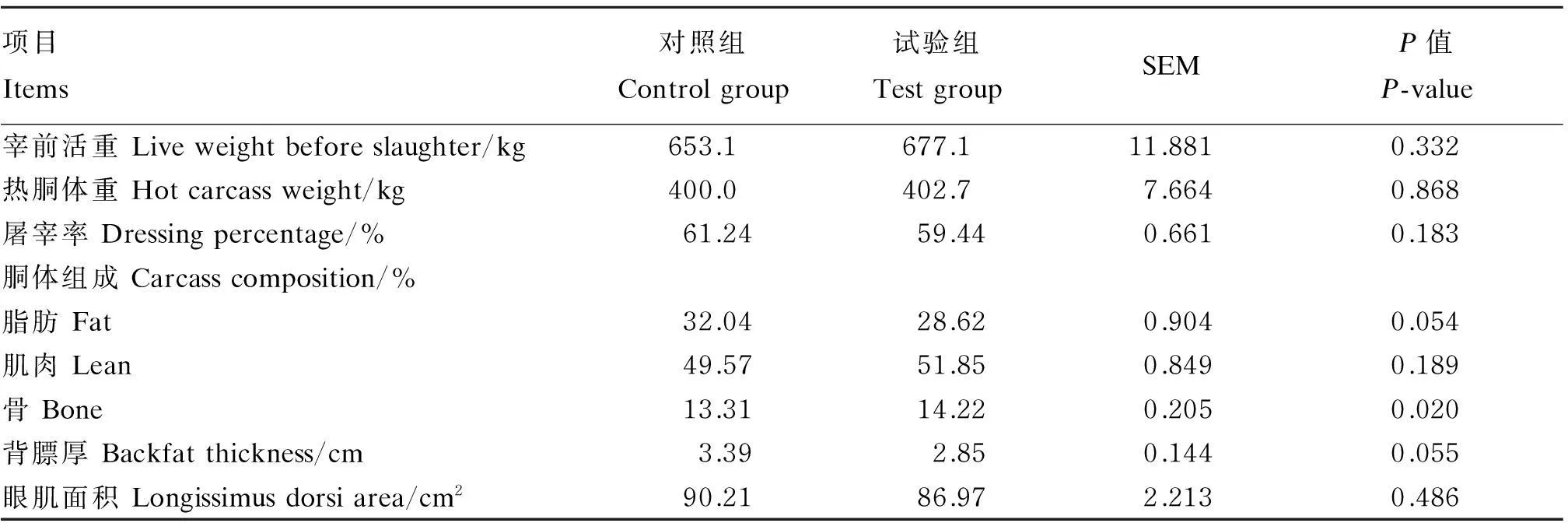
表2 大豆素对育肥牛胴体性能指标的影响
2.2肉品质指标
由表3可见,与对照组相比,试验组牛背最长肌的红度值显著提高(P<0.05),排酸24 h的pH显著降低(P<0.05)。添加大豆素使背最长肌的粗脂肪含量及大理石花纹评分显著提高(P<0.05),分别较对照组提高了8.34%及1.93分,水分含量显著降低(P<0.05),剪切力有所降低,但差异不显著(P>0.05)。
2.3血清生化指标
由表4可见,与对照组相比,添加大豆素显著降低了血清葡萄糖、尿素氮、甘油三酯、总胆固醇、非酯化脂肪酸、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇的浓度(P<0.05),对糖化血清蛋白浓度影响不显著(P>0.05)。

表3 大豆素对育肥牛背最长肌肉品质指标的影响
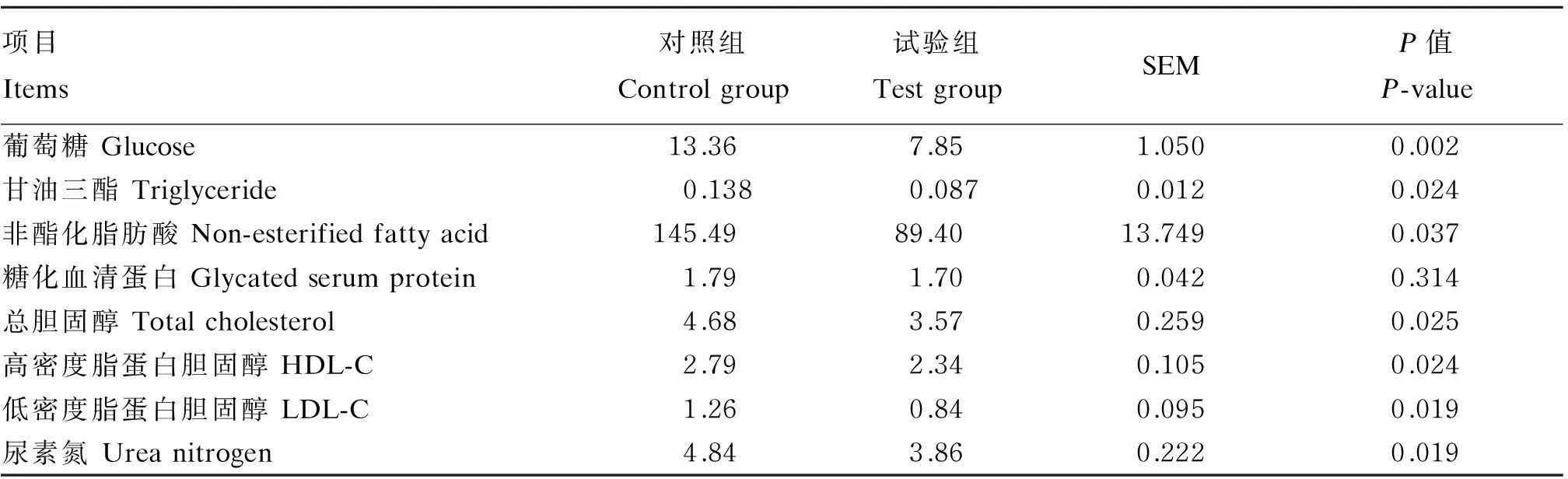
表4 大豆素对育肥牛血清生化指标的影响
2.4肌肉中脂类合成酶活性
由表5可见,与对照组相比,添加大豆素显著提高了背最长肌的异柠檬酸脱氢酶活性(P<0.05),显著降低了葡萄糖-6-磷酸脱氢酶活性(P<0.05)。对苹果酸脱氢酶活性影响不显著(P>0.05)。
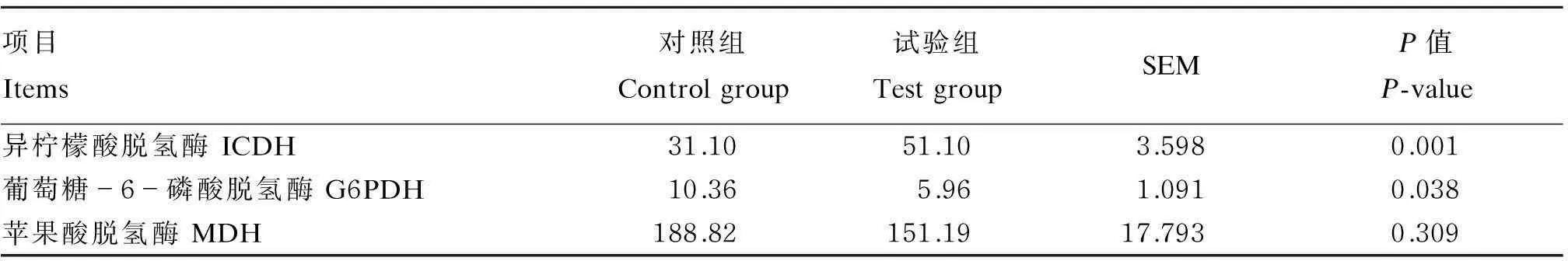
表5 大豆素对育肥牛背最长肌脂类合成酶活性的影响
3讨论
3.1大豆素对肉牛胴体性能指标的影响
本研究发现大豆素具有提高湘中黑牛育肥牛胴体骨含量和降低胴体脂肪含量及背膘厚的作用,这与Kaludjerovic等[5]、Fujioka等[6]、Ohtomo等[7]在鼠上研究结果相似。这可能是由于大豆素能够抑制脂肪组织中脂肪细胞的分化[8],促进骨细胞生长[9-10],导致了大豆素对骨形成与发育具有促进作用,并对体脂肪合成具有抑制作用有关。有研究表明,大豆素能在瘤胃中部分代谢为雌马酚[11],而雌马酚具有抑制体脂(不包括肌肉脂肪)积累,促进骨骼发育的作用[6-7]。
3.2大豆素对肉牛肉品质指标的影响
肌肉的pH影响肌肉的剪切力、风味、持水力,这些肌肉特性对消费者选择有非常重要影响[12-13]。当肌肉排酸24 h的pH由5.5增加至6.1时,其剪切力有降低趋势[13]。肌肉排酸24 h的pH高于5.5,一般认为是由于肌肉糖元较少的缘故,以致肌肉中无法积累足够的乳酸[12]。本研究发现添加大豆素降低了背最长肌的排酸24 h的pH,剪切力有降低的趋势,这可能是因为大豆素增加了肌肉中的糖元含量。在Malardé等[14]的研究中,添加大豆异黄酮(含大豆素和染料木素)增加了鼠肌肉中的糖元含量,这与本研究结果相似。
肉色是重要的肉质性状,它直接影响消费者的购买欲。肉色的差异与肌肉中亚铁肌红蛋白(鲜红)、肌红蛋白(暗红色)、正铁肌红蛋白(灰-褐色)的比例有关[15]。当肉色由亮红色变为暗褐色时,消费者一般会认为肉的养分已损失或变质,进而不去购买这类产品[16]。因此,肉中的肌红蛋白应维持亚铁形式。本研究发现,添加大豆素增加了背最长肌的红度值,这意味着大豆素抑制了肌肉在空气中的氧化,改善了肉色的稳定性,这可能与大豆素和雌马酚内在的抗氧化特性有关[17]。
3.3大豆素对肉牛肌肉脂肪及大理石花纹评分的影响
本研究发现大豆素显著降低了湘中黑牛皮下脂肪含量,但显著促进了背最长肌肉脂肪含量及大理石花纹评分。Crespillo等[18]发现添加大豆素可增加鼠骨骼肌中的脂肪含量并降低肝脏中的脂肪含量。还有一些体内或体外试验研究发现,大豆素和雌马酚能够加强人和鼠前脂肪细胞的分化、脂粒形成和脂肪的积累[19-21]。但是Rehfeldt等[22]研究了母猪妊娠期饲喂大豆素对仔猪胴体组成的影响,结果显示大豆素不影响仔猪的皮下脂肪含量,但显著提高了仔猪整个胴体的脂肪含量。这些结果表明,大豆素具有调脂作用,能选择性地促进脂肪在肌肉中的沉积。
3.4大豆素对肉牛血清生化指标及肌肉脂类合成酶活性的影响
本研究发现,添加大豆素降低了湘中黑牛血清中脂代谢产物如非酯化脂肪酸、甘油三酯、总胆固醇等的浓度。这与前人以鼠为研究动物发现大豆素具有明显的降胆固醇作用的结果[18,23-24]一致。本研究中添加大豆素降低了湘中黑牛血清中葡萄糖的浓度,这与Cao等[24]和Choi等[25]的结果一致。大豆素能够通过增加葡萄糖转运蛋白-4(GLUT4)和胰岛素受体底物-1(IRS-1)的基因表达量,提高胰岛素浓度,刺激葡萄糖摄入量[19],进而可能导致较低的血清葡萄糖浓度。
葡萄糖-6-磷酸脱氢酶、苹果酸脱氢酶、异柠檬酸脱氢酶参与了脂肪酸从头合成中NADPH的合成。本研究发现添加大豆素增加了背最长肌异柠檬酸脱氢酶的活性,这可能与肌肉脂肪含量提高有关。葡萄糖-6-磷酸脱氢酶曾被认为与肉牛肌肉脂肪的沉积有关,是一个较好的用于预测大理石花纹的指标[26]。然而,本研究中添加大豆素较对照组显著降低了葡萄糖-6-磷酸脱氢酶的活性。出现这一矛盾结果的原因不清,尚需要进一步的研究。
4结论
添加大豆素能够影响湘中黑牛育肥牛的脂类代谢,促进肌肉脂肪沉积,改善牛肉的大理石花纹和品质。大豆素是一种可用于高档牛肉生产的绿色添加剂。
参考文献:
[1]NISHIMURA T,HATTORI A,TAKAHASHI K.Structural changes in intramuscular connective tissue during the fattening of Japanese black cattle:effect of marbling on beef tenderization[J].Journal of Animal Science,1999,77(1):93-104.
[2]LIGGINS J,MULLIGAN A,RUNSWICK S,et al.Daidzein and genistein content of cereals[J].European Journal of Clinical Nutrition,2002,56(10):961-966.
[3]FRANKE A A,CUSTER L J,CERNA C M,et al.Quantitation of phytoestrogens in legumes by HPLC[J].Journal of Agricultural and Food Chemistry,1994,42(9):1905-1913.
[4]AOAC.Official methods of analysis[M].15th ed.Washington,D.C.:Association of Official Analytical Chemists,1990.
[5]KALUDJEROVIC J,WARD W E.Neonatal exposure to daidzein,genistein,or the combination modulates bone development in female CD-1 mice[J].The Journal of Nutrition,2009,139(3):467-473.
[6]FUJIOKA M,UEHARA M,WU J,et al.Equol,a metabolite of daidzein,inhibits bone loss in ovariectomized mice[J].The Journal of Nutrition,2004,134(10):2623-2627.
[7]OHTOMO T,UEHARA M,PEALVO J L,et al.Comparative activities of daidzein metabolites,equol and O-desmethylangolensin,on bone mineral density and lipid metabolism in ovariectomized mice and in osteoclast cell cultures[J].European Journal of Nutrition,2008,47(5):273-279.
[8]KIM M H,PARK J S,SEO M S,et al.Genistein and daidzein repress adipogenic differentiation of human adipose tissue-derived mesenchymal stem cells via Wnt/β-catenin signalling or lipolysis[J].Cell Proliferation,2010,43(6):594-605.
[9]SUGIMOTO E,YAMAGUCHI M.Stimulatory effect of daidzein in osteoblastic MC3T3-E1 cells[J].Biochemical Pharmacology,2000,59(5):471-475.
[10]JIA T L,WANG H Z,XIE L P,et al.Daidzein enhances osteoblast growth that may be mediated by increased bone morphogenetic protein (BMP) production[J].Biochemical Pharmacology,2003,65(5):709-715.
[11]LUNDH T.Metabolism of estrogenic isoflavones in domestic animals[J].Experimental Biology and Medicine,1995,208(1):33-39.
[12]MACH N,BACH A,VELARDE A,et al.Association between animal,transportation,slaughterhouse practices,and meat pH in beef[J].Meat Science,2008,78(3):232-238.
[13]VILLARROEL M,MARA G A,SAUDO C,et al.Effect of transport time on sensorial aspects of beef meat quality[J].Meat Science,2003,63(3):353-357.
[14]MALARDÉ L,VINCENT S,LEFEUVRE-ORFILA L,et al.A fermented soy permeate improves the skeletal muscle glucose level without restoring the glycogen content in streptozotocin-induced diabetic rats[J].Journal of Medicinal Food,2013,16(2):176-179.
[15]CARLEZ A,VECIANA-NOGUES T,CHEFTEL J C.Changes in colour and myoglobin of minced beef meat due to high pressure processing[J].LWT-Food Science and Technology,1995,28(5):528-538.
[17]RIMBACH G,DE PASCUAL-TERESA S,EWINS B A,et al.Antioxidant and free radical scavenging activity of isoflavone metabolites[J].Xenobiotica,2003,33(9):913-925.
[18]CRESPILLO A,ALONSO M,VIDA M,et al.Reduction of body weight,liver steatosis and expression of stearoyl-CoA desaturase 1 by the isoflavone daidzein in diet-induced obesity[J].British Journal of Pharmacology,2011,164(7):1899-1915.
[19]CHO K W,LEE O H,BANZ W J,et al.Daidzein and the daidzein metabolite,equol,enhance adipocyte differentiation and PPARγ transcriptional activity[J].The Journal of Nutritional Biochemistry,2010,21(9):841-847.
[20]HIROTA K,MORIKAWA K,HANADA H,et al.Effect of genistein and daidzein on the proliferation and differentiation of human preadipocyte cell line[J].Journal of Agricultural and Food Chemistry,2010,58(9):5821-5827.
[21]NISHIDE Y,TOUSEN Y,INADA M,et al.Bi-phasic effect of equol on adipocyte differentiation of MC3T3-L1 cells[J].Bioscience,Biotechnology,and Biochemistry,2013,77(1):201-204.
[22]REHFELDT C,ADAMOVIC I,KUHN G.Effects of dietary daidzein supplementation of pregnant sows on carcass and meat quality and skeletal muscle cellularity of the progeny[J].Meat Science,2007,75(1):103-111.
[23]PARK S A,CHOI M S,CHO S Y,et al.Genistein and daidzein modulate hepatic glucose and lipid regulating enzyme activities in C57BL/KsJ-db/dbmice[J].Life Sciences,2006,79(12):1207-1213.
[24]CAO Y K,ZHANG S F,ZOU S E,et al.Daidzein improves insulin resistance in ovariectomized rats[J].Climacteric,2012,16(1):111-116.
[25]CHOI M S,JUNG U J,YEO J,et al.Genistein and daidzein prevent diabetes onset by elevating insulin level and altering hepatic gluconeogenic and lipogenic enzyme activities in non-obese diabetic (NOD) mice[J].Diabetes/Metabolism Research and Reviews,2008,24(1):74-81.
[26]BONNET M,FAULCONNIER Y,LEROUX C,et al.Glucose-6-phosphate dehydrogenase and leptin are related to marbling differences among Limousin and Angus or Japanese Black× Angus steers[J].Journal of Animal Science,2007,85(11):2882-2894.
(责任编辑王智航)
Effects of Daidzein on Carcass Performance and Meat Quality of FatteningXiangzhongBlack Cattle
XU Lanjiao1BAO Linbin1ZHAO Xianghui1WANG Canyu1QU Mingren1*OUYANG Kehui1XIONG Xiaowen1ZHU Yuankui2
(1. Jiangxi Province Key Laboratory of Animal Nutrition, Engineering Research Center of Feed Development, Jiangxi Agricultural University, Nanchang 330045, China; 2. Hunan Tianhua Industrial Corporation, Loudi 417100, China)
Abstract:This study was to investigate the effects of dietary supplementation of daidzein on carcass performance and meat quality of Fattening Xiangzhong Black cattle. Fourteen healthy castrated Hunan black cattle aged about 2 years with similar body weight [(450±20) kg] were randomly divided into two groups (n=7). Control group was fed a basal diet while test group was fed the basal diet added 500 mg/kg daidzein. The experiment lasted for 120 days. The results showed as follows: compared with control group, 1) the supplementation of daidzein had no significant effects on live weight before slaughter, hot carcass weight and dressing percentage, and carcass fat content and backfat thickness tended to decrease with an insignificant difference (P>0.05); 2) daidzein supplementation significantly increased ether extract content and marbling score of longissimus dorsi by 8.34% and 1.93 (P<0.05), respectively, pH after aging for 24 h and moisture content in muscle were significantly reduced (P<0.05), and redness value of muscle was significantly increased (P<0.05); 3) daidzein supplementation significantly reduced serum concentrations of glucose, urea nitrogen, triglyceride, total cholesterol, non-esterified fatty acid, high density lipoprotein cholesterol (HDL-C) and low density lipoprotein cholesterol(LDL-C) (P<0.05); 4) daidzein supplementation significantly increased and reduced the activities of isocitrate dehydrogenase and glucose 6 phosphate dehydrogenase (P<0.05), respectively. The results indicate that dietary supplementation of daidzein can affect fat metabolism, promote intramuscular fat deposition, and improve beef marbling and meat quality of fattening cattle.[Chinese Journal of Animal Nutrition, 2016, 28(1):191-197]
Key words:daidzein; Xiangzhong black cattle; meat quality; intramuscular fat; carcass performance
*Corresponding author, professor, E-mail: qumingren@sina.com
中图分类号:S816.7;S823
文献标识码:A
文章编号:1006-267X(2016)01-0191-07
作者简介:许兰娇(1981—),女,江西临川人,助理研究员,博士,研究方向为动物营养与饲料科学。E-mail: xulanjiao1314@163.com*通信作者:瞿明仁,教授,博士生导师,E-mail: qumingren@sina.com
基金项目:国家公益性行业(农业)科研专项(201303143);国家现代肉牛牦牛产业技术体系项目(CARS-38);江西省赣鄱555工程领军人才计划(赣才字[2012]1号);江西省自然科学基金计划(20151BAB214009)
收稿日期:2015-07-23
doi:10.3969/j.issn.1006-267x.2016.01.025

