惰性介质对甲烷/空气预混气体爆炸极限的影响❋
曲忠伟 颜事龙 李学超安徽理工大学理学院(安徽淮南,232001)
惰性介质对甲烷/空气预混气体爆炸极限的影响
❋
曲忠伟 颜事龙 李学超
安徽理工大学理学院(安徽淮南,232001)
[摘 要]以化学平衡和吉布斯自由能为基础,采用ChemKin数值模拟软件并选取临界温度1 450 K作为混合气体是否可燃的判别标准,研究了氮气、二氧化碳惰性介质对混合气体爆炸极限的影响。并在7 L爆炸容器内,对瓦斯和空气的混合气体的爆炸极限进行实测,得到了甲烷与二氧化碳(或氮气)按不同比例混合时在空气中的爆炸极限。结果表明:当甲烷与二氧化碳体积比为0.294时,爆炸上下限重合,当体积比小于0.294时,任何配比下均不被点燃。同时得出二氧化碳的抑爆能力强于氮气。
[关键词]爆炸力学;爆炸极限;绝热燃烧温度;CH4
[分类号] X932;TE88+2
引言
随着科学进步和国民经济的发展,能源消耗随之增加。目前,传统的能源日益枯竭,可燃气体作为一种理想的轻型能源具有广泛的应用前景。但泄漏事故时有发生,造成人员伤亡和国家财产损失。工业上为了防止可燃气体在传输过程中意外点燃后沿管道网传播,根据可燃气体的不同种类采用不同类型的阻火器。但阻火器的阻火芯设计受很多因素影响,其中可燃气体的爆炸极限是主要原因。
工业上常用氮气(N2)、二氧化碳(CO2)、水蒸气(H2O)等惰性介质作为阻燃剂。目前,国内外学者做了一定的研究。汪泉等[1]研究了半开口管道内瓦斯预混火焰传播特性。王博[2]、孙俊芳[3]等对甲烷/空气、甲烷/氮气及甲烷/二氧化碳的爆炸极限进行了数值模拟。Min等[4-5]对掺入氮气或二氧化碳的甲烷预混气体的爆炸极限进行了试验研究。Dorofeev[6]、王华[7-8]等研究了容器因素、初始湍流及初始压力对甲烷爆炸极限的影响。结果表明:随容器拓展性的增大,其爆炸极限会增宽。Chen 等[9-10]并未采用一个固定的绝热燃烧温度,而是在绝热燃烧温度为1 000~1 600 K的情况下,对可燃物/惰性介质混合物的爆炸极限进行了估算及比较。
本文以二氧化碳和氮气为例计算惰性介质对预混气体爆炸极限的影响程度。通过数值模拟结果与试验结果进行对比,研究了在不同浓度的惰性介质条件下甲烷/空气预混气体的爆炸极限。为工业上如何选用阻燃剂提供理论上的指导,并为工业上阻火器的阻火芯设计提供技术上的支持。
1 试验装置
试验装置是根据欧洲标准EN1839[11]自制的圆柱形燃烧罐,材质为优质钢,燃烧罐内径210 mm、高度210 mm,体积大约为0.029 m3,下面和侧面为一个整体,侧面安装4个进气孔,便于充气和抽真空,燃烧罐的上面用螺栓加胶垫进行紧密,外形如图1所示。
点火电极设置在容器的中心,电极尖端间距可调。在容器侧壁的上下对称位置,各安装有光电传感器,用以记录火焰传播到达100 mm处时的光信号,光电传感器到电极的垂直距离为100 mm。在容器的上下底面上、中心位置及四分之一位置处,分别设置有压力传感器,用以记录点火后压力的变化,以获得点火后的压力与火焰传播方向的关系等。
2 惰性介质对爆炸极限影响的模拟
2.1 二氧化碳对爆炸极限的影响
在有关二氧化碳对预混气体爆炸极限影响程度的计算中,以1450 K为临界温度,采用三角坐标图解法进行分析。其计算结果如图2。为了与加入氮气的爆炸极限进行对比,在图2中画了二氧化碳与氧气的体积比为79/21、62.5/37.5、50/50、25/75的4条曲线。分别用0#、1#、2#和3#线表示。
对上述比例的预混气体的爆炸极限进行了计算,其计算结果见表1、图3。从图3可看出,随着惰性介质二氧化碳体积分数的增加,其预混气体的爆炸下限随之增大,预混气体的爆炸上限却随之减小。二氧化碳的加入使得预混气体的爆炸极限宽度明显地变窄,说明二氧化碳对预混气体有明显的抑爆作用。
经过进一步的分析发现,随着氧化剂中二氧化碳含量的增加,其预混气体爆炸上限降低得很明显;而爆炸下限略有增加。分析原因为在富燃料区(甲烷含量大),爆炸上限随着氧化剂中二氧化碳含量的增加(空气中氧气的含量降低),其燃料燃烧不充分。而在贫燃料区(甲烷含量低),由于二氧化碳的比热容大于氧气的比热容,导致绝热温度降低,其爆炸下限就会有所增加。
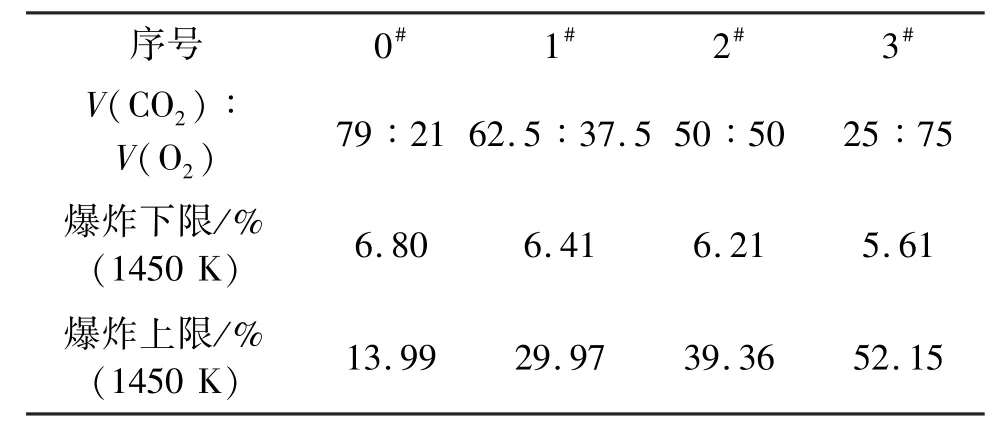
表1 不同V(CO2)/V(O2)时的爆炸极限计算值Tab.1 Calculation of flammability limit under different V(CO2)/V(O2)
另一方面可从自由基反应方面进行分析,二氧化碳的加入使得化学反应生成的自由基与二氧化碳碰撞的几率增加,势必要损耗掉大部分的自由基,这样就使得维持化学反应的自由基的数目下降,甲烷爆炸极限变窄。
2.2 氮气对爆炸极限的影响
氮气对预混气体爆炸极限影响也是采用三角坐标图解法(图4)。图4中,黑实线为化学计量比的曲线(stoichiometric line),因为当甲烷和氧气按照这条线上的比例配比时,其预混气体燃烧是最充分的。也就是说,这种比例的预混气体绝热燃烧温度最高。并对氮气与氧气的体积比为79/21(0#)、62.5/37.5 (1#)、50/50(2#)、25/75(3#)的爆炸极限进行了计算,其计算结果如表2、图3。
从图3氮气对甲烷预混气体爆炸极限的影响中可看出,随着氮气体积分数的增加,其预混气体的爆炸下限随之略有降低,而预混气体的爆炸上限随之大幅降低。分析原因为在富燃料区(甲烷含量大),爆炸上限随着氮气含量的增加,其燃料燃烧就不会很充分,致使爆炸极限迅速降低。而在贫燃料区(甲烷含量低),由于氮气的比热容小于氧气的比热容,所以在甲烷体积分数相同的情况下,氮气的含量增加时,温度升高时吸收的热量就少。这样就导致绝热温度升高,预混气体的爆炸下限就会有所降低。
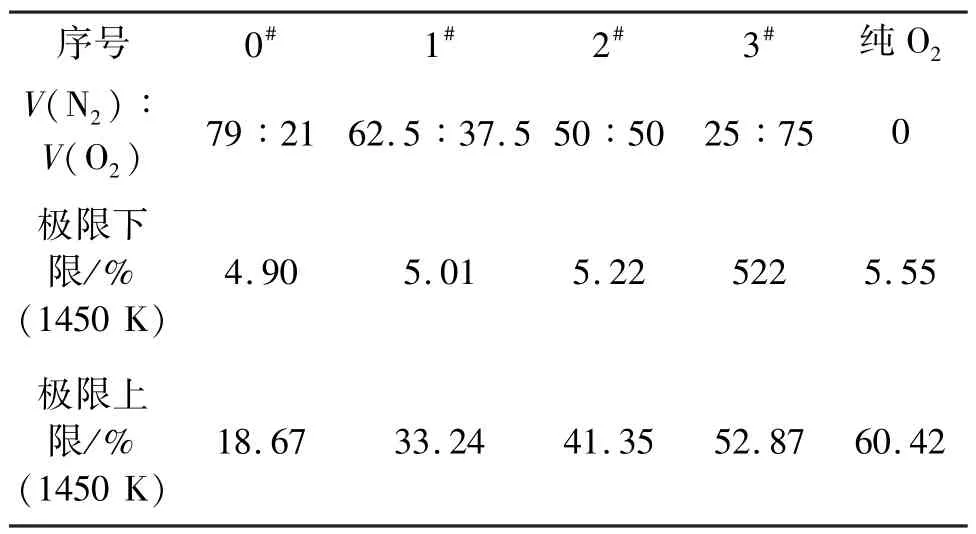
表2 不同V(N2)/V(O2)时的爆炸极限计算值Tab.2 Calculation of flammability limit under different V(N2)/V(O2)
把加入二氧化碳和氮气的预混气体爆炸极限的计算值进行对比(如图3),发现在加入相同体积分数的氮气或二氧化碳时,其预混气体爆炸极限都相应地变窄,只是变窄的程度略有不同,加入二氧化碳的预混气体爆炸极限变窄的程度要大于加入氮气的。说明二氧化碳对预混气体的抑爆能力要大于氮气的抑爆能力。
分析原因为在富燃料区(甲烷含量大),爆炸上限随着氧化剂中二氧化碳或氮气含量的增加(空气中氧气的含量降低),其燃料燃烧得不充分。而二氧化碳的吸热要大于氮气的吸热,这样就使得相同体积分数下二氧化碳的影响程度要大于氮气的影响程度。而在贫燃料区(甲烷含量低),由于二氧化碳的比热容大于氮气的比热容,所以在甲烷体积分数相同的情况下,二氧化碳含量和氮气含量相同时,升高相同温度时二氧化碳吸收的热量大于氮气。导致绝热温度降低,对预混气体的爆炸下限,二氧化碳的影响程度要高于氮气的影响程度。
另一方面从自由基反应方面进行分析,二氧化碳或氮气的加入都会使得化学反应生成的自由基与惰性介质分子碰撞的几率增加,但二氧化碳的分子体积大于氮气的分子体积,势必二氧化碳损耗掉的自由基要多于氮气损耗的自由基,这样就使得二氧化碳对爆炸极限的影响程度高于氮气。
3 惰性介质对爆炸极限影响的试验研究
3.1 甲烷/二氧化碳/空气爆炸极限的测定
当加入惰性介质二氧化碳时,试验结果见表3。试验中的甲烷和二氧化碳是按照一定的体积比例充入的,其余的为空气。试验中,按照V (CH4)/V (CO2)为100/0、75/25、50/50、25/75这4种具有代表性的配比进行试验。当二氧化碳的体积分数增加时,甲烷的爆炸下限将增加。说明惰性介质二氧化碳对甲烷的燃烧具有很强的抑制作用。当二氧化碳的体积分数不是很大(0%、1.69%)时,对甲烷爆炸下限的影响程度只有0.01%,影响程度可以忽略不计了。但是当二氧化碳体积分数增加到5.51%时,甲烷的爆炸下限体积分数增加了0.50%,说明对甲烷爆炸下限有一定的影响,当二氧化碳体积分数继续增加时(18.60%),这时甲烷爆炸下限的体积分数增加到了6.20%,与没有加入惰性介质相比,增加了1.1%。这就对甲烷爆炸下限的影响程度很大。
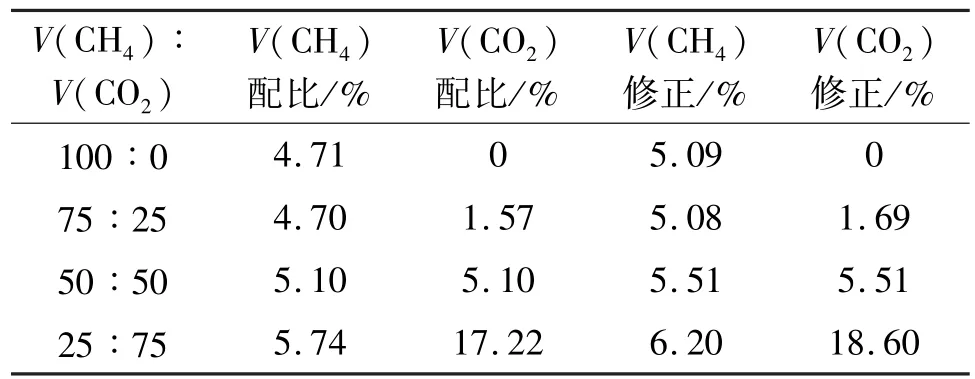
表3 甲烷/二氧化碳/空气混合介质爆炸下极限测量结果Tab.3 Lower explosion limit of CH4/CO2/air mixture
同理,对甲烷的爆炸上限进行了测量,其试验结果见表4。从中可以看出,随着二氧化碳体积分数的增加,其甲烷混合气体的爆炸上限在减小。当没有加入二氧化碳时,甲烷爆炸上限的试验修正值为14.81%,少量加入二氧化碳(0.773%)时,爆炸上限下降了0.13%,已对爆炸上限产生了影响。当二氧化碳体积分数为23.650%时,甲烷爆炸上限下降到7.89%,与没有加入二氧化碳相比,下降程度接近50%左右。
为了验证试验值的合理性,把试验值、文献值[12]和计算值绘制在图5中,从图5中可以看出:当甲烷/二氧化碳体积比减小时,爆炸上限下降得很明显,而爆炸下限略有上升,当甲烷/二氧化碳体积比为0.294时,爆炸上下限重合,当体积比小于0.294时,任何配比下均不被点燃(点火能量小于20 J)。说明二氧化碳在甲烷/二氧化碳/空气混合气体中的体积分数有一个最大值(23.93%),继续增大二氧化碳含量会导致预混气体变为不可燃气体;试验值与文献值吻合得很好,只是比文献的可燃范围略大一些。分析原因认为,文献中提到其测试是在水蒸气饱和的前提下得到的,而本文试验使用的空气为未饱和水蒸气,这样就小于文献中提到的饱和水蒸气。因此,本文测试的可燃范围略大于文献中的可燃范围是合理的。计算值大于测试值,分析认为在计算中没有考虑点火能量、化学反应速率和容器体积等因素,而只是从化学平衡的观点出发,计算吉布斯自由能最小时的绝热燃烧温度,通过绝热燃烧温度来判断是否可燃,这个温度只是理论上可以达到的最高燃烧温度。而在试验中受到外界的影响因素很多,如:点火能量、热量耗散等。使得燃烧产物的实际温度并不能达到绝热燃烧温度。所以,试验值的燃烧范围要小于计算值。
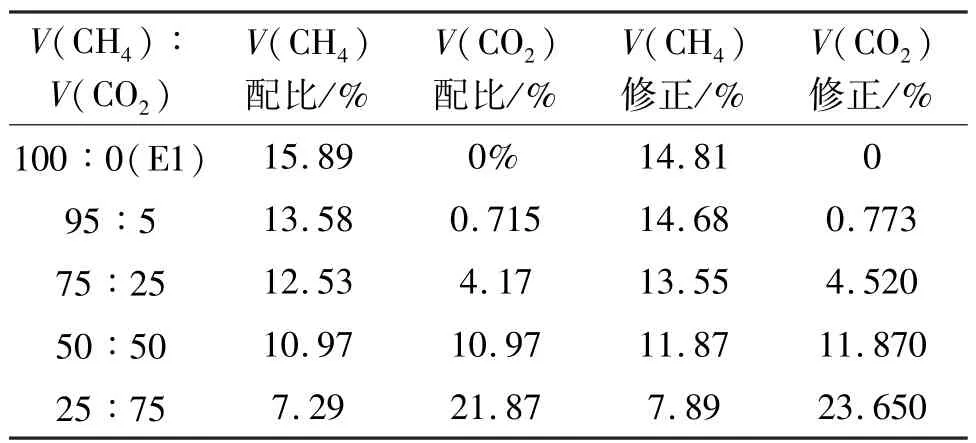
表4 甲烷/二氧化碳/空气混合介质爆炸上极限测量结果Tab.4 Upper explosion limit of CH4/CO2/air mixture
3.2 甲烷/氮气/空气爆炸极限的测定
加入惰性介质氮气时试验结果绘制在图6中,从图6中可以看出,氮气的加入同样对甲烷的爆炸极限起到了抑制的作用。
当氮气的体积分数增加时,甲烷的爆炸下限将增加。说明惰性介质氮气对甲烷的燃烧具有很强的抑制作用。当氮气的体积分数不是很大(小于5%)时,对甲烷爆炸下限的影响程度只有0.01%,影响程度可以忽略不计了。但是当氮气体积分数增加到5.00%时,甲烷的爆炸下限体积分数增加了0.02%,说明对甲烷爆炸下限有一定的影响;当氮气体积分数继续增加至20%,这时甲烷爆炸下限的体积分数增加到了5.8%,当氮气体积分数为30%左右时,甲烷的爆炸上限和爆炸下限重合。
随着氮气体积分数的增加,其甲烷混合气体的爆炸上限在减小。当没有加入氮气时,甲烷爆炸上限的试验修正值为14.81%;少量加入氮气(0.912%)时,爆炸上限下降了0.10%,已对爆炸上限产生了影响;当氮气体积分数为10.00%时,甲烷爆炸上限浓度为11.97%,和没有加入氮气相比下降了2.84%。继续增加其体积分数,氮气体积分数为25.00%时,甲烷爆炸上限下降到7.99%,与没有加入氮气相比,下降程度接近50%左右。当氮气体积分数为30%左右时,试验发现,甲烷的爆炸上限和爆炸下限重合。说明氮气体积分数大于30%时,任何配比下甲烷均不会被点燃(点火能量小于20 J)。
4 结论
1)当甲烷/二氧化碳体积比减小时,爆炸上限下降得很明显,而爆炸下限略有上升,当甲烷/二氧化碳体积比为0.294时,爆炸上下限重合,当体积比小于0.294时,任何配比下均不被点燃(点火能量小于20J)。说明二氧化碳在甲烷/二氧化碳/空气混合气体中的体积分数有一个最大值(23.93%),继续增大,二氧化碳含量过多会导致预混气体变为不可燃气体。
2)当氮气体积分数大约增加到30%时,甲烷/空气混合气体的爆炸上下限重合到一点,此点被称为甲烷的爆炸临界点;而当加入二氧化碳时,甲烷/空气混合气体的爆炸临界点明显小于加入氮气时的爆炸临界点,约为24%。因此,得出二氧化碳抑制甲烷燃烧的效果明显优于氮气抑制甲烷燃烧的效果。
3)当单独加入氮气或二氧化碳后,甲烷的爆炸极限的变化情况基本是一致的。但从数据分析中可以明显地看出,在加入相同体积分数的氮气和二氧化碳的情况下,加入二氧化碳时甲烷/空气混合气体爆炸极限的变化幅度比较大,而加入氮气时甲烷/空气混合气体爆炸极限的变化则比较缓慢,尤其是爆炸下限几乎没有变化。
参考文献
[1] 汪泉,沈兆武,郭子如,等.基于高速摄像的半开口管道内瓦斯预混火焰传播特征的分析[J].爆破器材,2013,42(5):18-22.WANG Q,SHEN Z W,GUO Z R,et al.Analysis on propagation characterstics of premixed methane-air flame in an half-open tube based on high-speed video camera[J].Explosive Materials,2013,42(5):18-22.
[2] 王博,李文武,攀保龙,等.大尺寸密闭空间内甲烷-空气混合过程的数值模拟[J].爆破器材,2014,43(2): 5-9.WANG B,LI W W,PAN B L,et al.Numerical simulation of the mixing process of methane and air in large scale confined spaces[J].Explosive Materials,2014,43(2):5-9.
[3] 孙俊芳,张可,郭保玲,等.CH4/N2、CH4/CO2二元和CH4/N2/CO2三元混合气体的爆炸极限的实验与估算[J].爆炸与冲击,2015,35(5):747-752.SUN J F,ZHANG K,GUO B L,et al.Measurment and extimation for the flammability limits of binary mixtures of CH4/N2、CH4/CO2and ternary mixtures of CH4/N2/CO2[J].Explosion and Shock Waves,2015,35(5):747-752.
[4] MIN J S,BAILLOT F,GUO H S,et al.Impact of CO2,N2or Ar diluted in air on the length and lifting behavior of a laminar diffusion flame[J].Proceeding of the Combustion Institute,2011,33(1):1071-1078.
[5] MIN J J,BAILLOT F.Experimental investigation of the flame extinction processes of nonpremixed methane flame inside an air coflow diluted with CO2,N2or Ar[J].Combustion and Flame,2012,159(12):3502-3517.
[6] DOROFEEV S B.Flame acceleration and explosion safety application[J].Proceeding of the Combustion Institute,2011,33(2):2161-2175.
[7] 王华,葛岭梅,邓军,等.受限空间可燃性气体爆炸特性的对比[J].煤炭学报,2009,34(2):218-223.WANG H,GE L M,DENG J,et al.Comparison of explosion characteristics of ignitable gases in confined space [J].Journal of China Coal Society,2009,34(2):218-223.
[8] 王华,邓军,葛岭梅.初始压力对矿井可燃性气体爆炸特性的影响[J].煤炭学报.2011,36(3):423-428.WANG H,DENG J,GE L M.Influence of initial pressure on explosion characteristics of flammable gases in coal mine[J].Journal of China Coal Society,2011,36(3): 423-428.
[9] CHEN C C,WANG T C,LIAW H J,et al.Nitrogen dilution effect on the flammability limits for hydrocarbons [J].Journal of Hazardous Materials,2009,166(2/3): 880-890.
[10] CHEN C C,LIAW H J,WANG T C,et al.Carbon dioxide dilution effect on flammability limit for hydrocarbons[J].Journal of Hazardous Materials,2009,163(2/3):795-803.
[11] BSI.Determination of explosion limits of gases and vapors:EN1839[S].London:BSI,2003.
[12] COWARD H F,JONES G W.Limit of flammability of gases and vapors:Bulletin 503 [R].Washington DC: Bureau of Mines,1952.
Effect of Inert Gas to Gas Explosion Limits of Methane/Air Premixed
QU Zhongwei,YAN Shilong,LI Xuechao
College of Science,Anhui University of Science and Technology (Anhui Huainan,232001)
[ABSTRACT]Based on chemical equilibrium and Gibbs free energy,ChemKin numerical simulation software was applied and the critical temperature of 1 450 K was selected as a criterion whether the gas mixture is combustible or not,the impact of N2and CO2as an inert medium on the explosion limit of mixed gas was studied.The explosion limits of gas and air mixed gas within the explosion container 7L were measured to obtain the explosive limits of CH4and CO2(or N2) mixed in different volume ratio.Results show that,when V(CH4)/V(CO2) =0.294,the upper and lower explosion are coinciding,and when V(CH4)/V(CO2) is less than 0.294,it would not be ignited in any ratio.And CO2has stronger derived explosion suppression ability than N2.
[KEY WORDS]mechanics of explosion;flammability limit;adiabatic flame temperature;CH4
作者简介:曲忠伟(1979~),男,硕士,副教授,主要从事预混气体传播特性、火焰淬熄研究。E-mail:wzqu@ mail.ustc.edu.cn
基金项目:安徽省自然科学基金资助项目(1508085ME85);安徽省自然科学基金资助项目(1508085QF140)
收稿日期:❋2016-01-05
doi:10.3969/j.issn.1001-8352.2016.02.003

