血流感染假丝酵母菌菌种构成及其药物敏感性
徐鸣皋,丁进亚,徐 娟,孙 洁
(广州军区武汉总医院,湖北 武汉 430070)
·论著·
血流感染假丝酵母菌菌种构成及其药物敏感性
徐鸣皋,丁进亚,徐娟,孙洁
(广州军区武汉总医院,湖北 武汉430070)
[摘要]目的分析某院假丝酵母菌血流感染菌种构成及其对抗真菌药物的敏感性,为临床预防和治疗假丝酵母菌血流感染提供依据。方法回顾性分析2009—2013年该院临床科室送检血标本中检出的假丝酵母菌,并对假丝酵母菌血流感染的高危因素进行分析。结果2009—2013年42例患者血标本分离假丝酵母菌42株,以近平滑假丝酵母菌为主(20株,47.62%),其次为白假丝酵母菌(16株,38.10%)、热带假丝酵母菌(4株,9.52%)、光滑假丝酵母菌(2株,4.76%)。来源科室主要为:急诊监护病房(EICU,11株)、泌尿外科(9株)、心胸外科(8株)等。37例(占88.10%)患者静脉导管与血标本培养出相同的假丝酵母菌,留置静脉导管至血培养阳性和导管培养阳性的平均时间分别为31.47 d和33.18 d;导管和血培养阳性比例随着置管时间的延长均呈上升趋势(均P<0.001)。检出的假丝酵母菌对氟康唑、伏立康唑的敏感率均为75.00%~100.00%,对两性霉素B的敏感率均为100.00%;而不同菌种对伊曲康唑的敏感率存在较大差异(0~87.50%)。结论该院假丝酵母菌血流感染菌株以近平滑假丝酵母菌为主,且与静脉导管的使用有关,其对氟康唑、两性霉素B、伏立康唑的敏感性均较高。
[关键词]假丝酵母菌; 近平滑假丝酵母菌; 抗真菌药物; 血流感染; 药敏试验; 抗药性,微生物; 耐药性; 医院感染
[Chin J Infect Control,2016,15(3):172-175]
假丝酵母菌常定植在健康人的口腔、皮肤和胃肠道等部位,通常情况下并不致病[1]。但自1979年以来,假丝酵母菌从血液中检出的比例不断增加,已成为血流感染的主要病原菌之一,免疫力受损及患有严重基础疾病的住院患者成为其感染的高危人群。本研究分析某院2009—2013年假丝酵母菌血流感染患者病例,对其高危因素和药敏试验结果进行分析,为临床预防和治疗相关疾病提供方法和参考依据。
1资料与方法
1.1菌株来源回顾性分析2009—2013年广州军区武汉总医院临床科室送检血标本中检出的不重复菌株(同一位患者从血液和静脉导管中分离的菌株,如果鉴定结果和药敏结果完全一致视为同一株)。
1.2方法
1.2.1培养及真菌鉴定使用BactAlert 3D 120血培养仪对送检的血标本进行培养,使用血琼脂平板对拔除的静脉导管进行半定量培养。将分离出的假丝酵母菌在生物安全柜内转种TTC-沙保罗琼脂平板和科玛嘉假丝酵母菌显色培养基平板,分别放入25℃和35℃孵箱培养。使用Vitek 2 Compact YST真菌鉴定卡对假丝酵母菌进行菌种鉴定。质控菌株:白假丝酵母菌ATCC 14053。
1.2.2药敏试验使用ATB FUNGUS 3真菌药敏试剂盒进行药敏试验。质控菌株:近平滑假丝酵母菌ATCC 22019和克柔假丝酵母菌ATCC 6258。最小抑菌浓度(MIC)结果采用和阳性对照孔相比较的方法。35℃培养24 h后判读结果,伊曲康唑、氟康唑和伏立康唑达到50%抑制生长为其MIC,两性霉素B的MIC为达到100%抑制生长时的药物浓度。
1.2.3药敏判断折点(mg/L)S表示敏感,SDD表示剂量依赖性敏感,R表示耐药,标准来源于美国临床实验室标准化协会(CLSI)抗真菌药物敏感性试验方案M27-A3。氟康唑:S≤8,SDD=16~32,R≥64;伊曲康唑:S≤0.125,SDD=0.25~0.5,R≥1;伏立康唑:S≤1,SDD=2,R≥4;两性霉素B:S≤1。
1.3统计学分析应用Epicalc 2000软件进行统计学分析。趋势卡方检验分析统计数据的变化趋势,以P≤0.05为差异有统计学意义。
2结果
2.1基本资料2009—2013年42例患者血标本中分离假丝酵母菌42株,均为单一检出假丝酵母菌,未检出其他病原菌。以近平滑假丝酵母菌为主(20株,47.62%),其次为白假丝酵母菌(16株,38.10%)、热带假丝酵母菌(4株,9.52%)、光滑假丝酵母菌(2株,4.76%)。来源科室居前5位的依次为:急诊监护病房(EICU,11株)、泌尿外科(9株)、心胸外科(8株)、普通外科(6株)和肿瘤血液科(4株)。科室来源分布见表1。
表1血标本分离假丝酵母菌的科室来源分布(株)
Table 1Department distribution ofCandidaspp.isolated from blood specimens (No. of isolates)
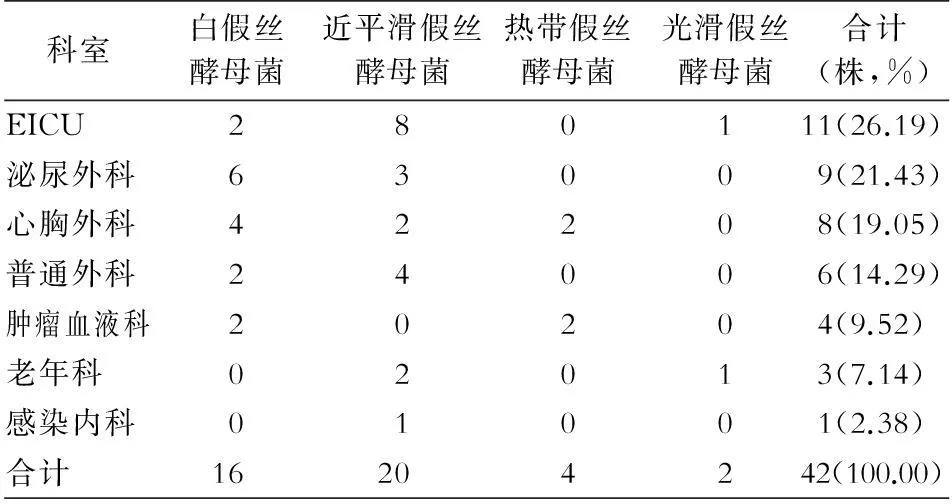
科室白假丝酵母菌近平滑假丝酵母菌热带假丝酵母菌光滑假丝酵母菌合计(株,%)EICU280111(26.19)泌尿外科63009(21.43)心胸外科42208(19.05)普通外科24006(14.29)肿瘤血液科20204(9.52)老年科02013(7.14)感染内科01001(2.38)合计16204242(100.00)
2.2不同置管时间血标本和导管培养情况42例患者中37例(占88.10%)患者静脉导管与血标本培养出相同的假丝酵母菌,且半定量计数>15 CFU,有临床感染迹象,置管时间>7 d,无其他感染源,确定其感染来源为静脉导管[2],留置静脉导管至血培养阳性和导管培养阳性的平均时间分别为31.47 d和33.18 d。静脉导管和血培养阳性比例随着置管时间的延长均呈上升趋势(均P<0.001)。不同置管时间导管和血培养阳性例数及构成情况见表2。
2.3药敏结果检出的假丝酵母菌对氟康唑、伏立康唑的敏感率均为75.00%~100.00%,对两性霉素B的敏感率均为100.00%;而对伊曲康唑的敏感率视菌种不同差异较大(0~87.50%)。不同类型假丝酵母菌对常用抗真菌药物的敏感率见表3。
表2不同置管时间静脉导管和血培养阳性例数及其构成情况(例,%)
Table 2Number and constitute of positive cultures of blood and catheters of different indwelling catheter time (No. of cases, %)

置管时间血培养阳性静脉导管培养阳性第1周2(5.41)1(2.70)第2周4(10.81)5(13.52)第3周5(13.51)4(10.81)第4周9(24.32)8(21.62)>4周17(45.95)19(51.35)χ220.5825.55P<0.001<0.001
表3不同类型假丝酵母菌对常用抗真菌药物敏感率(%)
Table 3Antifungal susceptibility rates of differentCandida(%)

药物名称白假丝酵母菌(n=16)近平滑假丝酵母菌(n=20)热带假丝酵母菌(n=4)光滑假丝酵母菌(n=2)氟康唑93.75100.0075.00100.00伊曲康唑87.5065.0075.000.00两性霉素B100.00100.00100.00100.00伏立康唑100.00100.0075.00100.00
3讨论
Pfaller等[3]抗菌药物监测数据显示,94.30%的假丝酵母菌血流感染是由白假丝酵母菌、近平滑假丝酵母菌、光滑假丝酵母菌和热带假丝酵母菌引起。本研究显示,血标本中分离的假丝酵母菌,近平滑假丝酵母菌和白假丝酵母菌占85.71%,其他假丝酵母菌仅占14.29%,说明近平滑假丝酵母菌和白假丝酵母菌是假丝酵母菌血流感染的主要病原菌,其中近平滑假丝酵母菌所占比例最多,这与以往国内白假丝酵母菌占多数的报道[4-5]不一致。血流感染假丝酵母菌的构成存在区域性差别,美国和西班牙白假丝酵母菌排在假丝酵母菌血流感染的第1位,近平滑假丝酵母菌排在第2位[3,6];而日本和意大利近平滑假丝酵母菌排在假丝酵母菌血流感染的第1位,白假丝酵母菌排在第2位[7-8];美国和欧洲某些地区白假丝酵母菌仍然是假丝酵母菌血流感染最主要的病原真菌[3,6]。研究指出,随着时间的推移,非白假丝酵母菌占假丝酵母菌血流感染的比例不断上升,特别是近平滑假丝酵母菌上升趋势最明显[9],在某些地区已经取代白假丝酵母菌成为血流感染最主要的病原真菌[7-8]。
42例血标本培养出假丝酵母菌的患者中,37例患者静脉导管培养出与血标本相同的假丝酵母菌,比率高达88.10%。剩余5例患者中,有2例为置管患者,虽然这2例患者的静脉导管和血标本中培养出相同的假丝酵母菌,但是半定量计数<5 CFU,置管时间<3 d,且均为直肠切除术后患者,因此难以界定其感染是手术引起还是留置静脉导管引起。另外3例患者均未使用静脉导管,其中2例为肾结石患者,于碎石术后出现高热,送检血培养,多次检出假丝酵母菌;另1例为急性淋巴细胞白血病患者,但该患者无侵袭性真菌感染的相关症状,重新采集血标本培养也未复检出假丝酵母菌,患者出院后随访亦未见异常,判断为污染菌[10]。本次研究中,88.10%的假丝酵母菌血流感染是由留置静脉导管引起,由此可见若患者血培养出假丝酵母菌且使用静脉导管,则其感染来源为静脉导管的可能性很高,应立刻拔除导管送检,以明确诊断。值得注意的是,并非所有留置静脉导管的患者均会发生由假丝酵母菌引起的导管相关性血流感染(CRBSI),目前CRBSI主要病原菌仍然以革兰阴性杆菌为主。文献[11-12]指出,假丝酵母菌引起的CRBSI发生率分别为7.14%、1.17%,均低于革兰阴性杆菌引起的CRBSI发生率9.52%、8.98%。37例患者留置静脉导管到血培养阳性和静脉导管培养阳性的平均时间分别为31.47 d和33.18 d,血培养阳性时间比静脉导管培养阳性时间早1.71 d,通过对血和静脉导管送检的先后顺序分析可知,有5例患者静脉导管检出假丝酵母菌后送检血培养,有9例患者同时送检静脉导管和血培养,另外23例患者是在血培养检出假丝酵母菌后才拔除静脉导管送检,62.16%的患者为血培养阳性后才拔除导管送检,因此静脉导管培养的阳性时间比血培养的阳性时间滞后。通过对置管时间和阳性比例进行对比发现,留置静脉导管1周内血和静脉导管培养阳性数占总阳性数的5.41%和2.70%,说明留置静脉导管1周内发生假丝酵母菌血流感染的比例较低。而随着时间的推移,第1周至>4周血培养的阳性比率分别为5.41%、10.81%、13.51%、24.32%、45.95%,阳性比率随着置管时间的延长呈上升趋势;第1周至>4周静脉导管培养的阳性比率分别为2.70%、13.52%、10.81%、21.62%、51.35%,阳性比率随着置管时间的延长呈上升趋势。由此可见留置静脉导管的时间越长,血培养和静脉导管培养阳性的比例越高,发生假丝酵母菌血流感染的风险越大[12-13]。
本研究结果中42例患者中有34例来自外科病区和EICU病区,占总数的80.95%,其中又以EICU所占比例最多,其次是泌尿外科、心胸外科、普通外科。侵袭性真菌感染最容易从胃肠道起源[14],特别是经历腹腔手术的患者[1],最容易发生侵袭性真菌感染。同一患者食道、胃和肠道分离出的假丝酵母菌与其血流感染的菌株往往相同或有密切关联[15]。假丝酵母菌在患者身体多部位高强度的定植,进而在各项护理、诊疗或手术过程中发生易位,并可通过医护人员的手进行医院传播[16]。假丝酵母菌可在静脉导管等各种植入设备中形成生物膜,而经历手术或放射治疗、化学治疗的患者往往免疫力低下,且必须长期留置静脉导管,因此CRBSI的发生无法完全避免。为降低CRBSI的发生率,美国医疗卫生改善协会(IHI)提出了中心静脉导管集束干预策略(CLB),主要措施有以下5项:手卫生、使用洗必泰消毒皮肤、置管时提供无菌屏障、选择最理想的置管位置和每日检查患者的导管是否需要保留。施行CLB能有效的降低CRBSI的发生率[17]。
本组白假丝酵母菌对氟康唑、两性霉素B和伏立康唑的敏感率依次为93.75%、100.00%、100.00%,近平滑假丝酵母菌和光滑假丝酵母菌对氟康唑、两性霉素B和伏立康唑的敏感率均为100.00%,与吴剑涌等[5]的研究结果相似。而伊曲康唑的敏感率视菌种不同有较大差异(0~87.50%)。说明血标本中分离的假丝酵母菌对氟康唑、两性霉素B和伏立康唑的敏感性较高,可以用于预防和治疗假丝酵母菌血流感染。而不同假丝酵母菌对伊曲康唑的敏感性差异较大,应根据药敏结果选择使用。在选择敏感药物进行抗真菌感染治疗的过程中,有1例患者使用敏感药物后3 d仍高烧不退,临床医生因此怀疑报告的准确性,经检查发现该患者血中检出假丝酵母菌后,仍未拔出留置的静脉导管,因而造成感染的迁延。该患者在拔出静脉导管后的次日体温即恢复正常,提示若不积极清除原发感染病灶则抗感染治疗的疗效难以保证。
[参 考 文 献]
[1]MacCallum DM. The yeast handbook [M]. New York: Springer, 2010:41-67.
[2]Mermel LA,Allon M, Bouza E,et al. Clinical practice guidelines for the diagnosis and management of intravascular catheter-related infection: 2009 Update by the Infectious Diseases Society of America [J]. Clin Infect Dis,2009,49(1):1-45
[3]Pfaller MA, Moet GJ, Messer SA, et al. Candida bloodstream infections: comparison of species distributions and antifungal resistance patterns in community-onset and nosocomial isolates in the SENTRY Antimicrobial Surveillance Program, 2008-2009[J]. Antimicrob Agents Chemother,2011,55(2): 561-566.
[4]刘晓颖, 吴霖, 陈影, 等.酵母菌血症流行病学及影响近期病死率的危险因素分析[J].微生物与感染, 2013, 8(4):234-243.
[5]吴剑涌, 杨青.血流感染真菌的分布及耐药性分析[J].中国微生态学杂志, 2013, 25(10):1188-1191.
[6]Bassetti M, Merelli M, Righi E, et al. Epidemiology, species distribution, antifungal susceptibility, and outcome of candidemia across five sites in Italy and Spain[J]. J Clin Microbiol,2013,51(12):4167-4172.
[7]Nakamura T, Takahashi H. Epidemiological study ofCandidainfections in blood: susceptibilities ofCandidaspp.to antifungal agents, and clinical features associated with the candidemia[J]. J Infect Chemother,2006,12(3):132-138.
[8]Montagna MT, Caggiano G, Lovero G, et al.Epidemiology of invasive fungal infections in the intensive care unit: results of amulticenter Italian survey (AURORA Project)[J]. Infection,2013,41(3):645-653.
[9]Pfaller MA, Diekema DJ, Gibbs DL, et al. Results from the ARTEMIS DISK Global Antifungal Surveillance Study,1997-2007: a 10.5-year analysis of susceptibilities ofCandidaspecies to fluconazole and voriconazole as determined by CLSI standardized disk diffusion[J]. J Clin Microbiol,2010,48(4):1366-1377.
[10] 中华医学会“念珠菌病诊治策略高峰论坛”专家组.念珠菌病诊断与治疗:专家共识[J].中国感染与化疗杂志, 2011, 11(2):81-95.
[11] 陈扬波, 张庚, 季春莲, 等.重症监护病房深静脉导管感染及相关因素分析[J].现代实用医学, 2009, 21(2):120-121, 147.
[12] 黄华艳, 李兰新.重症监护室中心静脉导管相关性感染分析[J].中国感染控制杂志, 2012, 11(5):374-375, 382.
[13] 贾会学, 任军红, 赵秀莉, 等.外科重症监护室预防器械相关感染的干预性研究[J].中国感染控制杂志, 2011, 10(3):166-169.
[14] Delaloye J,Calandra T. Invasive candidiasis as a cause of sepsis in the critically ill patient[J].Virulence,2014,5(1): 161-169.
[15] Odds FC, Davidson AD, Jacobsen MD, et al.Candidaalbicansstrain maintenance, replacement, and microvariation demonstrated by multilocus sequence typing[J]. J Clin Microbiol, 2006,44(10):3647-3658.
[16] van Asbeck EC, Clemons KV, Stevens DA.Candidaparapsilosis: a review of its epidemiology, pathogenesis, clinical aspects, typing and antimicrobial susceptibility [J].Crit Rev Microbiol,2009,35(4):283-309.
[17] 葛学顺, 陈维开, 蒋福云, 等.集束化干预策略在预防ICU中心静脉导管相关血流感染中的应用[J].中国感染控制杂志, 2012, 11(6):422-424.
(本文编辑:张莹)
Constitute and antifungal susceptibility ofCandidaspp.causing bloodstream infection
XUMing-gao,DINGJin-ya,XUJuan,SUNJie
(WuhanGeneralHospitalofGuangzhouMilitaryCommand,Wuhan430070,China)
[Abstract]ObjectiveTo analyze the constitute and antifungal susceptibility of Candida spp. causing bloodstream infection in a hospital, so as to provide evidence for the prevention and treatment of bloodstream infection caused by Candida spp.MethodsCandida spp. isolated from blood specimens of clinical patients in a hospital between 2009 and 2013 were analyzed retrospectively, the high risk factors for Candida bloodstream infection were analyzed.ResultsA total of 42 isolates of Candida spp. were isolated from blood specimens of 42 patients between 2009 and 2013, the major was Candida parapsilosis (C. parapsilosis, n=20,47.62%), followed by C.albicans (n=16,38.10%), C.tropicalis (n=4, 9.52%), and C.glabrata(n=2, 4.76%). Candida spp. were mainly distributed in emergency intensive care unit(n=11), departments of urologic surgery (n=9) and cardiothoracic surgery(n=8). The venous catheters of 37 patients(88.10%) were isolated the same Candida spp. as blood culture, the average time from indwelling venous catheters to positive culture of blood and catheters were 31.47 and 33.18 days respectively; the percentage of positive culture for blood and catheters both increased with the prolongation of catheterization (both P<0.001). Susceptibility rates of Candida spp. to fluconazole and voriconazole were 75.00%-100.00%, to amphotericin B were all 100.00%, to itraconazole varied significantly with different species (0-87.50%).ConclusionThe major Candida strains causing bloodstream infection in this hospital is C. parapsilosis, and is related to the use of intravenous catheters, susceptibility rates to fluconazole, amphotericin B, and voriconazole are all high.
[Key words]Candida;Candida parapsilosis;antifungal drug;bloodstream infection; antimicrobial susceptibility testing; drug resistance, microbial; drug resistance; healthcare-associated infection
[中图分类号]R379.3
[文献标识码]A
[文章编号]1671-9638(2016)03-0172-04
DOI:10.3969/j.issn.1671-9638.2016.03.007
[作者简介]徐鸣皋(1982-),男(汉族),湖北省武汉市人,主管技师,主要从事临床微生物检验研究。[通信作者]徐鸣皋E-mail:117242829@qq.com
[收稿日期]2015-04-10

