应用Tem-PCR技术同时检测3种致病菌的研究
曲 敏,莫春生,刘 佳,刘忠梅,徐义刚,李苏龙
(1. 哈尔滨商业大学 食品工程学院,哈尔滨 150076;2. 辽宁出入境检验检疫局,辽宁 大连 116001;3. 黑龙江出入境检验检疫局,哈尔滨 150001)
应用Tem-PCR技术同时检测3种致病菌的研究
曲敏1,莫春生1,刘佳2,刘忠梅3,徐义刚3,李苏龙3
(1. 哈尔滨商业大学 食品工程学院,哈尔滨 150076;2. 辽宁出入境检验检疫局,辽宁 大连 116001;3. 黑龙江出入境检验检疫局,哈尔滨 150001)
摘要:应用靶序列富集多重PCR (target enriched multiplex PCR,Tem-PCR)技术建立同时检测沙门氏菌、单核细胞增生李斯特氏菌、大肠埃希氏菌O157三种致病菌的高通量简易检测方法.实验分别以沙门氏菌的invA基因、单核细胞增生李斯特氏菌的hly基因、大肠埃希氏菌O157 rfbE基因为靶基因,设计3对特异性引物,并与通用引物连接组成Tem-PCR引物,通过反应条件优化,建立了Tem-PCR检测方法.结果表明,建立的Tem-PCR方法特异性强,其检测灵敏度分别为沙门氏菌1.1×103 CFU/mL、单核细胞增生李斯特氏菌5.6×102 CFU/mL、大肠埃希氏菌O157 2.3×103 CFU/mL.方法不需要优化调整各引物对的浓度,易于使用,有效地解决了传统多重PCR方法扩增效率不均衡的问题.
关键词:靶序列富集多重PCR方法;沙门氏菌;单核细胞增生李斯特氏菌;大肠埃希氏菌O157
沙门氏菌、单核细胞增生李斯特氏菌、大肠埃希氏菌O157是引起食物中毒的主要食源性致病菌[1-5].目前,针对食源性致病菌检测的主要方法有传统生化鉴定方法[6-10]、酶联荧光免疫检测方法、胶体金试纸方法、分子探针检测方法、PCR方法、PCR-DHPLC方法[11-15]及基因芯片方法等[16-17].传统生化鉴定方法操作繁琐,检测时间长,完成鉴定工作通常需要5~10 d时间,不能满足食源性致病菌快速检测的要求.免疫学为基础建立的检测方法,虽然检测快速,但灵敏性差,假阳性高.PCR方法因具有检测灵敏度高、特异性强、操作简便等优点,在病原微生物的检测中发挥了巨大的作用,成为主要采用的检测方法.其中,多重PCR检测通量高,可以实现多种致病菌的同时检测,但建立多重PCR方法时需要反复优化各引物对的浓度,以应对不同引物对扩增效率的不均衡性.
靶序列富集多重PCR(target enriched multiplex PCR, Tem-PCR)技术是一种新颖的引物设计方式与扩增方法,巧妙地克服了多重PCR的扩增不均衡困难.原理是:设计一对没有亲源性通用引物,其浓度较高,足以进行指数扩增.再针对扩增的每一种靶序列,设计一对特异性引物,将它与通用引物连接,成为复合引物,它浓度极低,用于在PCR的最初几个循环中以富集目标序列.这样在保证了特异性的情况下,既提高了灵敏度,又平衡了各种引物的扩增效率[18-19].本研究利用该技术,建立了同时检测沙门氏菌、单核细胞增生李斯特氏菌、大肠埃希氏菌O157的Tem-PCR检测方法.
1材料与方法
1.1材料
1.1.1菌株
实验菌株沙门氏菌ATCC 10708、志贺氏菌CMCC 51592、单核细胞增生李斯特菌CMCC 54002、金黄色葡萄球菌CMCC 26003、创伤弧菌ATCC 27562、溶藻弧菌ATCC 17749、霍乱弧菌ATCC 25872、副溶血弧菌ATCC 17802、大肠埃希氏菌O157 ATCC 35150、大肠杆菌ATCC 25922、产肠毒素大肠杆菌ATCC 35401、肠侵袭性大肠杆菌ATCC 43893、肠致病性大肠杆菌ATCC 43887、阪崎肠杆菌ATCC 51329、空肠弯曲菌ATCC 33560、变形杆菌ATCC 49027、蜡样芽孢杆菌ATCC 10987由黑龙江出入境检验检疫局提供.
1.1.2试剂
细菌基因组DNA提取试剂盒购自北京天根生化科技有限公司;Taq DNA聚合酶、dNTP购自日本TaKaRa(大连)公司;所有培养基购自北京兰伯瑞生物技术公司.
1.2方法
1.2.1引物设计
首先人工设计一对与细菌没有同源性的一段碱基序列,作为通用引物(表1引物序列的下划线部分).然后分别以沙门氏菌的invA基因、单核细胞增生李斯特氏菌的hly基因、大肠埃希氏菌O157 rfbE基因为靶基因,选择基因保守区域设计3对特异性引物.特异性引物和通用引物连接构成复合引物.Tem-PCR检测由复合引物和通用引物进行.引物由上海生工公司合成.
表1Tem-PCR 引物序列

细菌基因引物序列(5'→3')产物大小沙门氏菌invAF:AACTGTGTTTACTACTAGGGTGGGTTTTGTTGTCTTCTCR:GGATTTAATGGCTACTCTCAAGATAATAATGATGCCGGC316单核细胞增生李斯特杆菌hlyF:AACTGTGTTTACTACTAGGGTAAGCGGAAAATCTGTCTCR:GGATTTAATGGCTACTCTCATTTCGTTACCTTCAGGATC412出血性大肠杆菌O157rfbEF:AACTGTGTTTACTACTAGGAATTGAAGATTGCGCTGAAGR:GGATTTAATGGCTACTCTCGTGTGGACAGGGTAAAAAAC530
注:划线部分为通用引物,未划线部分为特异性引物.
1.2.2核酸提取
采用细菌基因组DNA提取试剂盒提取实验菌株基因组DNA,具体操作详见说明书.
1.2.3复合引物浓度优化
复合引物终浓度分别为20、40、80、200 nmol/L,其他PCR反应成份为:10 μmol/L的通用引物2 μL、10×PCR Buffer2.5 μL、10 mmol/L的dNTPs 2 μL、细菌基因组DNA模板各0.5 μL、5 U/μL的Taq DNA聚合酶0.2 μL、去离子水补充至25 μL,反应体系为25 μL.扩增产物经琼脂糖凝胶电泳检测,最终确定复合引物的最佳浓度.
1.2.4Tem-PCR扩增步骤的优化
分别采用二步扩增法和三步扩增法优化Tem-PCR反应条件,经凝胶电泳检测,以确定Tem-PCR最佳反应条件,具体方案见表2.
表2Tem-PCR 扩增方案
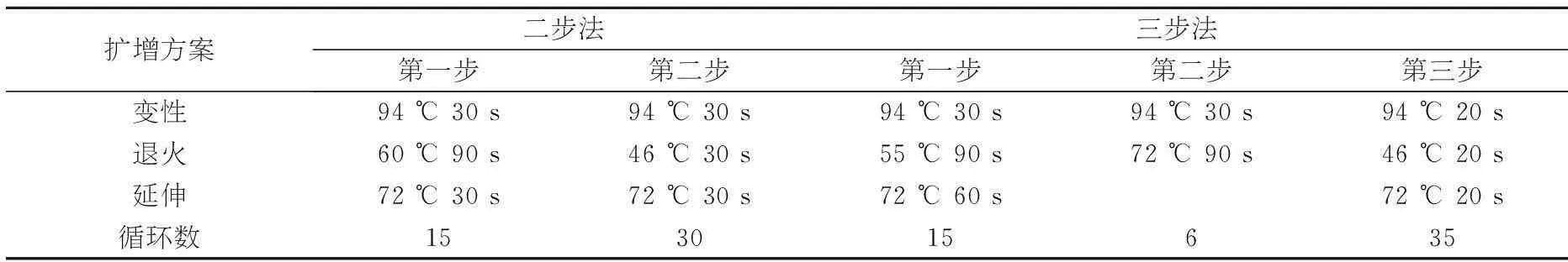
扩增方案二步法三步法第一步第二步第一步第二步第三步变性94℃30s94℃30s94℃30s94℃30s94℃20s退火60℃90s46℃30s55℃90s72℃90s46℃20s延伸72℃30s72℃30s72℃60s72℃20s循环数153015635
1.2.5Tem-PCR方法的特异性实验
利用建立的Tem-PCR方法检测1.1.1节所示菌株,以验证本方法的特异性.
1.2.6Tem-PCR方法的简易性评价
利用设计的3对特异性引物(表1中未划线部分),不经过引物浓度优化,直接进行多重PCR扩增,扩增效果与Tem-PCR方法进行比较.
1.2.7Tem-PCR方法的灵敏度实验
分别将菌体浓度约为1.1×108CFU/mL、5.6×107CFU/mL和2.3×108CFU/mL的沙门氏菌、单核细胞增生李斯特氏菌、大肠埃希氏菌O157进行10倍梯度稀释,采用试剂盒法提取每个稀释度细菌基因组DNA,以此作为模板进行Tem-PCR检测,经凝胶电泳检测以确定该方法的灵敏度.
1.2.8Tem-PCR方法的应用性实验
将未检出目标菌的猪肉、牛奶和香肠食品样品分成两组:一组样品经人工随机污染沙门氏菌、单核细胞增生李斯特氏菌、大肠埃希氏菌O157;另一组样品作为阴性对照.分别采用Tem-PCR法和国家标准法(GB 4789.4、30、36)对两组样品进行检测,检测结果进行符合性验证.
2结果与分析
2.1复合引物的浓度优化
结果如图1所示,随着复合引物浓度的增加,目标条带越来越明亮和粗壮.当复合引物浓度为80 nmol/L时,3种致病菌的扩增条带最粗壮和均匀;但当复合引物浓度较大而达到200 nmol/L时,PCR扩增效率出现不均衡.因此,复合引物最佳反应浓度为80 nmol/L.

泳道M—100 bp DNA Ladder Marker;泳道1~4—复合引物浓度分别为20、40、80、200 nmol/L时的扩增产物图1 复合引物浓度优化
2.2Tem-PCR扩增步骤的优化
结果显示:采用三步扩增法能够较均匀地扩增出3条目标带(图2:泳道1),而二步法扩增出的3条目标带不均衡(图2:泳道2),单核细胞增生李斯特氏菌条带暗弱.三步扩增法中,第一步保证了特异性引物(复合引物的一部分)与细菌基因组DNA模板结合,达到了富集靶基因的初步目的;第二步保证了复合引物与初步扩增的靶基因模板结合,达到了进一步富集靶基因的目的;第三步保证了通用引物与富集的模板结合,达到高速且均匀的扩增目的.二步扩增法中,复合引物不能很好地发挥富集作用,扩增出现了不均衡现象.所以,三步法更能满足Tem-PCR引物退火温度的要求.

泳道M—100 bp DNA Ladder Marker;泳道1—三步法扩增产物;泳道2—二步法扩增产物;泳道3—阴性对照图2 Tem-PCR扩增步骤的优化
2.3Tem-PCR方法的检测特异性
利用建立的Tem-PCR方法检测1.1.1节所示菌株,结果显示:沙门氏菌、单核细胞增生李斯特氏菌、大肠埃希氏菌O157均为Tem-PCR阳性结果,其他为阴性结果,且未见非特异性扩增条带出现,显示了良好的检测特异性(图3).
2.4Tem-PCR方法的简易性

泳道M—100 bp DNA Ladder Marker;泳道1~17—分别为沙门氏菌、单核细胞增生李斯特菌、大肠埃希氏菌O157、金黄色葡萄球菌、志贺氏菌、创伤弧菌、溶藻弧菌、霍乱弧菌、副溶血弧菌、产肠毒素大肠杆菌、肠侵袭性大肠杆菌、肠致病性大肠杆菌、大肠杆菌、阪崎肠杆菌、空肠弯曲菌、变形杆菌、蜡样芽孢杆菌的扩增产物图3 Tem-PCR方法的检测特异性
利用3对特异性引物,未经引物浓度优化,直接进行常规多重PCR扩增,其扩增效果与Tem-PCR方法进行比较.结果如图4所示,Tem-PCR能高效地扩增出三条目标带,而常规多重PCR方法由于未调整引物浓度,导致扩增效率不均衡.沙门氏菌和大肠埃希氏菌O157扩增条带明显,单核细胞增生李斯特氏菌条带微弱.结果证明Tem-PCR方法不用优化引物浓度,方法简单易行.

泳道M—DNA Marker 100 bp Ladder;泳道1—Tem-PCR法;泳道2—传统多重PCR法图4 Tem-PCR方法和常规多重PCR方法扩增效果的对比
2.5Tem-PCR方法的检测灵敏度
将已知菌体浓度的3种致病菌培养液10倍稀释5次后,利用建立的Tem-PCR方法均能同时有效地扩增出靶基因片段(图5),显示该Tem-PCR方法检测沙门氏菌、单核细胞增生李斯特氏菌、大肠埃希氏菌O157灵敏度分别为1.1×103、5.6×102、2.3×103CFU/mL.
2.6Tem-PCR检测方法的实用性
采用建立的Tem-PCR方法对沙门氏菌、单核细胞增生李斯特氏菌、大肠埃希氏菌O157随机组合污染的食品样品进行检测,结果显示,利用该方法能够准确检测出污染样品中的致病菌,与传统国家标准方法(简称国标法)(GB 4789.4, 30, 36)检测结果相符合,显示了良好的实用性.见表3.
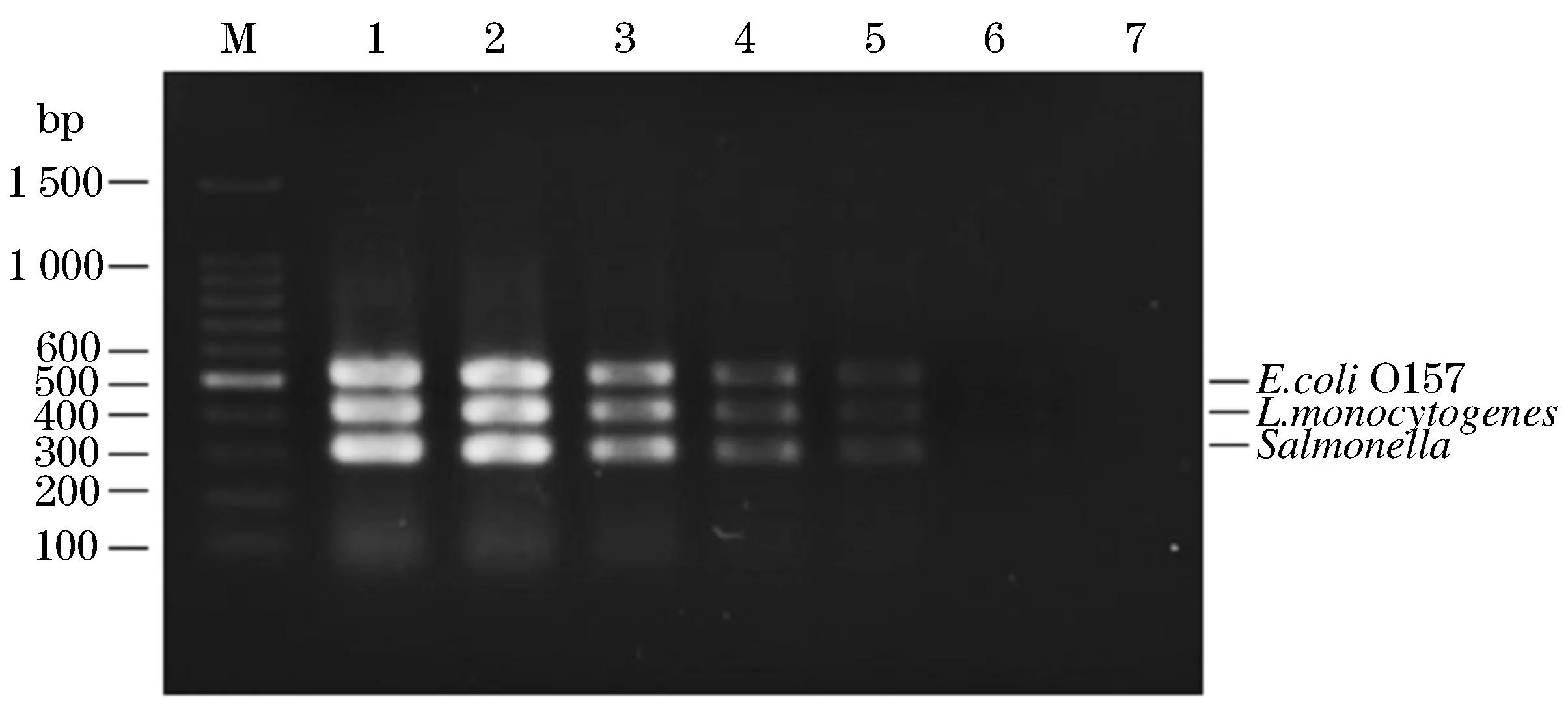
泳道M—100 bp DNA Ladder Marker;泳道1-7—三种致病菌培养液依次10倍递减稀释液的扩增产物图5 Tem-PCR灵敏度
3讨论
Tem-PCR方法的独特之处在于靶序列的复合引物的浓度极低,用在PCR的最初几个循环中富集目标序列,只有通用引物的浓度足以进行指数扩增.通用引物的浓度通常是复合引物浓度的10倍.整个扩增过程包括富集阶段和扩增阶段.在富集阶段,本实验采用了二个步骤,分别保证了复合引物与相关模板的完全结合,达到了富集目的.在扩增阶段,所有目标基因都采用同一引物(通用引物)进行扩增,所以扩增效率相同,不但所有目标条带都能扩增出来,而且条带亮度相当,解决了传统多重PCR中不同引物扩增效率不均衡问题.因此,Tem-PCR方法不需要优化调整各种引物的浓度,相比传统多重PCR方法,Tem-PCR法变得简单易行.
表3方法验证

样品国标法Tem-PCR法人工污染组猪肉沙门氏菌、单核细胞增生李斯特氏菌沙门氏菌、单核细胞增生李斯特氏菌牛奶单核细胞增生李斯特氏菌、大肠埃希氏菌O157单核细胞增生李斯特氏菌、大肠埃希氏菌O157香肠沙门氏菌、单核细胞增生李斯特氏菌、大肠埃希氏菌O157沙门氏菌、单核细胞增生李斯特氏菌、大肠埃希氏菌O157阴性对照组猪肉--牛奶--香肠--
本研究采用Tem-PCR技术,建立了同时检测沙门氏菌、单核细胞增生李斯特氏菌、大肠埃希氏菌O157的方法,避开传统多重PCR方法扩增效率不均衡的缺陷,为简单快速建立致病菌高通量检测方法提供了新的手段.
参考文献:
[1]王军, 郑增忍, 王晶钰. 动物源性食品中沙门氏菌的风险评估[J]. 中国动物检疫, 2007, 24(4): 23-25.
[2]DANYLUK M D, HARRIS L J, SCHAFFNER D W. Montecarlo simulations assessing the risk of salmonellosis from consumption of almonds [J]. Journal of Food Protection, 2006, 69(7): 1594-1599.
[3]金建潮, 袁丹茅, 何云, 等. 速冻面米食品中微生物污染状况分析[J]. 河南预防医学杂志, 2007, 18(4): 305.
[4]JORGENSEN H J, MORK T, HOGASEN H R,etal. Enterotoxigenic Staphylococcus aureus in bulk milk in Norway [J]. Journal of Applied Microbiology, 2005, 99(1): 158-166.
[5]PHILPOTT D J, EDGEWORTH J D, SANSONETTI P J. The pathogenesis of Shigella flexneri infection: lessons from in vitro and in vivo studies [J]. Philosophical transactions of the Royal Society of London, Series B, Biological Sciences, 2000, 1397(355): 575-586.
[6]吴清平, 孙永, 蔡芷荷, 等. 快速测试片在食品微生物检测中的应用[J]. 中国卫生检验杂志, 2006, 16(5): 635-637.
[7]巢强国, 杨学明, 葛宇, 等. PCR法检测食品中大肠杆菌O157:H7[J]. 食品科学, 2010, 31(8): 212-215.
[8]祝儒刚, 李拖平, 宋立峰. 应用基因芯片技术检测肉及肉制品中5种致病菌[J]. 食品科学, 2012, 33(14): 211-215.
[9]李丁玲, 任敬, 马晓燕, 等. 多重PCR检测食源性致病菌的研究[J]. 食品工业, 2012, 33(10): 159-163.
[10]张晓焱, 王梅, 周映霞. 多重PCR技术检测肉品中致病菌的应用研究[J]. 肉类研究, 2009, 7: 47-49.
[11]韩卫宁, 张正姬, 雅雪蓉, 等. 分子鉴别诊断(MDD)技术在呼吸道病原体检测中的应用[J]. 细胞与分子免疫学杂志, 2010, 26(11): 1146-1148.
[12]王洁, 李利平, 王卫萍, 等. 4种常见呼吸道病毒快速分子检测方法的建立[J]. 东南国防医药, 2013, 15(6): 551-555.
[13]曹际娟, 闫平平, 徐君怡, 等. 单核细胞增生李斯特氏菌PCR-DHPLC检测新技术的建立[J]. 生物技术通报, 2008, S1:415-419.
[14]杨春华, 曹际娟, 桂家祥, 等. 乳及乳制品中阪崎肠杆菌PCR-DHPLC检测新技术的建立[J]. 微生物学通报, 2008, 35(11): 1845-1849.
[15]王玉平. 变性高效液相色谱法同时检测5种食源性致病菌[J]. 现代预防医学, 2009, 36(18): 3520-3523.
[16]LI H, MCCORMAC M A, ESTES R W,etal. Simultaneous detection and high-throughput identification of a panel of RNA viruses causing respiratory tract infections[J]. Journal of Clinical Microbiology, 2007, 45 (7): 2105 -2109.
[17]COIRAS MT, AGUILAR JC, GARCIA ML,etal. Simultaneous detection of fourteen respiratory viruses in clinical specimens by two multiplex reverse transcription nested-PCR assays [J]. Journal of Medical Virology, 2004, 72(3): 484-495.
[18]HAN J, SWAN D C, SMITH S J,etal. Simultaneous amplification and identification of 25 human papillomavirus types with templex technology [J]. Journal of Clinical Microbiology, 2006, 44 (11): 4157- 4162.
[19]韩卫宁, 韩健. 分子鉴别诊断领域的革命性技术-Tem-PCR[J]. 细胞与分子免疫学杂志, 2009, 25(2): 184-186.
Development of target-enriched multiplex PCR assay for simultaneous detection of three foodborne pathogens
QU Min1, MO Chun-sheng1, LIU Jia2, LIU Zhong-mei3, XU Yi-gang3, LI Su-long3
(1. School of Foodstuff Engineering, Harbin University of Commerce, Harbin 150076, China; 2. Liaoning Entry-Exit Inspection and Quarantine Bureau,Dalian 116001, China;3. Heilongjiang Entry-exit Inspection and Quarantine Bureau, Harbin 150001, China)
Abstract:A novel simple assay of target-enriched multiplex PCR (Tem-PCR) for the simultaneous detection of Salmonella, Listeria monocytogenes , Escherichia coli O157 was developed. Targeted on InvA gene of Salmonella, hly gene of Listeria monocytogenes, rfbE gene of Escherichia coli O157, three pairs of specific primers combined with a universal primer were designed. After optimizing the reaction conditions, the Tem-PCR assay was highly specific, with the sensitivity of 1.1×103 CFU/mL, 5.6×102 CFU/mL and 2.3×103 CFU/mL for Salmonella, Listeria monocytogenes and Escherichia coli O157, respectively. Tem-PCR is easy to use without optimization of the concentration of each primer, which effectively solves the problem of uneven amplification efficiency in the conventional multiplex PCR.
Key words:Tem-PCR assay; Salmonella; Listeria monocytogenes; Escherichia coli O157
中图分类号:TS207
文献标识码:A
文章编号:1672-0946(2016)01-0033-05
作者简介:曲敏(1966-),女,博士,教授,研究方向:食品检测.通讯作者:李苏龙(1966-),男,硕士,研究员,研究方向:微生物检测.
基金项目:质检公益性行业科研专项(201310126)
收稿日期:2015-10-04.

