无法切除的体尾部胰腺癌术中微波治疗的临床研究*
李 龙 林存红
(泰安市肿瘤防治院,山东 泰安 271000)
无法切除的体尾部胰腺癌术中微波治疗的临床研究*
李龙林存红
(泰安市肿瘤防治院,山东 泰安 271000)
摘要:目的探讨无法切除的体尾部胰腺癌术中微波治疗的可行性、安全性及有效性。方法将33例无法切除的体尾部胰腺癌患者随机分成A、B两组。A组为实验组,在完成常规手术干预后,术中直视下行胰腺癌的微波治疗;B组为对照组,不行微波治疗,A、B两组术后仍均行常规放疗。通过对比A、B两组围术期相关并发症发生率以及分析治疗后对患者生存质量及生存期的改善情况,评价微波治疗的安全性及有效性。结果A、B两组术后均没有发生肠瘘、胆瘘、大出血情况,胰瘘发生率分别为8%和5%,差异无统计学意义(P>0.05),且均属低流量、生化型胰瘘,经短期保守治疗均痊愈。A组较B组术后疼痛、生存质量均有较明显改善(P<0.05),而生存期也有改善(P<0.05)。结论术中微波治疗是一种安全、有效的改善无法切除的体尾部胰腺癌患者生存质量的治疗方式。
关键词:胰腺癌;无法切除;微波治疗;术中
胰腺癌是恶性消化道肿瘤中恶性程度最高的肿瘤之一,其具有起病隐匿、病情进展快、手术切除率低、预后差等特点,大多数患者临床确诊时,已经失去手术机会[1],其根治性手术切除率仅为20%左右[2]。其2年总体生存率不足20%[1],5年生存率不足5%,在全球癌症死亡原因中位于第4位。对于无法切除的胰腺癌患者来说,其常规放化疗等综合治疗措施对肿瘤的治疗有效率不理想,微波治疗对于不能切除的实体肿瘤有着确切的疗效[3-4],但胰腺位置深在、与毗邻脏器关系密切,经皮穿刺治疗困难是其得不到应用的主要原因。胰腺体尾部较胰头部位毗邻关系相对简单,考虑应用微波治疗操作相关风险较低,我们首先筛选了2010年5月-2013年5月无法切除的体尾部胰腺癌在开腹手术过程中应用微波治疗肿瘤并作相应临床研究,探讨了此种技术的可行性及有效性。
1资料和方法
1.1一般资料本研究共纳入2010年5月- 2013年5月至本科就诊,选择经临床诊断为体尾部胰腺癌,经手术探查无法切除病变,或者已经确定无法切除病变但仍然需要手术干预解除胆道、消化道梗阻的患者共33例,其中男性13例,女性20例。术中行组织活检或者细针穿刺细胞学诊断[5],确诊为胰腺癌,随机分为A、B两组:A组为实验组,共17例,术中一并施行微波治疗;B组为对照组,共16例,术中不施行微波治疗。术后常规建议患者行放射治疗[6]。
1.2治疗方法开腹手术中,在完成常规探查确定病变无法切除,如有需要,行胆肠、胃肠吻合术后,行肿瘤组织活检病理检查或者以8个5ml细针穿刺抽吸胰腺病变行细胞学检查,明确胰腺癌诊断。A组患者常规行微波治疗,方法为以ECO-100A型冷循环微波刀(南京亿高微波系统工程有限公司)直视下穿刺肿瘤,结合术前CT及术中彩超确定穿刺位置与深度,调节功率为50 W,均为15分钟。B组患者不行微波治疗。A、B两组患者均常规放置肿瘤旁腹腔引流管。
1.3术后观察指标
1.3.1术后并发症胰瘘根据国际胰瘘研究小组 (ISGPF)的定义[7],为胰腺手术后 3 d或 3 d以上,术中放置的腹腔引流管中引流液淀粉酶浓度大于正常血清淀粉酶标值的3倍上限,并按其定义将胰瘘根据临床症状、体征及辅助检查结果分为 A、B、C 3级。胆瘘、肠瘘及出血结合术后引流物观察确定。
1.3.2疼痛及生活质量评价疼痛强度(PI)采用0~10疼痛数字评分法(NRS)记录,0为无痛,10为剧烈疼痛,1~3为轻度疼痛,4~6为中度疼痛,7~10重度疼痛。由患者记录,记录时间为微波治疗前和治疗后1个月、2个月和3个月[8]。疗效评定:止痛药物剂量不变的情况下,按NRS评分法与治疗前相比,完全缓解(CR):完全无痛,NRS评分减少到0分;部分缓解(PR):疼痛较前明显减轻,NRS评分减少1/2以上;轻度缓解(MR):疼痛较治疗前减轻,但仍有明显疼痛,NRS评分减少于1/2;无效(NR):疼痛与治疗前比无减轻,NRS评分无减少。有效率=(完全缓解例数+部分缓解例数)×100%/总治疗例数。生活质量(KPS)评分:采用国际抗癌联盟(UICC)Karnofsky评分 (KPS,百分法)。分别观察和记录患者治疗前和治疗后1个月、2个月、3个月的KPS评分。记录受试者生活质量改善与微波治疗的相关性。出院标准:手术切口愈合,体温正常,拔除引流管后无不适,进食情况好,大小便正常。
1.3.3生存期电话回访生存时间,生存期计算主要起点时间为开始治疗时间,主要终点时间为死亡时间,次要终点时间为回访结束时间,末次回访时间为2015年1月1日。
2结果
2.1围手术期情况分析全组术前共有13例患者存在各种危险因素,术后有2例患者出现并发症。术后住院天数12~22天,平均16.5天。两组患者在年龄、性别、术前危险因素、术中情况、术后并发症以及术后住院天数等各项数据均无统计学差异,相关术后胰瘘等并发症无统计学差异。见表1。
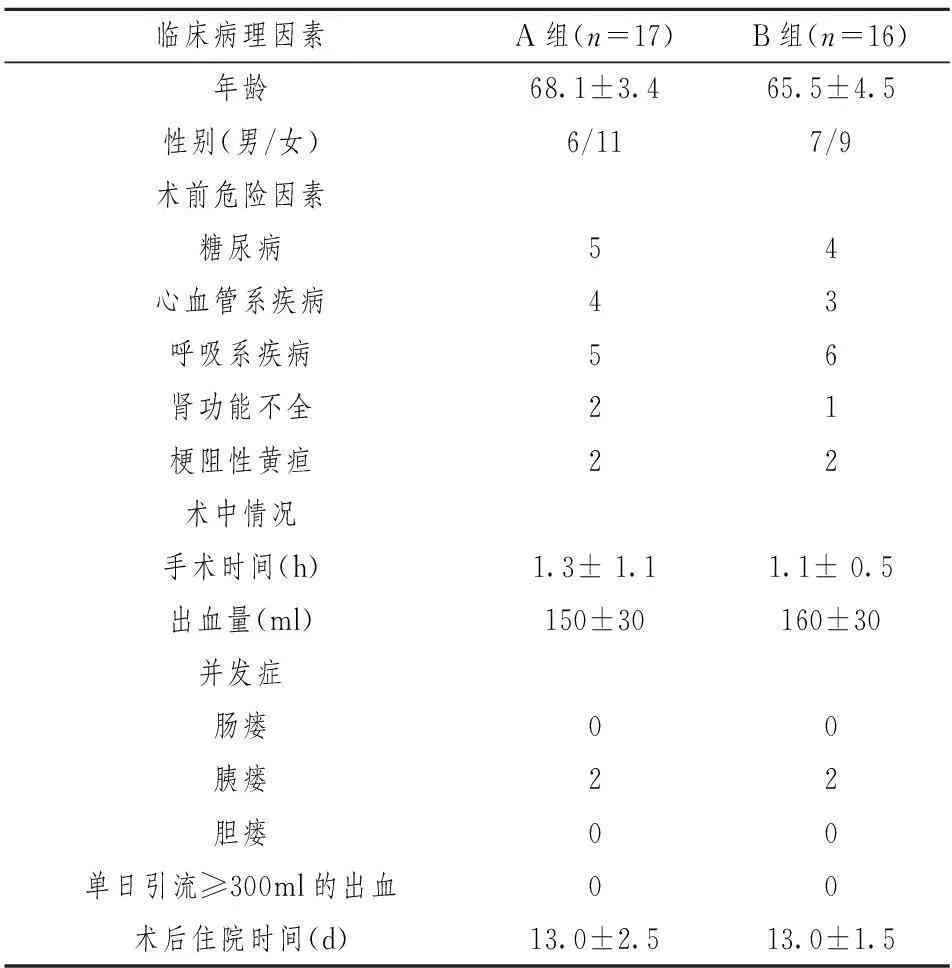
表1 两组患者围手术期情况的比较
2.2疼痛缓解情况疼痛缓解率:观察组及对照组术后1个月分别为58.8%(10/17)、37.5%(6/16),术后2个月分别为52.9%(9/17)、37.5%(6/16),术后3个月分别为52.9%(9/17)、25.0%(4/16)。术后各时间观察组疼痛缓解率均高于对照组(P均<0.05)。KPS评分:术后1个月观察组及对照组>80分者分别为11例(64.7%)、10例(62.5%),术后2个月分别为12例(70.5%)、9例(56.2%),术后3个月分别为14例(82.3%)8例(50.0%)例。观察组术后各时间KPS评分>80分者均多于对照组(P均<0.05)。
2.3生存期术后9个月和12个月后A组患者生存率较B组高,有统计学差异(P<0.05),见表2。
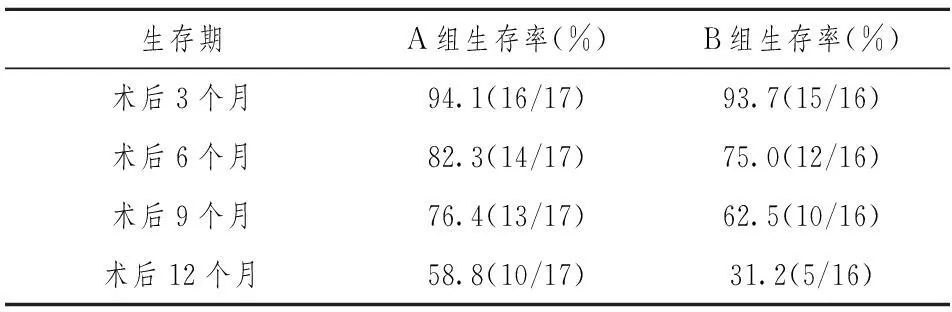
表2 A组和B组患者治疗后生存率比较
3讨论
3.1胰腺治疗现状胰腺癌是恶性消化道肿瘤中恶性程度最高的肿瘤之一,因其生长部位隐蔽、起病隐匿、病情进展快,临床上以中晚期病例为主,手术切除率低,预后较差,大多数患者临床确诊时已经失去根治性切除的机会,其根治性手术切除率仅为20%左右,2年总体生存率不足20%,5年生存率不足5%。对于无法根治性切除的胰腺癌患者来说,放、化疗结合的综合治疗是目前常用的姑息治疗手段,但结合综合报道来看,与其他消化道肿瘤来说,其效果不尽理想。
胰腺癌患者常见的首发症状主要为黄疸、疼痛、消瘦及消化道梗阻等情况,对于没有远处转移的胰腺癌患者,相当一部分需要开腹手术探查,以明确是否可以切除,即使确定无法切除的患者,由于胆系梗阻、消化道梗阻[9]等情况,也常需要开腹手术干预。
3.2无法切除的体尾部胰腺癌术中微波治疗的可行性、安全性微波治疗是一种局部的物理治疗,在以肝癌为代表的实体肿瘤治疗中取得了很好的疗效。但胰腺癌位置隐匿、深在,与周围重要血管、胆管及十二指肠关系密切,常规经皮穿刺治疗风险极大,因此,结合局部晚期胰腺癌开腹手术干预几率高的情况,我们探索了在术中直视下直接穿刺胰腺癌行微波治疗的方式,结合术前CT评估、术中彩超定位,术中给予胰腺癌微波凝固治疗,由于局部晚期胰腺癌外侵明显,对胰腺周围毗邻血管、胆管及十二指肠的顾忌,本研究均采用单针,低剂量,凝固边界均未超出肿瘤边界,加之微波有选择加热的特性,我们在术中以超声随时观察凝固边界,本研究34例均未出现大出血及肠瘘、胆瘘的情况。但考虑到血管的热流空效应及正常组织的散热性高于肿瘤组织原理,结合冷循环微波治疗仪微波固化过程中对固化周边组织的降温保护作用,应可以多针穿刺并延长治疗时间,下一步我们会做此方面的尝试与研究。
胰腺癌微波治疗最大的风险为胰瘘,本研究实验组17例行微波治疗患者,有2例经引流物检测证实为胰瘘,但均属低流量、生化型胰瘘,经短期保守治疗后均痊愈,未发生腹腔大出血、感染等并发症。对照组发生胰瘘2例,亦属于低流量、生化型胰瘘,经短期保守治疗后痊愈,考虑与组织活检病理及细针穿刺细胞学诊断相关。
3.3胰腺癌术中微波治疗的临床意义目前对于无法切除的胰腺癌患者治疗目标的共识为延长生命,改善症状,提高生存质量[10],本研究通过对比A,B两组患者术后NRS及KPS评分变化的情况,认为术中增加微波治疗可以有效改善患者术后的生存质量。本研究术后生存期的比较结果,表明微波治疗可以提高无法切除的体尾部胰腺癌患者的生存期,证实了此治疗手段的有效性,但同时考虑到我们所做病例例数相对较少,可扩大例数作进一步研究。
综上所述,对于无法切除的体尾部胰腺癌需行手术干预者,在完成相关手术处置后,在直视下行微波治疗,围术期并不增加出血、胰瘘、胆瘘等相关风险,术后可以延长生存期,且患者的生存质量有明显的改善,有良好的可操作性、安全性、有效性,为无法切除的体尾部胰腺癌患者的综合治疗提供了新的选择,下一步,我们会将此治疗谨慎的扩展至局部晚期的胰头癌的患者。
参考文献:
[1]顾凯,吴春晓,鲍萍萍,等.上海市胰腺癌流行现况、回顾与比较分析[J].外科理论与实践, 2009,14(5):510-515.
[2]Ozaka M, Matsumura Y, Ishii H, et al. Randomized phase II study of gemcitabine and S-1 combination versus gemcitabine alone in the treatment of unresectable advanced pancreatic cancer (Japan Clinical Cancer Research Organization PC-01 study)[J].Cancer Chemother Pharmacol, 2012, 69(5): 1197-1204.
[3]Seki T, Wakabayashi M, Nakagawa T, et al. Ultrasonically guided percutaneous microwave coagulation therapy for small hepatocellular carcinoma [J]. Cancer, 1994, 74(3):817-825.
[4]Dong BW, Zhang J, Liang P, et al. Sequential pathological and immuno-logic analysis of percutaneous microwave coagulation therapy of hepatocellular carcinoma [J]. Int J Hyperthermia, 2003,19(2):119-133.
[5]胡伟国,袁祖荣,施新民,等.术中细针穿刺细胞学检查在诊断胰腺肿瘤中的价值[J].临床外科杂志, 2004, 6: 22-24.
[6]Valentini V, Calvo F, Reni M, et al. Intra-operative radiotherapy (IORT) in pancreatic cancer joint analysis of the ISIORT-Europe experience [J]. Radiother Oncol, 2009, 91:54-59.
[7]Bassi C, Dervenis C, Butturini G, et al. Postoperative pancreatic fistula: an international study group (ISGPF) definition [J]. Surgery, 2005, 138(1): 8-13.
[8]邢迎清,方贵龙.胰腺癌的物理治疗现状[J].临床医学杂志, 2013, 33(1):103-106.
[9]郑树国,何振平,董家鸿,等. 307例胰腺癌的外科治疗体会[J].中华肝胆外科杂志, 2002, 8:539.
[10]王成锋,赵平,单毅,等. 5-氟尿嘧啶缓释剂植入治疗局部进展期胰腺癌[J].中华肿瘤杂志, 2010,32(9):706-708.
(收稿日期2015-11-18)
doi:10.3969/j.issn.1004-7115.2016.03.026
中图分类号:R735.9
文献标识码:B
文章编号:1004-7115(2016)03-0310-03
*作者简介:李龙(1982-),男,山东泰安人,主治医师,本科,主要从事肿瘤外科工作。

