超低频经颅磁刺激联合米氮平治疗阿尔茨海默病伴发抑郁症状的疗效观察
李 沫,高茂龙,吕继辉,郝智慧,李文杰,母海艳
超低频经颅磁刺激联合米氮平治疗阿尔茨海默病伴发抑郁症状的疗效观察
李 沫1*,高茂龙2,吕继辉1,郝智慧1,李文杰1,母海艳1
(北京老年医院:1精神心理二科,2老年病临床与康复研究所,北京 100095)
探讨超低频经颅磁刺激(TMS)治疗阿尔茨海默病(AD)伴发抑郁症状的疗效及安全性。采用单盲随机对照研究,收集2014年8月至2015年8月在北京老年医院住院的伴有抑郁症状的AD患者47例,随机分为研究组(23例)和对照组(24例),研究组给予超低频TMS联合米氮平治疗,对照组给予伪刺激联合米氮平治疗,两组分别于治疗前、治疗第2周末和治疗第4周末采用老年抑郁量表(GDS)评估抑郁症状,以总有效率评定对抑郁症状的治疗效果。治疗2周末研究组GDS评分较对照组明显下降 [(13.43±2.57)(16.08±3.96)],差异有统计学意义(<0.05);治疗4周末两组GDS评分[(9.48±3.11)(9.67±3.95)],差异无统计学意义(>0.05)。疗效评估表明,治疗2周末研究组治疗总有效率高于对照组(60.87%29.17%),差异有统计学意义(2=4.776,=0.029);治疗4周末疗效差异无统计学意义(2=3.297,=0.348)。超低频TMS联合米氮平治疗比单纯米氮平治疗起效时间更早,早期疗效更好。
抑郁;阿尔茨海默病;经颅磁刺激;老年人
抑郁症状是阿尔茨海默病(Alzheimer’s disease,AD)的常见并发症,近年来据报道其发生率约为30%~80%[1−3]。由于抑郁症状可进一步加重认知功能损害,对患者的生活质量及认知功能恢复均造成严重影响,因此对AD患者危害很大。目前AD尚无法根治,但抑郁症状是可治疗的,因此积极干预AD患者伴发的抑郁症状,可减轻由于抑郁引起的相关损害,有助于改善AD患者临床症状、提高生活质量。经颅磁刺激(transcranial magnetic stimulation,TMS)治疗作为一种无创性物理疗法,在美国已被食品药品管理局(FDA)批准并应用于抑郁障碍的临床治疗。相关研究亦表明,TMS治疗能显著缓解抑郁情绪,并对执行功能及记忆功能具有促进作用[4,5]。然而TMS在AD伴发抑郁症状领域应用很少。本研究旨在探讨将TMS作为辅助治疗,联合米氮平治疗AD患者伴发抑郁症状的疗效及安全性。
1 对象与方法
1.1 研究对象
选取2014年8月至2015年8月在北京老年医院住院的伴有抑郁症状的AD患者。纳入标准:(1)符合美国国立神经疾病、语言交流障碍和卒中研究所−阿尔茨海默病及相关疾病学会可能或很可能阿尔茨海默病诊断标准;(2)抑郁症状采用老年抑郁量表(geriatric depression scale,GDS)筛查,总分≥10分作为具有抑郁症状的标准;(3)获得本人或监护人的知情同意。排除标准:(1)有TMS治疗禁忌证者;(2)有癫痫发作史,或严重躯体疾病者;(3)体内有金属植入物或心脏起搏器者;(4)在诊断为AD前曾有明确情感障碍病史者;(5)其他不适合TMS治疗或不能完成测量者。
共收集符合入组标准的伴有抑郁症状的AD患者47例,以入组时间为序,按随机数字表法分为研究组(23例)和对照组(24例)。
1.2 研究方法
采用单盲随机对照设计,由研究设计者将受试者随机分为研究组和对照组,其他研究参与者均不知晓分组情况。
1.2.1 药物治疗 入院后所有患者均根据需要予常规的促智药物[盐酸美金刚(memantine hydrochloride)、盐酸多奈哌齐(donepezil hydrochloride)等]治疗,同时辅以抗抑郁药物米氮平(mirtazapine;瑞美隆,N.V.Organon公司生产,规格30mg/片)治疗,起始剂量7.5mg/d,以后视病情加量,最大加至22.5mg/d。
1.2.2 经颅磁刺激 治疗使用KF-10超低频经颅磁刺激仪(中国深圳市康立高科技有限公司生产),圆形刺激线圈。研究组患者采用抗抑郁模式进行治疗,即刺激强度为500Gs,刺激频率为11mHz,持续时间30min,5次/周,治疗4周,共计进行20次。对照组采取与研究组同样的操作,但是在断开电源,即不产生磁场的状态下进行。
1.2.3 疗效评估 由2名经过培训的精神心理科主治医师应用GDS评估患者抑郁症状。该量表共有30个条目,总分30分,≥10分提示存在抑郁症状,得分越高,症状越严重[6]。2名评定者经过培训进行一致性检验,组内相关系数(intraclass correlation,ICC)值为0.82。评估过程采用盲法,分别于治疗前、治疗第2及第4周末3个时间点进行评估。以总有效率评定疗效,GDS总分减分率≥75%为临床痊愈,50%~74%为显效,26%~49%为进步,≤25%为无效。减分率=(治疗前总分−治疗后总分)/治疗前总分×100%,总有效率为临床痊愈、显效、进步之和。
1.2.4 安全性评估 由TMS师记录治疗过程中患者发生的不良事件,检测心率及血压的变化,并在治疗前、治疗第2及第4周末检测血常规、血生化、心电图、脑电图等。
1.3 统计学处理
采用SPSS13.0软件对数据进行统计学分析。计量资料采用均数±标准差表示,两组治疗前后不同时间点GDS评分的比较采用重复测量的方差分析,两组数据组间比较采用独立样本检验;计数资料采用百分率表示,两组疗效的比较采用2检验。以<0.05为差异有统计学意义。
2 结 果
2.1 两组患者一般资料比较
研究组共23例,其中男9例,女14例,年龄67~84(79.00±4.74)岁,受教育年限6~12(8.22±2.07)年,病程12~66(42.74±16.41)个月。对照组共24例,其中男8例,女16例,年龄61~87(77.67±1.35)岁,受教育年限3~15(8.50±3.39)年,病程19~76(50.83±14.83)个月。两组患者性别构成(2=0.171,=0.679)、年龄(=0.791,=0.433)、受教育年限(=0.343,=0.733)、病程(=1.775,=0.083)的差异均无统计学意义。
米氮平用药情况:对照组平均剂量(20.00±7.22)mg/d,研究组平均剂量(19.57±7.06)mg/d,共治疗4周,两组米氮平药物剂量差异无统计学意义(=0.533,>0.05)。
2.2 两组患者治疗前后GDS评分比较
首先,经重复测量的方差分析得出,研究组和对照组的分组主效应(=1.750,=0.193)差异无统计学意义,而时间主效应(=227.012,=0.000)、分组×时间的交互效应(=3.862,=0.025)差异均具有统计学意义。进而,经独立样本检验得出,治疗前两组GDS评分差异无统计学意义(=0.862,=0.393);治疗2周末两组GDS评分差异有统计学意义(=2.676,=0.011),治疗4周末两组GDS评分差异无统计学意义(=0.058,=0.954;表1)。
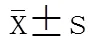
表1 两组治疗前后GDS评分比较
GDS: Geriatric Depression Scale. Compared with the control group,*<0.05
2.3 两组患者疗效比较
治疗第2周末,研究组治愈0例,显效1例,进步13例,无效9例,总有效率60.87%;对照组治愈0例,显效0例,进步7例,无效17例,总有效率29.17%,两组疗效差异有统计学意义(2=4.776,=0.029)。治疗第4周末,研究组治愈2例,显效14例,进步4例,无效3例,总有效率86.97%;对照组治愈0例,显效14例,进步6例,无效4例,总有效率83.33%,两组疗效差异无统计学意义(2=3.297,=0.348)。
2.4 两组患者治疗安全性比较
两组患者在治疗过程中未出现严重的不良事件,无癫痫发作。研究组2例在治疗过程中出现便秘,3例出现嗜睡;对照组4例出现便秘,2例出现嗜睡,1例出现轻度恶心,余未见明显不良反应。两组不良反应发生率差异无统计学意义(2=0.341,=0.559)。
3 讨 论
TMS主要通过影响情绪调节回路,降低下丘脑−垂体−肾上腺轴敏感性等作用达到治疗抑郁的目的[7]。由于TMS具有无痛、无创、安全等优势,近年来在抑郁障碍的治疗中逐渐受到重视,但在AD伴抑郁症状方面的治疗应用很少。目前,AD伴发抑郁症状的发病机制尚未完全明确,临床上大多使用抗抑郁药物来改善AD患者的抑郁症状。
本研究中将TMS作为一种辅助治疗手段,联合去甲肾上腺素(noradrenalin,NE)、5−羟色胺(5-hydroxytryptamine,5-HT)双通道受体阻滞剂米氮平治疗AD伴随的抑郁症状。结果显示,超低频TMS联合米氮平治疗2周末GDS评分降低幅度更为明显,治疗总有效率高于单一药物治疗的患者,临床症状得到改善。而在治疗4周末,超低频TMS联合米氮平治疗的总有效率与单纯米氮平治疗相比差异无统计学意义,这表明,超低频TMS联合米氮平治疗的起效时间更早,早期疗效更好。2006年,Garcia-Toro等[8]报道TMS作为辅助治疗对难治性抑郁症有明显的增效作用,国内亦有类似报道[9,10]。本研究则证实针对AD患者伴有的抑郁症状,TMS同样有效。有研究发现,TMS可以增强神经突触再生,促进NE及5-HT神经递质水平提高,加速有助于改善情绪的脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)分泌[11,12]。同时,TMS还可促进刺激白质修复生长[13],提高脑白质病变N−乙酰基天门冬氨酸(N-acetyl aspartate,NAA)的水平[14],而NAA是认知功能损害的一个重要标志物[15],超低频TMS联合米氮平治疗AD患者伴发的抑郁症状起效快、临床症状改善早,可能得益于上述作用机制。
另一方面,关于TMS治疗的安全性和耐受性亦备受关注。TMS治疗最常见的不良反应是头痛,一般为暂时性和一过性的,可自然减轻或服用止痛药物缓解。本研究中所有参与患者在接受超低频TMS治疗过程中均未出现严重不良反应,患者均能坚持每个疗程的治疗,提示TMS应用于AD伴发抑郁症状患者的治疗有很好的安全性和耐受性。
综上所述,超低频TMS联合米氮平治疗AD伴有的抑郁症状比单纯米氮平治疗起效时间更早,早期疗效更好,且具有较高的安全性和耐受性。本研究的不足之处在于样本量较小,研究周期相对较短,未观察超低频TMS的远期疗效,同时没有考虑到促智药物、躯体疾病、社会心理因素等对抑郁症状的影响,研究结果有待进一步验证。
[1] Rodrigues R, Petersen RB, Perry G. Parallels between major depressive disorder and Alzheimer’s disease: role of oxidative stress and genetic vulnerability[J]. Cell Mol Neurobiol, 2014, 34(7): 925−949.
[2] Rozzini L, Chilovi BV, Riva M,. Depressive disorders in dementia[J]. Int J Geriatr Psychiatry, 2011, 26(6): 657−658.
[3] Baquero M, Martín N. Depressive symptoms in neurodegenerative diseases[J]. World J Chin Cases, 2015, 3(8): 682−693.
[4] Berlim MT, van den Eynde F, Tover-Perdomo S,. Response, remission and drop-out rates following high-frequency repetitive transcranial magnetic stimulation (rTMS) for treating major depression: a systematic review and meta-analysis of randomized, double-blind and sham-controlled trials[J]. Psychol Med, 2014, 44(2): 225−239.
[5] Janicak PG, Dokucu ME. Transcranial magnetic stimulation for the treatment of major depression[J]. Neuropsychiatr Dis Treat, 2015, 11: 1549−1560.
[6] Wang XD, Wang XL, Ma H. The Handbook of Rating Scales of Mental Health (Revised Edition)[M]. Beijing: Press of Chinese Journal of Mental Health, 1999: 217−218. [汪向东, 王希林, 马 弘. 心理卫生评定量表手册(增订版)[M]. 北京: 中国心理卫生杂志社, 1999: 217−218. ]
[7] Wang M, Pan XP. Progress in the treatment of major depression disorder by repetitive transcranial magnetic stimulation[J]. Chin J Nerv Ment Dis, 2014, 40(9): 562−565. [王 梦, 潘小平. 重复经颅磁刺激治疗重性抑郁障碍的研究进展[J]. 中国神经精神疾病杂志, 2014, 40(9): 562−565. ]
[8] Garcia-Toro M, Salva J, Daumal J,. High (20Hz) and low (1Hz) frequency transcranial magnetic stimulation as adjuvant treatment in medication-resistant depression[J]. Psychiatry Res, 2006, 146(1): 53−57.
[9] Wang LN, Pan F, Li YF. Effects of low frequency repetitive transcranial magnetic stimulation on treatment-resistant depression and cognitive function[J]. Chin J Rehabil Med, 2013, 28(6): 544−548. [王丽娜, 潘 飞, 李玉凤. 低频重复经颅磁刺激对难治性抑郁症的疗效及认知功能的影响[J]. 中国康复医学杂志, 2013, 28(6): 544−548.]
[10] Zhang J, Cui M, Wu YH,. The effect of low frequency repetitive transcranial magnetic stimulation combined with duloxetine in treatment of depressive disorder[J]. Chin J Nerv Ment Dis, 2015, 41(5): 288−292. [张 俊, 崔 明, 吴延海, 等. 低频重复经颅磁刺激联合度洛西汀治疗抑郁障碍[J]. 中国神经精神疾病杂志, 2015, 41(5): 288−292.]
[11] Xu JL, Xu XX, Cai Q,. Effects of gamma aminobutyric acid and dopamine characteristic repetitive ultra-low frequency transcranial magnetic stimulations on rats’ neurotransmitter power[J]. Chin J Rehabil Med, 2010, 25(2): 127−130. [徐建兰, 徐晓雪, 蔡 青, 等. 连续多次γ−氨基丁酸和多巴胺特征重复超低频经颅磁刺激对大鼠脑内神经递质功率的影响[J]. 中国康复医学杂志, 2010, 25(2): 127−130.]
[12] Price RB, Shungu DC, Mao X,. Amino acid neurotransmitters assessed by 1H MRS: relationship to treatment resistance in major depressive disorder[J]. Biol Psychiatry, 2009, 65(9): 792−800.
[13] Kozel FA, Johnson KA, Nahas Z,. Fractional anisotropy changes after several weeks of daily left high-frequency repetitive transcranial magnetic stimulation of the prefrontal cortex to treat major depression[J]. J ECT, 201l, 27(1): 5−10.
[14] Fregni F, Potvin K, Dasilva D,. Clinical effects and brain metabolic correlates in non-invasive cortical neuromodulation for visceral pain[J]. Eur J Pain, 2011, 15(1): 53−60.
[15] Gan JL, Tian XL, Duan HF,. Proton magnetic resonance spectroscopy study on prefrontal lobe and hippocampus in depression[J]. Chin J Behav Med Brain Sci, 2012, 21(10): 919−921. [甘景梨, 田秀丽, 段惠峰, 等. 抑郁症患者前额叶海马质子波谱研究[J]. 中华行为医学与脑科学杂志, 2012, 21(10): 919−921.]
(编辑: 周宇红)
Efficiency of infra-low-frequency transcranial magnetic stimulation combined with mirtazapine on depressive symptoms in patients with Alzheimer’s disease
LI Mo1*, GAO Mao-Long2, LYU Ji-Hui1, HAO Zhi-Hui1, LI Wen-Jie1, MU Hai-Yan1
(1Second Department of Psychiatry,2Institute of Geriatric Clinic and Rehabilitation Medicine, Beijing Geriatric Hospital, Beijing 100095, China)
To investigate the efficiency and safety of infra-low-frequency transcranial magnetic stimulation (TMS) in the treatment of depressive symptoms in Alzheimer’s disease (AD) patients.A randomized, controlled and single-blinded trial was conducted on 47 AD patients with depressive symptoms admitted in our hospital from August 2014 to August 2015. The patients were randomly divided into the treatment group (=23) and the control group (=24). The patients of the former group was treated by mirtazapine combined with infra-low-frequency TMS for 4 weeks, while those of the latter group received sham infra-low-frequency TMS and mirtazapine treatment. The geriatric depression scale (GDS) was used to assess the depressive symptoms before, and after 2 and 4 weeks treatment to evaluate the curative effect by the total efficacy.After 2 weeks’ treatment, GDS score was significantly lower in the treatment group than in the control group [(13.43±2.57)(16.08±3.96),<0.05], but there was no significant difference in the score between the 2 groups [(9.48±3.11)(9.67±3.95),>0.05] in 4 weeks. There existed significant difference in the total efficacy between the 2 groups after 2 weeks’ treatment (square=4.776,=0.029), but no difference after 4 weeks (square=3.297,=0.348).Infra-low-frequency TMS combined with mirtazapine has a shorter onset time and better short-term efficacy than medication alone in the treatment of depressive symptoms in AD patients.
depression; Alzheimer’s disease; transcranial magnetic stimulation; aged
R592; R745.7; R749.42
A
10.11915/j.issn.1671-5403.2016.02.032
2015−10−09;
2015−11−25
李 沫, E-mail: limo333@163.com

