青霉素对土壤微生物群落结构的影响
刘 燕,张振华,鲍王波,余 冉①,王长永②
(1.环境保护部南京环境科学研究所,江苏 南京 210042;2.东南大学能源与环境学院,江苏 南京 210096)
青霉素对土壤微生物群落结构的影响
刘燕1,张振华2,鲍王波2,余冉2①,王长永1②
(1.环境保护部南京环境科学研究所,江苏 南京210042;2.东南大学能源与环境学院,江苏 南京210096)
摘要:利用Biolog-ECO技术分析不同青霉素浓度处理下土壤微生物的群落代谢活性及结构多样性,利用变性梯度凝胶电泳 (denaturing gradient gel electrophoresis, DGGE)技术分析典型微生物群落结构变化情况,探讨青霉素对土壤微生物群落的生态毒理效应。主成分分析(PCA)结果表明,高浓度青霉素(400和800 mg·kg(-1))处理能快速诱导土壤中以酚酸类化合物为碳源的微生物菌群富集。DGGE结果显示,在高浓度青霉素(800 mg·kg(-1))胁迫初期,土壤中微生物多样性指数(Shannon-Wiener index)显著降低(P<0.05);7 d后,主要微生物群落结构随土壤中青霉素降解又逐渐恢复。
关键词:青霉素;微生物多样性;BiologEcoplates(TM);PCR-DGGE
抗生素生产过程中产生的菌渣和废水已成为重大环境污染问题之一[1]。抗生素菌渣与废水的不合理处置会导致大量抗生素及其降解产物进入土壤中,直接影响土壤微生物的组成,并且土壤中残留抗生素在迁移、降解、转化等复杂的生物及物理化学过程中亦可影响土壤微生物数量和群落结构,从而影响土壤生态系统。
关于土壤中残留抗生素对土壤微生物的影响在国内外均有研究[2-6]。谢显传等[7]的研究表明1~10 mg·kg-1阿维菌素对土壤微生物活性无明显影响,而50~100 mg·kg-1阿维菌素对土壤微生物活性有显著抑制作用;刁晓平等[5]研究发现安普菌素对土壤细菌生长有明显抑制作用。ZIELEZNY等[3]研究了金霉素对土壤微生物群落结构及呼吸强度的毒性效应。然而,这些研究主要集中在磺胺类、四环素类等大宗类兽药抗生素残留对土壤微生物多样性及群落结构的影响上,而青霉素的相关研究还鲜见报道。
变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)技术能较灵敏地分辨土壤中优势菌群的多样性变化而被广泛应用于抗生素对土壤微生物群落多样性影响的分析上[8]。魏松林[9]应用DGGE法比较了长期施用含抗生素牛粪的土壤与未施用牛粪土壤的细菌群落多样性;WESTERGAARD等[10]用DGGE法分析了泰乐素对土壤微生物多样性的影响。将Biolog-ECO法应用于土壤微生物群体代谢的动力学特征研究,以评价微生物群落的功能多样性[11]。刘文娜[12]采用Biolog-ECO法分析了土霉素对土壤微生物多样性的影响,发现添加土霉素能刺激土壤微生物对碳源底物的利用;唐非凡[13]的研究结果则表明经金霉素处理后土壤微生物的AWCD值、Simpson、Shannon和McIntosh指数均显著低于对照组。
目前,国内抗生素生产领域中青霉素最多,年产量超过4万t,青霉素菌渣的不合理处置会导致土壤污染,开展青霉素对土壤微生物多样性影响的研究具有重要意义。笔者采用Biolog-ECO及DGGE技术分析青霉素对土壤微生物功能多样性及群落结构的变化,旨在初步揭示土壤中青霉素对微生物的潜在生态毒性,为青霉素菌渣的环境风险评价与安全处置提供理论依据。
1研究方法
1.1试验仪器及试剂
高速离心机(Eppendorf AG,22331 Hamburg,Germany);研磨机(RetschM400,Germany);PCR仪(Varity 96-wellApplied Biosystems,USA);核酸定量仪(Thermo NanoDrop 1000,USA);全自动微生物鉴定分型系统(Biology Omnilag plus,USA);Dcode突变检测DGGE系统(BIO-RAD,USA);高效液相色谱仪(Waters 2695,USA)。
土壤DNA提取试剂盒(MP Biomedicals,USA); PCR缓冲溶液、dNTP Mix、MgCl2和Taq酶(均购自大连Takara公司);青霉素钠标准品(纯度w>98%,Sigma,USA);甲醇、乙腈(色谱纯,Merck,Germany); Oasis HLB柱(6 mL/200 mg,Waters,USA)。
1.2试验设计
准确称取供试土壤(选自江苏省南京市横溪镇农田土)200 g共5份,参考环境中残留浓度(2 mg·kg-1),在此基础上设置空白组(0 mg·kg-1)、模拟青霉素累积浓度(20 mg·kg-1)、胁迫浓度(200 mg·kg-1)、重度胁迫浓度(400 mg·kg-1)及菌渣中残留的青霉素浓度(800 mg·kg-1),与土样充分搅拌混匀,添加适量超纯水,使土壤含水量w为最大持水量的50%[6],将处理后的土样置于大烧杯中,用保鲜膜盖住烧杯口并在保鲜膜上扎小孔以保持空气流通。25 ℃条件下在恒温恒湿培养箱中培养,分别在0、1、3、5、7、14 d采集土壤样品20 g,取10 g新鲜土样用于Biolog分析,10 g冻存备用。
1.3土壤中青霉素残留检测
准确称取土壤样品1 g于15 mL离心管中,加入提取液(超纯水)5 mL,涡旋1~2 min充分混匀后,20 ℃超声40 min,4 ℃条件下按4 000 r·min-1离心15 min(离心半径为7.7 cm),上清液转移到干净的离心管中净化处理后上机检测。分析方法参考张振华等[14]的研究方法。每个处理组设3次重复,每个重复设3个平行。
1.4Biolog分析
称取10 g新鲜土样,加入90 mLw为0.85%的NaCl溶液,置于摇床以200 r·min-1振摇30 min,静置5 min,取上清液2 mL置于100 mL灭菌三角瓶中,加入18 mL无菌水,重复稀释2次,制得1∶100的稀释液,以每孔150 μL稀释液加入微孔板中,30 ℃ 恒温培养。分别在培养0、1、2、3、4、5、6、7 d后测定波长在590 nm下的吸收值。检测培养168 h后土壤微生物对6类碳的平均利用率[15],并进行主成分分析(PCA)。
采用Microsoft Excel 2007和SPSS 19.0软件分析数据,采用Canoco for Windows 4.5软件进行PCA分析。
1.5PCR-DGGE分析
以土壤DNA为模板,用V3可变区通用引物341F(5′-G ̄C ̄C G ̄C ̄C C ̄G ̄C G ̄C ̄G C ̄G ̄G C ̄G ̄G G ̄C ̄G G ̄G ̄G C ̄G ̄G G ̄G ̄G C ̄A ̄C G ̄G ̄G G ̄G ̄G C ̄C ̄T A ̄C ̄G G ̄A ̄G G ̄C ̄A G ̄C ̄A G-3′)和518R (5′-A ̄T ̄T A ̄C ̄C G ̄C ̄G C ̄G ̄T G ̄C ̄T G ̄G-3′)。PCR-DGGE方法参考WATANABE等[16]的研究方法。切取DGGE图谱上特异性条带回收后进行克隆测序分析。
DGGE图谱使用Quantity one软件分析,计算每个条带的丰度值和条带数(S),并由此计算每条泳道的Shannon指数(H′)[17]及均匀度(E)[18]。
H′=-∑Pi×lnPi,
(1)
E=H′/lnS,
(2)
Pi=ni/N。
(3)
式(1)~(3)中,Pi为第i个种占总数的比例,%;ni为第i个条带丰度值;N为第i个条带的泳道上所有条带丰度之和。
2结果与讨论
2.1土壤中青霉素残留量
对土壤样品进行青霉素残留量分析(图1)。土壤经青霉素处理后立即采集样品检测,检出浓度接近于理论添加量,回收率均在90%左右;试验1 d时,青霉素添加量为0、2和20 mg·kg-1处理组青霉素残留量低于检测限,添加量为200、400和800 mg·kg-1处理组青霉素降解率均高达50%以上,3 d后所有处理组青霉素残留量均低于检测限。土壤中青霉素降解较快,这可能是因为青霉素的β-内酰胺环不稳定,对pH值、环境温度及β-内酰胺酶非常敏感[19-20]。同时,土壤中的微生物也是导致青霉素快速降解的一个重要因素[21]。

图1 各青霉素浓度处理组土壤中青霉素随时间的降解
2.2Biolog分析
图2为各处理组土壤微生物对6类碳源利用率的PCA分析。0 d时,其第1、2主成分分别可解释变量特征的51.2%和23.7%。碳源对PC1轴的方差贡献率:多聚物类为-0.939,羧酸类为-0.705,酚酸类为-0.600;PC2轴:酚酸类为-0.778,碳水化合物类为0.556,氨基酸类为0.530。1 d时,其第1、2主成分分别可解释变量特征的62.5%和31.5%。碳源对PC1轴的方差贡献率:多聚物类为-0.641,羧酸类为-0.645,酚酸类为-0.421;PC2轴:酚酸类为-0.618,碳水化合物类为0.421,氨基酸类为0.721。各处理组的空间分布分散,无显著差异。
3 d时,其第1、2主成分分别可解释变量特征的59.9%和26.5%。碳源对PC1轴的方差贡献率:酚酸类为0.989,氨基酸类为-0.716,碳水化合物类为-0.618;PC2轴:多聚物类为0.947,羧酸类为-0.427,碳水化合物类为-0.406。5 d时,其第1、2主成分分别可解释变量特征的58.5%和25.5%。碳源对PC1轴的方差贡献率:酚酸类为0.788,氨基酸类为-0.831,碳水化合物类为-0.588;PC2轴:多聚物类为0.747,羧酸类为-0.217,碳水化合物类为-0.676。在3和5 d时,400和800 mg·kg-1青霉素处理组均匀分布在图右侧,且各聚成一簇,均与酚酸类化合物呈显著正相关,说明这2组微生物群落对酚酸类化合物的利用率相对较高,其他处理组则分布在图的左侧,无显著差异。
7 d时,其第1、2主成分分别可解释变量特征的62.0%和20.1%,碳源对PC1轴的方差贡献率:多聚物类为0.918,酚酸类为-0.818,羧酸类为-0.095;PC2轴:酚酸类为-0.562,羧酸类为-0.492,多聚物类为-0.391。14 d时,其第1、2主成分分别可解释变量特征的59.5%和27.5%,碳源对PC1轴的方差贡献率:多聚物类为0.522,酚酸类为-0.521,羧酸类为-0.671;PC2轴:酚酸类为-0.441,羧酸类为-0.361,多聚物类为-0.678。7 d时,400和800 mg·kg-1青霉素处理组分布趋势与3 d时一致,均匀分布在图的左下侧,且各聚成一簇,与酚酸类化合物呈显著正相关。14 d时,各处理组空间分布分散,无显著差异,说明14 d时各处理组微生物多样性又趋于一致。
大部分抗生素都有其作用的靶标微生物,当土壤中其靶标菌群被抑制时,可能会诱导其抗性菌群以及能以其作为营养而利用的菌群富集,而对土壤微生物群落结构和功能产生影响。该研究结果表明,低浓度(2~200 mg·kg-1)青霉素处理组土壤微生物的代谢功能多样性并无显著改变;而400和800 mg·kg-1青霉素处理组土壤微生物菌群对碳源的利用则发生显著改变,以酚酸类化合物为碳源的微生物菌落被快速诱导、富集。
2.3DGGE分析
2.3.1DGGE图谱及微生物多样性
对0、3和7 d的土壤样品进行PCR-DGGE多样性指数及特异条带的16S rDNA测序分析。由图3可知,0 d时各处理组DGGE条带数差异较小,且条带分布均匀;3 d时,条带1在各个处理组均存在且为优势条带,条带2和3在0和2 mg·kg-1青霉素处理组为优势条带,而在其他处理组相对丰度较低;7 d时,各处理组微生物多样性逐渐恢复,但对照组条带4相对丰度较低。
表1表明,3 d时,800 mg·kg-1处理组Shannon指数比对照组显著降低(P<0.05),其他处理组较对照组也有一定程度降低,但无显著差异;7 d时,800 mg·kg-1处理组Shannon指数恢复到对照组水平。各泳道条带均匀度均在0.99左右,无显著差异。以上结果表明,在高浓度(800 mg·kg-1)青霉素胁迫初期,土壤微生物多样性显著降低,但随着青霉素在土壤中的快速降解,微生物多样性逐渐恢复到对照组水平。

图2 各青霉素浓度处理组对6类碳源利用率的主成分分析
2.3.2DGGE特异性条带的测序及分析
DGGE特异性条带测序比对结果表明,条带1与Burkholderialessp.、条带4与Sphingomonasroseiflava16S rDNA片段序列的同源性均为100%,且不受青霉素浓度及作用时间的影响。ZHANG等[22]的研究表明伯克氏菌属能以青霉素为单一碳源生长繁殖,是一种青霉素降解菌。COLQUHOUN等[23]则发现Sphingomonasroseiflava中携带编码β-内酰胺酶的青霉素抗性基因。条带2与Bacillusniabensis、条带3与Agromyceslapidis16S rDNA片段序列的同源性分别为100%和99%。土壤中条带2和3代表的优势菌株丰度随青霉素浓度的升高逐渐降低。据报道,这2种菌株对青霉素的最高耐受浓度分别为23[24]和10 mg·kg-1[25],可见它们能适应在低浓度青霉素环境介质中生存。

图3 各青霉素浓度处理组在0、3和7 d时土壤样品的DGGE图谱
表10、3和7 d时各青霉素浓度处理组土壤微生物多样性指数和均匀度
Table 1Functional diversity and evenness indices of soil microbial community on 0, 3 and 7 d relative to concentration of penicillin added
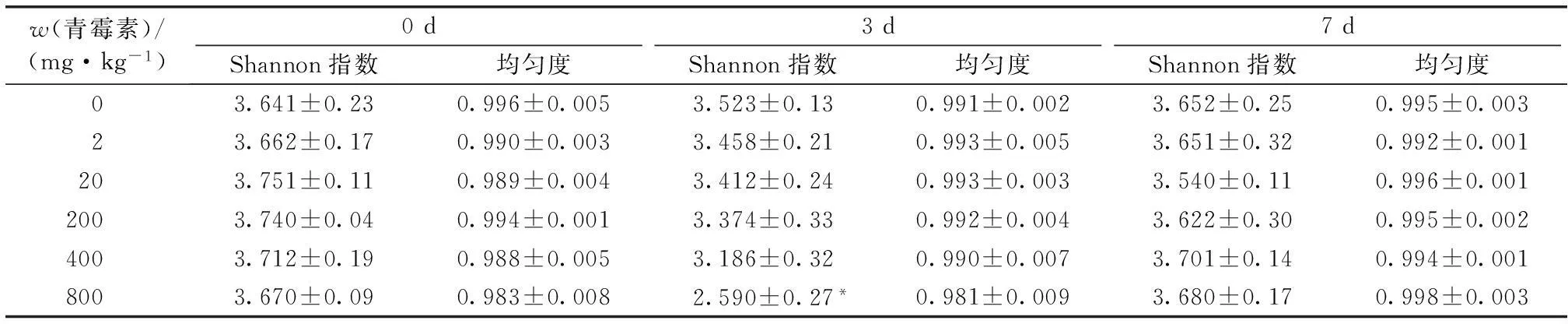
w(青霉素)/(mg·kg-1)0d3d7dShannon指数均匀度Shannon指数均匀度Shannon指数均匀度03.641±0.230.996±0.0053.523±0.130.991±0.0023.652±0.250.995±0.00323.662±0.170.990±0.0033.458±0.210.993±0.0053.651±0.320.992±0.001203.751±0.110.989±0.0043.412±0.240.993±0.0033.540±0.110.996±0.0012003.740±0.040.994±0.0013.374±0.330.992±0.0043.622±0.300.995±0.0024003.712±0.190.988±0.0053.186±0.320.990±0.0073.701±0.140.994±0.0018003.670±0.090.983±0.0082.590±0.27*0.981±0.0093.680±0.170.998±0.003
*表示与对照组差异显著(P<0.05)。
3结论
青霉素在土壤中降解较快,3 d后所有处理组青霉素残留量均低于检测限;高浓度青霉素能快速诱导土壤中以酚酸类化合物为碳源的微生物菌群富集;在高浓度(800 mg·kg-1)青霉素胁迫初期,土壤微生物多样性显著降低,但随着青霉素在土壤中的快速降解,微生物多样性水平逐渐恢复。
参考文献:
[1]李再兴,田宝阔,左剑恶.抗生素菌渣处理处置技术进展[J].环境工程,2014(30):72-75.
[2]THIELE-BRUHN S,BECK I.Effects of Sulfonamide and Tetracycline Antibiotics on Soil Microbial Activity and Microbial Biomass[J].Chemosphere,2005,59(4):457-465.
[3]ZIELEZNY Y,GROENEWEG J,VEREECKEN H,etal.Impact of Sulfadiazine and Chlorotetracycline on Soil Bacterial Community Structure and Respiratory Activity[J].Soil Biology & Biochemisty,2006,38(8):2372-2380.
[4]BOLEAS S,ALONSO C,PRO J,etal.Toxicity of the Antimicrobial Oxytetracycline to Soil Organisms in a Multi-Species-Soil System (MS Center Dot 3) and Influence of Manure Co-Addition[J].Journal of Hazardous Materials,2005,122(3):233-241.
[5]刁晓平,孙英健,孙振钧,等.安普霉素对不同土壤中微生物活动的影响[J].生态环境,2004,13(4):565-568.
[6]章明奎,刘兆云.猪粪和土霉素对不同肥力土壤微生物数量及活性的影响[J].应用生态学报,2009,20(11):2790-2798.
[7]谢显传,张少华,王冬生,等.阿维菌素对蔬菜地土壤微生物及土壤酶的生态毒理效应[J].土壤学报,2007,44(4):740-743.
[8]MUYZER G,DEWAAL E C,UITTERLINDEN A G.Profiling of Complex Microbial Populations by Denaturing Gradient Gel Electrophoresis Analysis of Polymerase Chain Reaction-Amplified Genes Coding for 16S rRNA[J].Applied Environmental Microbiology,1993,59(3):695-700.
[9]魏松林.抗生素污染土壤细菌生态学及其耐药性研究[D].扬州:扬州大学,2008.
[10]WESTERGAARD K,MÜLLER A K,CHRISTENSEN S,etal.Effects of Tylosin as a Disturbance on the Soil Microbial Community[J].Soil Biology and Biochemistry,2001,33(15):2061-2071.
[11]郑华,欧阳志云,方治国,等.BIOLOG在土壤微生物群落功能多样性研究中的应用[J].土壤学报,2004,41(3):456-461.
[12]刘文娜.兽用抗生素胁迫下农田土壤微生物效应研究[D].北京:中国科学院研究生院,2012.
[13]唐非凡.金霉素、磺胺嘧啶在土壤中的降解特征及其对土壤微生物的影响[D].杭州:浙江大学,2012.
[14]张振华,马珊珊,刘燕等.青霉素钠在土壤中的吸附和淋溶特性研究[J].生态与农村环境学报,2014,30(6):749-753.
[15]贾夏,董岁明,周春娟.微生物生态研究中Biolog Eco微平板培养时间对分析结果的影响[J].应用基础与工程科学学报,2013(1):10-19.
[16]WATANABE T,ASAKAWA S,NAKAMURA A,etal.DGGE Method for Analyzing 16S rDNA of Methanogenic Archaeal Community in Paddy Field Soil[J].FEMS Microbiology Letters,2004,232(2):153-163.
[17]YU Z,MORRISON M.Comparisons of Different Hypervariable Regions of Genes for Use in Fingerprinting of Microbial Communities by PCR-Denaturing Gradient Gel Electrophoresis[J].Applied and Environmental Microbiology,2004,70(8):4800-4806.
[18]PIELOU E C.An Introduction to Mathematical Ecology[M].New York,USA:Wiley Interscience,John Wiley & Sons,1969:105-107.
[19]HIRSCH R,TERNES T,HABERER K,etal.Occurrence of Antibiotics in the Aquatic Environment[J].Science of the Total Environment,1999,225(1/2):109-118.
[20]SACHER F,LANG F T,BRAUCH H J,etal.Pharmaceuticals in Groundwaters-Analytical Methods and Results of a Monitoring Program in Baden-Wurttemberg,Germany[J].Journal of Chromatography A,2001,938(1/2):199-210.
[21]BUSH K,JACOBY G A,MEDEIROS A A.A Functional Classification Scheme for Beta-Lactometersandits Correlation With Molecular-Structure[J].Antimicrobial Agents and Chemotherapy,1995,39(6):1211-1233.
[22]ZHANG Q,DICK W A.Growth of Soil Bacteria,on Penicillin and Neomycin,Not Previously Exposed to These Antibiotics[J].Science of the Total Environment,2014,493:445-453.
[23]COLQUHOUN D R,HARTMANN E M,HALDEN R U.Proteomic Profiling of the Dioxin-Degrading BacteriumSphungomonaswittichiiRW1[J].Journal of Biomedicine and Biotechnology,2012(3):408690.
[24]NITHYA C,PANDIAN S K.Isolation of Heterotrophic Bacteria From Palk Bay Sediments Showing Heavy Metal Tolerance and Antibiotic Production[J].Microbiological Research,2010,165(7):578-593.
[25]JURADO V.Agromycesitalicussp. nov.,Agromyceshumatussp. nov.andAgromyceslapidissp. nov. Isolated From Roman Catacombs[J].International Journal of Systematic and Evolutionary Microbiology,2005,55(2):871-875.
(责任编辑: 陈昕)
Effects of Penicillin on Soil Microbial Community Structure.
LIUYan1,ZHANGZhen-hua1,BAOWang-bo2,YURan2,WANGChang-yong1
(1.Nanjing Institute of Environmental Sciences, Ministry of Environmental Protection, Nanjing 210042, China;2.Department of Energy and Environment, Southeast University, Nanjing 210096, China)
Abstract:Effect of penicillin, varying in concentration, on metabolic activity and structural diversity of soil microbial community was analyzed with the Biolog-ECO technology, and changes in the soil microbial community structure were with the DGGE (denaturing gradient gel electrophoresis) technology, so as to explore eco-toxicological effect of penicillin on soil microbial community. PCA based on the BiologEcoplates(TM) shows that penicillin high in concentration (400-800 mg·kg(-1)) may induce rapid enrichment of microbial groups that use phenolic compounds as carbon source in the soil microbial community. PCR-DGGE analysis reveals that in the soil treated with a high dose(800 mg·kg(-1)) of penicillin, Shannon-Wiener diversity index was significantly lowered in the first days and gradual recovered 7 days later with the penicillin in the soil degrading.
Key words:penicillin;microbial diversity;BiologEcoplates(TM);PCR-DGGE
作者简介:刘燕(1977—),女,江苏南京人,副研究员,硕士,主要研究方向为生物安全与生物多样性保护。E-mail: liuyan@nies.org
DOI:10.11934/j.issn.1673-4831.2016.02.021
中图分类号:X51
文献标志码:A
文章编号:1673-4831(2016)02-0309-06
通信作者①E-mail: yuran@seu.edu.cn ②E-mail: wcy@nies.org
基金项目:环保公益性行业科研专项(201209024);国家自然科学基金青年基金(41401363);江苏省自然科学基金青年基金(BK20130102);公益性科研院所基本科研业务费项目
收稿日期:2015-06-26

