基于流式细胞特性的LNA和HNA细菌相关性研究
刘 杰,宋宇昊,马 芮,王莹莹(南开大学环境科学与工程学院,环境污染过程与基准教育部重点实验室,天津市城市生态环境修复与污染防治重点实验室,天津 300071)
基于流式细胞特性的LNA和HNA细菌相关性研究
刘杰,宋宇昊,马芮,王莹莹*(南开大学环境科学与工程学院,环境污染过程与基准教育部重点实验室,天津市城市生态环境修复与污染防治重点实验室,天津 300071)
摘要:采用流式细胞技术分析了7种不同陆地环境介质中LNA和HNA细菌的浓度变化及流式细胞特性特征.结果显示,在水体和土壤等环境中都存在LNA和HNA细菌的分类,其中,土壤环境中LNA细菌浓度(107~108cells/g数量级)高于水环境中浓度(105~106cells/mL数量级),但其相对比重(29.80%~33.94%)低于水环境(除地下水外,21.60%)中LNA细菌(42.25%~65.92%),主成分分析(PCA)显示水体和土壤环境介质中LNA和HNA流式细胞参数具有明显差异;相关分析表明,LNA与HNA细菌的流式细胞参数(绿色荧光信号FL1和侧向散色信号SSC)之间具有显著相关性(FL1:R2=0.711, P<0.01, SSC:R2=0.762, P<0.01),在不同生态系统中SSC变异大于FL1变异.结果表明,LNA和HNA细菌之间既不是各自对应的某一特殊生理阶段细菌,也不是两个完全相互独立的细菌群体,而是具有特殊共变关系的细菌.
关键词:陆地生态;流式细胞技术(FCM);低核酸含量(LNA)细菌;高核酸含量(HNA)细菌;DNA;荧光染色
∗ 责任作者, 教授, wangyy@nankai.edu.cn
近年来以DNA荧光染色技术为基础、不依赖于培养的流式细胞技术(FCM)在水环境微生物研究领域得到了广泛应用[1-3],微生物被荧光染色后,在流式细胞仪FCM中,细菌被明显分为低核酸含量(LNA)细菌和高核酸含量(HNA)细菌两大类[4-7].这种依据DNA含量高低来进行的分类是一种流式细胞仪所特有现象,它通过DNA染色后的荧光密度和侧向角散色信号来进行区分,其中荧光密度信号(FL1)表示细菌细胞DNA含量,侧向散射角信号(SSC)表示细胞大小,此种分类现象不受其DNA核酸染料类型、实验技术操作等影响,仅仅取决于细菌的群落结构、细胞特性以及环境梯度[5],这种基于仪器方法的细胞分类迄今来没有在其他方法中观察到,但是仍被许多学者所引用[8].
关于LNA细菌是否具有生物活性,起初存在着较大争论.研究认为,细胞生长活性与其核酸含量及体积具有显著的正相关,因此,通常认为HNA细菌具有代谢活性,而LNA细菌则不然[9].初期在FCM上观察到LNA细菌的存在时,它被认为是死的或即将衰亡(没有细胞代谢活性)的细菌,以致有学者提出将HNA细菌作为环境中活性细菌的指标[10-11],但随着研究的深入,发现LNA细菌不仅具有活性,同时在环境中也具有重要生态作用[12]. Wang等[13]从细胞内ATP角度分析发现,在相同培养条件下,LNA细菌和HNA细菌具有相似的ATP单位体积浓度(1.2×10-15vs. 1.5×10-15gATP/ µm3); Longnecker等[4]从基质利用和基因发育组成两方面分析,证明了在海洋中LNA菌和HNA菌具有相同作用,在一些海洋环境中,LNA细菌的代谢活性和生长速率甚至要高于HNA细菌[14-15], LNA细菌的特殊膜结构和蛋白代谢抗性机制使得其能够适用某些外界环境压力,如低营养环境[16-17]、氧化消毒[18];Bouvier等[19]发现LNA细菌比HNA细菌更能规避病毒感染,研究还发现LNA细菌能够采用“休眠”策略以应对不利环境,在寡营养环境中这种菌比重可达40%[20].上述特性使得LNA细菌在某些特定环境下,生存竞争能力要高于HNA细菌,成为环境中优势菌,因而在生物地球化学循环中担当着重要角色.然而,尽管对LNA细菌的活性已有所认同,但是LNA和HNA细菌的相互关系却仍不清晰.
目前,LNA和HNA细菌的分类在海洋环境中已有大量报道[15,21-24],但是这些研究主要集中于细菌丰度以及在环境中比重,而对LNA细菌在陆地环境分布的认识有限[5,13],特别是在土壤等环境中的分布还处于空白,关于LNA细菌在不同环境介质中的分布缺乏报道.此外,由于操作程序的不同(仪器、样品固定和保存等差异)导致不同研究对象之间难以比较LNA和HNA细菌的特性,导致了以往的研究主要侧重于比较其丰度,而且对LNA和HNA细菌流式细胞技术特性参数之间变化的认识也有限[5].为了弥补这一缺失,本文研究分析了不同类型的水体环境(地下水、河流、湖泊)以及土壤和污水处理厂等其他陆地环境中LNA细菌的分布,同时通过FCM特性参数探讨了LNA和HNA细菌之间的相互关系.
1 材料与方法
1.1样品的采集
水样采集与保存参照《水质采样技术指导(HJ 494-2009)》[25],水样分别来自松花江(98个样点)、海河(9个样点)、鄱阳湖(4个样点)以及地下水(湖南,2个样点).参照《土壤环境监测技术规范(HJ/T 166 -2004)》[26]中方法采集农田土壤(天津津南,4个样点)、石油污染土(天津大港,4个样点),去表层土、采集表层以下5~20cm深度土壤,此外,试验采集了某污水处理厂中的活性污泥(5个样点).试验样品用121℃、20min高温灭菌的1L Schott玻璃瓶收集,所有样品在常温下采集,并于4℃环境下运回实验室,在24h内立即进行试验.
1.2样品的预处理
水样采集后,如水中浑浊度较高则用20μm滤膜过滤颗粒物,否则无需过滤,直接进行后续实验.
土壤及活性污泥在进行流式细胞技术测定前的预处理参照Foladori等[27]方法,用灭菌磷酸缓冲溶液PBS(3g/L K2HPO4, 1g/L KH2PO4, 8.5g/L NaCl, pH =7.2)按照1:10的比例稀释,然后用细胞超声波破碎仪分散颗粒物中的微生物,超声破碎的功率及时间通过预实验确定最佳条件(本实验为2kJ/L, 10min),最后3000r/min离心10min取上清液.
1.3流式细胞技术测定
流式细胞仪的测定参照Liu等[28]方法.用0.22μm尼龙膜(PALL,美国)过滤后的二甲基亚砜将SYBR Green I标准母液(Invitrogen,美国)稀释100倍作为DNA染色工作液.取菌液1mL,加入10μL DNA染色工作液,在室温条件下避光染色15min.
实验所用仪器为CyFlow Space (Partec公司,德国)流式细胞仪,光源功率为50mW,发射波长488nm,采用绝对计数来测定微生物细胞数,其线性范围为2×102~1×105cells/mL,检出限为200cells/mL,绝对计数误差小于5%[29].实验设定绿色荧光(FL1)为触发参数,其信号收集波长为(520±20) nm,红色荧光(FL3)信号收集波长大于615nm,所有信号均被收集在绿/红荧光二维散点图上,信号收集软件为FlowMax.仪器增益设置具体为地下水:SSC=280、FL1=360、FL3=700;鄱阳湖水:SSC=250、FL1=400、FL3=700;海河水SSC=369、FL1=380、FL3=750;松花江:SSC=300、FL1=390、FL3=600;土壤:SSC=280、FL1=360、FL3=750;石油污染土壤:SSC=280、FL1=320、FL3=750;活性污泥:SSC=320、FL1=280、FL3=700.实验测定时,用灭菌Millipore水稀释样品或调节流速以确保测定过程中仪器的读数小于500cells/s.在增益参数确定后,通过“门Gate”的设定将水样中LNA细菌和HNA细菌进行分开,最后计算出环境中LNA和HNA细菌的比例.每个样重复3次平行.
1.4数据处理与分析
使用方差分析(One-Way ANOVA)统计数据间的差异性,水质数据标准化后,应用Canoco软件进行多元排序(主成分分析PCA)[30-31]分析LNA和HNA细菌组成在环境介质中的变化.采用Origin 8.5和Microsoft excel软件进行绘图和相关性分析.
2 结果与分析
2.1细菌群落的FCM指纹图谱

图1 各环境样品中典型LNA和HNA细菌流式细胞分类Fig.1 Flow cytometry plot of LNA and HNA bacteria in various environmental samples
细菌在进行流式细胞技术检测时,通过电压增益调节以及“Gate门”设定,按照FL1绿色荧光信号和SSC侧向散射角信号对细菌群落组成进行分析.结果显示,在各环境样品中均具有LNA 和HNA细菌分类现象(图1),所采样的不同介质中都能检测出LNA细菌存在,大部分环境水样都出现了LNA和HNA细菌两团分类(FL1双峰分配模型),如图1中地下水和海河水体,在鄱阳湖水样中出现了3团分类,而在松花江水样中甚至出现多达5团.同时,实验也发现,在农田土壤、石油污染土壤以及污水处理厂的活性污泥中出现高低核酸细菌的分类.
2.2LNA和HNA细菌的浓度变化
环境样品中LNA和HNA细菌的平均浓度以及LNA细菌占总菌浓度百分比(LNA%)如图2所示.不同环境中LNA细菌浓度具有极显著差异(P<0.01),在土壤等介质中LNA细菌浓度(107~108cells/g数量级)明显高于水体中LNA浓度(105~106cells/mL数量级).但是,除地下水(21.60%± 6.19%)具有最低LNA细菌比重外,水体中LNA细菌比重(鄱阳湖65.92%±6.31%,海河42.25%± 15.88%,松花江46.97%±17.3%)均高于固体介质中LNA细菌比重(农田土壤33.94%±12.53%,石油污染土29.80%±10.98%,活性污泥33.21%± 5.60%),其中鄱阳湖中LNA细菌比重最高.
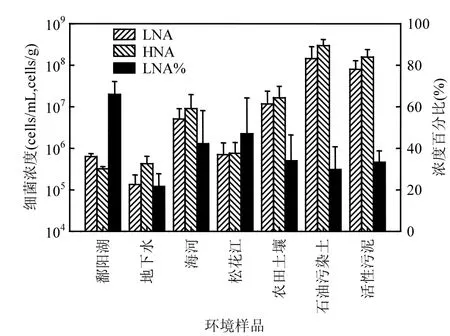
图2 不同环境样品中LNA细菌和HNA细菌浓度Fig.2 Concentration of LNA and HNA bacteria in various environmental samples
2.3LNA和HNA细菌的FCM特性参数变化在流式细胞技术中FL1绿色荧光信号反映细菌DNA结构特征,SSC侧向散色角反映细胞形态特征.图3显示了各环境介质中LNA细菌与HNA细菌的流式细胞FL1和SSC信号参数比值,在水体中FL1荧光信号比值(LNA:HNA)显著高于固体环境中比值(P<0.05),这说明在土壤等固体环境中LNA细菌的核酸量相对于水体环境中LNA细菌的含量更低;而除了地下水中SSC侧向散色角信号比值(LNA:HNA)显著高于其它环境介质外(P<0.01),其它环境介质之间无显著差异.

图3 不同环境样品中LNA细菌与HNA细菌流式细胞参数比值Fig.3 Parametric ratio of flow cytometry between LNA and HNA bacteria in various environmental samples

图4 环境样品流式细胞技术参数主成分分析Fig.4 Principal component analysis of various samples based on flow cytometric parameters
对各类环境样品LNA和HNA细菌的流式细胞技术参数(LNA和HNA细菌浓度、信号参数比值等)进行主成分分析(PCA),结果显示(图4)样品具有明显的两种聚类(水体和固体),这表明水体和固体中LNA和HNA细菌的浓度及流式细胞特性具有显著差异.
2.4LNA和HNA细菌的FCM特性参数相互关系LNA细菌和HNA细菌的FL1绿色荧光具有极显著的正相关(FL1LNA与FL1HNA:R2=0.711、P<0.01)[图5 (a)],表明这两类细菌的流式细胞特性不是相互独立的,而是在一个给定的样本(系统)中共变:即具有较高FL1HNA的样品意味着也具有相对较高的FL1LNA,反之亦然;同时,细菌的SSC侧向散色光也具有相同的变化规律(SSCLNA与SSCHNA:R2=0.762、P<0.01)[图5 (b)].然而,在单独的细菌分团(HNA或LNA细菌)中,FL1和SSC之间的相关性较小(FL1LNA与SSCLNA: R2= 0.328、P<0.01;FL1HNA与SSCHNA:R2=0.186、P<0.01),如图5(c) (d)所示,这表明FL1和SSC这两个参数是不同的细菌生理特性指标,所以它们之间的耦合性相对较低,同时,这也说明,这两个参数可能受不同因子的影响;另一方面,与HNA细菌相比,LNA细菌的FL1和SSC之间相关性相对较高(RLNA2=0.328vs. RHNA2=0.186),即,在LNA细菌中,细胞的FL1绿色荧光信号(反映细胞核酸结构)和SSC侧向散色光信号(反映细胞尺寸大小)之间的相关性大于HNA细菌,这也说明LNA细菌的流式细胞特性参数受影响的因素较少.

图5 HNA与LNA细菌以及单独LNA和HNA细菌FL1绿色荧光和SSC侧向散色光的相关性Fig.5 Correlations between HNA and LNA bacterial green fluorescence (FL1) and side scatter (SSC), and relationship between green fluorescence (FL1) and side scatter (SSC) in LNA and HNA bacteria
实验分析中,用LNA与HNA之间的绿色荧光FL1和侧向散色光SSC的比值(FL1LNA: FL1HNA和SSCLNA:SSCHNA)分别表示它们的变异,并进行相关性分析和比较,结果如图6所示,在HNA和LNA细菌中,SSC侧向散射的变异(SSCLNA:SSCHNA)要大于FL1绿色荧光的变异(FL1LNA:FL1HNA),其中,LNA细菌的SSC具有较大的变异[图5 (c) (d)],以上均表明SSC和FL1之间不是共变关系.

图6 FL1和SSC变异(LNA:HNA)的相关性Fig.6 Relationship between variation (LNA:HNA) of green fluorescence (FL1) and side scatter (SSC)
3 讨论
3.1流式细胞技术参数SSC和FL1的变异
以往研究仅注重于用流式细胞技术参数(FL1和SSC)来区分LNA和HNA细菌,较少分析其图谱特征及变化.由于FL1和SSC均能反映细胞特性(如细胞核酸、形态、活性等),因此这些参数能作为重要的额外信息来解释LNA和HNA细菌的重要性[5].本研究采样包含多种生态系统(松花江、海河、湖泊、地下水和土壤等),各类环境样品中虽然都有LNA和HNA细菌分类现象,但是用流式细胞技术描述这些样品时,它们的参数却具有多变性(甚至在相同的操作条件下)(图3),对这些参数进行多元排序PCA分析,结果显示(图4),环境样品被明显地分为两大类:水体和土壤固体,这表明流式参数具有生态系统的特异性.
细菌DNA核酸染色后的荧光激发主要与其胞内核酸含量有关,微生物物种基因大小和基因拷贝数共同影响细菌的荧光信号FL1[32],而染色体的拓扑形态也会随细胞生理条件变化,从而影响荧光激发[33];通过SYBR Green I染色时,不仅能染色DNA,同时还可以染色RNA,因此这种荧光双峰分布曾被认为可能是细菌处于不同的生理期[34],尽管有研究显示RNA的影响很小[14],但是其含量也会潜在地影响荧光激发,如一些细菌被病毒感染后,在其裂解后期会表现出较高荧光[35];也有部分研究认为细胞基因组与细胞尺寸大小具有联系,因此FL1信号也与细胞生物体积具有一定关联[36];另外,染色效果差异[34]及染料本身自发荧光也有可能引起FL1变化,尽管如此,但是上述潜在可能影响对环境细菌群落的FCM荧光差异贡献很微小.
SSC变化机理较为复杂,研究认为叶绿素α、细菌生产和生态系统类型共同作用于侧向散射角信号SSC[37],SSC表征细胞形态特征(细胞体积大小和细胞结构),包括胞内颗粒、细胞支架蛋白、细胞膜厚度、外膜化学组成、液泡形成等.细胞形态学和亚显微结构上的本质差异使得细菌的光散射表现出规律性变化[38],即细菌在系统发育方面具有很大差异[39],细菌组成的变化对SSC具有明显影响[28].因此,系统发育组成上的差异能够部分解释不同生态系统中SSC的差异,这也是为什么SSC比FL1具有较大差异的原因(图6).
在不同生态系统中,LNA和HNA细菌的浓度比例具有较大差异,这说明环境因子影响其共分布.同时,不同环境样品之间流式细胞技术特性也具有较大变异,即FL1和SSC参数的数量级有较大变化(图5),而在整个生态系统中这种变化特征具有一致性:HNA和LNA细菌的FL1(或SSC)具有极显著的共变关系,因此这两类细菌在流式细胞图中一起(随仪器参数改变而)移动,HNA和LNA细菌也具有相似的FL1(或SSC)离散程度,因而LNA和HNA细菌可以通过FL1和SSC两个特性参数进行很好的区分.此外,FL1和SSC的较大变异也表明LNA和HNA细菌的分类不仅与具体的核酸量或细胞尺寸有关,而且与微生物群落的内在结构相关,即在不同生态系统或环境梯度下表现出不同的差异,LNA和HNA细菌可能同时受相似的环境因子影响,或完全取决于不同的环境因子[5].LNA(HNA)细菌FL1和SSC之间相关性的离散程度较大(R2较小)还表明这两类细菌都具有较高的形态和基因功能多样性[5], Bouvier等[5]研究指出FL1和SSC受不同因素影响,细菌的FL1主要受细胞的活性和生态系统的生产力影响,其次是生态系统的类型,而SSC则刚好相反,它首先与环境类型的特性相关,然后才与系统的生产力有关.
3.2LNA和HNA细菌的相互关系
HNA和LNA细菌的分类已经被广泛认同,并引起了生态学家的重视,然而其生态意义仍然处于争论阶段.本研究结果显示无论是地下水、河流和湖泊的水生态系统还是土壤等环境中都有DNA双峰(FL1信号)模型分布,HNA和LNA细菌之间具有极显著相关性(图5),在流式细胞中被明显地分为两类(以上)(图1),这种分类与所处何种DNA水平无关,它只在不同生态系统或环境梯度中表现出变化,就目前所知,这种现象没有出现在环境中的其他类型微生物或多细胞动物中.关于这种现象的最初解释是,HNA代表细菌中最高活性的部分,而LNA则是那些灭活的、休眠的或具有非常低活性的细菌[10],这源于原位研究得出的总细菌活性与HNA细菌动力学之间具有显著相关性的结论[11]以及流式分选研究得出的大部分营养被分配到HNA细菌的结果[10,40].但是近来研究表明LNA细菌的比生长速率与HNA细菌相当,甚至有些还高于HNA细菌[4,14,39,41-42],因而关于LNA和HNA细菌代表不同细胞活性的解释过于简单也不能够解释上述问题.
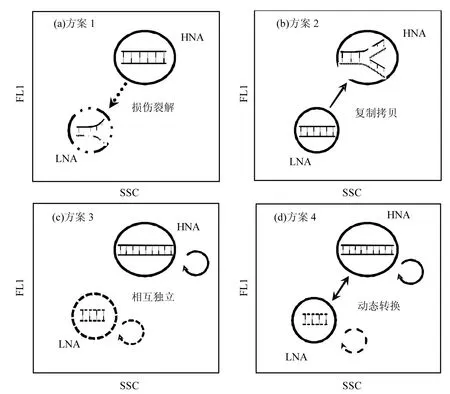
图7 自然环境中HNA和LNA细菌之间四种可能相互联系的假设示意[5]Fig.7 Illustrated outline of the four potential scenarios that may be envisioned concerning the nature of the HNA and LNA bacteria[5]
从已有研究来看,HNA和LNA细菌之间的相互关系有4种假设[5]:(1)HNA是活的、生长中的细菌,而LNA则是非活性、休眠、受损或死亡的HNA细菌[图7(a)];(2)与(1)情形相反,LNA细菌由处于多种不同生理状态的细菌组成,包括健康、活性、非活性、休眠和受损伤的细菌,所有这些状态细菌具有相似DNA水准,而HNA只是那些活性LNA细菌处于迅速分裂期,此时它们正进行DNA复制或获得了多个基因拷贝[图7(b)];(3)极端假设理论:HNA和LNA是两种完全不同的微生物群落,它们各自具有本身独立的生理特性,HNA和LNA之间很少或甚至没有相互作用[图7(c)];(4)折中假设:HNA和LNA之间是动态转变的,但它们的组成仍具有明显差异[图7(d)].
其中,假设方案1和方案2是基于:在细菌分裂阶段DNA含量会因为复制出现周期性增加或减少[33]、处于高活性状态时细胞具有高DNA含量[43]、在饥饿状态时DNA裂解[44]、由于天敌捕获或其它因子而细胞失活[43]、不同程度的多倍体[33]及基因大小短时间的适应性改变[45]等理论.在复杂的细菌群落环境中,以上所有反应都有可能同时并以不同速率发生,最终导致细胞核酸荧光的连续光谱.但是这也有一个相矛盾的情况,即在本研究大多数样品中存在两类(以上)不同核酸含量的细菌,而这两类(以上)细菌具有不连续的细胞特性.如果LNA细菌来源于非活性或裂解的HNA细菌(方案1),那么有:1)LNA细菌的流式细胞参数与HNA细菌的参数将是共变关系,两者之间的变化范围及离散程度应一致;2)在流式细胞仪中这两者应该是连续跃迁,而不是被明显地分开;3)不管HNA细菌中FL1程度如何,在不同样品中LNA细菌的DNA含量应该收敛到一个相同低水平.相反的,如果HNA细菌来源于LNA细菌的自身复制(方案2),那么有:1)HNA细菌将共变于LNA细菌,而不会比LNA细菌更均匀;2)HNA和LNA细菌之间应该也是连续跃迁;3)HNA和LNA之间的距离应该在DNA复制或基因拷贝数以内.而本研究结果均不支持这2种推论:HNA和LNA细菌的FL1具有显著的共变关系,但是在大分部样品中很清晰地分开;在不同样品中LNA细菌的荧光特性没有收敛,而是在不同样品中具有很大差异;HNA和LNA细菌之间的FL1距离(FL1LNA:FL1HNA小于0.24)超过了自然环境中细菌DNA的复制程度[41],且在不同生态系统中这种距离具有较大差异.
假设方案3用HNA和LNA细菌在组成上具有本质差异来解释细菌群落核酸荧光的双峰分配模型,这种推论假设HNA和LNA细菌具有各自独特的结构和功能特性,从而导致了DNA含量和侧向散色的变异.这方面报道仍然是相互矛盾,结合流式分选、原位荧光检测及分子指纹图谱分析,有研究指出HNA和LNA细菌在组成上没有明显区别[4,40],然而也有研究发现某些系统发育组或分支是LNA(如SAR11和SAR86分支)和HNA(如Roseobacter, γ-Proteobacteria, Bacteroidetes)的特有菌或优势菌[39,42,46].这种推理不能解释这两种完全独立但是在流式细胞特性上却又具有显著共变关系的现象.正如前文所述:SSC的差异可能反映细菌组成变化,在不同的生态系统中SSC具有较大的差异,但是在给定的环境样品中SSC的差异相对较少(图4).因此,本研究表明推论方案3并不成立.
综上所述,HNA和LNA细菌既不代表活性细胞或失活细胞,也不是完全相互独立的.结果说明HNA和LNA细菌存在于所有细菌微生物群落中是因为其复杂的细菌变化过程,HNA和LNA之间可能相互“迁移”(方案4),这一结论与前人研究具有相似性,HNA和LNA之间具有动态关联性,这种联系不止是单向,而且在细菌激活生长以及失活受到损伤或死亡时都会起作用[5,14].本文结果还显示,HNA和LNA细菌具有自身内在特性,HNA和LNA的分类并不仅仅局限于水体浮游细菌,而且在土壤等环境中也有出现.Bouvier等[5]认为HNA和LNA细菌分类可能是原核生物的一种普遍适应性过程,Islas等[47]等分析了已知的641种不同原核生物DNA含量,结果显示独立生存的原核生物基因大小分布也具有双峰分布(在2000kb和4000~5000kb处有两个峰).通过对实验结果及文献分析,表明HNA细菌并不就是活性细菌,而LNA细菌也不是非活性细菌.同时,HNA和LNA细菌之间并不是绝对相互对立,而是可能具有一定动态联系,它们共同出现在一个较大范围的DNA含量和细胞尺寸之中,这可能是生物进化所引起的一个生态共性,这也暗示细菌的双峰分布可能具有重要作用,然而,关于这种原核生物基因双峰分布现象的进化意义仍不清楚,这可能根源于原核生物具有普遍的HNA和LNA分类,或者反过来,它们有着特殊而不同的生态位和生态功能,因而需要进一步研究分析这种分类的根本原因以及它们在生态系统和环境微生物食物链中的作用.
4 结论
4.1在水体环境和土壤等介质中都存在LNA 和HNA细菌分类,其中,土壤环境中LNA细菌浓度高于水环境中浓度,但是其相对比重低于水环境中LNA细菌;主成分分析(PCA)结果表明,水体和土壤环境的LNA和HNA细菌流式细胞特性具有明显差异.
4.2LNA细菌与HNA细菌具有特殊共变关系,其流式细胞特性参数(FL1和SSC)显著相关;在LNA细菌中,FL1与SSC的相关性大于HNA细菌中的相关性;在不同生态系统中SSC的变异大于FL1的变异.
参考文献:
[1] 陈姝,郭照冰,方华,等.CO2浓度升高对湖泊浮游藻类与浮游细菌耦合关系的影响 [J]. 中国环境科学, 2015,35(7):2209-2216.
[2] Wang YY, Hammes F, De Roy K, et al. Past, present and future applications of flow cytometry in aquatic microbiology [J]. Trends in Biotechnology, 2010,28(8):416-424.
[3] 刘杰,宋宇昊,赵志鹏,等.三种淡水环境中低核酸含量细菌的滤过性[J/OL]. 微生物学通报, http://www.cnki.net/ kcms/detail/ 11.1996.Q.20160106.20160954.20160004.html.
[4] Longnecker K, Sherr BF, Sherr EB. Activity and phylogenetic diversity of bacterial cells with high and low nucleic acid content and electron transport system activity in an upwelling ecosystem [J]. Applied and Environmental Microbiology, 2005,71(12):7737-7749.
[5] Bouvier T, del Giorgio P A, Gasol J M. A comparative study of the cytometric characteristics of High and Low nucleic-acid bacterioplankton cells from different aquatic ecosystems [J]. Environmental Microbiology, 2007,9(8):2050-2066.
[6] 刘杰,李蕾,王莹莹.水环境中微小细菌的分布及生态作用研究进展 [J]. 微生物学通报, 2014,41(10):2100-2111.
[7] 郭沛涌,沈焕庭,张利华.淡水微型浮游植物的FCM研究 [J]. 中国环境科学, 2002,22(2):6-9.
[8] Prest EI, Hammes F, Kotzsch S, et al. Monitoring microbiological changes in drinking water systems using a fast and reproducible flow cytometric method [J]. Water Research, 2013,47(19):7131-7142.
[9] Gomes A, Gasol J M, Estrada M, et al. Heterotrophic bacterial responses to the winter-spring phytoplankton bloom in open waters of the NW Mediterranean [J]. Deep-Sea Research Part I-Oceanographic Research Papers, 2015,96:59-68.
[10] Lebaron P, Servais P, Baudoux AC, et al. Variations of bacterial-specific activity with cell size and nucleic acid content assessed by flow cytometry [J]. Aquatic Microbial Ecology, 2002,28(2):131-140.
[11] Lebaron P, Servais P, Agogué H, et al. Does the high nucleic acid content of individual bacterial cells allow us to discriminate between active cells and inactive cells in aquatic systems?[J]. Applied and Environmental Microbiology, 2001,67(4):1775-1782. [12] Gozdereliler E, Boon N, Aamand J, et al. Comparing metabolic functionalities, community structures, and dynamics of herbicidedegrading communities cultivated with different substrate concentrations [J]. Applied and Environmental Microbiology, 2013,79(1):367-375.
[13] Wang YY, Hammes F, Boon N, et al. Isolation and characterization of low nucleic acid (LNA)-content bacteria [J]. ISME Journal, 2009,3(8):889-902.
[14] Jochem F J, Lavrentyev P J, First M R. Growth and grazing rates of bacteria groups with different apparent DNA content in the Gulf of Mexico [J]. Marine Biology, 2004,145(6):1213-1225.
[15] Zubkov M V, Tarran G A, Burkill P H. Bacterioplankton of low and high DNA content in the suboxic waters of the Arabian Sea and the Gulf of Oman: abundance and amino acid uptake [J]. Aquatic Microbial Ecology, 2006,43(1):23-32.
[16] Williams T J, Ertan H, Ting L, et al. Carbon and nitrogen substrate utilization in the marine bacterium Sphingopyxis alaskensis strain RB2256 [J]. ISME Journal, 2009,3(9):1036-1052.
[17] Salcher M M, Pernthaler J, Posch T. Seasonal bloom dynamics and ecophysiology of the freshwater sister clade of SAR11bacteria 'that rule the waves' (LD12) [J]. ISME Journal, 2011,5(8):1242-1252.
[18] Ramseier M K, von Gunten U, Freihofer P, et al. Kinetics of membrane damage to high (HNA) and low (LNA) nucleic acid bacterial clusters in drinking water by ozone, chlorine, chlorine dioxide, monochloramine, ferrate(VI), and permanganate [J]. Water Research, 2011,45(3):1490-1500.
[19] Bouvier T, Maurice C F. A Single-Cell Analysis of Virioplankton Adsorption, Infection, and Intracellular Abundance in Different Bacterioplankton Physiologic Categories [J]. Microbial Ecology, 2011,62(3):669-678.
[20] Roesel S, Grossart H-P. Contrasting dynamics in activity and community composition of free-living and particle-associated bacteria in spring [J]. Aquatic Microbial Ecology, 2012,66(2): 169-181.
[21] Vila-Costa M, Gasol J M, Sharma S, et al. Community analysisof high- and low-nucleic acid-containing bacteria in NW Mediterranean coastal waters using 16S rDNA pyrosequencing [J]. Environmental Microbiology, 2012,14(6):1390-1402.
[22] Garcia F C, Lopez-Urrutia A, Moran XAG. Automated clustering of heterotrophic bacterioplankton in flow cytometry data [J]. Aquatic Microbial Ecology, 2014,72(2):175-185.
[23] Grob C, Ostrowski M, Holland R J, et al. Elemental composition of natural populations of key microbial groups in Atlantic waters [J]. Environmental Microbiology, 2013,15(11):3054-3064.
[24] Santic D, Krstulovic N, Solic M, et al. HNA and LNA bacteria in relation to the activity of heterotrophic bacteria [J]. Acta Adriatica, 2012,53(1):25-40.
[25] HJ 494-2009水质采样技术指导 [S].
[26] HJ/T 166-2004土壤环境监测技术规范 [S].
[27] Foladori P, Bruni L, Tamburini S, et al. Direct quantification of bacterial biomass in influent, effluent and activated sludge of wastewater treatment plants by using flow cytometry [J]. Water Research, 2010,44(13):3807—3818.
[28] Liu J, Ding YL, Bartlam M, et al. Microbial community analysis of underground drinking water using denaturing gradient gel electrophoresis and flow cytometry technologies [J]. Applied Mechanics and Materials, 2015,700:519-524.
[29] Ma L L, Mao G N, Liu J, et al. Rapid quantification of bacteria and viruses in influent, settled water, activated sludge and effluent from a wastewater treatment plant using flow cytometry [J]. Water Science and Technology, 2013,68(8):1763-1769.
[30] 刘杰,屠腾,纪玉蕊,等.松花江流域沉积物ATP微生物量的分布特征 [J]. 中国环境科学, 2015,35(1):171-178.
[31] Liu J, Wang J, Gao G, et al. Distribution and diversity of fungi in freshwater sediments on a river catchment scale [J]. Frontiers in Microbiology, 2015,6:329.
[32] Button D K, Robertson B R, Lepp P W, et al. A small, dilutecytoplasm, high-affinity, novel bacterium isolated by extinction culture and having kinetic constants compatible with growth at ambient concentrations of dissolved nutrients in seawater [J]. Applied and Environmental Microbiology, 1998,64(11):4467-4476.
[33] Lebaron P, Joux F. Flow cytometric analysis of the cellular DNA content of Salmonella typhimurium and Alteromonas haloplanktis during starvation and recovery in seawater [J]. Applied and Environmental Microbiology, 1994,60(12):4345-4350.
[34] Lebaron P, Parthuisot N, Catala P. Comparison of blue nucleic acid dyes for flow cytometric enumeration of bacteria in aquatic systems [J]. Applied and Environmental Microbiology, 1998, 64(5):1725-1730.
[35] Brussaard C P D, Thyrhaug R, Marie D, et al. Flow cytometric analyses of viral infection in two marine phytoplankton species, Micromonas pusilla (Prasinophyceae) and Phaeocystis pouchetii (Prymnesiophyceae) [J]. Journal of Phycology, 1999,35(5): 941-948.
[36] Moran X A G, Bode A, Angel Suarez L, et al. Assessing the relevance of nucleic acid content as an indicator of marine bacterial activity [J]. Aquatic Microbial Ecology, 2007,46(2): 141-152.
[37] La Ferla R, Lo Giudice A, Maimone G. Morphology and LPS content for the estimation of marine bacterioplankton biomass in the Ionian Sea [J]. Scientia Marina, 2004,68(1):23-31.
[38] Bouvier T, Troussellier M, Anzil A, et al. Using light scatter signal to estimate bacterial biovolume by flow cytometry [J]. Cytometry, 2001,44(3):188-194.
[39] Zubkov M V, Fuchs B M, Burkill P H, et al. Comparison of cellular and biomass specific activities of dominant bacterioplankton groups in stratified waters of the Celtic Sea [J]. Applied and Environmental Microbiology, 2001,67(11):5210-5218.
[40] Servais P, Casamayor E O, Courties C, et al. Activity and diversity of bacterial cells with high and low nucleic acid content [J]. Aquatic Microbial Ecology, 2003,33(1):41-51.
[41] Button D K, Robertson B R. Determination of DNA content of aquatic bacteria by flow cytometry [J]. Applied and Environmental Microbiology, 2001,67(4):1636-1645.
[42] Mary I, Heywood J L, Fuchs B M, et al. SAR11dominance among metabolically active low nucleic acid bacterioplankton in surface waters along an Atlantic meridional transect [J]. Aquatic Microbial Ecology, 2006,45(2):107-113.
[43] Gasol J M, Zweifel U L, Peters F, et al. Significance of size and nucleic acid content heterogeneity as measured by flow cytometry in natural planktonic bacteria [J]. Applied and Environmental Microbiology, 1999,65(10):4475-4483.
[44] Joux F, Lebaron P, Troussellier M. Succession of cellular states in a Salmonella typhimurium population during starvation in artificial seawater microcosms [J]. FEMS Microbiology Ecology, 1997,22(1):65-76.
[45] Nilsson A I, Koskiniemi S, Eriksson S, et al. Bacterial genome size reduction by experimental evolution [J]. Proceedings of the National Academy of Sciences of the United States of America, 2005,102(34):12112-12116.
[46] Fuchs B M, Woebken D, Zubkov M V, et al. Molecular identification of picoplankton populations in contrasting waters of the Arabian Sea [J]. Aquatic Microbial Ecology, 2005,39(2):145-157.
[47] Islas S, Becerra A, Luisi P L, et al. Comparative genomics and the gene complement of a minimal cell [J]. Origins of Life and Evolution of the Biosphere, 2004,34(1):243-256.
Correlation of LNA and HNA bacteria based on flow cytometric characteristics.
LIU Jie, SONG Yu-hao, MA Rui, WANG Ying-ying*(Key Laboratory of Pollution Processes and Environmental Criteria (Ministry of Education), Tianjin Key Laboratory of Environmental Remediation and Pollution Control, College of Environmental Science and Engineering, Nankai University, Tianjin 300071, China). China Environmental Science, 2016,36(3):865~874
Abstract:In the present study, bacterial concentration and FCM characteristics of LNA and HNA were analyzed in seven different terrestrial environments. Results showed clear separation between LNA and HNA bacteria in both aquatic and soil environments. The LNA abundance in soil (107~108cells/g) was higher than that of freshwater (105~106cells/mL) while the proportion of LNA in soil (29.80%~33.94%) was lower than that of freshwater (42.25%~65.92%), but not underground water (21.60%). Principal component analysis (PCA) indicated that the flow cytometric characteristics of LNA and HNA had distinct differences between freshwater and soil. Correlation analysis further revealed that both green fluorescence (FL1) and side scatter (SSC) signals between LNA and HNA bacteria had a significant correlation (FL1:R2=0.711, P<0.01; SSC:R2=0.762, P<0.01), i.e. co-variation between LNA and HNA. The variance of SSC was higher than that of FL1 in different ecosystems. The results demonstrated that LNA and HNA bacteria were neither physiologically related nor completely independent communities, but rather have a close co-variation.
Key words:terrestrial ecosystems;flow cytometry (FCM);low nucleic acid content (LNA) bacteria;high nucleic acid content (HNA) bacteria;DNA; fluorescence staining
作者简介:刘杰(1987-),男,湖南益阳人,博士,主要研究方向为环境微生物生态学、土壤生态修复等.发表论文18篇.
基金项目:国家自然基金项目(31322012)
收稿日期:2015-06-11
中图分类号:X172
文献标识码:A
文章编号:1000-6923(2016)03-0865-10

