Orexin-A对大鼠海马神经细胞凋亡的影响及机制
池恒,李国华,唐吉友
(1山东省千佛山医院,济南250014;2泰山医学院;3济南市第三人民医院)
Orexin-A对大鼠海马神经细胞凋亡的影响及机制
池恒1,2,李国华3,唐吉友1
(1山东省千佛山医院,济南250014;2泰山医学院;3济南市第三人民医院)
摘要:目的探讨Orexin-A对大鼠海马神经细胞凋亡的影响及作用机制。方法 提取36只Wistar大鼠的海马神经细胞,培养后随机分为空病毒组、PLCβ1组、PLCβ4组,分别用空病毒和携带目的基因PLCβ1、PLCβ4的慢病毒转染沉默目的基因,各组各自取一半细胞加入Orexin-A(100 nmol/L)培养8 h,用流式细胞术测算各组细胞凋亡指数,Western blotting法检测海马神经细胞外信号调节激酶(ERK)1/2的表达。结果与不加Orexin-A比较,加Orexin-A后空病毒组、PLCβ4组海马神经细胞凋亡率降低、ERK1/2表达升高(P均<0.05),而PLCβ1组海马神经细胞凋亡率、ERK1/2表达无明显变化(P均>0.05)。结论 Orexin-A可减少大鼠海马神经细胞的凋亡,该作用可能与OX1R/OX2R-Gq-PLCβ1信号通路有关。
关键词:Orexin-A;海马神经细胞;细胞凋亡;细胞外信号调节激酶1/2;大鼠
Orexin是下丘脑产生的一种神经肽,包括Orexin-A、Orexin-B。Orexin主要通过两个G蛋白偶联受体(OX1R、OX2R)发挥作用。其中,Orexin-A不仅能激活OX1R,也能激活OX2R,Orexin-B只能激活OX1R[1,2]。Orexin-A参与睡眠-觉醒的调节。研究表明,OX1R和OX2R被Orexin-A激活后,通过与多种G蛋白结合启动细胞内的多条信号转导途径[3]。其中,Gq蛋白/磷脂酶C(PLC)/蛋白激酶C(PKC)是Orexin-A的关键信号途径,可通过激活细胞外信号调节激酶(ERK1/2)的磷酸化影响细胞凋亡。2014年11月~2015年8月,我们通过慢病毒转染沉默PLCβ1、PLCβ4的基因表达,探讨Orexin-A对海马神经细胞的作用及机制,为发作性睡病等睡眠障碍及其引起的学习记忆功能损害的患者提供新的治疗靶点。
1材料与方法
1.1材料出生24 h内Wistar大鼠36只(山东大学实验动物中心提供),雌雄不拘,营养良好;DMEM/F12培养基、Neurobasal培养基、B27、L-谷氨酰胺、青链霉素(美国Gibco 公司);胎牛血清、胰蛋白酶(美国HyClone公司);多聚赖氨酸(北京索莱宝公司);携带目的基因的病毒和空病毒(上海吉凯基因化学技术有限公司);Total RNA Kit (美国 Omega公司);PCR试剂盒(美国Thermo公司);引物(上海生物工程公司);Western blotting法检测试剂盒、电泳液、转膜液(杭州碧云天公司);p-ERK1/2一抗、总ERK1/2(美国Cell Signaling Technology公司);超净工作台、恒温培养箱(美国Thermo公司);荧光显微镜(日本电子公司);实时定量PCR仪(ⅦA7 DX,美国Applied Biosystems公司);电泳转膜装置(美国Bio-Rad公司);流式细胞仪(美国BD公司)。
1.2海马神经细胞培养及分组75%的乙醇消毒大鼠全身,急性分离其海马组织。将海马组织剔除脑膜和血膜,剪成1 mm3左右的碎块,加入0.125%胰蛋白酶溶液于37 ℃、5% CO2培养箱中消化10 min,用含20%胎牛血清的DMEM/F12培养基终止消化。悬浮、离心、过滤,收集细胞,计数后,用含有20%胎牛血清的DMEM/F12培养基制成细胞密度为1×106/mL的细胞悬液,接种于预先用0.01%多聚赖氨酸包被的六孔板内,置于37 ℃、5% CO2培养箱中培养。8 h后细胞贴壁,换无血清细胞饲养液(96% Neurobasal+2% B27+1%谷氨酰胺+1%双抗),每3天半量换新鲜的无血清细胞饲养液。培养3 d细胞均分为3组:空病毒组、PLCβ1组、PLCβ4组。
1.3慢病毒转染及基因沉默效率检测采用慢病毒作为载体转染siRNA,3组细胞分别转染不携带任何siRNA的空病毒和携带与PLCβ1和PLCβ4基因位点对应的siRNA的慢病毒。依据感染复数值,每组分别加入适量的病毒。8 h后观察细胞状态,更换培养基,继续培养72 h。利用荧光显微镜观察转染情况,根据细胞计数计算转染效率,3组细胞转染效率均>90%。采用RT-PCR法检测PLCβ1、PLCβ4mRNA 的表达。Total RNA Kit 提取细胞总RNA,反转录合成cDNA后进行PCR扩增。95 ℃预变性10 min、95 ℃变性15 s、60 ℃退火30 s、72 ℃延伸30 s,共40 个循环,4 ℃保存,选取GAPDH作为内参。取目的基因Ct值计算沉默效率,PLCβ1、PLCβ4基因沉默效率均>70%,达到基因沉默技术的标准(>50%)。
1.4Orexin-A干预3组海马神经细胞转染并基因沉默后,各组均取一半细胞加入Orexin-A(终浓度100 nmol/L),于37 ℃、5% CO2培养箱中培养48 h。
1.5海马神经细胞凋亡率测算采用流式细胞术。Orexin-A干预48 h后,用预冷4 ℃无菌PBS充分洗涤细胞2次,取1×106/mL的细胞待检测;用250 μL结合缓冲液重新悬浮细胞浓度至2×105~5×105/mL;取195 μL细胞悬液加入5 μL Annexin V-PE,轻轻混匀后间隔3 min,加入10 μL浓度为20 μg/mL的7AAD溶液;混匀于室温避光孵育15 min;加300 μL结合缓冲液,轻轻混匀,采用流式细胞仪计算细胞凋亡指数。以上实验重复5次取均值。
1.6海马神经细胞中磷酸化ERK1/2(p-ERK1/2)表达检测采用Western blotting法。Orexin-A干预48 h,各组细胞去除培养基,4 ℃ PBS冲洗,加入细胞裂解液于冰上裂解20 min,14 000×g离心力离心,取上清进行蛋白定量测定,后按4∶1加入上样缓冲液,95 ℃加热5 min,取10 μg加入上样孔,12%分离胶分离蛋白后4 ℃恒流200 mA转膜1 h,5%脱脂奶粉于摇床室温封闭2 h,1×TBST震荡洗涤5 min×3次,p-ERK1/2单克隆一抗(1∶10 000)4 ℃孵育过夜,1×TBST震荡洗涤5 min×3次,HRP标记二抗(1∶5 000)37 ℃摇床孵育1 h,TBST洗涤后混合等体积发光液A液与B液孵育1 min,显影、定影。用Western blotting法检测p-ERK1/2表达水平,用Image J软件测量条带的灰度值,将p-ERK1/2与内参的灰度值进行比较,取对比值作为p-ERK1/2的相对表达量。以上实验重复5次取均值。

2结果
2.1Orexin-A对海马神经细胞凋亡指数的影响见表1。

表1 Orexin-A对海马神经细胞凋亡指数的
注:与同组不加Orexin-A比较,*P<0.05;与PLCβ1组加Orexin-A后比较,#P均<0.05。
2.2Orexin-A对海马神经细胞ERK1/2表达的影响见图1、表2。
3讨论
Orexin-A能够通过调节乙酰胆碱能、谷氨酸能和肾上腺素能等系统诱导海马突触可塑性的形成[4,5];能够产生Orexin的神经元可以发出神经纤维投射到大鼠中枢神经系统广泛区域,包括海马、杏仁核、纹状体、下丘脑前部等。海马是与学习记忆有关的重要脑区,任何原因导致海马的损害都会引起学习记忆能力下降。正常生理状态下,缺乏Orexin-A 或阻断其受体可导致学习记忆功能减退,另外睡眠剥夺容易损害海马依赖性记忆也已得到动物实验和临床的证实[6,7]。本研究采用24 h内出生的Wistar大鼠幼鼠的海马组织作为实验标本,新生的乳鼠具有完整的海马神经细胞,3组海马神经细胞纯度均>95%。利用快速眼动睡眠期睡眠剥夺可诱导Orexin-A 过度表达,导致大鼠双侧海马神经细胞损害,给予OX1R 或OX2R 拮抗剂则能减轻睡眠剥夺的不利影响[8]。由此我们推测,睡眠剥夺可能通过过度诱导Orexin信号系统的激活来损害学习记忆。
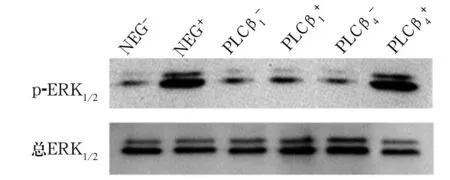
图1 Orexin-A对海马神经细胞内p-ERK1/2表达的影响
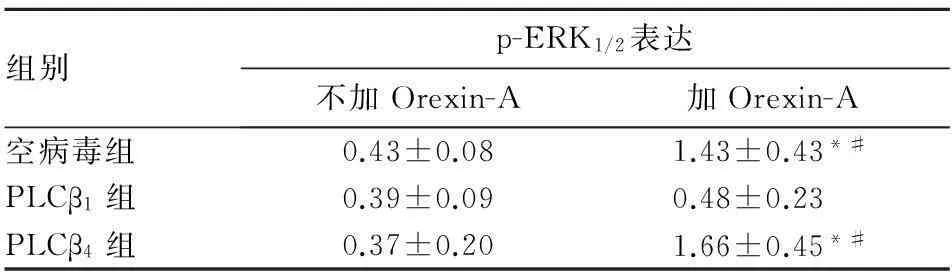
组别p-ERK1/2表达不加Orexin-A加Orexin-A空病毒组0.43±0.081.43±0.43*#PLCβ1组0.39±0.090.48±0.23PLCβ4组0.37±0.201.66±0.45*#
注:与同组不加Orexin-A比较,*P<0.05;与PLCβ1组加Orexin-A后比较,#P<0.05。
PLCβ1主要表达于端脑,包括海马、大脑皮质、杏仁核、侧间隔和嗅球,PLCβ4除在小脑的浦肯野纤维高水平表达外,还表达于海马、丘脑和中隔等,且PLCβ1和PLCβ4在胎儿晚期开始表达。因此,本研究中出生24 h内的大鼠海马神经细胞主要表达PLCβ1和PLCβ4。本研究采用的慢病毒载体,一旦转染即可长期稳定表达,是基因沉默模型的理想选择。PLCβ1和PLCβ4的基因沉默效率均>70%,说明RNA干扰有效。本研究结果显示,空病毒组中加Orexin-A比不加Orexin-A的细胞凋亡指数低,说明Orexin-A对细胞有保护作用;PLCβ4组中加Orexin-A比不加Orexin-A的细胞凋亡指数低,说明Orexin-A也对细胞产生了保护作用,细胞通路没有被阻断;PLCβ1组中加Orexin-A和不加Orexin-A的细胞凋亡指数无明显差异,说明Orexin-A没有对细胞产生影响,细胞通路被阻断。由此我们推测,Orexin-A对海马神经细胞的作用主要依赖于OX1R/OX2R-Gq-PLCβ1信号途径。
ERK1/2是丝裂原活化蛋白激酶(MAPK)家族的一员,是将信号从表面受体传导至细胞核的关键。在此途径中, ERK1/2发生磷酸化(p-ERK1/2),即ERK1/2的活化形式,由胞质转位到核内,参与细胞增殖与分化、细胞骨架的构建、维持细胞形态、细胞凋亡等。Orexin-A通过信号转导机制调节ERK1/2通路激活,具有剂量依赖性,表现为当Orexin-A增加至终浓度为100 nmol/L时,ERK1/2被最大激活[9]。所以本研究采用100 nmol/L的Orexin-A,以保证ERK1/2能够被充分激活。本研究结果显示,空病毒组中不加Orexin-A与加Orexin-A的ERK1/2表达有统计学差异,PLCβ4组中加Orexin-A与不加Orexin-A的ERK1/2表达有统计学差异,说明空病毒组和PLCβ4组Orexin-A所通过的信号转导通路没有被阻断,充分激活了ERK1/2。PLCβ1组中不加Orexin-A和加Orexin-A的细胞凋亡和ERK1/2表达无统计学差异,说明Orexin-A所通过的细胞信号转导通路被阻断,没有充分激活ERK1/2。与上述流式细胞术的结果一致。因此我们证实,Orexin-A对海马神经细胞的作用主要依赖于OX1R/OX2R-Gq-PLCβ1信号途径。
参考文献:
[1] Kaminski T, Smolinska N, Nitkiewicz A, et al. Expression of orexin receptors 1 (OX1R) and 2 (OX2R) in the porcine pituitary during the oestrous cycle[J]. Anim Reprod Sci, 2010,117(1-2):111-118.
[2] Steiner MA, Sciarretta C, Brisbare-Roch C, et al. Examining the role of endogenous orexins in hypothalamus-pituitary-adrenal axis endocrine function using transient dual orexin receptor antagonism in the rat[J]. Psychoneuroendocrinology, 2013,38(4):560-571.
[3] 赵璇,唐吉友,任延艳,等.Orexin-1受体拮抗剂对慢性点燃癫痫大鼠学习记忆的影响及海马神经细胞的增殖变化[J].中国临床神经科学,2012,20(3):247-253.
[4] Meerlo P, Mistlberger RE, Jacobs BL, et al. New neurons in the adult brain: the role of sleep and consequences of sleep loss[J]. Sleep Med Rev, 2009,13(3):187-194.
[5] Yan J, He C, Xia JX, et al. Orexin-A excites pyramidal neurons in layer 2/3 of the rat prefrontal cortex[J]. Neurosci Lett, 2012,520(1):92-97.
[6] Havekes R, Vecsey CG, Abel T. The impact of sleep deprivation on neuronal and glial signaling pathways important for memory and synaptic plasticity[J]. Cell Signal, 2012,24(6):1251-1260.
[7] Vecsey CG. Baillie GS, Jaganath D, et al. Sleep deprivation impairs cAMP signalling in the hippocampus[J]. Nature, 2009,461(7267):1122-1125.
[8] Ni LY, Zhu MJ, Song Y, et al. Pentylenetetrazol-induced seizures are exacerbated by sleep deprivation through orexin receptor-mediated hippocampal cell proliferation[J]. Neurol Sci, 2014,35(2):245-252.
[9] Guo Y, Feng P. OX2R activation induces PKC-mediated ERK and CREB phosphorylation[J]. Exp Cell Res, 2012,318(16):2004-2013.
Influence of Orexin-A on apoptosis of rat hippocampal nerve cells
CHIHeng1,LIGuohua,TANGJiyou
(1ShandongProvincialQianfoshanHospital,Jinan250014,China)
Abstract:ObjectiveTo invesitage the effect of Orexin-A on the apoptosis of rat hippocampal nerve cells and the mechanism of action. MethodsThe primary cultured hippocampal nerve cells from 36 Wistar rats were randomly divided in the empty virus group, PLCβ1 group and PLCβ4 group which were respectively transfected by empty vectors, lentiviruses with PLCβ1 and lentiviruses with PLCβ4. After the transfection, all three groups were further divided into subgroups treated with Orexin-A respectively for 8 h. We investigated the expression of ERK1/2by Western blotting and apoptosis rate was measured by flow cytometry for each subgroup.ResultsAfter treatment of Orexin-A, the expression of ERK1/2was increased and the apoptosis rate was decreased significantly in the PLCβ4 group and empty virus group (all P<0.05). However, these changes in the PLCβ1 group were not obvious after treatment with Orexin-A (all P>0.05).ConclusionOrexin-A may decrease the apoptosis of rat hippocampal nerve cells, and this function may be related with OX1R/OX2R-Gq-PLCβ1 signaling pathway.
Key words:Orexin-A; hippocampal nerve cells; apoptosis; extracellular signal-regulated kinase 1/2; rats
(收稿日期:2016-01-06)
中图分类号:R741
文献标志码:A
文章编号:1002-266X(2016)09-0010-03
doi:10.3969/j.issn.1002-266X.2016.09.004
通信作者简介:唐吉友(1963-),男,主任医师,博士,主要研究方向为睡眠与学习记忆。E-mail:tangjiyou@sohu.com
作者简介:第一池恒(1990-),女,硕士研究生,主要研究方向为睡眠与学习记忆。E-mail:hedwigchi@qq.com
基金项目:山东省自然科学基金资助项目(ZR2012HM068);国家自然科学基金资助项目(81471345)。

