植酸酮对宫颈癌细胞株中HPV16/18 E6/E7 mRNA及蛋白表达的影响
王侃,高晓丽,田文艳,岳天孚
(天津医科大学总医院,天津300052)
植酸酮对宫颈癌细胞株中HPV16/18 E6/E7 mRNA及蛋白表达的影响
王侃,高晓丽,田文艳,岳天孚
(天津医科大学总医院,天津300052)
摘要:目的观察植酸酮对宫颈癌细胞株中HPV16/18 E6/E7 mRNA及蛋白表达的影响。方法 体外培养Caski细胞株(含HPV16)与Hela细胞株(含HPV18),将所有细胞分成实验1、2、3、4组和对照组,每组均包含Caski细胞和Hela细胞。实验1、2、3、4组分别加入含58.6、117、586、5 860 mg/L植酸酮的培养液,对照组加入不含植酸酮的培养液。各组培养72 h后,采用real-time PCR法分别检测HPV16/18 E6/E7 mRNA,采用Western blotting法检测E6/E7蛋白。结果实验1、2、3、4组同一型别细胞中E6/E7 mRNA及蛋白相对表达量低于对照组,且实验1、2、3、4组E6/E7 mRNA及蛋白相对表达量依次降低(P均<0.05)。各实验组内,Caski细胞中E6/E7 mRNA相对表达量低于Hela细胞(P均<0.05)。各实验组内同一型别细胞中,E6 mRNA相对表达量低于E7 mRNA(P均<0.05)。结论 植酸酮可下调人宫颈癌细胞株中HPV16/18 E6/E7 mRNA及蛋白表达,且作用呈剂量依赖性;植酸酮对HPV16 E6/E7 mRNA的抑制作用强于HPV18 E6/E7 mRNA,并可能以抑制E6 mRNA表达为主导。
关键词:植酸酮;人乳头瘤病毒16;人乳头瘤病毒18;E6蛋白;E7蛋白;宫颈癌;Caski细胞株;Hela细胞株
高危型人乳头瘤病毒(HPV)持续感染是宫颈癌发生的重要原因[1~3]。植酸酮是一种植物提取物,前期研究[4, 5]发现,植酸酮治疗高危型HPV感染合并CIN Ⅰ有显著疗效,并能有效抑制宫颈癌Hela细胞生长。HPV基因整合进人类宫颈细胞后,E6、E7蛋白表达失控,并与致癌基因p53、Rb相互作用,发挥致癌作用[6~8]。研究[9]表明,Caski细胞株和Hela细胞株分别整合了HPV16、HPV18基因,且不存在交叉。本研究观察了不同浓度植酸酮对宫颈癌Caski细胞株(含HPV16)与Hela细胞株(含HPV18)中E6/E7 mRNA及蛋白表达的影响,为植酸酮抗HPV治疗宫颈病变提供理论依据。
1材料与方法
1.1实验材料与试剂Hela细胞由南开大学生命科学院刘新奇教授实验室惠赠,腺癌细胞,含HPV18基因;Caski细胞由中国医学科学院基础医学研究所惠赠,鳞癌细胞,含HPV16基因;植酸酮妇科清洗装置Ⅱ型(植酸酮1号)由天津贤博医疗科技有限公司惠赠。MTT购自上海生工生物工程股份有限公司,总RNA提取试剂TRIzol购自美国Invitrogen公司,DNA Marker购自大连宝生物工程有限公司,辣根过氧化物酶、羊抗鼠免疫球蛋白二抗、鼠源性HPV18 E7 单克隆抗体购自Santa cruz biotechnology公司,鼠源性HPV16 E6+HPV18 E6 单克隆抗体、鼠源性HPV16 E7 单克隆抗体购自Abcam公司。
1.2Caski、Hela细胞培养及植酸酮用药方法取对数生长期的Hela细胞及Caski细胞,分别置于DMEM(完全高糖)培养基及RPMI1640培养基,37 ℃、5% CO2环境中培养24 h至细胞贴壁。将所有细胞分成实验1、2、3、4组和对照组,每组均包含Caski细胞和Hela细胞。实验1、2、3、4组分别加入含58.6、117、586、5 860 mg/L植酸酮的培养液,对照组加入不含植酸酮的培养液,各组均设6个复孔。培养72 h后进行相关基因和蛋白检测。
1.3各组细胞中HPV16/18 E6/E7 mRNA检测提取各组总RNA,逆转录为cDNA,进行PCR反应,根据Genbank里的基因数据,使用Primer Premier6和Oligo7软件设计引物序列。内参为β-actin。设定对照基因表达量为100,以目的基因占对照基因相对百分含量代表目的基因表达量。
1.4各组细胞中HPV16/18 E6/E7蛋白检测裂解细胞,离心,留取样本用BCA法测定蛋白浓度,制备分离胶、浓缩胶,上样,电泳。将电泳后凝胶上的蛋白转移至聚偏二氟乙烯膜,ECL显色曝光。目的蛋白相对表达量=目的蛋白条带灰度值/β-actin条带灰度值。
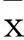
2结果
实验1、2、3、4组同一型别细胞中E6/E7 mRNA相对表达量低于对照组,且实验1、2、3、4组E6/E7 mRNA相对表达量依次降低(P均<0.05)。各实验组内,Caski细胞中E6/E7 mRNA相对表达量低于Hela细胞(P均<0.05)。各实验组内同一型别细胞中,E6 mRNA相对表达量低于E7 mRNA(P均<0.05)。实验1、2、3、4组同一型别细胞中E6/E7蛋白相对表达量低于对照组,且实验1、2、3、4组E6/E7蛋白相对表达量依次降低(P均<0.05)。见表1。
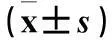
表1 各组细胞中HPV16/18 E6/E7 mRNA及蛋白表达比较
注:与对照组同一型别细胞相比,*P<0.05;与实验1组同一型别细胞相比,#P<0.05;与实验2组同一型别细胞相比,△P<0.05;与实验3组同一型别细胞相比,☆P<0.05;与同组内Caski细胞相比,*P<0.05;与同组、同一型别细胞中E7 mRNA表达量相比,※P<0.05。
3讨论
宫颈癌已经明确为感染性疾病,HPV疫苗的开发为宫颈癌的防治开辟了新的途径。但对于已经感染HPV者,目前尚无疗效确切的药物。植酸酮妇科清洗装置分为1号和2号两种,前者主要用于清除HPV,后者主要用于治疗后的养护及巩固疗效。植酸酮妇科清洗装置的活性成分为植物提取素,含植酸、硅酮、黄酮等。我们前期研究[4,5]表明,植酸酮妇科清洗装置2号治疗高危型HPV感染合并CIN Ⅰ疗效显著,且该药对含HPV16基因的Caski细胞株和含HPV18基因的Hela细胞株有增殖抑制作用,作用呈剂量依赖性。
目前认为HPV主要通过E6、E7蛋白发挥致癌作用。HPV诱发宫颈癌可分为三个过程:HPV DNA整合到宿主细胞DNA中,E6、E7表达失控,E6、E7蛋白发挥致癌作用[10~12]。HPV基因整合进人类宫颈细胞后,E6、E7基因转录后产生的蛋白是病毒复制至关重要的分子。在HPV导致的宫颈细胞恶变过程中,E6、E7蛋白还与p53、Rb之间存在相互作用,共同调节细胞基因组稳定性、转录活性和细胞代谢,最终导致宫颈癌的发生[13~15]。
本研究以不同浓度植酸酮作用于Caski细胞株、Hela细胞株,发现植酸酮对宫颈癌细胞中E6/E7 mRNA及蛋白表达均有抑制作用,且作用呈剂量依赖性;各实验组内,Caski细胞中E6/E7 mRNA相对表达量低于Hela细胞;各实验组内同一型别细胞中,E6 mRNA相对表达量低于E7 mRNA。上述结果提示,植酸酮对宫颈癌细胞的增殖抑制作用可能是通过下调HPV16/18 E6/E7基因及蛋白表达实现的。研究[16]表明,将E6基因转染到上皮细胞内,可引起细胞恶性转化,E6基因本身即有较强的致癌作用。本实验中,植酸酮对HPV16基因的抑制作用强于HPV18基因,并可能以抑制E6 mRNA表达为主。
结合上述研究结果,我们认为,植酸酮对人宫颈癌细胞株中HPV16/18 E6/E7 mRNA及蛋白表达有抑制作用,且作用呈剂量依赖性;植酸酮对不同型别宫颈癌细胞株中HPV E6、E7 mRNA的抑制作用也存在差异。然而,由于体内和体外环境差异巨大,植酸酮在体内的作用是否与体外实验相同,尚需进一步研究证实。
参考文献:
[1] 陈万青,郑荣寿,曾红梅,等. 2011年中国恶性肿瘤发病和死亡分析[J].中国肿瘤, 2016,25(1):1-8.
[2] Walboomers JMM, Jacobs MV, Manos MM, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide[J]. J Pathol, 1999,189(1):12-19.
[3] zur Hausen H. Papillomaviruses in the causation of human cancers-a brief historical account[J]. Virology, 2009,384(2):260-265.
[4] 王滨,齐荣义,李俊魁,等.植酸酮治疗HPV感染合并CINⅠ期的临床疗效观察[J].国际妇产科学杂志,2012,39(5):535-536.
[5] 武志丹,杨志谋,岳天孚.四甲基偶氮唑蓝法测定植酸酮对HeLa细胞的作用[J].国际妇产科学杂志,2012,39(5):533-534.
[6] Mighty KK, Laimins LA. The role of human papillomaviruses in oncogenesis[J]. Recent Results Cancer Res, 2014,(193):135-148.
[7] Moody CA, Laimins LA. Human papillomavirus oncoproteins : pathways to transformation[J]. Nat Rev Cancer, 2010,10(8):550-560.
[8] Ganguly N, Parihar SP. Human papillmavirus E6 and E7 oncoproteins as risk factors for tumorigenesis[J]. J Biosci, 2009,34(1):113-123.
[9] 唐双阳,范瑞岗,余敏君,等.Daxx与PML在Hela和Caski细胞株的定位观察[J].中南医学科学杂志,2012,40(9):440-442.
[10] 卞美璐,陈庆云.人乳头状瘤病毒感染与子宫颈癌[J].中华全科医师杂志,2009,8(8):522-525.
[11]Ghittoni R, Accardi R, Chiocca S, et al. Role of human papillomaviruses in carcinogenesis[J]. Ecancer Med Sci, 2015,9(4):526.
[12] Klingelhutz AJ, Roman A. Cellular transformation by human papillomaviruses: lessons learned by comparing high-and low-risk viruses[J]. Virology, 2012,424(2):77-98.
[13] Yang L, Yang H, Wu K, et al. Prevalence of HPV and variation of HPV 16/HPV 18 E6/E7 genes in cervical cancer in women in South West China[J]. J Med Virol, 2014,86(11):1926-1936.
[14] Filippova M, Song H, Connolly JL, et al. The human papillomavirus 16 E6 protein binds to tumor necrosis factor (TNF) R1 and protects cells from TNF-induced apoptosis[J]. J Biol Chem, 2002,277(24):21730-21739.
[15] Moody CA, Laimins LA. Human papillomavirus oncoproteins: pathways to transformation[J]. Nature Reviews Cancer, 2010,10(8):550-560.
[16] Hong S, Laimins LA. Regulation of the life cycle of HPVs by differentiation and the DNA damage response[J]. Future Microbiol, 2013,8(12):1547-1557.
Effect of phytic acid ketone on expression of HPV16/18 E6/E7 mRNA and protein in human cervical cancer cell line
WANGKan,GAOXiaoli,TIANWenyan,YUETianfu
(TianjinMedicalUniversityGeneralHospital,Tianjin300052,China)
Abstract:ObjectiveTo observe the effects of phytic acid ketone on expression of HPV 16/18 E6/E7 mRNA and protein in human cervical cancer cells. MethodsThe Caski cells (containing HPV16) and Hela cells (containing HPV18) were cultivated in vitro and then divided into the experimental groups 1, 2, 3, 4 and the control group (each group contained Caski cell line and Hela cell line). The experimental groups 1, 2, 3, 4 were respectively treated with different concentrations of phytic acid ketone (58.6 mg/L, 117 mg/L, 586 mg/L, 5 860 mg/L) for 72 h. The levels of HPV16/18 E6/E7 mRNA were determined with real-time PCR. Western blotting was used to measure the expression levels of E6 and E7 proteins. ResultsE6/E7 mRNA and protein expression in the same type of cells of the experimental groups 1, 2, 3 and 4 was lower than that of the control group, and the E6/E7 mRNA and protein expression showed a decreasing tendency in the experimental groups 1, 2, 3 and 4 (all P<0.05). In each experimental group, E6/E7 mRNA expression in Caski cells was lower than that in Hela cells (all P<0.05).In the same type of cells of the experiential groups, the E6 mRNA expression was lower than that of E7 mRNA (all P<0.05). ConclusionsPhytic acid ketone could down-regulate the expression of E6/E7 mRNA and protein in human cervical cancer lines, which was in a dose-dependent manner. The inhibitory effect of phytic acid ketone on HPV16 E6/E7 mRNA was stronger than that on HPV18 E6/E7 mRNA and the suppression of E6 probably played a leading role.
Key words:phytic acid ketone; human papillomavirus 16; human papillomavirus 18; E6 protein; E7 protein; cervical carcinoma; Caski cell line; Hela cell line
(收稿日期:2015-12-01)
中图分类号:R711.74
文献标志码:A
文章编号:1002-266X(2016)07-0010-03
doi:10.3969/j.issn.1002-266X.2016.07.004
通信作者简介:岳天孚(1951-),男,主任医师,教授,主要研究方向为妇科肿瘤。E-mail: yuetianfu163@163.com
作者简介:第一王侃(1983-),男,硕士,主要研究方向为妇科肿瘤。E-mail: waking119@hotmail.com

