miR-146a(rs2910164)单核苷酸多态性与青海回族胃癌易感性
吉栋德,杨雪莹,王荣华,安 玲,李正娥,苏占海
(1.青海省人民医院;2.中国计量大学;3.青海大学附属医院肿瘤放疗科;4.青海红十字医院;5.青海大学医学院)
miR-146a(rs2910164)单核苷酸多态性与青海回族胃癌易感性
吉栋德1,杨雪莹2,王荣华3,安 玲1,李正娥4,苏占海5#
(1.青海省人民医院;2.中国计量大学;3.青海大学附属医院肿瘤放疗科;4.青海红十字医院;5.青海大学医学院)
目的 探讨miR-146a(rs2910164)单核苷酸多态性与青海回族胃癌易感相关关系。方法 采集42例青海回族胃癌患者(胃癌组)和38例正常者(正常组)胃黏膜组织基因组DNA,应用PCR-RFLP多态性检测方法,分析青海回族胃癌患者miR-146a(rs2910164)基因型G/G、G/C、C/C多态性特点。结果 miR-146a(rs2910164)三种基因型G/G、G/C、C/C在胃癌组和对照组中分别是45.2%、47.6%、7.1%和34.2%、47.4%、18.4%,G和A等位基因频率为0.69、0.31和0.58、0.42,其中基因型频率和等位基因频率在胃癌组和对照组之间无显著性差异(P=0.268,P=0.300)。结论 miR-146a(rs2910164)单核苷酸多态性三种基因型及等位基因分布频率在青海地区不存在地域性,与青海回族胃癌易感性无关。
miR-146a(rs2910164) 单核苷酸多态性 回族 胃癌易感性
miRNA是在真核细胞中较为保守的一组非编码RNA,通过调节mRNA的稳定性及翻译效率来对蛋白表达层面进行调控,从而控制蛋白相应的功能实现。miRNA在肿瘤组织和正常细胞中表达有差异性,并且具有组织特异性。因此利用检测miRNA表达特点,可以为肿瘤诊断、预防和治疗提供重要的指导[1-8]。单核苷酸多态性(single nucleotide polymorphism,SNP)作为常见的遗传标志之一,与疾病易感、药物敏感、肿瘤筛查性等有关。miRNA-146a位于人基因组5q33,研究发现miR-146a表达异常可能与肿瘤易感密切相关,如已在乳头状甲状腺癌、乳腺癌、肝癌、前列腺癌中发现miR-146a表达异常。深入研究发现,miR-146a前体pre-miRNA在其结构上有一个G/C单核苷酸多态性易导致miR-146a表达异常,使得肿瘤易感性提升[1,9-14]。胃癌的发生、发展和细胞内许多因子表达异常有关,如抑癌基因或细胞生长因子等发生突变。同时也发现一些基因多态性与胃癌易感性有关。
荣光宏等[15]发现回族胃癌患病率较高。因此,探讨回族胃癌易感因素具有重要意义。
本研究通过基因组学方法,探讨miR-146a(rs2910164)单核苷酸多态性与青海回族胃癌发病易感性关系。
1 材料与方法
1.1 材料
1.1.1 胃癌组和对照组基因组DNA收集
收集2012~2015年青海省人民医院、青海大学附属医院及西宁市回族医院42例回族胃癌患者(其中男性25例,女性17例,平均年龄为56.170±12.708岁)和38例正常回族者(其中男性21例,女性17例,平均年龄为55.400±12.071岁)胃黏膜组织,并用DNA提取试剂盒行DNA提取并纯化。
1.1.2 试剂和设备选择
TaqDNA聚合酶、10×PCR Buffer(without Mg2+:100mM Tris-HCl,pH 8.8,25℃;500mM KCl)、MgCl2(25mM)、dNTP(10mM)、6×DNA Loading Dye(生工,上海);PCR产物纯化回收试剂盒(生工,上海),限制性内切酶SacI(MBI,英国);基因组DNA提取试剂盒(碧云天,北京)。PCR反应扩增仪(加拿大 BBI公司);SW-CJ-1D洁净工作台(苏洁,江苏);DK-8D型电热恒温水槽(森信,上海);DYY-8型稳压稳流电泳仪(琪特,上海);YXJ-2离心机(湘仪,湖南);凝胶成像系统(Gene Genius,美国)。
1.2 研究方法
1.2.1 基因组DNA提取和纯化
将组织标本液氮速冻、研磨后,立刻用蛋白酶K行37 ℃水浴消化,然后按照基因组DNA提取试剂盒说明提取DNA并纯化,最后将基因组DNA溶解于200 μL nuclease-free water中,储存于-20 ℃冰箱中。
1.2.2 miR-146a(rs2910164) 单核苷酸多态性分析
单核苷酸多态性通过PCR-RFLP法分析,其主要过程为miR-146a(rs2910164)PCR扩增引物:Forward 5 '-TTC CAT GGG TTG TGT CAG TGT CAG ACG T-3';FN TTC CAT GGG TTG TGT CAG TGT CAG AGC T;Reverse 5'-TTT CTC ACA GGA ACT CAC ACT CCT T-3',反应条件是95 ℃ 10 min;95 ℃ 45 sec;65 ℃ 1 min;72 ℃ 1 min,共38个循环,最后于72 ℃反应8 min。 20 μL PCR 产物经过SacI限制性内切酶消化,上样于2%琼脂糖凝胶电泳进行电泳,并用DNA凝胶成像系统观察结果。
1.2.3 统计学处理
数据处理采用SPSS for windows 17 软件。结果分析采用卡方检验,P<0.05为差异统计学意义。
2 结果
2.1 miR-146a(rs2910164)基因多态性酶切结果
miR-146a(rs2910164)产物经过SacI酶切后基因多态性特点分别是不能被内切酶消化者为G/G基因型、杂合型为C/G基因型,而完全消化者为C/C基因型(图1)。
2.2 miR-146a(rs2910164)基因型和基因频率(表1)
表1显示,miR-146a(rs2910164)G/G、C/G和C/C基因型频率在青海回族胃癌组和对照组中分别是45.2%、47.6%、7.1%和34.2%、47.4%、18.4%,G和A等位基因频率为0.69、0.31和0.58、0.42,其中基因型频率在青海回族胃癌组和对照组间无显著性差异(P=0.268),G和A等位基因频率在青海回族胃癌组和对照组中亦无统计学意义(P=0.300)。
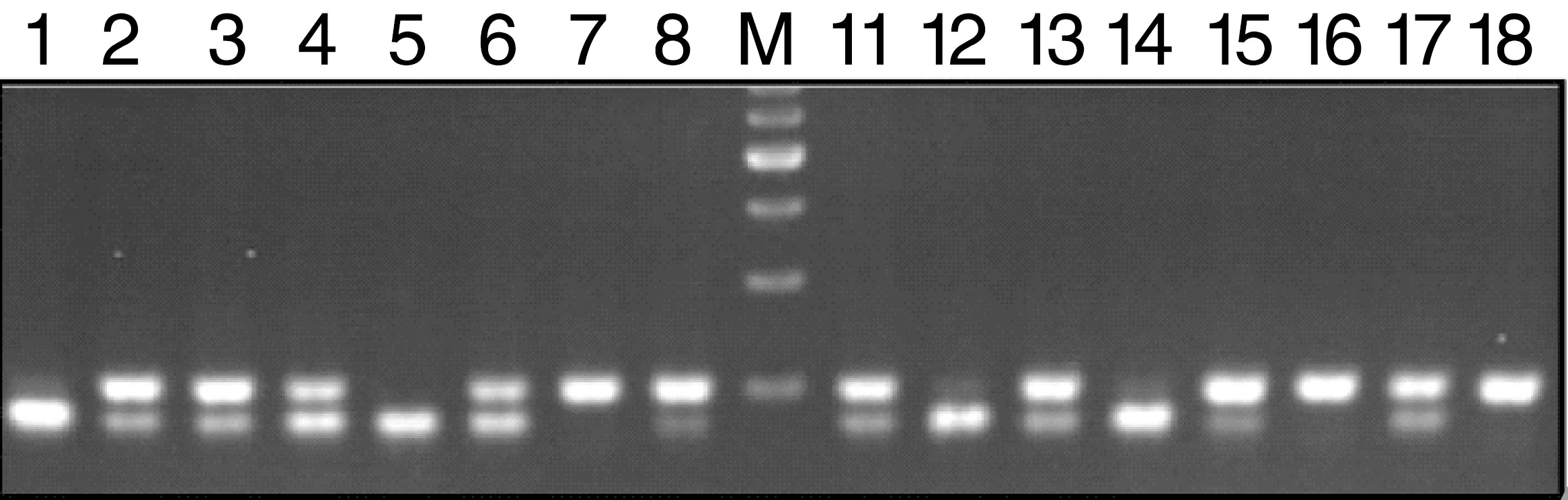
图1 miR-146a(rs2910164)PCR酶切基因多态性分析图
Figure1 Thegenetic polymorphisms of miR-146a (rs2910164) analyzedbyPCR
(M:DNA 马克;1、5、12、14为C/C型;2、3、4、6、8、11、13、15、17为C/G型;7、16、18为G/G型)(M:DNA marker;1、5、12、14are C/C genotype;2、3、4、6、8、11、13、15、17are C/G genotype;7、16、18 are G/G genotype)
表1 miR-146a(rs2910164)基因与青海回族胃癌发病风险的关系(%)

Table 1 Relationshipof genotype distribution of miR-146a (rs2910164) polymorphism with the risk
3 讨论
本研究结果显示,miR-146a(rs2910164)单核苷酸多态性三种基因型及等位基因分布频率在青海地区不存在地域性,与青海回族胃癌易感性无关。
胃癌的发生是一个多步骤多基因参与的过程,牵涉到很多因素,目前认为遗传因素、环境因素、生物因素(如幽门螺杆菌感染)和不良生活习惯及它们相互作用共同促成了胃癌的发生和发展。但个体对胃癌易感性的不同在胃癌发生中扮演重要的角色,而这种不同的易感性的遗传学基础是人类基因组DNA序列的变异性,其中最常见的是单核苷酸多态性(SNP),其占已知基因多态性的90%左右,说明其在遗传特异性、基因特异性及易感性研究方面占有明显的优势,如程序死亡因子-1(Programmed death-1,PD-1)、肿瘤生长因子(Tumor growth Factor)-beta-1因子多态性和胃癌易感性有密切关系;白介素-16(IL-16)、IL-17单核苷酸多态性与胃癌易感有关。对于胃癌患者预后与miR-146a(rs2910164)C>G多态性的关系,目前的研究结论尚不一致。在日本,预后最好的胃癌基因型为CC基因型[15-16]。由于CC基因型患者胃癌组织中的miR-146a表达较高,其通过下调白介素1受体相关激酶(IRAK1)和表皮生长因子受体(EG-FR)来抑制胃癌细胞迁移和浸润。因此miR-146a低表达的胃癌患者更容易发生血管侵犯和淋巴结转移,从而导致生存率下降[17-18]。而在韩国则相反,CC基因型的生存率却低于CG/GG基因型[19]。在希腊和德国,miR-146aC>G(rs2910164)多态性与胃癌患者的预后不具有相关性[20]。有Meta分析表明[21],亚洲人群中胃癌发生与miR-146aC>G(rs2910164)多态性具有相关性,而在高加索人群则不具有相关性。上述结论的不一致,可能主要与种族差异有关。
本研究显示,miR-146a(rs2910164)G/G、C/G和C/C基因型频率在青海回族胃癌和正常胃黏膜组织中表达无明显差异性,意即其单核苷酸多态性与青海回族胃癌易感性没有相关关系,不存在地域性差异。单个碱基突变有时候导致同义突变,蛋白整体功能不受影响,但是会提升其与其他蛋白、病原体或病毒的结合能力,如p53基因在单个碱基发生突变后,与病毒结合能力就有巨大的提高,导致个体对某种疾病的易感性就明显提升。虽然还未明确miR-146a(rs2910164)单核苷酸突变在致病分子机制中的具体作用,但是利用分子手段进行单核苷酸多态性分析,在临床上可对胃癌早期诊断和预测提供帮助。
[1]Williams AE,Perry MM,Moschos SA,et al.Role of miRNA-146a in the regulation of the innate immune response and cancer. Biochem Soc Trans[J],2008,36(6):1211-1215.
[2]Liu Z,Li G,Wei S,et al.Genetic variants in selected pre-microRNA genes and the risk of squamous cell carcinoma of the head and neck.Cancer[J],2010,116(20):4753-4760.
[3]Yue C,Wang M,Ding B,et al.Polymorphism of the pre-miR-146a is associated with risk of cervical cancer in a Chinese population.Gynecol Oncol[J],2011,122(1):33-37.
[4]Kumar S,Keerthana R,Pazhanimuthu A,et al.Overexpression of circulating miRNA-21 and miRNA-146a in plasma samples of breast cancer patients. Indian J Biochem Biophys[J],2013,50(3):210-214.
[5]Du J,Wang J,Tan G,et al.Aberrant elevated microRNA-146a in dendritic cells(DC)induced by human pancreatic cancer cell line BxPC-3-conditioned medium inhibits DC maturation and activation. Med Oncol[J],2012,29(4):2814-2823.
[6]Xiang Y,Fan S,Cao J,et al.Association of the microRNA-499 variants with susceptibility to hepatocellular carcinoma in a Chinese population.Mol Biol Rep[J],2012,39(6):7019-7023.
[7]Crone SG,Jacobsen A,Federspiel B,et al.microRNA-146a inhibits G protein-coupled receptor-mediated activation of NF-kappaB by targeting CARD10 and COPS8 in gastric cancer.Mol Cancer[J],2012,11:71.
[8]Lung RW,Wang X,Tong JH,et al.A single nucleotide polymorphism in microRNA-146a is associated with the risk for nasopharyngeal carcinoma.Mol Carcinog[J],2013,52(1):28-38.
[9]Jiang X.Different signal pathways regulate IL-1beta-induced mature and primary miRNA-146a expression in human alveolar epithelial cells.Acta Physiol Hung[J],2014,101(3):282-290.
[10]Liu X,Nelson A,Wang X,et al.MicroRNA-146a modulates human bronchial epithelial cell survival in response to the cytokine-induced apoptosis.Biochem Biophys Res Commun[J],2009,380(1):177-182.
[11]Perry MM,Adcock IM,Chung KF,et al.Role of microRNAs in allergic asthma:present and future.Curr Opin Allergy Clin Immunol[J],2015,15(2):156-162.
[12]Lukiw WJ,Andreeva TV,Grigorenko AP,et al,Studying micro RNA Function and Dysfunction in Alzheimer′s Disease[J].Front Genet2012,3:327.
[13]Naderi M,Hashemi M,Khorgami P,et al.Lack of Association between miRNA-146a rs2910164 and miRNA-499 rs3746444 Gene Polymorphisms and Susceptibility to Pulmonary Tuberculosis[J].Int J Mol Cell Med,2015,4(1):40-45.
[14]Lederhuber H,Baer K,Altiok I,et al.MicroRNA-146:tiny player in neonatal innate immunity[J].Neonatology,2011,99(1):51-56.
[15]荣光宏,熊元治.1979-2008年青海地区经胃镜检出胃癌6362例[J].世界华人消化杂志,2012,20(36):3777-3781.
[16]Okubo M,Tahara T,Shibata T,et al.Association between common genetic variants in pre-microR-NAs and the clinicopathological characteristics and survival of gastric cancer patients[J].Exp Ther Med,2010,6(1):1035-1040.
[17]Kogo R,Mimori K,Tanaka F,et al.Clinical significance of miR-146a in gastric cancer cases[J].Clin Cancer Res,2011,17(13):4277-4284.
[18]Hou Z,Xie L,Yu L,et al.MicroRNA-146a is down-regulated in gastric cancer and regulates cell proliferation and apoptosis[J].Med Oncol,2012,29(2):868-892
[19]Ahn DH,Rah H,Choi YK,et al.Association of the miR-14a C>G,miR-149 T>C,miR-196a 2T>C,and miR-499A>G polymorphisms witn gastric cancer risk and survival in the Korean population[J].Mol Carcinog,2013,52(1):39-51.
[20]Stenholm L,Stoehlmacher-Williams J,Al-Batran SE,et al.Prognophisms in advanced gastric cancer:a translational study of the Arbeitsgemeinschaft Internistische Onkologie(AIO)[J].Ann Oncol,2013,24(10):2581-2588.
[21]Wang J,Bi J,Liu X,et al.Has-miR-146a polymor-phism(rs2910164)and cqncer risk:a meta-analys of 19 case-control studies[J].Mol Biol Rep,2012,39(4)4571-4679.
Relationship of single nucleotide polymorphisms of miR-146a(rs2910164)with the susceptibility of gastric cancerin Qinghai Hui patients
Ji Dongde1,Yang Xueying2,Wang Ronghua3,An Ling1,Li Zhenge4,Su Zhanhai5#
(1.The people′s hospital of Qinghai Province;2.Chinese Universityof Metrology;3.Qinghai University Affiliated Hospital;4.Qinghai Red Cross Hospital;5.Qinghai University Medical College)
Objective To study the relationshipofmiR-146a(rs2910164)single nucleotide polymorphismswith the susceptibility ofgastric cancer in Qinghai Hui patients.Methods 42 gastric cancer tissues and 38 normal mucosa from patientswithgastriccancerinHui ethnic peoplewere selected,the genome DNA wasisolated and miR-146a(rs2910164)genotypes G/G,G/C and C/C single nucleotide polymorphisms were analyzed by PCR-RFLP.Results The genotype of miR-146a(rs2910164)G/G,G/C,C/C in the gastric cancer group and in the control groupwere 45.2%,47.6%,7.1% and 34.2%,47.4%,18.4%,respectively.The allele frequent of G and C in gastric cancer group and in the control group were 0.69,0.31 and 0.58,0.42,respectively.The frequent of genotype and allele between gastric cancer group and control group werenot statistically different(P=0.268,P=0.300).Conclusions The single nucleotide polymorphism of miR-146a (rs2910164)is not correlated with the susceptibility of gastric cancer in Qinghai hui patients.
miR-146a(rs2910164) Single nucleotide polymorphism QinghaiHuiethnicpatientswithgastric cancer susceptibility
R735.2
A
10.13452/j.cnki.jqmc.2016.02.010
2015-09-08
吉栋德(1978~),男,汉族,青海籍,主治医师. #:通信作者,教授,博士生导师,Email:suzhanhai@qhu.edu.cn

