氮对土壤中精甲霜灵残留量及其微生物的影响
杨艳梅 郑 毅 范茂攀 丁 凯
(1.云南云天化国际农业生产资料有限公司,云南昆明650051;2.西南林业大学林学院,云南昆明650224;3.云南农业大学资源与环境学院,云南昆明650201)
氮对土壤中精甲霜灵残留量及其微生物的影响
杨艳梅1,2郑 毅2范茂攀3丁 凯3
(1.云南云天化国际农业生产资料有限公司,云南昆明650051;2.西南林业大学林学院,云南昆明650224;3.云南农业大学资源与环境学院,云南昆明650201)
为了解氮素的存在对进入红壤中精甲霜灵残留的影响,本研究通过室内培养和盆栽试验,设定了N0、N1/2、N、N3/2分别为0.0、37.5、75.0、112.5mg/kg 4个氮肥水平,添加8.1mg/kg的精甲霜灵溶液,并采用甲醇浸提土壤中精甲霜灵,FID气相色谱法检测,研究了土壤中残留精甲霜灵的降解情况。结果表明:精甲霜灵在土壤中的降解存在吸附-解吸的现象,且消解动态符合一级动力学方程;在4个不同氮水平中,75.0mg/kg水平下精甲霜灵在红壤中的降解最快;微生物数量在施精甲霜灵后2 h~7 d都急剧减少,在第7天后开始增加。不同氮水平下土壤中微生物数量最终呈现出N>N3/2>N1/2>N0的趋势,N、N3/2水平与其他水平间的差异均达显著程度,而N和N3/2水平间差异不显著。施药后17 d,微生物数量开始恢复,氮素和残留的精甲霜灵都成了微生物的能源物质,促进了微生物的生长和繁殖。
氮;精甲霜灵;降解;红壤;微生物;残留量
Key words:nitrogen;metalaxyl-M;degradation;microorganism;residual amount
精甲霜灵又称高效甲霜灵,是甲霜灵两个异构体中的一个,即R-甲霜灵,化学名称为N-(2,6-二甲苯基)-N-(甲氧基乙酰基)-D-丙胺酸甲酯。精甲霜灵是一种具有保护治疗作用的内吸性杀菌剂,在多种作物上通过拌种、拌土、喷施等措施,专用于防治卵菌纲引起的霜霉病、霜疫霉病、疫病和晚疫病等病害。有研究显示,精甲霜灵对立枯丝核菌、瓜果腐霉菌和大豆疫霉菌菌丝生长抑制率分别达到100%、100%和84.82%[1],因此,精甲霜灵被广泛用于农业生产上。而病菌对精甲霜灵较容易产生抗性[2-4],也因此在农业生产中应用的精甲霜灵常与不同防病机制的农药进行复配,以达到更好的杀菌效果。罗志明等[5]用28.7%精甲霜灵·咯菌腈·噻虫嗪FS处理蔗种后发现甘蔗凤梨病的防效明显优于对照50%多菌灵WP,刘煜财等[6]试验发现11%精甲霜灵·咯菌腈·嘧菌酯的种衣剂对玉米丝黑穗病有较好的防治效果,冯铁瑛等[7]研究也发现选用6.25%精甲霜灵·咯菌腈FS对水稻立枯病的防治效果较好。进入土壤中的精甲霜灵主要靠微生物作用来进行降解[8],而进行复配后的精甲霜灵对微生物的作用可能就更强,如毒死蜱与百菌清复配后对微生物的抑制效果更强[9]。而施化肥是保证粮食稳定生产的一种必不可少的农业措施,相对有机质而言,化肥更容易被土壤微生物利用[10],因此,化肥的施用不仅直接影响土壤化学成分变化,而且还能引起土壤微生物活性的变化,进而引起土壤微生物群落结构改变,同时,化肥还能改变土壤的物理性状,影响土壤上植被的生长,从而间接影响土壤微生物群落结构[11]。而氮肥不仅在维持土壤有机碳的稳定性中占有重要的作用[12],还是影响微生物量碳的主导因素,无论是适量施用还是过量施用都会对微生物量碳有较大的影响[13];相反,土壤中若氮源不足,微生物生长则会受到抑制,因此加入氮肥后,微生物生长加快,活性提高,农药降解加快[14]。目前,施肥对农药降解的研究较少,McGhee等[15]试验发现,施用硝酸铵可以促进2,4-D降解,28 d后,施氮处理比对照增加了近2.5倍;王鸿显等[16]试验发现,过碳酰胺的施用可以促进Brij35的降解,且降解时间越长降解率越高。但更多研究表明,施用氮肥尤其是无机氮肥,农药降解会受到抑制[17-19]。因此,本试验通过研究氮肥水平与土壤中精甲霜灵残留的降解关系,以确定氮肥的施用是否会促进土壤中精甲霜灵残留的降解及适宜的施氮水平,为进一步的田间试验研究提供参考依据。
1 材料与方法
1.1 试验材料
1)土壤:土壤基本理化性状为,有机质36.25 g/kg,全氮1.28 g/kg,碱解氮153.19 mg/kg,pH 6.24;质地为粉质粘土,其中沙粒含量7.90%,粘粒含量45.98%,粉粒含量46.12%,TiO2含量6.01%;为山原红壤。
2)供试农药:68%精甲霜·锰锌水分散粒剂(先正达投资有限公司,中国)施用量为2 700 g/hm,精甲霜灵标准品(100μg/mL)由上海农药研究所提供。
3)肥料:尿素(N≥46.4%),过磷酸钙(P2O5≥14.0%),硫酸钾(K2O≥50.0%)。
4)供试作物:小白菜(Brassica rapa var.chinensis),金绿。
1.2 仪器与试剂
1)仪器:Agilent 7890A气相色谱仪(FID检测器),色谱柱为HP-INNOWax Polyethylene Glyco,30 m×320μm×0.5μm,可控温加热水浴锅均产自美国,往复式振荡器及实验室常用仪器均为国产仪器。
2)试剂:甲醇(色谱纯)、精甲霜灵标准品(纯度99.0%),甲醇、二氯甲烷、无水Na2SO4,NaCl;淀粉、硝酸钾、磷酸氢二钾、硫酸镁、琼脂(日本)、葡萄糖、蛋白胨、孟加拉红、链霉素,以上试剂若无特别强调,则均是分析纯的。
1.3 试验设计和处理
本试验分室内培养和大棚盆栽,都设4个处理:1)缺氮处理(N0),不施氮肥;2)低氮处理:正常供氮量的50%(N1/2);3)正常供氮处理(N);4)高氮处理:正常供氮的3/2倍(N3/2)。正常氮肥用量都为75mg/kg,氮磷钾肥配比为N∶P2O5∶K2O=1.0∶1.0∶2.5,溶于水;每个处理设4个重复。根据NY/T 788—2004《中华人民共和国农业行业标准农药残留试验准则》中推荐高剂量和推荐高剂量的1.5倍设置施精甲霜灵浓度。
1)室内培养试验:分别称取20.00 g风干土壤8份(过1mm筛孔),于口径9 cm的培养皿中,分别加入10.00mL肥料溶液,于通风橱中待溶剂挥发后,继续滴加10.00ml精甲霜灵溶液(浓度8.1mg/kg),待溶剂挥发后,将各组土壤充分混匀,然后分别转入250 mL三角烧瓶中,调节土壤水分至饱和持水量的60%。用棉塞将瓶口塞紧,置于25°C培养箱中恒温培养,当天(施精甲霜灵后2 h)、1、5、12、19 d取样测定土壤中精甲霜灵含量。
2)大棚盆栽试验:称取10.0 kg供试土壤(过1 cm筛孔)与基肥(N:60%,P2O5:100%,K2O:40%)混匀后装盆,然后移栽,待植株成活后浇灌900mL精甲霜灵溶液(浓度8.1 mg/kg),于施精甲霜灵后2 h、3 d、7 d、11 d、17 d取样测定土壤中精甲霜灵的含量。盆栽管理为,干旱时正常灌水,每次灌水1 L,植株进入旺长期(移栽后10 d)后进行追肥(N:40%,K2O:60%)。
1.4 取样与分析测定
对于室内培养试验,施精甲霜灵后按不同的间隔时间从培养箱里直接取出样品浸提。盆栽试验则用土钻于施精甲霜灵后不同的间隔时间进行采样,每盆分3~4点取土,混合后剔除石头等杂物后用四分法带走200 g左右,装入塑料自封袋贮藏于1~3℃的冰箱中。
1.4.1 精甲霜灵残留量测定
1)仪器条件:进样口温度为205℃,保持1min,然后以8℃/min进行升温至250℃,保持7min;载气为氮气,纯度≥99.999%;检测器温度为240℃;柱箱温度为240℃;H2流量为40 mL/min;空气流量为400mL/min;N2流量为26.939 mL/min;进样量为1.00μL;进样方式为不分流进样。上述色谱条件下,保留时间约12.375min,外标定量法测定。
2)标准曲线的绘制:在上述检测条件下,分别取浓度为1.00、5.00、10.00、15.00、20.00、40.00、60.00、100.00 ng/μL标准工作液,绘制精甲霜灵标准曲线,以峰面积作为定量指标,得回归方程为y=2.877 6x-8.632 6,r2=0.994 9,这证明在试验条件范围内仪器响应信号与进样量成良好的线性关系。
3)测定方法步骤:准确称取土壤20.00 g置于250mL三角瓶中,加入100 mL甲醇,震荡提取1 h,过滤,吸取滤液60 mL转入250 mL分液漏斗中,加入5%氯化钠溶液50 mL,用50、40、30m L二氯甲烷萃取3次,合并萃取液,过无水硫酸钠漏斗脱水,浓缩至近干(水浴70~80℃),1 mL甲醇溶解定容,过0.45 um滤膜,待检测[20-21]。
1.4.2 土壤微生物数量的测定 采用稀释平板计数法,参照文献[22]。
1.5 分析方法
数据用Excel 2010进行统计分析,差异性分析(Tukey法)和相关性分析用Spss 19.0软件分析。
2 结果与分析
2.1 不同施氮水平下精甲霜灵在土壤中的残留动态
在室内培养和盆栽条件下土壤中精甲霜灵的残留情况见图1~2。

由图1~2可知,无论在室内培养还是在盆栽条件下,精甲霜灵进入土壤后其降解规律都符合一级动力学消解方程CT=COe-KT,且相关系数都达显著水平。精甲霜灵在室内培养的降解过程中,第2次采样(施精甲霜灵后1 d)时其残留量增加至一个极值后又接着降低,而在盆栽中则未出现。施精甲霜灵后2 h,精甲霜灵在培养土壤中(图1)的残留量为34.05~39.46 ng/μL,在盆栽土壤中(图2)的残留量为12.48~15.57 ng/μL,显著低于培养土壤中的残留量;施精甲霜灵后1 d,培养土壤中精甲霜灵残留量除N水平外其他水平下的残留量增加了3.35%~27.85%,而在盆栽土壤中却降低了9.75%~51.03%;第5次采样时,培养土壤中的精甲霜灵降解了81.56%~87.24%,而在盆栽中降解了80.68%~88.76%,其残留量显著低于培养试验中的。研究结果表明,精甲霜灵在土壤中的残留除受植株的影响因素外,还受其他因素的影响。由图1~2可以得到培养和盆栽条件下精甲霜灵在土壤中的消解方程,见表1。

表1 不同试验条件下土壤中精甲霜灵的消解方程Tab.1 The dissipation equation ofmetalaxyl-M in soil under different test condition
由表1可知,在培养条件下精甲霜灵在土壤中的消解半衰期为1.97~2.29 d,N水平下的精甲霜灵残留降解最快,其次是N0、N1/2水平下的,N3/2水平下的降解得最慢。在盆栽试验中,精甲霜灵在土壤中的消解半衰期为1.55~2.06 d,在不同氮水平下,精甲霜灵降解的快慢趋势与室内培养一致。最终精甲霜灵在土壤中的残留量所呈现出的高低趋势也与消解半衰期得到的结果一致,即N3/2>N1/2>N0>N。试验结果表明,在N水平下,土壤中的精甲霜灵降解得较快。
2.2 不同施氮水平下土壤中微生物数量的变化
盆栽试验中不同氮水平下土壤中细菌、放线菌、真菌、微生物数量的变化情况见图3~6。
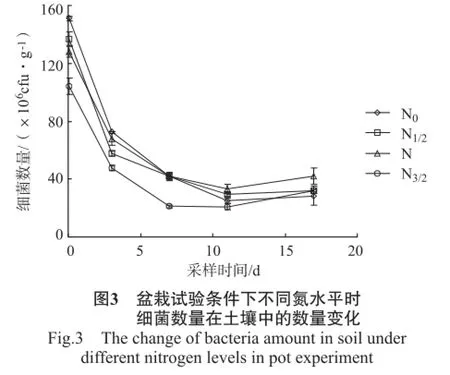
由图3可知,精甲霜灵施用后2 h,土壤中细菌的数量随施氮量的增加而减少,除N1/2和N水平之间外,其他氮水平间均达显著水平;精甲霜灵施用后2 h~3 d,不同氮水平下的细菌数量急剧减少,第3天后,减少速率减缓,至第11天后出现增加的情况;精甲霜灵施用后17 d,细菌数量N0水平显著低于N水平,而N水平与N1/2、N3/2水平间差异性却不显著。

由图4可知,施用精甲霜灵后2 h,在不同氮水平下土壤中放线菌数量呈现出N1/2>N0>N>N3/2的高低趋势,两氮水平间的差异显著。施用精甲霜灵后,N1/2、N、N3/2水平下的放线菌数量一直降低,至第11天后才出现增加的情况,而N0水平下的放线菌数量在减少至第7天后就开始增加,至第11天时出现极值后又再次降低,因此,精甲霜灵施用后17 d,放线菌数量低于其他氮水平,N0与N水平间差异显著,而N与N1/2、N3/2水平间差异不显著。
由图5可知,施用精甲霜灵后2 h,N水平土壤中真菌数量显著高于N1/2水平,而N1/2水平显著高于N3/2水平,N0水平真菌数量最低。2 h后,N0和N水平真菌数量的变化情况如放线菌数量的变化情况一样,但N水平真菌数量的降低程度和增加程度都比N0水平大;N1/2水平。土壤中真菌数量在施用精甲霜灵后2 h~17 d都在缓慢地减少,而N3/2水平真菌数量在施药后却出现增加情况,至第3天后才急剧降低,第7天真菌减少至最小值后急剧增加至第11天,第11天后再次减少;第17天时,N和N3/2水平真菌数量显著高于N1/2水平,而N1/2水平又显著高于N0水平。

由图6可知,施药后2 h,N1/2水平土壤中的微生物数量显著高于N0、N水平,N0、N水平又显著高于N3/2水平,N0、N水平间微生物数量无显著性差异;施药后2 h~7 d,土壤微生物数量急剧下降,至第7天时下降了54.39%~61.09%,N1/2、N水平下微生物数量显著高于N0水平,N0水平显著高于N3/2水平;施药7 d后,N0、N水平下的微生物数量出现了增加又降低的现象,即刺激效应;至第17天时,N0水平下的微生物数量下降得更低,而N水平却仍然出现了增加的趋势,N1/2、N3/2水平下的微生物数量自第7天起就开始恢复,至施药后17 d时,分别增加了5.62%、32.17%,而施用过克菌丹、氯硝胺后微生物数量要在施药后157 d才能恢复[23]。因此,氮素的存在促进了微生物数量的恢复,且在最终不同氮水平下土壤中微生物数量呈现出N>N3/2>N1/2>N0的趋势,N、N3/2水平与其他水平间的差异均达显著程度,而N和N3/2水平间差异不显著。

2.3 土壤氮素、微生物和精甲霜灵相互间的关系
土壤氮素与细菌、放线菌、真菌数量的相关性分析结果见表2。

表2 氮含量分别与细菌、放线菌、真菌数量的相关性Tab.2 The correlation of nitrogen levels and bacteria,actinomycetes and fungi amount amount
由表2可知,精甲霜灵施用后2 h~7 d,土壤氮素与细菌数量呈显著的负相关关系,说明此时期氮肥的施用抑制了细菌的生长;至第11天时,该相关性由负相关变为正相关,氮素促进了细菌的生长。对放线菌而言,在施用精甲霜灵后3天内,土壤氮素与其数量也呈显著的负相关关系;但在第7天时却呈一定的正相关关系,可在第11天时又恢复显著的负相关关系,这说明在施用精甲霜灵后2 h~11 d氮肥的施用不利于放线菌的生长;而在第17天时土壤氮素与放线菌数量呈显著的正相关关系,说明土壤氮素明显地促进了放线菌的生长。精甲霜灵施用后,土壤氮素与真菌数量的相关性除第7天外的其他时间点都是正相关关系,尤其是施药后11~17 d正相关关系达到显著水平,说明氮素的施用促进了真菌的生长繁殖。

表3 微生物数量与氮素及精甲霜灵残留量的相关性Tab.3 The correlation of nitrogen levels and microorganism's amount and the correlation of microorganism's amount and metalaxyl-M residues
土壤氮素与微生物数量、微生物数量与精甲霜灵残留量的相关性见表3。
由表3可知,施药后2 h~11 d,土壤氮素与微生物数量一直呈负相关关系,但负相关程度自施药第3天后就逐渐减弱,至第17天时变成了显著的正相关关系。微生物数量与精甲霜灵的残留量在施药后呈一定的负相关关系,然而在施药后第3天却变成显著的正相关关系;施药后7~11 d,微生物数量与精甲霜灵残留量呈显著负相关关系;在施药后17 d时也变成正相关关系。这说明施药后2 h~3 d,氮肥的存在抑制了微生物的生长,但是抗性微生物的存在可以利用土壤中精甲霜灵,从而降解精甲霜灵,而抗性微生物数量增长到一定程度后就转向土壤中较好利用的氮素,并以氮素为主要能源物质,因此在施药后7~11 d与氮肥水平的负相关程度减弱,故与精甲霜灵残留量呈显著负相关关系。施药后17 d,微生物数量开始恢复,氮素和残留的精甲霜灵都成了微生物的能源物质,促进了微生物的生长、繁殖。
3 结论与讨论
精甲霜灵在土壤中的降解符合一级动力学消解方程,然而在施用精甲霜灵后1天时发现室内培养条件下土壤中精甲霜灵残留量增加,但在大棚盆栽土壤中却未出现此种情况。本研究中精甲霜灵的消解半衰期较短,为1.55~2.29 d,而大多数研究表明精甲霜灵在土壤中的半衰期为2.91~12.77 d[21,24-26]。其主要原因如下:1)山原红壤理化性状与其他土壤明显不同。贺小敏[27]和Fernandes等[28]研究表明甲霜灵进入土壤后会与土壤颗粒进行明显的吸附-解吸过程;王化国等[29]研究显示,14C-甲霜灵用甲醇提取后,其未提取残留还可以释放出来;而本研究土壤中粘粒和粉粒共占了92.1%,对精甲霜灵的吸附可以造成巨大的影响,因此当被吸附的这一部分精甲霜灵被释放出来后,就能增加土壤溶液中精甲霜灵的含量。2)影响精甲霜灵降解的因素颇多。在盆栽试验中,除了植株这个因素与室内培养的条件不同外,土壤中的精甲霜灵很有可能发生了光解作用。虽然胡娟对甲霜灵在水中的稳定性进行了研究表明,在太阳光照射的条件下,甲霜灵在纯水中比较稳定[30],但影响精甲霜灵进行光解的因素较多;胡娟[31]研究结果也表明,甲霜灵在碱性缓冲液中较容易发生光解反应,其半衰期为6.49min,而TiO2对甲霜灵的光解也有一定的促进作用。大棚试验中,温度较高,土壤水分蒸发较快,为确保植株能正常生长和精甲霜灵不被淋失,需灌水次数较多,土壤就能长时间保持湿润状态,而光照条件成了一个不可控制的主要因素,因此在TiO2存在的情况下,土壤中的精甲霜灵必然会发生光解反应,进而使降解加快,以致没出现其残留量增加的情况。3)精甲霜灵与无机氮肥的施用存在明显的交互效应。土壤微生物的作用是影响精甲霜灵降解的主要因素[9,29],而精甲霜为广谱性杀菌剂,杀菌剂除了作用于靶真菌,对靶真菌以外的大多微生物种类也有不利的影响[32]。Atlas等[33]发现灭菌丹在施药后7~14 d能使真菌数量减少,但细菌数量却不受影响;Siegel[34]也发现苯菌灵的施用后,真菌数量减少了25%~35%,放线菌数量也减少,细菌数量却不受影响;Moorman[35]和Agnihotri[36]却发现克菌丹施用后,真菌数量减少而细菌数量增多。因此,精甲霜灵的施用势必会造成土壤中微生物群落结构的破坏,对农药的降解产生不利的影响。而Bailey和Coffey[37]发现微生物在没有其他物质为能源的条件下,是不能对精甲霜灵起降解作用的,但添加了蔗糖后微生物就能把精甲霜灵作为能源物质来进行代谢,且微生物可以对附近可利用的养分做出快速反应,并迅速吸收[38]。施入低浓度或适量的无机氮后就可被微生物迅速吸收利用,因此在精甲霜灵施用后2 h,N1/2水平下土壤中的微生物数量显著高于其他氮素,也就是说,适宜的氮肥施用量促进了土壤中精甲霜灵残留的降解。
在本研究中,精甲霜灵的消解半衰期较短,而土壤中残留的精甲霜灵在施药后17 d仍能检测到,说明精甲霜灵在土壤里出现了滞留的情况。而化学物质在环境中的转化及其立体选择性对作物中残留的影响主要是基于它们在环境中的持久性[39],因此植株中精甲霜灵的残留情况有待进一步研究。本试验是按NY/T 788—2004《农残试验准则》设计的残留试验,跟大田生物试验的结果还是有一定的出入,因此有必要进行进一步研究探讨。
[1] 杨明秀,张艳菊,张齐凤,等.精甲霜灵对大豆根腐病菌的毒力研究[J].东北农业大学学报,2012,43(7):22-25.
[2] 王文桥,王丽,韩秀英,等.北方五省(区)马铃薯晚疫病菌对甲霜灵和精甲霜灵的敏感性检测[J].植物保护,2012,38(3):116-121.
[3] 崔林开,李井干,陆静,等.大豆疫霉菌对甲霜灵抗性风险的研究[J].南京农业大学学报,2013,36(1):47-51.
[4] 路则宝.烟草黑胫病菌对苯基酰氨类杀菌剂-甲霜灵的抗性研究进展[J].农业灾害研究,2012,2(5):55-58.
[5] 罗志明,李文凤,黄应昆,等.28.7%精甲霜灵·咯菌睛·噻虫嗪FS防治甘蔗凤梨病田间药效评价[J].中国农学通报,2014,30(7):316-320.
[6] 刘煜财,王义山,郭冬梅,等.11%精甲霜灵·咯菌腈·嘧菌酯悬浮种衣剂防治玉米丝黑穗病试验[J].吉林农业科学,2014,39(3):56-58.
[7] 冯铁瑛,赵海涛,越刚.不同水稻种衣剂防治立枯病试验[J].吉林农业,2015(3):71.
[8] Baker K L,Marshall S,Nicol G W,et al.Degradation of metalaxyl-M in contrasting soils is influenced more by differences in physicochemical characteristics than inmicrobial community composition after re-inoculation of sterilised soils[J].Soil Biology and Biochemistry,2010,42(7):1123-1131.
[9] Xiaoqiang CH U,Hua F,Xuedong P A N,et al.Degradation of chlorpyrifos alone and in combination with chlorothalonil and their effects on soilmicrobialpopulations[J].Journal of Environmental Sciences,2008,20(4):464-469.
[10] 施开良.环境·化学与人类健康[M].北京:化学工业出版,2003.
[11] 时亚南,张奇春,王光火,等.不同施肥处理对水稻土微生物生态特性的影响[J].浙江大学学报(农业与生命科学版),2007,33(5):551-556.
[12] 李林.不同施氮水平对草甸黑土有机碳稳定性的影响[D].长春:吉林农业大学,2014.
[13] 王继红,刘景双,于君宝,等.氮磷肥对黑土玉米农田生态系统土壤微生物量碳、氮的影响[J].水土保持学报,2004,18(1):35-38.
[14] 谢文军,周健民,王火焰,等.施肥对土壤中农药降解的影响[J].土壤通报,2009,40(2):446-450.
[15] McGhee I,Burn RG.Biodegradation of2,4-dichlorophenoxy-acetic acid(2,4-D)and 2-methyl-4-chlorophenoxyacetic acid(MC-PA)in contaminated soil[J].Applied Soil Ecology,1995(2):143-154.
[16] 王鸿显,曹文,朱星儿.新型氮肥对土壤中有机污染物降解的影响[J].江苏农业科学,2013,41(10):292-294.
[17] Caracciolo A B,Giuliano G,Grenni P,et al.Effect of urea on degradation of terbuthylazine in soil[J].Environmental toxicology and chem istry,2005,24(5):1035-1040.
[18] Abdelhafid R,Houot S,Barriuso E.How increasing availabilities of carbon and nitrogen affectatrazine behaviour in soils[J].Biology and Fertility of Soils,2000,30(4):333-340.
[19] Alvey S,Crowley D E.Influenceoforganic amendments on biodegradation of atrazine as a nitrogen source[J]. Journal of Environmental Quality,1995,24(6):1156-1162.
[20] 李义强,曹爱华,马强,等.精甲霜灵在烟叶和土壤中的残留量和降解规律[J].烟草科技,2008(6):56-59.
[21] 曹爱华,李义强,孙惠青,等.烟草及土壤中精甲霜灵残留分析方法和降解规律研究[J].中国烟草科学,2007,28(3):35-37,42.
[22] 林先贵.土壤微生物研究原理与方法[M].北京:高等教育出版社,2010.
[23] Wainwright M,Pugh G J F.Effect of fungicides on the numbers ofmicro-organisms and frequency of cellulolytic fungi in soils[J].Plantand Soil,1975,43(1):561-572.
[24] 韩丙军,陈丽霞,汤建彪,等.精甲霜灵在热带气候土壤中的残留及消解动态研究[J].湖北农业科学,2009,48(1):190-192.
[25] 丁蕊艳,陈子雷,李瑞菊,等.马铃薯及土壤中精甲霜灵残留动态[J].农药学学报,2008,10(4):450-454.
[26] 陈莉,贾春虹,朱晓丹,等.精甲霜灵在西瓜和土壤中的残留动态[J].农药,2010,49(4):282-283.
[27] 贺小敏.农药在土壤粘粒矿物表面的吸附解吸与生物降解研究[D].武汉:华中农业大学,2008:1-31.
[28] FernandesM C,Cox L,Hermosín M C,et al.Adsorption-desorption of metalaxyl as affecting dissipation and leaching in soils:role ofmineral and organic components[J].Pestmanagement science,2003,59(5):545-552.
[29] 王化国,彭根元,齐孟文.14C-甲霜灵在土壤中的残留与降解动态[J].北京农业大学学报,1995,21(4):395-401.
[30] 胡娟.甲霜灵在水中的光化学降解[J].安徽农学通报,2008,14(14):58-58.
[31] 胡娟.甲霜灵的光化学降解研究[D].安徽:安徽农业大学,2008.
[32] Wainwright M.Effects of fungicides on the microbiology and biochemistry of soils:a review[J].Zeitschrift für Pflanzenern hrung und Bodenkunde,1977,140(5):587-603.
[33] Atlas R M,Pramer D,Bartha R.Assessmentof pesticide effects on non-target soilmicroorganisms[J].Soil Biology and Biochemistry,1978,10(3):231-239.
[34] Siegel M R.Benomyl-soil microbial interactions[J]. Phytopathology,1975.
[35] Moorman TB.A review of pesticide effects onmicroorganisms and microbial processes related to soil fertility[J]. Journal of production agriculture,1989,2(1):14-23.
[36] Agnihotri V P.Persistence of captan and its effects on microflora,respiration,and nitrification of a forestnursery soil[J].Canadian journal ofmicrobiology,1971,17(3):377-383.
[37] Bailey A M,Coffey M D.Characterization of microorganisms involved in accelerated biodegradation ofmetalaxyl and metolachlor in soils[J].Canadian Journal of Microbiology,1986,32(7):562-569.
[38] Farrell M,Prendergast-Miller M,Jones D L,et al.Soil m icrobial organic nitrogen uptake is regulated by carbon availability[J].Soil Biology and Biochemistry,2014,77:261-267.
[39] MarucchiniC,Zadra C.Stereoselective degradation ofmetalaxyl and metalaxyl-M in soil and sunflower plants[J]. Chirality,2002,14(1):32-38.
(责任编辑 韩明跃)
Effect of Nitrogen on Metalaxyl-M Residues and Microorganism in the Soils
Yang Yanmei1,2,Zheng Yi2,Fan Maopan3,Ding Kai3
(1.Yunnan YTH International Agricultural Means of Production Co.Ltd,Kunming Yunnan 650051,China;2.College of Forestry,Southwest Forestry University,Kunming Yunnan 650224,China;3.College of Resource and Environmental,Yunnan Agricultural University,Kunming Yunnan 650201,China.)
In order to find out the effectof nitrogen on themetalaxyl-M residue in the krasnozem,the nitrogen fertilizer levels of N0,N1/2,N and N3/2were separately set for 0.0 mg/kg,37.5 mg/kg,75.0 mg/kg and 112.5 mg/kg and 8.1 mg/kg ofmetalaxyl-M were added in the incubation experiment and the pot experiment,and the metalaxyl-M residue were extracted by methanol,then were detected by gas chromatography with FID to research the degradation ofmetalaxyl-M in krasnozem under four differentnitrogen levels.The results showed thatmetalaxyl-M residues were degraded with a processof adsorption-desorption in soil,and the dissipation dynamics could be described by first-order rate equation.The degradation speed rate of metalaxyl-M under nitrogen fertilizer levels of 75.0 mg/kg was the fastest among four different nitrogen fertilizer levels.The amount of soilmicroorganisms also rapidly reduced after themetalaxyl-M treatment during the 2h-7d,and returned at the 7thday.Themicrobe quantity in different nitrogen levels was N>N3/2>N1/2>N0;besides,itwas significant among N,N3/2level and others,butnot significantbetween N and N3/2.Microbe quantity began to recover after17 days.It suggested thatboth nitrogen and metalaxyl-M residue were energy substance formicroorganisms,promoting their growth and propagation.

S714.8
A
2095-1914(2016)02-0035-07
10.11929/j.issn.2095-1914.2016.02.006
2015-09-21
国家自然科学基金项目(31260504,31460551,31210103906)资助;国家“973”计划项目(2011CB100405)资助;农业部公益性行业科研专项课题项目(201103003)资助。
第1作者:杨艳梅(1989—),女,硕士生。研究方向:氮肥的施用对农药降解的影响。Email:yangyanmei_89@126.com。
郑毅(1964—),男,教授。研究方向:土壤肥料与病害控制。Email:yzheng@ynau.edu.cn。

