基于三维荧光光谱—平行因子分析技术的蠡湖CDOM分布特征
王书航,王雯雯,姜 霞,赵 丽,张 博 (中国环境科学研究院,环境基准与风险评估国家重点实验室,北京100012)
基于三维荧光光谱—平行因子分析技术的蠡湖CDOM分布特征
王书航,王雯雯,姜 霞*,赵 丽,张 博 (中国环境科学研究院,环境基准与风险评估国家重点实验室,北京100012)
摘要:利用三维荧光光谱(EMMs),并结合平行因子分析法,研究了蠡湖水体中有色可溶性有机物(CDOM)的分布特征及其来源,并探讨了不同组分荧光强度与其他水质因子间的相关性.结果表明,蠡湖水体中CDOM主要由2个荧光组分组成,分别为类色氨酸荧光组分C1(225,280/335)和类腐殖质荧光组分C2(250,300/435),并且C1和C2对总荧光强度的贡献率分别75.70%和24.30%.空间上C1和C2荧光强度自东向西依次递减,呈现东蠡湖高于西蠡湖、沿岸区高于湖心区的趋势.荧光指数(FI)、生物源指数(BIX)和腐殖化指数(HIX)都显示蠡湖水体CDOM来源于自生微生物、藻类等新近自生源,整体呈现弱腐殖质特征.相关性分析表明,CDOM与N、P元素的迁移转化密切相关,并且对透明度有重要影响.
关键词:蠡湖;有色可溶性有机物;三维荧光光谱;平行因子分析
* 责任作者, 研究员, jiangxia@ craes.org.cn
有色可溶性有机物(CDOM)表征的是溶解性有机物中带发色团的那部分,主要由氨基酸、腐质酸、富里酸、芳烃聚合物以及一些人类活动产生的有机污染物等一系列物质组成[1-3].一方面,CDOM作为水体中光和有效辐射的重要吸收物质,对水体透明度和沉水植物的光补偿深度具有重大影响[4];另一方面,可以通过各种物理化学过程,与水体中的颗粒物以及污染物,如矿物颗粒、金属离子、有机污染物等相互作用,从而影响水体污染物的分布、迁移转化、生物可降解性以及生物毒性[5-8],同时CDOM含有丰富碳、氮、磷等湖泊生源要素,在藻类水华暴发过程中扮演了非常重要的角色[9-10],因而受到越来越多研究者的关注.
对于受人类活动影响频繁的湖泊水体, CDOM的成分复杂且来源各异,目前很难对其有机成分进行全面分析.而作为较新兴的研究方法,三维荧光光谱法—平行因子分析法(EEMS-PARAFAC)在水体CDOM研究中的应用为广大水环境研究者提供了新的可能[11].Zhang等[12-14]对中国云贵高原区38个湖泊以及中营养湖泊天目湖进行了研究,识别出了腐殖质类组分和蛋白质类组分,认为其主要由流域物质以及湖泊中生物产生的内源物质构成;同时通过基于野外和实验室试验研究了藻类降解对太湖CDOM的贡献.Bai等[15]利用平行因子分析法分析后得到南黄海沿岸带和海域内CDOM荧光物质至少有4种组分:3种腐殖质类物质和1种蛋白质类物质.Singh等[16]利用EEMs-PARAFAC技术在墨西哥湾的巴拉塔里亚流域水体成功解析了CDOM的来源及组分.
通过近年来水环境综合治理,蠡湖水环境恶化趋势得到有效遏制,总氮(TN)、总磷(TP)、高锰酸盐指数(CODMn)、叶绿素a(Chla)等反映湖泊富营养化状态的关键指标均显著下降,但代表感观指标的SD和ρ(SS)没有显著改善[18-19].因此,作为影响水体透明度的重要因素,CDOM的空间分布及其组分将是蠡湖水环境治理重点关注内容之一.本文尝试应用EEMS-PARAFAC技术对蠡湖有色可溶性有机物的分布特征、组成及其来源进行初步研究,为进一步揭示CDOM在蠡湖的环境行为特征以及对对水体富营养化的贡献提供基础资料.
1 材料与方法
1.1 研究区域
蠡湖位于太湖北部,东西长约6km,南北宽0.3~1.8km,面积约8.6km2,是一个既相对独立又与太湖相通的水体.为方便讨论,以蠡堤、宝界桥和蠡湖大桥为边界将蠡湖划分为4个区域(图1),其中,A区和B区为西蠡湖,已经开展了底泥疏浚和水生植被重建工程,水质较好;C区和D区为东蠡湖,实施了沿岸整治工程,建有长广溪湿地和金城湾公园,但底泥污染较为严重[17].
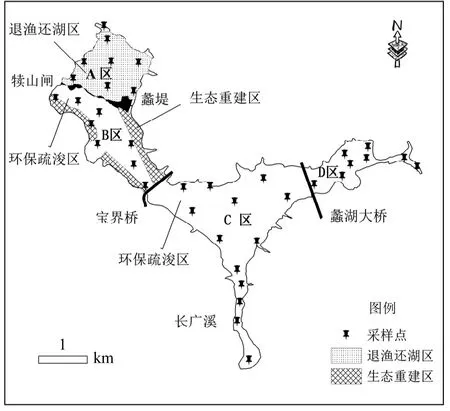
图1 蠡湖采样点分布示意Fig.1 Distribution of Sampling sites in Lihu Lake
1.2 样品的采集与处理
与2015年4月5日在蠡湖4个湖区设置了37个采样点位,每个采样点分别采集表层(0.5m)水样,于预先处理过的棕色玻璃瓶瓶中,现场测试指标包括溶解氧(DO)、透明度(SD)等,同时记录采样点环境.水样放入保温箱中送回实验室,过玻璃纤维微孔膜(Whatman GF/F,450℃马氟炉中灼烧5h后使用)后扫描CDOM三维荧光光谱,同时测定Chla、CODMn、溶解性有机碳(DOC)、溶解性总氮(DTN)、溶解性总磷(DTP)和氨氮(NH4+-N)和硝酸盐氮(NO3--N).
1.3 荧光光谱分析
荧光光谱用采用日立F7000荧光分析仪进行分析,使用150W氙灯为激发光源,9PMT电压设为700V;激发波长(λEx)扫描范围为200~450nm,发射波长(λEm)扫描范围为250~600nm,激发波长和发射波长增量均设为5nm,狭缝宽度为5nm,扫描速度为1200nm/min.为了尽量降低荧光淬灭作用,对扫描的样品进行稀释,直至其在波长254nm处的紫外吸光度小于0.1.
1.4 数据处理
1.4.1 平行因子算法 平行因子算法(PARAFAC)是基于三线性分解理论,采用交替最小二乘原理的迭代类型三维数阵分解算法,将一个由多个EEMs数据构成的三维阵列X分解为3个载荷矩阵后,对CDOM的三维荧光光谱进行解谱.将预处理好的数据,在Matlab12.0软件(美国Mathworks公司)中进行平行因子模型分析(PARAFAC),同时,采用裂半分析和残差分析检验PARAFAC模型的有效性,并确定最优的DOM组分数目[11].
1.4.2 CDOM荧光光谱的空白校正 为保证荧光光谱特性可比性,所得到的光谱均经过扣除超纯水空白后的矫正结果,以减少仪器条件和拉曼散射对荧光光谱的影响.通过扣除λEm<λEx+20nm的区域消除一级瑞利散射对EEMs的影响,通过扣λEm>2λEx-20nm的区域扣除二级瑞利散射对EEMs的影响,扣除部分用零替换.
1.4.3 荧光强度和荧光组分占总组分比例的计算 平行因子分析模型得出的是每种成分的相对荧光强度(scores),每种成分的荧光强度Ii按照以下公式计算[20]:
Ii= Scorei× Exi( λmax) × Emi( λmax)
式中:Scorei代表第i种成分的相对荧光强度;Exn(λmax)代表第n种成分激发负载的最大值;Emn(λmax)代表第n种成分发射负载的最大值.总荧光强度ITot和荧光组分占总组分比例Pi按照以下公式计算:
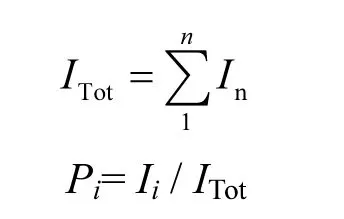
1.4.4 统计分析两组数据显著性差异 采用独立样本t检验,多组数据显著性差异采用单因素方差分析(one-way ANOVA).试验数据采用Excel2010、Origine9.0、suffer10.0以及SPSS19.0软件进行统计检验、绘图和分析.
2 结果与分析
2.1 不同区域水质参数特征
蠡湖不同区域采样点水质参数差异较大(表1).CODMn在3.31~8.12mg/L之间,平均为4.44mg/ L,C区和D区的含量较高.DOC浓度在9.16~ 22.35mg/L之间,平均为13.66mg/L,空间分布趋势与CODMn相似,两者呈显著正相关(P<0.01). DTN在C区最大,尤其是长广溪附近采样点位,都超过湖泊劣V类水质标准,可能是春季两侧绿化施肥随雨水进入蠡湖水体,导致蠡湖水体中氮,尤其是硝酸盐氮的含量明显升高.DTP在6.52~ 276.92µg/L之间,平均为29.13g/L,C区和D区的含量较高.SD空间分布趋势呈自西向东逐渐减小,在生态恢复较好的A区较高,平均值达到0.84m,D区最小,平均值仅为0.49m.Chl a含量在4.05~23.97mg/m3,平均为7.90mg/m3,C区显著高于其他区域;而DO在C区平均值较小,主要因为C的入湖河口较多,虽然大部分河口已经封堵,但河口水质明显差于湖体.
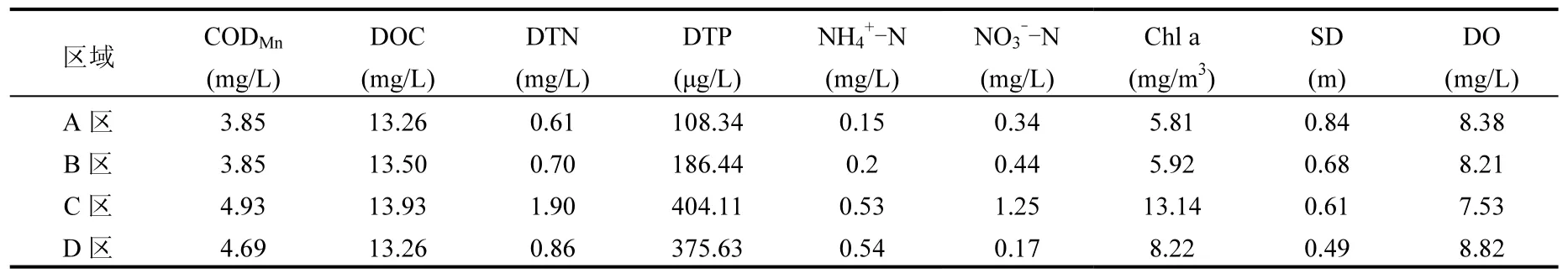
表1 蠡湖不同区域水质参数特征Table 1 Water quality parameters of different regions in Lihu Lake
2.2 水体CDOM的三维荧光光谱特征
蠡湖各采样点CDOM的三维荧光光谱图类似,主要有3个峰,即:类蛋白T1峰(λEx/Em= 225~ 230nm/320~350nm)、类蛋白T2峰(λEx/Em=270~ 285nm/320~340nm)和类腐殖质A峰(λEx/Em=220~ 230nm/380~440nm),同时还能观测到微弱的C峰(λEx/Em= 280~310nm/380~440nm).一般认为A峰和C峰反映的是外源输入的腐殖酸和富里酸形成的荧光峰值,而T1峰和T2峰则反映的是生物降解来源的色氨酸的荧光峰[1].各个点位荧光峰值出现的位置和强度的不尽相同,在A区、B区和D区类蛋白T1峰最为显著,而C区类腐殖质A峰最为显著,显示不同湖区部分水体采样点CDOM的来源不一样.蠡湖不同湖区部分水体采样点CDOM的三维荧光图谱如图2所示.
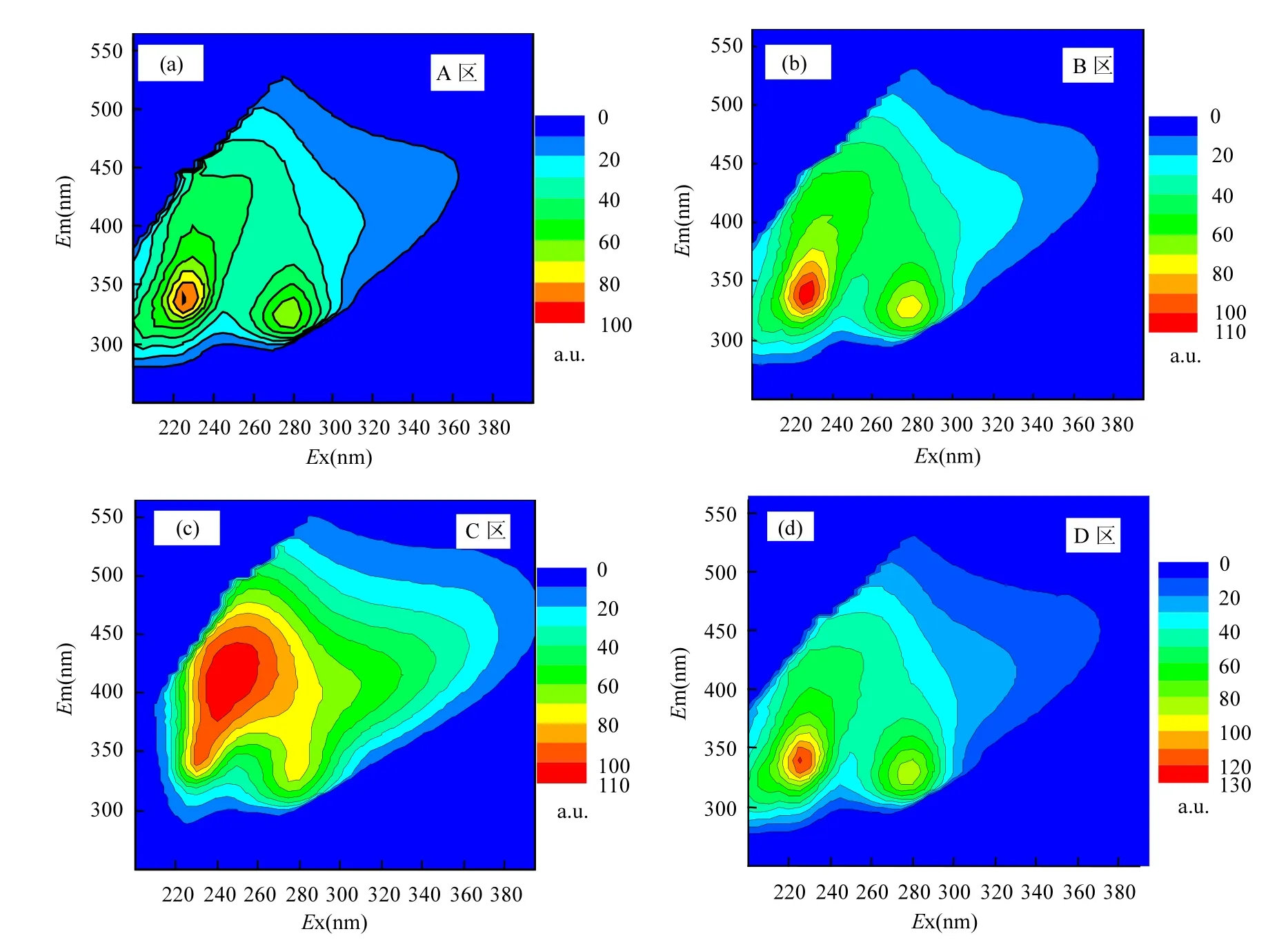
图2 蠡湖不同湖区部分水体采样点CDOM的三维荧光图谱Fig.2 The 3 DEEMs of CDOM of part sampling sites from different regions of Lihu Lake
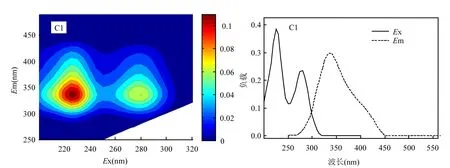
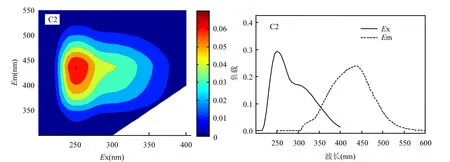
图3 蠡湖水体CDOM的2个组分的EEMS及最大激发/发射波长分布Fig.3 EEMs and the maximum excitation/emission wavelength distribution of two components of CDOM in water of Lihu Lake
利用PARAFAC模型对蠡湖水体CDOM的三维荧光光谱矩阵数据进行分析,主要解析出2个具有单一的最大发射波长CDOM荧光组分.2个荧光组分的最大激发/发射波长分布及主成分的三维荧光光谱见图3.
从图3可以看出,组分1在225nm和280nm存在两个明显激发波长,最大发射波长为335± 10nm附近,反映的是生物降解的类色氨酸形成的荧光峰;组分2在250nm以及300nm处存在明显的激发波长,最大发生波长在435±10nm,反映的是腐殖酸和富里酸形成的荧光峰[1,12].
2.3 水体CDOM各组分的荧光强度空间分布特征
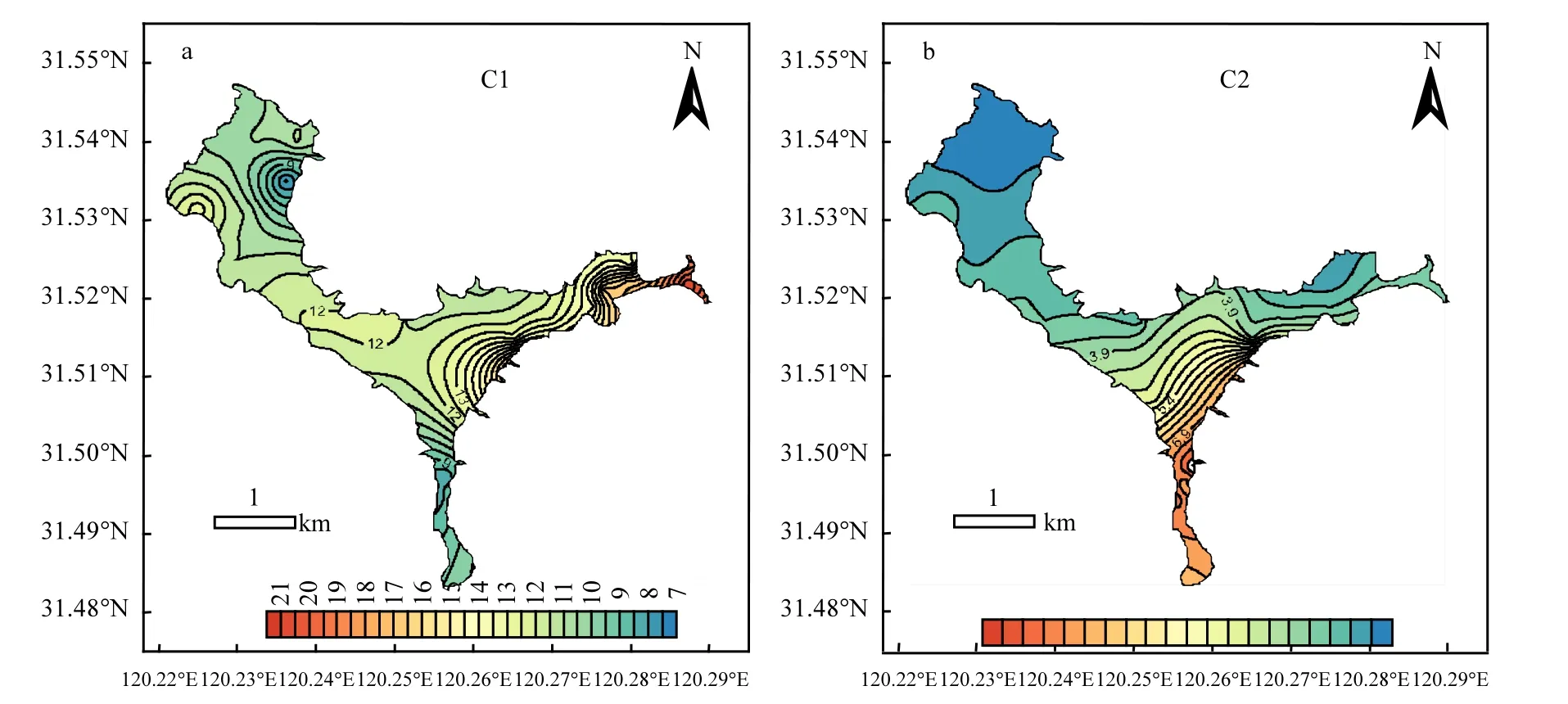
图4 蠡湖两种荧光组分 (C1和C2)荧光强度的空间分布Fig.4 Spatial distribution of fluorescence intensities for the two components (C1, C2) in Lihu Lake
蠡湖水体中CDOM各组分空间分布特征明显.各采样点上覆水中代表类色氨酸的C1的荧光强度在7.41~21.01之间,平均为11.95;代表类富里酸的C2的荧光强度在2.53~8.07之间,平均为3.85.总体来看,C1和C2荧光强度自东向西依次递减,呈现东蠡湖高于西蠡湖、沿岸区高于湖心区的趋势(图4a、图4b).同时可以看出,C1的高值区主要集中在D区,而C2主要集中在C区的长广溪区域,说明C1和C2的来源可能不同.
从各荧光组分占总组分比例的比例来看, C1占绝对优势,占总荧光强度的比例在52%~ 86%之间,平均为75.70%,其中在A区、B区、C区和D区的平均值分别为79.29%、79.00%、68.54%、75.70%.同时结合CDOM的三维荧光图谱可以明显看出,除长广溪区域个别点位外,蠡湖大部分湖区水体中CDOM主要以类蛋白质为主.
3 讨论
3.1 CDOM来源的辨识
CDOM的来源可以按陆源和生物来源进行区分,也可以按外源和内源进行区分.陆源由细菌和真菌降解流域土壤中高等动植物残体形成,多表现为类腐殖质峰占绝对优势;生物来源是指由水体中浮游生物、水生细菌、藻类等生物活动产生,多表现为类蛋白峰占绝对优势[13].荧光光谱特性是理想的表征天然水体中CDOM以及评估其来源的重要参数.荧光指数(FI)是在370nm激发波处,450nm与500nm发射波长下的荧光强度比值[21],后来修正为发射波长为470nm与520nm[22],可用来表征溶解有机质中腐殖质的来源,大于1.9说明主要来源于微生物代谢等过程,小于1.4说明陆源占主要贡献.本次研究中,采用I(370:470)/I(370:520)作为荧光指数,蠡湖各区域水体荧光指数范围为2.13~2.47,平均为2.22,说明各采样点生物来源作用大于陆源作用.
生物源指数(BIX)是310nm激发波长下380nm发射波长处荧光强度与420~435nm区间最大荧光强度的比值,反映了新产生的DOM在整体DOM中所占的比例,生物源指数越高,说明新近自生源组分的比例越高.Huguet等[23]指出,BIX 在0.6~0.7之间时,具有较少的自生成分;BIX在0.7~0.8时具有中度新近自生源特征;在0.8~1.0之间时,具有较强自生源特征;大于1.0是为生物细菌活动产生.蠡湖水体BIX指数在0.89~1.13之间,平均为0.96,说明各采样点整体处于较强的自生源特征,尤其是D区,平均值达到1.0.
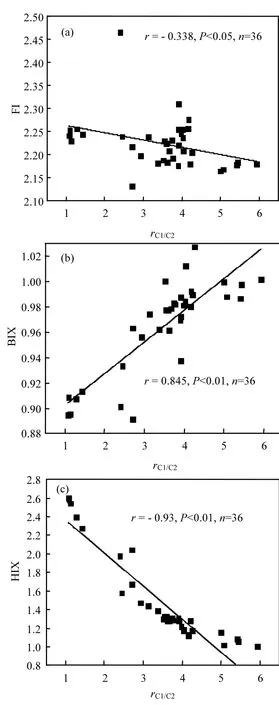
图5 蠡湖水体FI、BIX、HIX与rC1/C2的相关性分析Fig.5 The correlation analysis between FI、BIX、HIX and rC1/C2
腐殖化指数(HIX)用来表征有机质腐殖化的程度或成熟度,可以通过激发波长为254nm 时,发射波长从435~480nm的峰值面积比上300~345nm的荧光峰值面积计算.当HIX小于4 时,CDOM主要由生物活动产生,腐殖化程度较弱[24].本研究中,蠡湖水体HIX在1.00~2.60之间,平均为1.47,说明蠡湖的CDOM整体处于弱腐殖质特征.
综上所述,3种荧光指数对CDOM来源表征上都具有良好的指示性,都显示出蠡湖水体CDOM来源于自生微生物、藻类的自生源.除了以上3个表征CDOM荧光特性的常用指标外,还能利用CDOM中类蛋白组分的荧光强度与类腐殖质组分的荧光强度的比值来判断水体中CDOM来源,一般认为其比值大于1说明自生源占主要优势[25-27].本次研究中,C1与C2的比值在1.08~5.94之间,平均为3.52,并且与FI、BIX和HIX等反映水体CDOM来源的指数显著相关,见图5.
结合图5可以看出,rC1/C2与BIX、HIX呈极显著相关,而与FI呈负的显著相关,但相关性不明显,并且FI与BIX、HIX的相关性也不明显,说明在蠡湖这样的浅水湖泊中,用FI来指示CDOM的来源不太敏感.同时还可以看出,在图5(a)中有个明显的偏离点位,可能与其位于C区入湖河口处,周边有大片住宅有关,后期将做进一步研究.
2007年以后,无锡市政府根据蠡湖和太湖水质状况,对蠡湖与周边的一些重污染入湖河流实施闸控,保持蠡湖常年高水位,防止周边污水流入和渗入,因此,研究区的外源除了大气干湿沉降之外基本得到有效控制[19],本研究结果表明,蠡湖水体CDOM主要来源于自生微生物、藻类的自生源,与蠡湖的现状相呼应.
3.2 水体CDOM组分与其他水质参数的相关性
蠡湖水体CDOM的两个荧光组分(C1和C2)之间没有明显相关性,说明水体中类蛋白质与类富里酸在组成和来源上不尽相同,结合C1和C2的空间分布特征可以看出,C1荧光强度较大的区域主要分布于D区以及C区较为开阔的区域,而C2荧光强度较大的区域主要集中在长广溪区域及入湖河口处,进
一步说明,占绝对优势的C1主要来源于自生微生物、藻类的自生源,而占少量比重的C2可能来源于入湖河流及其两岸的陆源.两个荧光组分(C1和C2)都与DTN、NH4+-N、NO3--N、DTP、等营养盐呈显著正相关,说明CDOM与N、P元素的迁移转化密切相关.C1荧光强度与CODMn不呈显著正相关,而与DOC 呈极显著正相关,而C2、CTot都与CODMn和DOC呈极显著正相关,说明蠡湖水体中CDOM与DOC之间存在定量关系,可以相互替换;而C1荧光强度与CODMn不呈显著正相关,说明C1可能与CODMn没有氧化的部分有机物相关.
藻类的降解是CDOM的重要来源.Zhang 等[14]野外试验和降解实验数据均显示:藻类的降解是富营养化浅水湖泊中CDOM的重要来源之一.而本研究中,CDOM的组分,尤其是占绝对优势的C1与Chla相关性并不明显,可能与本次采样主要发生在4月份,除个别区域外蠡湖的藻类生物量整体较小有关.两个荧光组分(C1和C2)的荧光强度及总荧光强度CTot都与SD呈显著负相关,说明春季CDOM对透明度有重要影响.水体CDOM组分与其他水质参数的相关性见表2.
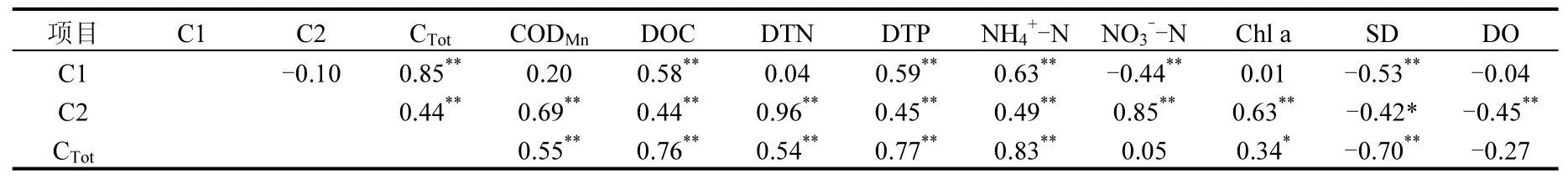
表2 水体CDOM组分与其他水质参数的相关性Table 2 Linear correlation between CDOM components and water quality parameters
4 结论
4.1 利用PARAFAC模型识别出蠡湖水体CDOM主要由2个荧光组分组成,分别为类色氨酸荧光组分C1(225, 280/335)和类腐殖质荧光组分C2(250,300/435),并且C1占绝对优势,占总荧光强度比例的平均值为75.70%.
4.2 组分C1的荧光强度在7.41~21.01之间,平均为11.95; C2组分的荧光强度在2.53~8.07之间,平均为3.85.空间上,C1和C2荧光强度自东向西依次递减,呈现东蠡湖高于西蠡湖、沿岸区高于湖心区的趋势.
4.3 荧光指数(FI)、生物源指数(BIX)和腐殖化指数(HIX)都显示蠡湖水体CDOM来源于自生微生物、藻类的自生源.相关性分析表明,两个荧光组分(C1和C2)都与DTN、氨氮、硝氮、DTP、DIP等营养盐呈显著正相关,说明CDOM与N、P元素的迁移转化密切相关,而与透明度呈显著负相关,说明春季CDOM对透明度有重要影响.
参考文献:
[1] Baker A. Fluorescence properties of some farm wastes: implications for water quality monitoring [J]. Water Research, 2002,36(1):189-195.
[2] Zhao J, Cao W, Wang G, et al. The variations in optical properties of CDOM throughout an algal bloom event [J]. Estuarine, Coastal and Shelf Science, 2009,82(2):225-232.
[3] Kim T H, Waska H, Kwon E, et al. Production, degradation, and flux of dissolved organic matter in the subterranean estuary of a large tidal flat [J]. Marine Chemistry, 2012,142-144:1-10.
[4] Kostoglidis A, Pattiaratchi C B, Hamilton D P. CDOM and its contribution to the underwater light climate of a shallow, microtidal estuary in south-western Australia [J]. Estuarine, Coastal and Shelf Science, 2005,63(4):469-477.
[5] Yao X, Zhang, Y L, Zhu G W, et al. Resolving the variability of CDOM fluorescence to differentiate the sources and fate of DOM in Lake Taihu and its tributaries [J]. Chemosphere, 2011,82(2):145-55.
[6] Ravichandran M. Interactions between mercury and dissolved organic matter-A review [J]. Chemosphere, 2004,55(3):319-331.
[7] Zhou Y Q, Zhang Y L, Shi K, et al. Lake Taihu, a large, shallow and eutrophic aquatic ecosystem in China serves as a sink for chromophoric dissolved organic matter [J]. Journal of Great Lakes Research, 2015,41(2):597–606.
[8] Mesfioui R, Abdulla H A, Hatcher P G. Photochemical alterations of natural and anthropogenic dissolved organic nitrogen in the York River [J]. Environmental Science and Technology, 2015, 49(1):159-167.
[9] 殷 燕,吴志旭,张运林,等.新安江水库夏季CDOM吸收光谱特征及来源分析 [J]. 中国环境科学, 2014,34(12):3207-3214.
[10] 朱晓敏,黄清辉,李建华.咸水藻水华期溶解有机质光谱特征变化的模拟 [J]. 中国环境科学, 2009,29(1):68-72.
[11] Stedmon C A, Bro R. Characterizing dissolved organic matter fluorescence with parallel factor analysis: a tutorial [J]. Limnology and Oceanography: Methods, 2008,6:572-579.
[12] Zhang Y L, Zhang E L, Yin Y, et al. Charcteristic and sources of chromophoric dissolved organic matter in lakes of the Yungui Plateau, China, differcing in trophic state and altitude [J]. Limnology and Oceanorgraphy, 2010,55(6):2645-2659.
[13] Zhang Y, Yin Y, Feng L, et al. Characterizing chromophoric dissolved organic matter in Lake Tianmuhu and its catchment basin using excitation-emission matrix fluorescence and parallel factor analysis [J]. Water Research, 2011,45(16):5110-5122.
[14] Zhang Y L, Dijk M A, Liu M L, et al. The contribution of phytoplankton degradation to chromophoric dissolved organic matter (CDOM) in eutrophic shallow lakes: Field and experimental evidence [J]. Water Research, 2009,43:4685-4697.
[15] Bai Y, Su R, Shi X. Assessing the dynamics of chromophoric dissolved organic matter in the southern Yellow Sea by excitation–emission matrix fluorescence and parallel factor analysis (EEM-PARAFAC) [J]. Continental Shelf Research, 2014,88:103-116.
[16] Singh S, D'Sa E J, Swenson E M. Chromophoric dissolved organic matter (CDOM) variability in Barataria Basin using excitation-emission matrix (EEM) fluorescence and parallel factor analysis (PARAFAC) [J]. Science of the Total Environment, 2010,408(16):3211-22.
[17] 张 博,李永峰,姜 霞,等.环境治理工程对蠡湖水体中磷空间分布的影响 [J]. 中国环境科学, 2013,33(7):1271-1279.
[18] 姜 霞,王书航,杨小飞,等.蠡湖水环境综合整治工程实施前后水质及水生态差异 [J]. 环境科学研究, 2014,27(6):595-601.
[19] 王书航,王雯雯,姜 霞,等.蠡湖水体氮、磷时空变化及差异性分析 [J]. 中国环境科学, 2014,34(5):1268-1276.
[20] 闫丽红,陈学君,苏荣国,等.2010年秋季长江口口外海域CDOM的三维荧光光谱-平行因子分析 [J]. 环境科学, 2013,34(1):51-60.
[21] McKnight D M, Boyer E W, Westerhoff P K, et al. Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity [J]. Limnology and Oceanography, 2001,46:38-48.
[22] Copy R M, Mcknight D M. Fluorescence spectroscopy reveals ubiquitous presence of oxidized and reduced quinones in DOM [J]. Environmental Science and Technology, 2005,39(21):8142–8149.
[23] Huguet A, Vacher L, Relexans S, et al. Properties of fluorescent dissolved organic matter in the Gironde Estuary [J]. Organic Geochemistry, 2009,40(6):706-719.
[24] Zsolnay A, Baigar E, Jimenez M, et al. Differentiating with fluorescence spectroscopy the sources of dissolved organic matter in soils subjected to drying [J]. Chemosphere,1999,38(1):45-50.
[25] Mopper K, Schultz, C A. Fluorescence as a possible tool for studying the nature and water column distribution of DOC components [J]. Marine Chemistry, 1993,41(1–3):229–238.
[26] 刘明亮,张运林,秦伯强.太湖入湖河口和开敞区CDOM吸收和三维荧光特征 [J]. 湖泊科学, 2009,21(2):234-241.
[27] 方 芳,翟端端,郭劲松,等.三峡水库小江回水区溶解有机物的三维荧光光谱特征 [J]. 长江流域资源与环境, 2010,19(3): 323-328.
Distribution of chromophoric dissolved organic matter in Lihu Lake using excitation-emission matrix fluorescence and parallel factor analysis.
WANG Shu-hang, WANG Wen-wen, JIANG Xia*, ZHAO Li, ZHANG Bo (State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China). China Environmental Science, 2016,36(2):517~524
Abstract:Excitation-emission matrix spectroscopy (EEMS) combined with parallel factor analysis (PARAFAC) was applied to investigate the fluorescence characteristics and its source of chromophoric dissolved organic matter (CDOM) in the water of Lihu Lake, and the relationship between the fluorescence intensity of different components and other water quality parameter was also discussed. The results indicated that two fluorescence components were identified by PARAFAC, including one tryptophan-like component and one humic-like component, namely C1 (225,280/335) and C2 (250/435). The contribution rates to the total fluorescence intensity of C1 and C2 were 75.70% and 24.30%, respectively. Spatially, fluorescence intensity of C1and C2 decreased from the east district of Lihu Lake to the west, and lakeside areas was higher than lake center. Fluorescence index (FI), the index of recent autochthonous contribution (BIX) and humification index (HIX) show that CDOM in the water mainly derived from microbes, algae and other newly autochthonous sources, appeared weak humic characteristics overall. CDOM was closely related to the transformation and migration of nitrogen and phosophorus, and had important influence on transparency.
Key words:Lihu Lake;chromophoric dissolved organic matter (CDOM);three-dimensional excitation-emission matrix spectra;EEMS-PARAFAC
作者简介:王书航(1985-),男,安徽阜阳人,工程师,硕士,主要从事湖泊水环境方面的研究.发表论文30余篇.
基金项目:国家水体污染控制与治理科技重大专项(2012ZX07101-013)
收稿日期:2015-07-11
中图分类号:X524
文献标识码:A
文章编号:1000-6923(2016)02-0517-08

