可溶性有机质生物改性介导17β-雌二醇生物降解作用
顾丽鹏,何 欢,胥志祥,熊 丹,刘 君,任 东,黄 斌,潘学军 (昆明理工大学环境科学与工程学院,云南昆明 650500)
可溶性有机质生物改性介导17β-雌二醇生物降解作用
顾丽鹏,何 欢,胥志祥,熊 丹,刘 君,任 东,黄 斌*,潘学军 (昆明理工大学环境科学与工程学院,云南昆明 650500)
摘要:利用元素分析、紫外-可见光谱、三维荧光指数对经过15d生物改性前后腐殖酸的组分和结构进行表征,并比较了生物改性前后3种腐殖酸对17β-雌二醇(E2)的结合作用;而且研究了结合后的腐殖酸介导微生物降解E2的影响.结果表明:经过元素分析后,生物改性前的腐殖酸OLHA、OLFA、OSHA和生物改性后的腐殖酸BLHA、BLFA、BSHA的(N+O)/C值分别为 0.801、1.214、0.820和0.629、1.080、0.797;紫外-可见光谱分析生物改性前后的SUVA254指数分别为0.146、0.023、0.073和0.179、0.036、0.011;生物改性前后荧光指数(FI)分别为:0.723、3.385、2.757和0.681、3.017、1.702.上述3种表征手段分析得出腐殖酸的极性是一致的,即改性后的腐殖酸要比改性前的腐殖酸极性小.此外,在30h内5mgC/L的腐殖酸生物改性前后对3mg/L的E2的结合效率分别为31.37%、4.96%、25.86%和37.78%、6.03%、29.92%,明显发现改性后的腐殖酸对E2的结合作用增强;5mgC/L的腐殖酸生物改性前后对3mg/L的E2的30h内的生物降解效率分别为46.28%、15.96%、38.76%和51.11%、17.30%、44.33%,而且同等浓度下的腐殖酸对E2的结合作用越大其介导微生物降解E2的效果越好.关键词:腐殖酸;生物改性;组分变化;结构变化;17β-雌二醇;生物降解
*责任作者, 副教授, huangbin@kmust.edu.cn
溶解性有机质(DOM)是动植物残体经生物、化学及生物化学作用过程产生的一类分子量分布宽、结构复杂的异质溶解性有机混合物[1-2],是地表水体中普遍存在的活跃组分.腐殖酸是溶解性有机质的主要组成部分,其包括胡敏酸(HA)和富里酸(FA),腐殖酸含量可占到环境地表水中溶解性有机碳总量的40%~80%[3].腐殖酸对疏水性有机污染物具有很强的结合作用,能够影响其在水环境中的迁移转化.此外,DOM自身生物转化过程对有机污染物结合和生物降解起着重要的介导作用.研究表明,胡敏酸可促进PCBs、PAHs等有机污染物的微生物降解[4-5].因此,腐殖酸影响疏水性有机污染物在环境中的转化过程成为当前研究中的热点.然而,腐殖酸通过自身生物转化行为来影响疏水性有机污染物的生物降解机理不是很清楚.
类固醇类雌激素(SEs)是一类典型的环境内分泌干扰物,在极低浓度下就会影响生物体自身雌激素的合成、分泌和传输等,干扰水生生物正常的生殖功能[6],其中尤以E2的内分泌干扰性最强,在河水中浓度仅为1ng/L时就会造成雄鱼雌性化[7-8].这类物质给野生动物、人类健康及生态安全带来了既成或潜在的危害[9-10].类固醇雌激素在水环境中的消减主要依靠生物降解[11]和物理化学[12-13]等途径去除.其中,物理化学方法,包括光化学法[14],电化学氧化法[15-16]然而,这些方法有很大的不足,例如,需要对化学物质纯度要求很高,消耗的能量很高;此外,类固醇雌激素具有很长的半衰期[17],此外,特别是在深水区或者沉积物中主要是依靠微生物对其降解.因此,微生物降解对环境水体中类固醇雌激素的去除可能起着关键作用.同时,本课题组前期研究调查也表明,微生物降解可能是滇池水体中类固醇雌激素未发生大量积累的主要原因[18].尽管类固醇雌激素能够发生发生微生物降解[19],但其直接生降解过程缓慢,半衰期一般为几十至数百天[20].然而, Larcher等[21]发现自然水体中的类固醇雌激素在几天的时间内被降解;并推测类固醇雌激素的生物降解降解过程受到了水体中腐殖酸.
因此,为了探究水体环境中广泛存在的腐殖酸对E2的结合作用对生物降解过程的影响以及DOM自身的生物转化对E2的结合作用和生物降解作用的影响.本研究通过对洱海沉积物中分离出的腐殖酸(OLHA)和富里酸(OLFA)以及市售腐殖酸(OSHA)进行了生物改性,采用元素分析、紫外-可见光谱技术、三维荧光光谱技术对生物改性前后的腐殖酸进行对比,并分析生物改性前后腐殖酸的组分和结构特性的改变进行表征,以探讨生物改性前后的腐殖酸对E2结合过程和生物降解过程的影响.
1 材料与方法
1.1 试剂与仪器
主要试剂:E2 标准品和市售OSHA购于美国 Sigma 公司,分子式为C18H24O2,相对分子质量为272,溶解度为13.30mg/L,辛醇水分配系数为4.01[22],E2的分子结构和其3D结构模型如图1所示.腐殖酸(OLHA)和富里酸(OLFA)是按照国际腐殖酸协会提供的标准方法从洱海沉积物中提取出来[23].实验其他药品均购置与购自国药集团化学试剂有限公司(产品等级为分析纯试剂).
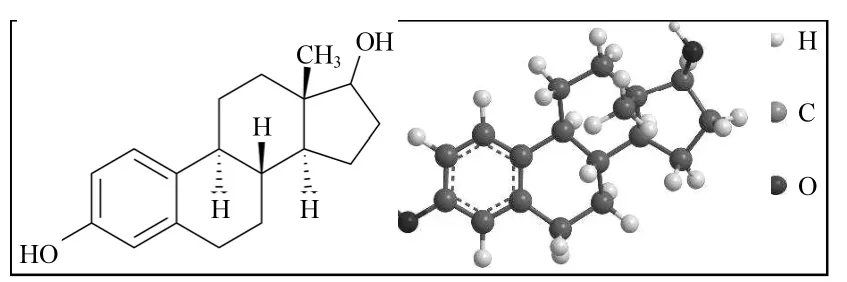
图1 E2的分子结构及其3D结构模型Fig.1 Molecular and optimized 3-dimensional structures of 17β-estradiol
主要仪器:紫外可见分光光度计UV-2600;德国ELEMENTAR元素分析仪vario micro;三维荧光光谱仪(Perkin Elemer LS55);美国Millipore 0.22µm玻璃纤维滤膜.
1.2 实验部分
1.2.1 腐殖酸生物改性实验 从洱海沉积物中提取的OLHA、OLFA和市售OSHA分别配成2L的腐殖酸溶液,装满在之前被酸化过的5L的玻璃容器中, 向溶液中添加NH4NO3和K2HPO4使营养物质比例达到: C:N:P=30:10:3以便微生物的生长不会受到抑制[24],其次,添加10mL的活性污泥上层清夜,再通过1mol/L的NaOH和6mol/L的HCl调整反应体系的pH为中性.将容器密封,放在室温、黑暗条件,250r/min的摇床下培养15d,每天取出手摇15min,这样防止微生物缺氧,每天都调整pH值呈中性.经过培养后,被生物改性后的腐殖酸通过0.22um玻璃纤维滤膜去除微生物,并进行121℃灭菌,取部分溶液冷冻干燥以便后续实验进行,其余的保存在4℃冰箱.以下实验将生物改性前的腐殖酸设置为:OLHA、OLFA、OSHA;将生物改性后的腐殖酸对应的设置为:BLHA、BLFA、BSHA.
1.2.2 生物改性前后腐殖酸的组分和结构的变化的表征 DOC的测定分析:3种腐殖酸经过15d的生物改性后,分别通过装有0.22um玻璃纤维滤膜的抽滤装置去除反应过程中的微生物,并121℃灭菌后冷却保存在4℃的冰箱中以待后续实验的进行.通过总有机碳分析仪(TOC仪)测定生物改性前后的腐殖酸的浓度大小.分别取0.50mL的生物改性前后的腐殖酸,然后将其稀释到25mL测定其可溶性有机碳浓度的变化,并且分别设定3组平行样.
元素分析:分别称取2.00mg的HA、FA和SAHA于锡箔盒中,将包好的样品放入元素分析仪(Elementar Vario,德国)进样口,对每个样品重复测定2次,其中氧的含量通过差减各元素的含量获得.元素含量测定条件为燃烧炉温度1150℃ ,还原炉温度850℃ ,载气氧和氦分别为0.25MPa 和0.20MPa;
UV-Vis分析:用移液器分别移取一定量的生物改性前后的腐殖酸于40mL试剂瓶中,将其配成腐殖酸的浓度为5mgC/L的溶液.于紫外-可见光谱仪(UV-2600,日本)上分别测定3种腐殖酸的吸收特征光谱.测试扫描范围为200~700nm,波长间距为0.50nm;
三维荧光分析:腐殖酸进行三维荧光光谱测试,用超纯水腐殖酸样品稀释至TOC为30mgC/L.测定三维荧光光谱时,将样品溶解于0.01mol/L 的KCl溶液中,用NaOH溶液调节pH值为6.00,保持温度恒定(恒温水浴20±1℃ ).将样品溶液分别置于1cm的石英比色皿中,并置于样品槽中进行检测.由于腐殖酸自身还是一种混合物,分别测定了其自身组分,其中蛋白质的吸收峰范围为250~300nm,类富里酸的吸收峰范围为300~ 380nm,类腐殖酸吸收峰范围为370~450nm,陆地腐殖酸吸收峰范围为420~600nm[24-25].
1.2.3 生物改性前后的腐殖酸与E2的相互作用 通过E2标准品配制1.50mg/L的水溶液.取6 个40mL的棕色瓶,分别加入5mgC/L生物改性前后的腐殖酸,再加入3mg/L的E2溶液配成取1.50mg/L的浓度E2进行结合实验,同时添加100mg/L的NaN3抑制结合过程中E2的微生物降解,结合实验在恒温摇床中进行,用铝箔将反应的棕色瓶包裹避光,25℃恒温连续振荡,摇床转速为250r/min.通过三维荧光分析结合作用的E2的初始浓度和平衡浓度的差值,确定腐殖酸对E2的结合效率,每个样设置3个平行样.
1.2.4 生物改性前后的腐殖酸介导E2的生物降解实验 配制30mL含5mgC/L生物改性前后的腐殖酸的E2溶液,调节溶液pH值为7.00±0.10,再加入0.10g/L干重的微生物进行E2微生物降解实验30h.实验温度控制为25℃ ,恒温连续振荡,摇床转速为250r/min.并保持与空气接触.同样的实验条件下,考察不同浓度的腐殖酸对E2微生物降解的影响.
1.2.5 E2定量分析 对于腐殖酸和E2的结合作用,通过三维荧光进行定量分析,从200~700nm进行荧光波长的扫射,其中E2的荧光检测器(Ex/Em=283/346).生物降解E2的过程中使用Agilent Technologies 1260高效液相色谱对E2进行定量分析;其测定条件为:Waters C18反相柱(4.60mm×250mm,5µm),流动相为60%的乙腈(含0.1%三氟乙酸),等度洗脱,流速为1mL/min.
2 结果与讨论
2.1 腐殖酸的生物改性前后的表征分析
2.1.1 腐殖酸的DOC的变化分析 3种腐殖酸经过15d的生物改性后,其DOC的变化如图2所示.
由图2可知,生物改性前后的腐殖酸OLHA、OLFA、OSHA和BLHA、BLFA、BSHA的值分356.10,162.50,353.70,213.80,105.60,247.10mgC/ L.经过15d的生物改性后,3种腐殖酸的浓度都在下降,说明在腐殖酸酸生物改性过程有很大的一部分有机碳被微生物氧化降解成CO2和H2O,这一结果和Hur等[26]的结果一致.其中的一部分组分和结构发生了变化,这个结论可以通过下列元素分析、UV-Vis 分析、三维荧光光谱分析等表征可以说明.
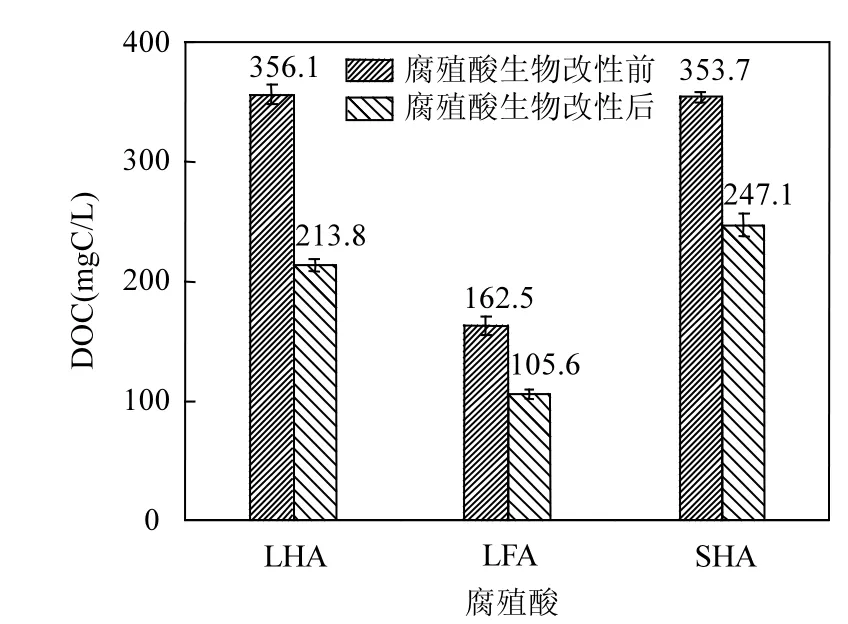
图2 三种腐殖酸生物改性前后DOC的变化Fig.2 The changes of the DOC about before and after humic acid bio-modification
2.1.2 腐殖酸的元素分析 通过对生物改性前后的腐殖酸中C、H、O、N和S等元素分析,其各元素含量、H/C、O/C、(N+O)/C值等分析结果如表1所示.结果表明,生物改性前后的腐殖酸的组分元素没有变化,都是由C、O、H、N及少量的S组成,其灰分含量都低于1.00%,H/C值都小于1.00,这表明生物改性前后的腐殖酸确实都为腐殖质[27].但是,生物改性前后腐殖酸中各元素所占的比例发生了明显的变化,例如,生物改性前的腐殖酸OLHA、OLFA、OSHA和生物改性后的腐殖酸BLHA、BLFA、BSHA的C元素的比值分别为52.47%、42.93%、51.76%和58.32%、45.40%、52.67%;这说明腐殖酸在生物改性过程中其元素所占的比例发生了改变.其中:H/C值可以分析腐殖酸的芳香结构和脂肪结构含量[28].经过生物改性后的腐殖酸H/C值均小于未改性的腐殖酸H/C的比值,因此,生物改性后的腐殖酸芳香性更好.此外,Wen等[29]认为通过(N+O)/C值可以反映出腐殖酸的极性大小,其值越大,极性越强,水溶性也越好.由表1可知,生物改性后的腐殖酸它的(N+O)/C值均减小,说明相对未经过生物改性的腐殖酸而言,生物改性后的腐殖酸极性变小,说明水溶性变差.
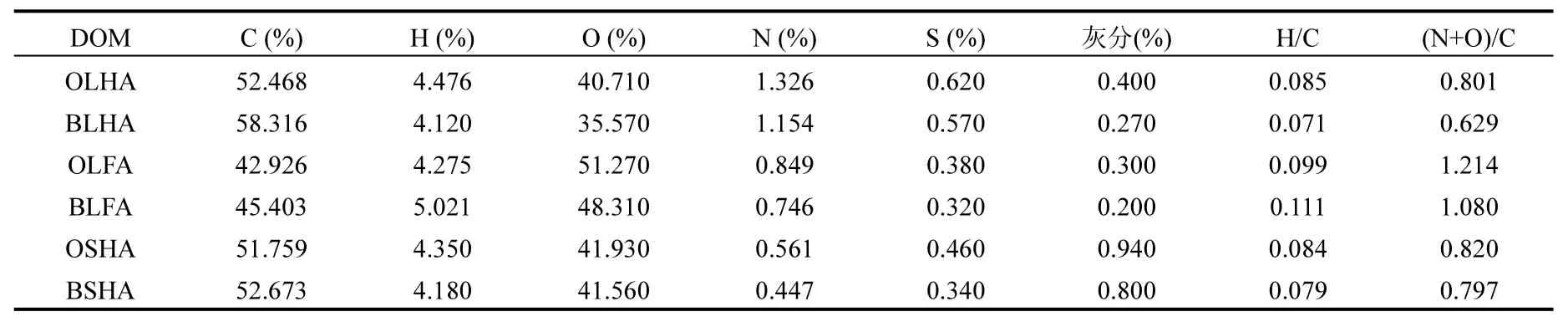
表1 生物改性前后腐殖酸的元素分析结果Table 1 The element analyzing of before and after bio-modification humic acid
2.1.3 紫外可见光谱分析 通过前期的研究表明腐殖酸都具有相似的紫外-可见吸收光谱特征,单位浓度腐殖酸的吸光系数均随波长增加而呈指数模型减小,最重要的是腐殖酸的SUVA254和色调系数Δlgk值等对其组分和结构具有明显的指示作用[30].按照式(1)和式(2)方程式分别对生物改性前后的腐殖酸的SUVA254和色调系数Δlgk数据计算,其结果如表2所示.
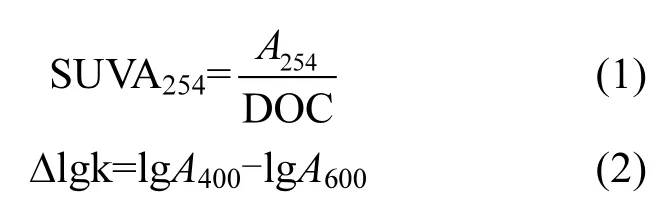
式中:A254、A400、和A600为生物改性前后腐殖酸在波长为254,400,600nm下的吸光度;[DOC]表示生物改性前后腐殖酸的浓度大小.
表2表明,生物改性后的腐殖酸其SUVA254值变大,说明腐殖化程度变高;此外,生物改性前的腐殖酸含有更多营养物质,经过生物改性后,腐殖酸中营养物质被微生物利用[31].研究表明[32]△lgk值越大,它的氧化程度和芳香度就越小.因此,本研究中生物改性后的腐殖酸其腐殖酸的△lgk值均变小,因此,生物改性后的腐殖酸它的氧化程度变大,芳香度也增大.
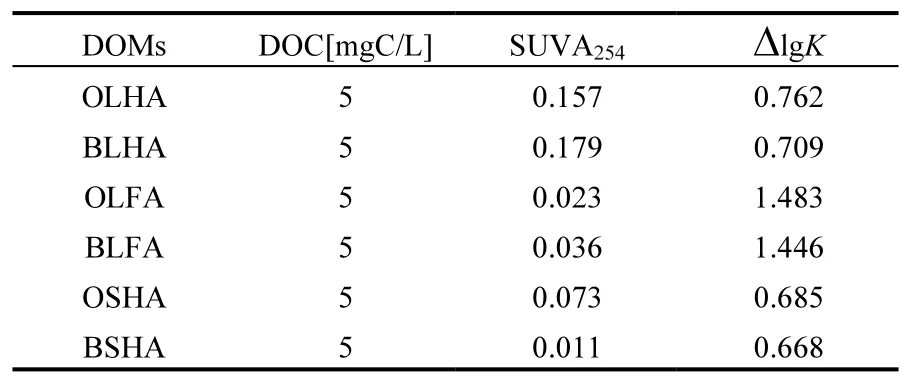
表2 生物改性前后腐殖酸的紫外-可见特征吸收值Table 2 The ultraviolet-visible light absorption eigenvalues of before and after bio-modification humic acid
2.1.4 三维荧光光谱分析 腐殖酸实验测得的荧光强度进行内过滤效应校正,并计算其各自的荧光指数、腐殖化指数(HIX)等参数.其校正公式如荧光指数(FI)能够衡量腐殖酸的芳香性,通常FI值越高,该腐殖类物质组分中含有的苯环结构越少,芳香性越弱[33].
HIX可以表征腐殖酸的腐殖化程度,其值越大,腐殖化程度越深[34].其中荧光指数和腐殖酸化程度的计算公式分别为:
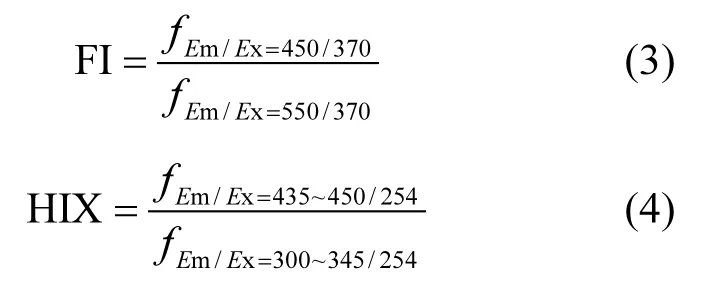
通过按照式(3)和式(4)方程式分别对生物改性前后的腐殖酸的FI和HIX值数据计算,其结果如表3所示,说明生物改性后的腐殖酸其FI值越小,HIX值越大说明经过生物改性后,其腐殖酸化程度变大,芳香性越好.
由于被分离的腐殖酸其中含有许多成分,研究表明腐殖酸其自身组分主要有蛋白质、类富里酸、类腐殖酸、陆地腐殖酸[26];为了表征腐殖酸在生物改性过程中其自身组分的变化,因此在三维荧光的测定过程中,分别对生物改性前后腐殖酸4个基本组分进行了更深入的测定.
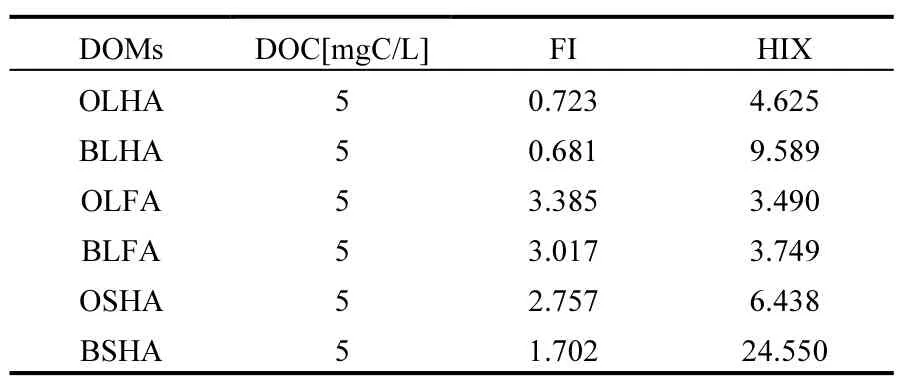
表3 生物改性前后腐殖酸的荧光特征参数Table 3 Fluorescent characteristic parameters of before and after bio-modification humic acid
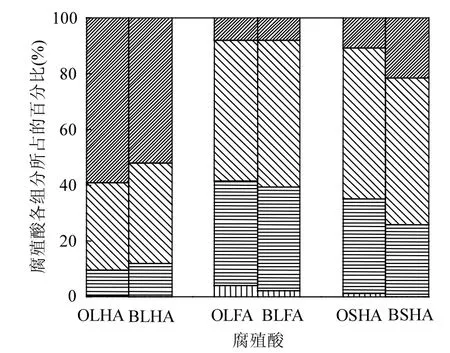
图3 腐殖酸的生物改性前后其自身组分的变化Fig.3 The change of its components on before and after bio-modification humic acid
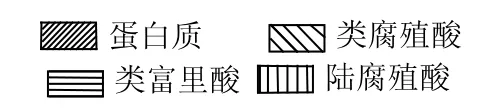
由图3表明,腐殖酸经过生物改性后其蛋白质组分变小,被微生物作为营养物质而分解掉.富里酸的所占的组分基本呈现一个减小的趋势,而腐殖酸和陆地腐殖酸所占的组分在增大,说明经过生物改性后,腐殖酸的腐殖化程度变大.这一结果和Hur等[2]所得的结果一致.
2.2 腐殖酸的生物改性前后与E2的结合作用分析
通过图4可见,经过生物改性后的腐殖酸其结合作用强度均比未经生物改性的结合强度大,说明腐殖酸经过生物改性以后,其腐殖酸化程度变大,芳香性变大,与水体中的E2结合程度增大.此外,对于3种腐殖酸来说,其结合作用大小为OLHA > OSHA > OLFA,这个结果和上面元素分析的(N+O)/C值分析的腐殖酸的极性结果一致,说明OLFA的极性越大,其水溶性越好,而OLHA 和OSHA的极性越小,其与水溶液中的E2的结合效果越好结果一致.腐殖酸和E2结合作用的结果与腐殖酸对菲的结合作用效果很类似[5].

图4 3种腐殖酸生物改性前后与E2的结合作用Fig.4 The combination of before and after bio-modification humic acid on E2
2.3 腐殖酸生物改性前后介导E2生物降解作用的分析
图5A表明,添加了腐殖酸有效地促进微生物与E2的接触作用,最重要的原因是增大了微生物细胞表面磷脂双分子层对E2的吸附效果.类似的结果表明疏水性有机污染物的生物降解过程中,通过添加一定量的Tween 80[35]或添加鼠李糖脂[36]等物质时,可以有效促进疏水性有机污染物的降解作用.此外,经过生物改性后的腐殖酸介导微生物对E2的降解效率更好,这个说明经过生物改性后的腐殖酸其极性变小并且与E2的结合作用变大,导致E2更容易被微生物细胞表面吸附.
通过图5B表明,腐殖酸浓度从0~10mgC/L逐渐增大,其对微生物降解E2的效果越好,说明增加腐殖酸浓度,能够有效的促进微生物对E2的降解;此外,经过生物改性后的腐殖酸介导E2的生物降解效率要比为改性的腐殖酸效果好,说明进过生物改性后的腐殖酸能够有效的提高微生物对E2的降解.类似的疏水性有机污染物,例如,菲在微生物生物降解过程中,随着腐殖酸浓度的增大,其微生物对菲的降解效率在增大[37].
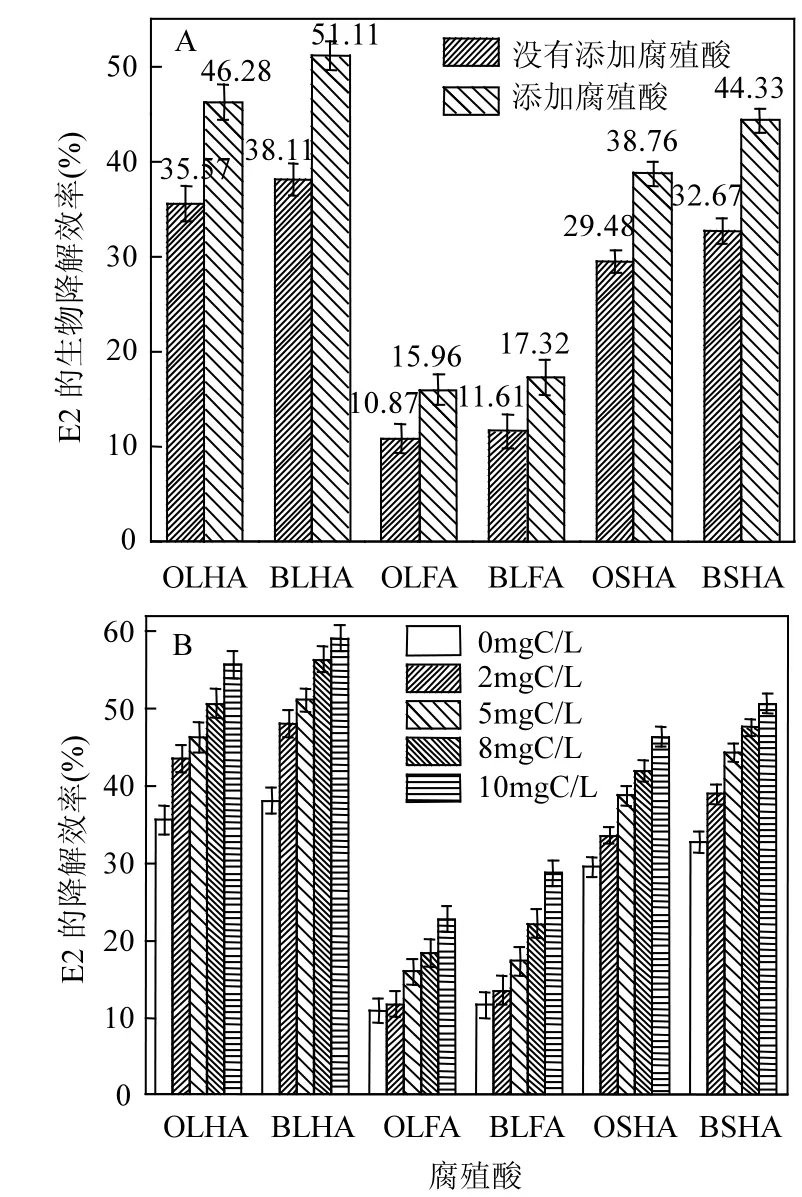
图5 腐殖酸的生物改性前后介导E2的生物降解Fig.5 The humic acid bio-modification mediated E2 biodegradation
2.4 评价生物改性前后的腐殖酸与E2的结合作用对E2生物降解作用的影响
对于疏水性有机污染物在水环境中的迁移转化过程中,大量的研究主要集中在腐殖酸影响疏水性有机污染物在环境介质中的吸附-解吸作用[38];或者在微生物直接作用于疏水性有机物的还原降解作用[39],而忽略了腐殖酸在水环境中对微生物降解有机污染物的作用.因为腐殖酸在水环境中是普遍存在的,生物对腐殖酸自身的降解作用一直存在,但是有关研究腐殖酸生物改性的很少,而且更少有研究深入的表征腐殖酸在生物改性过程中其自身组分和结构的变化,对疏水性有机污染物的结合作用以及其生物改性前后腐殖酸介导微生物降解E2的机理;此外,结合作用和降解作用对疏水性有机污染物的相互作用需要进一步阐明.因此,本文通过生物改性前后的腐殖酸其自身的组分和结构的变化对介导E2生物降解作用;通过与没有添加腐殖酸其微生物对E2的降解作用和添加了生物改性前后腐殖酸对E2的降解作用进行了比较.
由图6可知,通过添加了OLHA、OLFA、OSHA(5mgC/L)对E2的降解效果相对于没有添加腐殖酸而言分别提高了10.95%、5.21%、9.28%;对于生物改性后的BLHA、BLFA、BSHA (5mgC/L)对E2的降解效果相对于没有添加腐殖酸而言分别提高了13.11%、7.19%、12.07%;这说明腐殖酸对E2的结合作用越好,其微生物对E2降解作用越好.此外,通过添加了BLHA、BLFA、BSHA三种腐殖酸(5mgC/L)对E2的降解效果相对于添加未经生物改性的OLHA、OLFA、OSHA(5mgC/L)而言分别提高了2.16%、1.98%、2.79%;这说明经过生物改性后的腐殖酸其腐殖酸化程度变大,导致腐殖酸对E2的结合作用增大,促使了E2更容易的被微生物细胞吸附,从而使得E2降解效率增大.这个结果和上述元素分析、紫外可见光谱分析、三维荧光光谱的分析表征结果一致.说明对腐殖酸的生物改性能够有效的促进其对E2的结合,从而增大腐殖酸介导微生物对E2的降解效果.
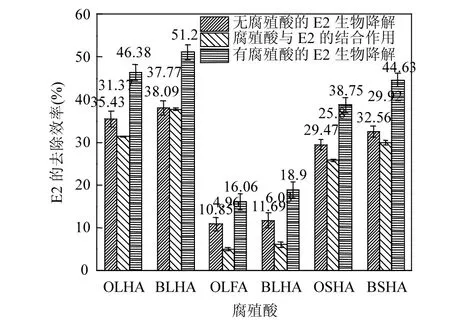
图6 腐殖酸对E2降解作用的影响贡献Fig.6 Humic acid contribution to E2biodegradation effect
3 结论
3.1 腐殖酸经过15d的生物改性后,三种腐殖酸的DOC浓度都在下降,说明在腐殖酸酸生物改性过程有很大的一部分有机碳被微生物氧化降解成CO2和H2O.
3.2 通过元素分析得出生物改性前后的腐殖酸元素组分没有变化,但是各元素所占的比例发生了明显的变化,通过H/C和(N+O)/C的比值表明生物改性后的腐殖酸芳香性更好,水溶性更差,与E2的结合效果更好.
3.3 通过腐殖酸的SUVA254分析表明,生物改性后的腐殖酸其SUVA254值变大,说明它的腐殖化程度变高;色调系数△lgk值分析表明,生物改性后的腐殖酸其值表小,说明它的氧化程度变大,芳香度也增大.
3.4 通过三维荧光光谱分析其荧光指数、腐殖化指数表明,生物改性后的腐殖酸其FI值越小,HIX值越大说明经过生物改性后,其腐殖酸化程度变大,芳香性越好.其组分的中蛋白质在减少,腐殖酸所占的比例在升高,都说明生物改性后的腐殖酸的腐殖酸化程度增大.
3.5 生物改性后的腐殖酸对E2的结合作用增大,生物改性后的腐殖酸对E2的生物降解作用增大;此外,腐殖酸对E2的结合作用越大,腐殖酸介导微生物降解E2的降解效果越好.
参考文献:
[1] Kang S, Xing B. Humic acid fractionation upon sequential adsorption onto goethite [J]. Langmuir, 2008,24(6):2525-2531.
[2] Hur J, Park M-H, Schlautman M A. Microbial transformation of dissolved leaf litter organic matter and its effects on selected organic matter operational descriptors [J]. Environmental Science and Technology, 2009,43(7):2315-2321.
[3] 吴丰昌,王立英,黎 文,等.天然有机质及其在地表环境中的重要性 [J]. 湖泊科学, 2015,20(1):1-12.
[4] Hur J, Schlautman M A. Using selected operational descriptors to examine the heterogeneity within a bulk humic substance [J]. Environmental Science and Technology, 2003,37(5):880-887.
[5] Pan B, Ghosh S, Xing B. Nonideal binding between dissolved humic acids and polyaromatic hydrocarbons [J]. Environmental Science and Technology, 2007,41(18):6472-6478.
[6] Tyler C, Jobling S, Sumpter J. Endocrine disruption in wildlife: a critical review of the evidence [J]. CRC Critical Reviews in Toxicology, 1998,28(4):319-361.
[7] Jürgens M D, Holthaus K I, Johnson A C, et al. The potential for estradiol and ethinylestradiol degradation in English rivers [J]. Environmental Toxicology and Chemistry, 2002,21(3):480-488.
[8] Hansen P-D, Dizer H, Hock B, et al. Vitellogenin–a biomarker for endocrine disruptors [J]. TrAC Trends in Analytical Chemistry, 1998,17(7):448-451.
[9] Jobling S, Williams R, Johnson A, et al. Predicted exposures tosteroid estrogens in UK rivers correlate with widespread sexual disruption in wild fish populations [J]. Environ. Heal. Perspect., 2005,114(S-1):32-39.
[10] Lee O, Takesono A, Tada M, et al. Biosensor zebrafish provide new insights into potential health effects of environmental estrogens [J]. Environ. Heal. Perspect., 2012,120(7):990.
[11] Silva C P, Otero M, Esteves V. Processes for the elimination of estrogenic steroid hormones from water:a review [J]. Environmental Pollution, 2012,165:38-58.
[12] Fang H, Gao Y, Li G, et al. Advanced oxidation kinetics and mechanism of preservative propylparaben degradation in aqueous suspension of TiO2 and risk assessment of its degradation products [J]. Environ. Sci. Technol., 2013,47(6):2704-2712.
[13] Ji H, Jiang L-Y, Zhang L, et al. Degradation Kinetics of Ethinyl Estradiol (EE2) Removal by Aqueous Manganese Dioxide [J]. Environ. Sci. Technol., 2011,12:008.
[14] Carlson J C, Stefan M I, Parnis J M, et al. Direct UV Photolysis of Selected Pharmaceuticals, Personal Care Products and Endocrine Disruptors in Aqueous Solution [J]. Water Research, 2015,84:350-361.
[15] Lee Y, Escher B I, Von Gunten U. Efficient removal of estrogenic activity during oxidative treatment of waters containing steroid estrogens [J]. Environ. Sci. Technol., 2008,42(17):6333-6339.
[16] Kuramitz H, Nakata Y, Kawasaki M, et al. Electrochemical oxidation of bisphenol A. Application to the removal of bisphenol A using a carbon fiber electrode [J]. Chemosphere, 2001, 45(1):37-43.
[17] Borrás M, Laios I, El Khissiin A, et al. Estrogenic and antiestrogenic regulation of the half-life of covalently labeled estrogen receptor in MCF-7breast cancer cells [J]. J. Steroid Biochemistry and Molecular Biology, 1996,57(3):203- 213.
[18] Huang B, Wang B, Ren D, et al. Occurrence, removal and bioaccumulation of steroid estrogens in Dianchi Lake catchment, China [J]. Environment International, 2013,59:262-273.
[19] Bagnall J, Ito A, McAdam E, et al. Resource dependent biodegradation of estrogens and the role of ammonia oxidising and heterotrophic bacteria [J]. J. Hazardous Materials, 2012,239: 56-63.
[20] 吴世闽,贾 瑷,彭 辉,等.辽东湾海水中甾体雌激素的检测及生态风险评价 [J]. 中国环境科学, 2011,31(11):1904-1909.
[21] Larcher S, Yargeau V. Biodegradation of 17α-ethinylestradiol by heterotrophic bacteria [J]. Environ. Poll., 2013,173:17- 22.
[22] Bai X, Casey F X, Hakk H, et al. Dissipation and transformation of 17β-estradiol-17-sulfate in soil–water systems [J]. Journal of Hazardous Materials, 2013,260:733-739.
[23] 沈 烁,王育来,杨长明,等.南淝河不同排口表层沉积物DOM光谱特征 [J]. 中国环境科学, 2014,34(9):2351-2361.
[24] Hur J, Lee M-H, Song H, et al. Microbial transformation of dissolved organic matter from different sources and its influence on disinfection byproduct formation potentials [J]. Environmental Science and Pollution Research, 2013,20(6):4176-4187.
[25] Stubbins A, Hood E, Raymond P A, et al. Anthropogenic aerosols as a source of ancient dissolved organic matter in glaciers [J]. Nature Geoscience, 2012,5(3):198-201.
[26] Hur J, Lee B-M, Shin H-S. Microbial degradation of dissolved organic matter (DOM) and its influence on phenanthrene–DOM interactions [J]. Chemosphere, 2011,85(8):1360-1367.
[27] Kang K H, Shin H S, Park H. Characterization of humic substances present in landfill leachates with different landfill ages and its implications [J]. Water Research, 2002,36(16):4023-4032.
[28] Chin Y-P, Aiken G R, Danielsen K M. Binding of pyrene to aquatic and commercial humic substances: the role of molecular weight and aromaticity [J]. Environmental Science and Technology, 1997,31(6):1630-1635.
[29] Wen B, Zhang J-j, Zhang S-z, et al. Phenanthrene sorption to soil humic acid and different humin fractions [J]. Environmental Science and Technology, 2007,41(9):3165-3171.
[30] 任 东,杨小霞,马晓冬,等.DOM结构特征及其对17β-雌二醇光降解的影响 [J]. 中国环境科学, 2015,35(5):1375-1383.
[31] Weishaar J L, Aiken G R, Bergamaschi B A, et al. Evaluation of specific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon [J]. Environmental Science and Technology, 2003,37(20):4702-4708.
[32] Zhao H, Chen J, Qiao X, et al. Polybrominated diphenyl ethers in soils of the modern Yellow River Delta, China: occurrence, distribution and inventory [J]. Chemosphere, 2012,88(7):791-797.
[33] 卢 松,江 韬,张进忠,等.两个水库型湖泊中溶解性有机质三维荧光特征差异 [J]. 中国环境科学, 2015,35(2):516-523.
[34] Nkhili E, Boguta P, Bejger R, et al. Photosensitizing properties of water-extractable organic matter from soils [J]. Chemosphere, 2014,95:317-323.
[35] Sakultantimetha A, Keenan H E, Beattie T K, et al. Effects of organic nutrients and growth factors on biostimulation of tributyltin removal by sediment microorganisms and Enterobacter cloacae [J]. Appl. Microbiol. Biotechnol., 2011,90(1):353-360.
[36] Ye J, Yin H, Peng H, et al. Biosorption and biodegradation of triphenyltin by Brevibacillus brevis [J]. Bioresource Technology, 2013,129:236-241.
[37] Yan Z, Song N, Cai H, et al. Enhanced degradation of phenanthrene and pyrene in freshwater sediments by combined employment of sediment microbial fuel cell and amorphous ferric hydroxide [J]. J. Hazardous Materials, 2012,199:217-225.
[38] Li J, Fu J, Xiang X, et al. Kinetics, equilibrium, and mechanisms of sorption and desorption of 17α-ethinyl estradiol in two natural soils and their organic fractions [J]. Science of the Total Environment, 2013,452:404-410.
[39] Meng X, Liu G, Zhou J, et al. Effects of redox mediators on azo dye decolorization by Shewanella algae under saline conditions [J]. Bioresource Technology, 2014,151:63-68.
Dissolved organic matters bio-modification mediated 17β-estradiol biodegradation.
GU Li-peng, HE Huan, XU Zhi-xiang, XIONG Dan, LIU Jun, REN Dong, HUANG Bin*, PAN Xue-jun (Faculty of Environmental Science and Engineering, Kunming University of Science and Technology, Kunming 650500, China). China Environmental Science, 2016,36(2):468~475
Abstract:Through elemental analysis, ultraviolet-visible spectra and fluorescence index, the composition and structure of the humic acid with and without 15 days biological modification were analyzed, and compared the binding function of three kinds of humic acid on 17β-estradiol (E2). And the binding function between 17β-estradiol (E2) and three different kinds of humic acid that before and after bio-modification were then compared. At last, the microbial degradation influences of E2 mediated by humic acid were studied. The elemental analysis results showed that the (N+O)/C values of humic acid (OLHA, OLFA, OSHA) that before bio-modification and humic acid (BLHA, BLFA, BSHA) that after biological modification were 0.801, 1.214, 0.820 and 0.629, 1.080, 0.797, respectively. The ultraviolet-visible spectrum results showed that the values of SUVA254were 0.146, 0.023, 0.073 and 0.179, 0.036, respectively. And the fluorescence index (FI) were 0.723, 3.385, 2.757 and 0.681, 3.017, 1.702, respectively. The above three kinds of characterization analysis results showed that the polarity of humic acid were consistent, suggesting that the polarity of modified humic acid were weaker than former. Moreover, the binding efficiency of 3mg/L E2 by 5mgC/L three humic acid before and after the bio-modification within 30h were 31.37%, 4.96%, 25.86% and 37.78%, 6.03%, 29.92%, respectively, which showed that the binding functions of E2 were increased obviously after humic acid bio-modification treatment. The biodegradation efficiency of 3mg/L E2 by 5mgC/L three humic acid before and after the bio-modification within 30h were 46.28%, 15.96%, 38.76% and 51.11%, 17.30%, 44.33%, respectively. Meanwhile, the stronger binding function of the same humic acid concentrations on E2, the greater efficiency of combined humic acid mediated microbial degradation of E2.
Key words:humic acid;bio-modification;component change;structure change;17β-estradiol;biodegradation
作者简介:顾丽鹏(1990-),男,江西上饶人,昆明理工大学硕士研究生,主要从事天然有机质介导微生物对内分泌干扰物的降解作用的研究.
基金项目:国家自然科学基金(21567014, 21267012, 41401558);中国博士后科学基金(2014T70887);中国科学院环境化学与生态毒理学国家重点实验室开放基金(KF2013-04);云南省教育厅科学研究基金项目(2014J022)
收稿日期:2015-07-14
中图分类号:X17
文献标识码:A
文章编号:1000-6923(2016)02-0468-08

