人脑胶质瘤细胞体外培养与形态学观察*
刘来兵, 刘 健,**, 出良钊,, 杨 华,, 李玉美
(1.贵州医科大学附属白云医院, 贵州 贵阳 550014; 2.贵州医科大学, 贵州 贵阳 550004)
人脑胶质瘤细胞体外培养与形态学观察*
刘来兵1, 刘健1,2**, 出良钊1,2, 杨华1,2, 李玉美2
(1.贵州医科大学附属白云医院, 贵州 贵阳550014; 2.贵州医科大学, 贵州 贵阳550004)
[摘要]目的: 探讨人脑胶质瘤原代细胞体外培养的方法。方法: 手术切除脑胶质瘤患者的病灶组织,采用机械分离胰酶消化法获取胶质瘤细胞,倒置显微镜下观察胶质瘤细胞的形态学变化,通过差速贴壁、反复传代、自然纯化法获得纯度高、生物性状稳定、增殖能力强的细胞株,绘制细胞生长曲线,免疫组织化学技术鉴定原代细胞及其纯度。结果: 培养成功的原代细胞贴壁生长状态好,有明显的对数生长期;恶性程度越高细胞增殖越快,可传代培养,胶质原纤维酸性蛋白(GFAP)染色阳性率达93%,证明培养的细胞为纯度较高的胶质瘤细胞。结论: 机械分离胰酶消化法适合于体外胶质瘤细胞的原代培养。
[关键词]神经胶质瘤; 胰酶; 消化; 细胞培养; 生长曲线; 免疫组织化学
脑胶质瘤是发生于神经外胚层的恶性肿瘤,在成人的发病率约为6/10万,5年生存率20%~30%[1-3]。部分脑胶质瘤恶性程度高,生存期短。原代细胞刚从肿瘤组织中分离出来,包含了肿瘤细胞的各种信号,生物学特性没有发生很大的变化,仍保留原来的遗传学特性,这样培养出的肿瘤细胞与在体肿瘤细胞的真实状态最接近, 是研究抗肿瘤药物作用机制及肿瘤基因表达的理想细胞模型[4]。
1材料与方法
1.1材料
1.1.1标本来源
收集2011年10月~2012年3月15例脑胶质瘤患者新鲜手术标本进行细胞培养,所取标本征得患者或家属的知情同意,所有标本经术后病理检查确诊。其中男9例,女6例,22~67岁,平均45.2岁。按WHO(2007)中枢神经系统肿瘤分类标准[5]:星形细胞瘤6例(Ⅱ级),间变形星形细胞瘤6例(Ⅲ级),胶质母细胞瘤3例(Ⅳ)。
1.1.2实验仪器及试剂
CO2培养箱(日本SANYO),DMEM/F12(Hyclone公司),鼠抗人GFAP(武汉博士德),SABC试剂盒(北京中杉金桥)等。
1.2方法
1.2.1原代细胞培养将手术切除的新鲜肿瘤标本(选择肿瘤细胞丰富的实质, 避开与正常组织交界区、钙化处、出血、坏死液化区)放入含双抗的DMEM/F12培养液的瓶中,冰浴下立即送实验室;镜下选取较单纯的肿瘤组织(剔除坏死组织和血管等组织),眼科剪剪成约1 mm3小块,研磨约1 min,滴加适量的胰酶-EDTA(0.02%EDTA及0.25%胰蛋白酶)37 ℃消化5 min,终止消化后用吸管轻轻吹打,使细胞尽量分散,用200目不锈钢筛网过滤;过滤后的悬液离心、重悬,按5×104/mL接种于50 mL的培养瓶,培养30 min后,将细胞悬液移至另一培养瓶中,去除成纤维细胞,48 h后更换培养液,弃除未贴壁细胞,以后每3 d换液1次。倒置相差显微镜下观察不同时期细胞的生长情况并照相。
1.2.2传代及纯化细胞细胞融合达80%~90%后,滴加胰酶-EDTA(0.02%EDTA及0.25%胰蛋白酶)37℃消化,当观察到细胞突起回缩、形态变圆、细胞间隙变大,约有80%细胞漂浮时,加入等体积的含10% FBS的DMEM/F12完全培养基中止消化;按1∶2传代,经多次传代扩增培养,使细胞逐渐得到纯化和扩增。
1.2.3细胞生长曲线的测定取已铺满培养瓶底的胶质瘤细胞,消化后以5×104个/mL的密度接种于24孔培养板。每24 h取3孔进行细胞计数,连续7 d,以细胞数量为纵坐标,时间为横坐标绘制细胞生长曲线。按Patterson 公式计算细胞倍增时间为:Td=tlg 2/lg(Nt/No),其中Td为倍增时间(h),t为细胞数由No增至Nt所需的时间,No为接种时的细胞数,Nt为培养t h后的细胞数。
1.2.4鉴定肿瘤细胞收获P3代生长状态良好的细胞, 4%多聚甲醛液固定,滴加相应的GFAP一抗(滴度1∶100),4 ℃过夜,滴加相应的二抗,DAB显色,脱水,透明,中性树胶封片,在高倍镜下(400×)随机选取10个视野,计数1 000个肿瘤细胞中阳性肿瘤细胞所占的百分率。
2结果
2.1人胶质瘤原代培养细胞
接种后48 h换液,去除不贴壁的细胞和碎片后,镜下可见单个分散或数个克隆样贴壁的细胞,形态较为均匀,呈棱形伸展状态或多边形,以棱形细胞为主(图1A);第3天可观察到贴壁细胞有分裂增殖,细胞数目增加明显,肿瘤细胞形态多样,呈棱形、三角形、多角形等,细胞轮廓清晰(图1B)。4~5 d原代培养的细胞逐渐形成分散的细胞集落(图1C),于培养6~7 d天渐渐铺满培养瓶底,细胞达90%融合(图1D),呈铺路石样排列,恶性程度越高细胞增殖越快。
2.2传代及纯化细胞
培养的细胞达90%左右融合时,消化传代。传代的细胞形态与原代相似,传代细胞生长潜伏期短,接种2~3 h后即贴壁伸展,逐渐恢复为棱形,12~24 h完全贴壁,传代后的细胞增殖速度较快, 3~5 d即可传代1次,且细胞形态单一均匀,呈铺路石样排列(图2A、2B)。
2.3细胞生长曲线
生长曲线显示细胞接种第2天后细胞进入对数生长期,第3~5天为对数生长期,培养第7天细胞增殖达到高峰,第7天后细胞生长进入平台期,见图3。
2.4第3代人胶质瘤细胞鉴定

注:A 为培养48 h(200×),B为培养第3天(200×),C为培养第5天(200×),D为培养第7天(100×)图1 原代培养的胶质瘤细胞Fig.1 Primary cultured glioma cells
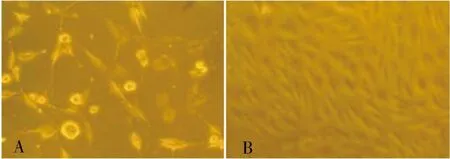
注:A为第3代培养第2天(200×),B为第3代培养第5天(100×)图2 传代培养的胶质瘤细胞Fig.2 Subcultured glioma cells

图3 胶质瘤细胞生长曲线图Fig.3 The glioma cell growth curve
原代培养的人胶质瘤细胞经纯化传代至第3代时,绝大多数肿瘤细胞胶质原纤维酸性蛋白(GFAP)染色阳性,细胞胞浆呈现棕黄色颗粒,阳性率达93%,证实所培养的细胞为胶质瘤细胞(图4A、B)。

注:A、B分别为第3代培养第5天细胞GFAP的表达(SABC×100,×400)图4 第3代人胶质瘤细胞的GFAP表达Fig.4 The GFAP expression of the third generation cells cultured for 5 days
3讨论
脑胶质瘤是颅脑肿瘤中最常见的一种,严重危害患者的健康。胶质瘤细胞的原代培养是直接取患者的肿瘤组织在体外进行扩增、培养,因刚从组织中分离,其生物学特性还未发生很大的变化,仍保留原来的遗传学特性,也最接近体内细胞的生长特性[6],适用于药物敏感试验、细胞分化等实验研究。国内外已有大量关于胶质瘤原代细胞培养的研究[7-8],脑胶质瘤细胞的原代培养在胶质瘤研究的各个领域均得到广泛的应用。
原代细胞培养方法有酶消化法和组织块培养法,对方法的选择很多学者持有不同的观点[9]。本实验先用研磨器研磨机械分离细胞,再加入胰酶短时间消化,不锈钢滤网过滤进行体外培养,这样既避开了单纯酶消化法步骤多、组织需要量大的缺点, 还可以减轻长时间酶消化时对原代细胞的损伤作用;同时也摒弃了组织块培养法细胞周期很长、成功率低等缺点,很适合目前的科学研究的需要。
大量研究证实GFAP是一种由胶质细胞特异表达的中间丝细胞骨架蛋白,决定胶质细胞的结构和功能[10]。细胞的恶性转化与细胞的形态改变密切相关,细胞形态一旦改变该细胞的生长特性与功能必发生改变。决定细胞形态的物质主要与细胞骨架有关。真核生物细胞的骨架主要由肌动蛋白、微丝及介于两者之间的中间丝三类网状蛋白质构成,其中以中间丝变异高,并显示出特异性的表达。目前GFAP是最常用于识别正常或病理情况下胶质细胞来源的一种特异性的蛋白质[11]。本实验在倒置显微镜下观察到体外原代培养细胞形态多样,有梭形、三角形、多角形,以棱形为主,这与众多文献报告的原代胶质瘤细胞的形态相符,且通过传代的纯化,细胞形态逐渐均匀、单一,以棱形为主。选用第3代细胞生长状态良好的胶质瘤细胞采用免疫组织化学的方法检测胶质细胞特异性的标志物GFAP的表达,结果显示肿瘤细胞高度表达GFAP,胞质染成棕黄色,阳性细胞率达93%,证明所培养的细胞为胶质瘤细胞,且纯度较高。
本实验采用机械分离胰酶消化法成功培养出人脑胶质瘤细胞,为下一步深入研究胶质瘤的生物学特性及体外药物敏感性试验、动物验证实验等奠定了基础。
4参考文献
[1] 李剑,郑莉莉,王建祯.脑胶质瘤细胞体外原代培养化疗药物敏感性研究[J].中国实用神经疾病杂志, 2011(6):13-15.
[2] Hargrave DR, Zacharoulis S. Pediatric CNS tumors:current treatment and future directions[J].Expert Rev Neurother, 2007(8):1029-1042.
[3] 袁勇,黄晓斌,廉坤,等.适度低氧微环境对体外培养脑胶质瘤干细胞生长的影响[J].昆明医科大学学报, 2015(6):22-25.
[4] 方川,檀艳丽,王佳良,等.人脑胶质瘤原代细胞培养及体外药物敏感度的实验[J].肿瘤防治研究, 2010(12):1380-1383.
[5] 杨学军.解读《世界卫生组织中枢神经系统肿瘤分类(2007年)》[J].中国神经精神疾病杂志, 2007(9):513-517.
[6] 杨继红,张革化,魏燕,等. 酶消化分离法原代培养人鼻黏膜上皮细胞的改进[J].临床耳鼻咽喉头颈外科杂志, 2009(23):1066-1068.
[7] 周蓉,滕晓华,曾瑜,等. 星形胶质瘤细胞的分离培养及生物学特性观察[J].国际神经病学神经外科学杂志, 2009 (6):495-499.
[8] 李晓良,孙王伟,张曙光,等. miR-125b对胶质瘤细胞侵袭能力影响的体内研究[J].临床神经外科杂志, 2014 (2):90-93.
[9] 刘国红,柴玉荣,朱晓燕,等.连续微量培养液胃癌组织块贴壁培养法[J].肿瘤防治研究, 2008(2):147-148.
[10]袁彬,李彤.转化生长因子β1对体外大鼠星形胶质细胞形态及胶质纤维酸性蛋白表达的影响[J].第四军医大学学报, 2007(16):1456-1458.
[11]Perng MD, Wen SF, Gibbon T, et al. Glial fibrillary acidic protein filaments can tolerate the incorporation of assembly-compromised GFAP-delta,but with consequences for filament organization and alphaB-crystallin association[J].Mol Biol Cell, 2008(10):4521-4533.
(2015-09-27收稿,2015-11-05修回)
中文编辑: 周凌; 英文编辑: 刘华
Culture of Primary Human Glioma Cellsinvitroand Morphological Observation
LIU Laibing1, LIU Jian1,2, CHU Liangzhao1,2, YANG Hua1,2, LI Yumei2
(1.AffiliatedBaiyunHospitalofGuizhouMedicalUniversity,Guiyang550014,Guizhou,China;2.GuizhouMedcialUniversity,Guiyang550004,Guizhou,China)
[Abstract]Objective: To probe the method of culturing primary human glioma cells in vitro. Methods: Glioma cells were obtained by mechanical separation and enzymatic digestion of glioma patients' focus tissue removed by surgical resection. The morphological changes of these glioma cells were observed under inverted microscope. The cell lines of high purity, biological traits stability, strong capacity of proliferation were obtained by differential speed stick wall, repeated passaging and natural purification. The cell growth curve was drawn and immunohistochemical technique was adopted to identify the primary cells and their purity. Results: The primary cells that were cultured successfully showed a good growing status of adhering to wall, apparent logarithmic growth period. The higher malignant degree of primary cells, the faster the proliferation. Those cells could be subcultured. The positive staining rate of glial fibrillar acidic protein (GFAP) was up to 93%, proving the cultured cells were glioma cells of high purity. Conclusion: The human glioma cells can be cultured by mechanical separation and enzymatic digestion.
[Key words]glioma cells; pancreatin; digestion; cell culture; growth curve; immunohistochemistry
[中图分类号]R739.41
[文献标识码]A
[文章编号]1000-2707(2016)01-0024-03
*[基金项目]国家自然科学基金(81560409);贵阳市社会发展与民生科技计划[筑科合同(2012)103.39号];贵州省科技局联合基金[黔科合LG字(2012)069号]; 教育部“创新团队发展计划”[国家教育部科技司(教技涵509-IRT13058)]
**通信作者 E-mail:136721361@qq.com网络出版时间:2016-01-07
网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160107.2042.050.html

