超声辅助分散液液微萃取-高效液相色谱测定护肤水中9种荧光增白剂
张宪臣,华洪波,薄艳娜,李 蓉,张朋杰,杨 芳,王 勇,熊仁广
(1.中山出入境检验检疫局 检验检疫技术中心,广东 中山 528403;2.中山市卓雅外国语学校,广东 中山 528401;3.暨南大学 包装工程研究所,广东普通高校产品包装与物流重点实验室,广东 珠海 519070)
超声辅助分散液液微萃取-高效液相色谱测定护肤水中9种荧光增白剂
张宪臣1*,华洪波2,薄艳娜3,李 蓉1,张朋杰1,杨 芳1,王 勇1,熊仁广1
(1.中山出入境检验检疫局 检验检疫技术中心,广东 中山 528403;2.中山市卓雅外国语学校,广东 中山 528401;3.暨南大学 包装工程研究所,广东普通高校产品包装与物流重点实验室,广东 珠海 519070)
建立了超声辅助分散液液微萃取技术结合高效液相色谱配荧光检测器(UA-DLLME-HPLC-FLD)同时测定护肤水中9种荧光增白剂(FWAs)残留量的检测方法。考察了萃取剂的种类与体积、分散剂的种类与体积分数、盐效应、pH值、超声时间等因素对萃取效果的影响,确定最佳萃取条件:50 μL三氯甲烷为萃取剂,250 μL甲醇为分散剂,氯化钠用量为0.20 g,4 500 r/min离心2 min。在优化条件下,9种荧光增白剂在一定质量浓度范围内线性关系良好,相关系数均大于0.999 0,方法检出限(S/N=3)为0.06~4.20 mg/kg,定量下限(S/N≥10)为0.2~14.0 mg/kg,方法的平均回收率为84.3%~102.4%。该方法具有有机溶剂用量少、操作简单、快捷、灵敏等优点。
分散液液微萃取;超声辅助;高效液相色谱;荧光增白剂(FWAs);护肤水
荧光增白剂(Fluorescent whitening agents,FWAs) 是一种荧光染料,可吸收不可见的紫外光(波长 300~400 nm),再激发出可见的蓝色或蓝紫色荧光(波长 420~480 nm),从而可以补充产品的蓝-紫光不足,并增加照射到产品上的光的总反射量,使肉眼看到的物质很白,达到增白增艳的效果[1]。目前,FWAs在纺织品、纸制品、塑料、洗涤剂、颜料和油漆中有广泛应用[2]。为了提高皮肤白度,达到美白效果,一些化妆品生产者在化妆品中添加FWAs。FWAs长时间与皮肤接触,一旦与人体中的蛋白质相结合,很难通过正常代谢排出体外[3]。同时,FWAs普遍含有芳香胺基结构和苯乙烯基结构,理论上具有潜在的致癌性[4]。此外,FWAs 会极大削弱免疫力及伤口愈合能力,一旦在人体内蓄积过量,除了对肝脏等重要器官造成严重危害之外,还会诱发细胞癌变,是潜在的致癌因素之一[3]。国家标准GB 9685-2008及欧盟法规EU 10/2011规定了食品接触材料中荧光增白剂184的特定迁移限量为0.6 mg/kg。
目前荧光增白剂的检测方法主要有光谱法和色谱法,光谱法包括白度法[5]、荧光分光光度法[6-8]和紫外分光光度法[9-10];色谱法包括薄层层析法、毛细管电泳法、液相色谱-质谱联用法(HPLC-MS)和高效液相色谱法等[11-14]。高效液相色谱法是一种准确度高、分离范围广的快速分离方法,但其灵敏度较HPLC-MS低,常需对样品进行富集处理。目前对化妆品中荧光增白剂进行分离富集的方法主要有液-液萃取和固相萃取,液-液萃取的富集倍数低,固相萃取的操作过程繁琐、成本高且有机试剂用量大。分散液液微萃取技术(DLLME)[15-19]集采样、浓缩于一体,具有简单、快速、成本低、对环境友好、富集倍数高等优点。本研究采用超声辅助DLLME结合高效液相色谱(UA-DLLME-HPLC)建立了护肤水中9种常用荧光增白剂的检测方法。
1 实验部分
1.1 材料、试剂与仪器
护肤水样品由中山检验检疫局资源与化学品安全监管科提供。
标准品:荧光增白剂220(C.I.220,纯度≥99.0%)、荧光增白剂85(C.I.85,纯度≥95.0%)、荧光增白剂113(C.I.113,纯度≥99.5%)、荧光增白剂351(C.I.351,纯度≥95.0%)、荧光增白剂71(C.I.71,纯度≥98.0%)、荧光增白剂162(C.I.162,纯度≥94.0%)、荧光增白剂140(C.I.140,纯度≥94.0%)、荧光增白剂135(C.I.135,纯度≥95.0%)、荧光增白剂199(C.I.199,纯度≥98.0%)均购于美国International Laboratory USA公司;甲醇、乙腈、环己烷、异丙醇(色谱纯,美国Fisher公司);三氯甲烷、二氯甲烷(色谱纯,德国Merck公司);二甲基甲酰胺、四氯化碳、氯化钠、乙醇(分析纯,北京化学试剂厂);海藻酸钠(德国Sigma公司)。实验用超纯水为Milli-Q水处理系统制得。
2695-2475高效液相色谱仪(美国Waters公司);超声波清洗器(南京皓海科学仪器仪表有限公司);0.5mL微量玻璃注射器(美国Thermo公司);DTY-B1200电子天平(福州华志科学仪器有限公司);ST40高速离心机(美国Thermo公司)。
1.2 标准溶液配制
称取9种荧光增白剂标准品约50.0 mg(精确至0.000 1 g),于各自的50 mL容量瓶中,用70%二甲基甲酰胺溶液溶解并定容至刻度,分别制成质量浓度为1 mg/mL的标准储备液,置于4 ℃冰箱中保存。其中C.I.71溶解时先加10 mL二甲基甲酰胺溶液超声溶解,再加10 mL水超声溶解。
混合标准储备液:准确吸取储备液(C.I.220) 7 mL,(C.I.85) 4 mL,(C.I.113) 4 mL,(C.I.351) 0.1 mL,(C.I.71) 2 mL,(C.I.162) 1 mL,(C.I.140) 0.4 mL,(C.I.135) 0.1 mL,(C.I.199) 0.2 mL于100 mL容量瓶中,并用乙腈定容至刻度。配成相应浓度分别为70,40,40,1,20,10,4,1,2 μg/mL。
1.3 液相色谱条件
色谱柱:Inertsil Ph-3(4.6 mm×250 mm,5 μm);柱温:35 ℃;进样量:10 μL;荧光检测波长:发射波长λex:365 nm,激发波长λem:430 nm;流动相:A为20 mmol/L乙酸铵溶液,B为甲醇,C为乙腈。梯度洗脱程序:0~7 min,75%~65%A,13.8%~19.3% B;7~9 min,65%A,19.3% B;9~25 min,65%~40%A,19.3 %~33% B;25~35 min,40%~20%A,33%~44% B;35~40 min,20%~0%A,44%~55% B;40~43 min,0%~75%A,55%~13.5% B;43~48 min,75%A,13.8% B。
1.4 样品预处理
称取5.0 g护肤水样品,过0.45 μm滤膜后,用水定容至5.0 mL,50 ℃超声提取10 min;加入0.20 g NaCl,涡旋溶解2 min,用2.5×10-2mol/L NaOH溶液调至pH 8.5,溶液移入10 mL锥形离心管中。将250 μL甲醇(分散剂)和50 μL CHCl3(萃取剂)混合,用0.5 mL玻璃注射器迅速注入溶液中,轻晃离心管,形成护肤水、甲醇、三氯甲烷的乳浊液,以 4 500 r/min 离心2 min后,下层溶液用50 μL微型注射器取30 μL放入加有内衬管的样品瓶中,进行 HPLC检测。
2 结果与讨论
2.1 DLLME条件的优化
2.1.1 萃取剂的选择及用量 分散液相微萃取中萃取剂需满足密度大于水,与水不互溶,对待测物溶解能力强的要求。本实验通过向阴性样品中添加9种荧光增白剂混标溶液,考察了不同萃取剂(三氯甲烷、四氯化碳、二氯甲烷、环己烷和氯苯)对回收率的影响,每组实验平行测定3次。结果显示,三氯甲烷作为萃取剂对目标物的回收率最高。二氯甲烷和环己烷与分散剂无法形成稳定的两相体系。相同体积下不同的萃取剂所形成沉积相的体积也不同,其中四氯化碳的沉积相体积为25 μL,氯苯为50 μL,三氯甲烷为50 μL。实验结果表明三氯甲烷的回收率较高,萃取效果最好,因此选用三氯甲烷作为萃取剂。
2.1.2 分散剂的选择及分散剂与萃取剂的体积比 分散剂的类型是影响萃取效率的重要因素,所选分散剂应与萃取剂及水有良好的混溶性,在分相时能形成两相,并对9种荧光增白剂的分析不产生干扰。实验比较了甲醇、乙醇、乙腈、异丙醇和海藻酸钠作为分散剂时的萃取性能,结果表明,甲醇作为分散剂时的萃取效率远高于其他溶剂。萃取剂和分散剂的体积比也是影响萃取效率的重要因素,实验考察了二者(三氯甲烷-甲醇)的体积比为1∶1~1∶9时对荧光增白剂萃取效率的影响(见图1)。结果显示,当二者体积比为1∶5时,萃取能力最强,因此最终确定萃取剂(三氯甲烷)和分散剂(甲醇)的体积比为1∶5。
2.1.3 超声时间的优化 充足的超声时间能够保证萃取效率,但超声时间过长可导致分析物被破坏,另外超声的热效应使得水温上升,也会对萃取效果产生影响。实验考察了不同超声时间(4,6,10,12,16 min)时的萃取效率,结果表明,超声时间短,目标化合物的提取效率低;超声时间为10~16 min时各目标物的萃取效率基本保持不变。为提高提取效率,节省时间,实验选择10 min作为最优超声时间。
2.1.4 盐浓度的影响 在萃取过程中,向样品溶液中加入无机盐既可改变待测组分的萃取效率,又可使两相间的分层更加明显。在其他实验条件不变的情况下,向样品溶液中加入0.0~0.5 g NaCl,考察了9种荧光增白剂的萃取效率。结果显示,加入0.2 g NaCl时萃取效率最高,随着加盐量的继续增加,萃取效率反而下降,这是因为适量的NaCl能增加溶液的离子强度,加大目标物从水相到萃取剂的传质效率,但NaCl浓度过大时由于沉积相体积增大而导致萃取效率降低。因此实验选择样品中加入0.2 g NaCl。
2.1.5 pH值的影响 样品溶液的pH值影响荧光增白剂分子在水溶液中的存在方式,进而影响萃取效率,因此以乙酸和KOH溶液调节水样的酸度,考察了不同pH值(pH 6.0,7.0,8.0,8.5,9.0,10.0)对萃取效率的影响(见图2)。由图2可知,pH 6.0时荧光增白剂的回收率最差,随着pH值升高,荧光增白剂的平均回收率显著提高,在pH 8.5时萃取效率最好,继续升高pH值,则荧光增白剂的回收率有所下降。因此选择样品溶液pH值为8.5。
2.2 色谱条件的优化
本实验最初选择Thermo C18柱(100 mm×2.1 mm,3 μm)、Capcell C18柱(2.0 mm×150 mm,5 μm)和Phenomenex C18柱(250 mm×4.6 mm,5 μm)3款C18色谱柱进行色谱分离,发现荧光增白剂C.I.220完全不出峰,C.I.85,113,351和71的分离效果不佳,不能达到基线分离。由于本研究的9种荧光增白剂多含有苯基和水磺基,改用岛津苯基柱(Inertsil Ph-3,4.6 mm×250 mm,5 μm)可获得良好的分离效果。实验对流动相进行了选择,采用甲醇-20 mmol/L乙酸铵溶液为流动相时,9种荧光增白剂标准物质可获得较好的分离效果,但个别色谱峰达不到基线分离;改用乙腈-20 mmol/L乙酸铵溶液为流动相时,分离效果未见显著改善,经反复调试最终确定以甲醇-乙腈-20 mmol/L乙酸铵溶液为流动相,采用合适的梯度洗脱,可实现各标准物质分离,获得的各峰峰形尖锐,峰对称性好(见图3)。
2.3 方法学验证
2.3.1 标准曲线、方法检出限与定量下限 精密量取0.5,1.0,2.5,5.0,10.0,25 mL混合标准储备工作液分别置于50 mL容量瓶中,用乙腈稀释至刻度。按照“1.3”色谱条件进样分析,记录色谱图。以峰面积(Y)对质量浓度(X,μg/mL)绘制标准曲线,进行回归计算。结果显示各化合物在一定质量浓度范围内线性关系良好,相关系数(r)均大于0.999 0,以3倍信噪比(S/N=3)和10倍信噪比(S/N=10)分别计算得方法的检出限(LOD)为0.06~4.20 mg/kg,定量下限(LOQ)为0.2~14.0 mg/kg(见表1)。
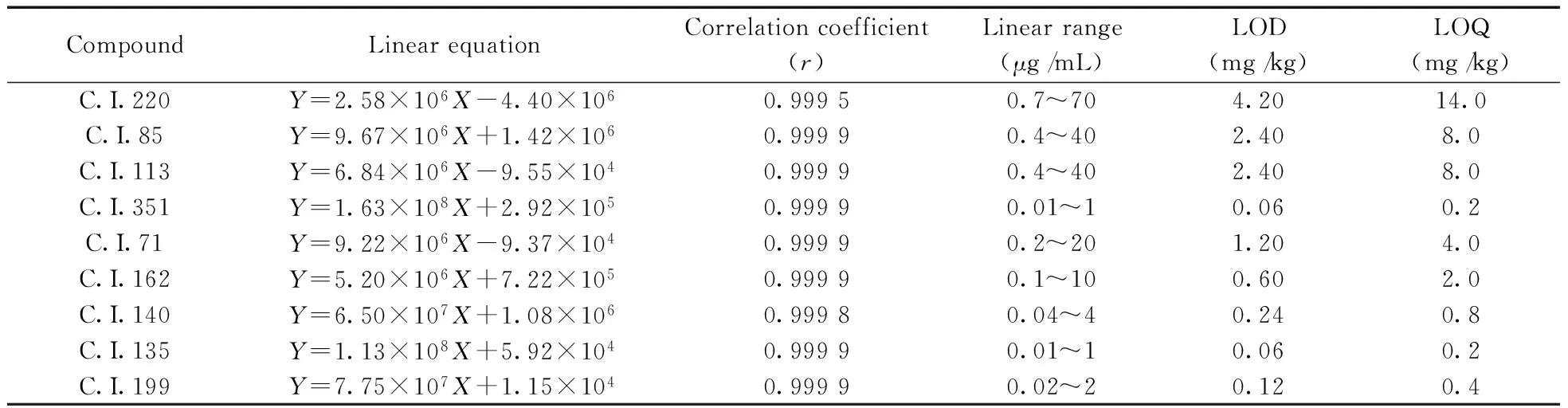
表1 9种荧光物质的线性关系、检出限与定量下限Table 1 Regression relations,LODs and LOQs of nine FWAs
Yis peak area of target analyte;Xis concentration of target analyte
2.3.2 方法准确度与精密度 在阴性护肤水样品中添加3个浓度水平的9种荧光增白剂标准品,每个浓度水平做6个平行样品,进行准确度与精密度试验,结果见表2。9种荧光增白剂的平均回收率为84.3%~102.4%,相对标准偏差(RSD)为1.2%~6.2%,说明方法的重现性很好。
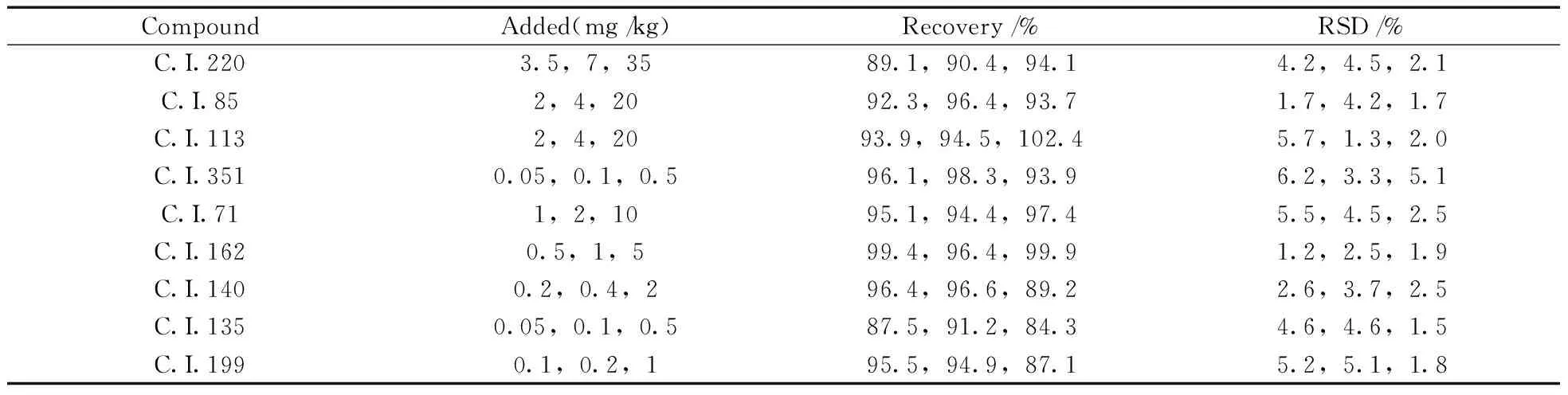
表2 样品的加标回收率及相对标准偏差(n=6)Table 2 Spiked recoveries and relative standard deviations(RSDs) of samples(n=6)
2.4 实际样品的检测
利用本研究建立的方法检测13批实际样品,包括市售国产和进口6个品牌,其中1批样品检出荧光增白剂C.I.199,含量为5.92 mg/kg;另有1批样品检出荧光增白剂C.I.140,含量为3.64 mg/kg。
3 结 论
本研究采用超声辅助-分散液液微萃取结合高效液相色谱技术(UA-DLLME-HPLC-FLD),建立了高灵敏度、快速测定护肤水中9种常用荧光增白剂的检测方法,方法能够节省大量对人体有害的有机溶剂的使用,具有灵敏、准确、省时、稳定、精密度高、重现性好等优点,适合实验室大批量护肤水样品的检测。
[1] Zhu X L,Liu J,Wen H,Yan H,Zhang L,Wang H X.Sci.Technol.FoodInd.(朱晓玲,刘杰,文红,严恒,张莉,王会霞.食品工业科技),2015,35(10):366-371.
[2] Yu K,Han Y,Zhang C M,Meng X,Jiang L H,Miao M M.Chem.Reagents(喻坤,韩熠,张承明,孟霞,蒋丽红,缪明明.化学试剂),2013,35(6):417-422.
[3] Jiao Y N,Ding L,Zhu S H,Fu S L,Gong Q,Li H,Wang L B.Chin.J.Chromatogr.(焦艳娜,丁利,朱绍华,傅善良,龚强,李晖,王利兵.色谱),2013,31(1):83-87.
[4] Wu Z L,Chen S D,Lin X J,Mu T N,Wu Z J,Guo X D,Guo M Z,Xian Y P,Luo D H.Mod.FoodSci.Technol.(吴钟玲,陈树东,林晓佳,穆同娜,吴治将,郭新东,郭茂章,冼燕萍,罗东辉.现代食品科技),2013,29(11):2757-2761.
[5] Guo R H,Zhou Y H.ChinaPulpPaper(郭仁宏,周颖红.中国造纸),2007,26(10):33-35.
[6] Luo G Z,Liu X,Wang X D,Gao Y J.Chin.Measur.Test.Technol.(罗冠中,刘祥,汪晓冬,高亦军.中国测试),2009,35(4):68-71.
[7] Liu J,Qin Z M,Zuo Y,Liu S P.PaperandPaperMaking(刘峻,秦紫明,左莹,刘水平.纸和造纸),2011,30(3):57-60.
[8] Yang M,Li Y Y.J.LanzhouUniv.ArtsSci.:Nat.Sci.Ed.(杨敏,李云云.兰州文理学院学报:自然科学版),2015,29(5):44-47.[9] Du Y,Wang Z H,Yue Q Q.Chin.Plast.Ind.(杜悦,王振华,岳青青.塑料工业),2014,42(11):89-92.
[10] Liu R Q,Gao L H,Wang W X,Ma D.GuangzhouChem.Ind.(刘荣琴,高磊红,王未肖,麻东.广州化工),2013,41(15):135-137.
[11] Gan H Y,Zhang T Y.Chin.J.Chromatogr.(甘宏宇,张天玉.色谱),2011,29(2):184-186.
[12] Lian X Z,Chen M S,Zheng L S,Wu G B.Mod.FoodTechnol.(练习中,陈梅斯,郑丽斯,伍国斌.现代食品科技),2011,27(10):1281-1284.
[13] Ma H J,Ma Q,Bai H,Li J R,Meng X S,Chen Y X,Li W T.Chin.J.Anal.Lab.(马会娟,马强,白桦,李晶瑞,孟宪双,陈云霞,李文涛.分析试验室),2014,33(5):569-573.
[14] Wang W X,Yang T J,Li Z G,Ting T G,Lee M R.Anal.Chim.Acta,2011 ,690(2):221-227.
[15] Yan H Y,Liu B M,Du,J J,Yang J L,Row K H.J.Chromatogr.,2010,1217(32):5152-5157.
[16] Huang K J,Wei C Y,Liu W L,Xie W Z,Zhang J F,Wang W.J.Chromatogr.,2009,1216(38):6636-6641.
[17] Rezaee M,Assadi Y,Hosseinia M M,Aghaee E,Ahmadi F,Berijani S.J.Chromatogr.,2006,1116(1/2):1-9.
[18] Berijani S,Assadi Y,Anbia M,Hosseini M M,Aghaee E.J.Chromatogr.,2006,1123(1):1-9.
[19] Dai L P,Cheng J, Matsadiq Z,Lu L,Li J K.Anal.Chim.Acta,2010,674(2):201-205.
Simultaneous Determination of Nine Fluorescent Whitening Agents in Skincare Water Using Ultrasound-assisted Dispersive Liquid-Liquid Microextraction Coupled with High Performance Liquid Chromatography
ZHANG Xian-chen1*,HUA Hong-bo2,BO Yan-na3,LI Rong1,ZHANG Peng-jie1,YANG Fang1,WANG Yong1,XIONG Ren-guang1
(1.Inspection and Quarantine Technology Center ,Zhongshan Entry-Exit Inspection and Quarantine Bureau,Zhongshan 528403,China;2.Zhongshan Zhuoya Foreign Language School,Zhongshan 528401,China;3.Key Laboratory of Product Packaging and Logistics,Institute of Packaging Engineering of Guangdong Higher Education Institutes,Jinan University,Zhuhai 519070,China)
A method based on ultrasonic-assisted dispersive emulsion microextraction procedure coupled to high performance liquid chromatography with fluorescence detector(UA-DLLME-HPLC-FLD) was developed for the determination of nine fluorescent whitening agents (FWAs) residues in skincare water.Experimental conditions affecting the microextraction procedure such as type and volume of extraction solvent,content of disperse solvent,salt concentration,pH value,extraction time and centrifugal time were investigated.The ultrasonic-assisted disperse emulsion microextraction conditions were optimized by using 50 μL chloroform as solvent and 250 μL methanol as disperser solvent,and the mixture was centrifuged at 4 500 r/min for 2 min.Under the optimum conditions,the calibration curves of nine fluorescent whitening agents in a certain concentration range with correlation coefficients more than 0.999 0.The limits of detection(LODs) of night fluorescent whitening agents ranged from 0.06 mg/kg to 4.20 mg/kg and the limits of quantitation(LOQs) ranged from 0.2 mg/kg to 14.0 mg/kg.The average recoveries for nine fluorescent whitening agents residues in skincare water were in the range of 84.3%-102.4%.Compared to the previous methods,the new procedure has the characteristics of simple sample preparation,low organic solvent consumption and high sensitivity.
dispersive liquid-liquid microextration(DLLME);ultrasound-assisted(UA);high performance liquid chromatography(HPLC);fluorescent whitening agents(FWAs);skincare water
2016-04-16;
2016-05-18
国家质检总局科技计划项目(2015IK052);中山市科技计划项目(2014A2FC241);广东检验检疫局科技计划项目(2015GDK32)
10.3969/j.issn.1004-4957.2016.11.014
O657.72;TQ610.495
A
1004-4957(2016)11-1451-05
*通讯作者:张宪臣,硕士,高级工程师,研究方法:食品中有毒有害物质的分析,Tel:0760-88887380,E-mail:zhangxc@zs.gdciq.gov.cn

