反相固相萃取/超高效液相色谱-串联四极杆质谱仪同时测定污水中9种卤乙酸的方法研究
吴睿清,梁欣然,李 伟,刘玉灿
(西安建筑科技大学 环境与市政工程学院,陕西 西安 710055)
反相固相萃取/超高效液相色谱-串联四极杆质谱仪同时测定污水中9种卤乙酸的方法研究
吴睿清,梁欣然,李 伟*,刘玉灿
(西安建筑科技大学 环境与市政工程学院,陕西 西安 710055)
使用反相固相萃取预处理与超高效液相色谱-串联四极杆质谱仪(RSPE UPLC-MS/MS)联用建立了同时测定污水中9种卤乙酸(HAAs)的分析方法。研究表明:ENVI-C18固相萃取小柱能有效去除污水样品中有机基质的干扰,样品pH值调至2.5能有效消除无机离子对HAAs离子化的影响;采用HSST3(2.1 mm×100 mm)色谱柱,以甲醇和0.000 5%甲酸为流动相,可在15.0 min内将9种HAAs分离且效果良好。采用优化后的程序建立标准曲线,9种HAAs的线性范围为0.5~100 μg/L,相关系数(r2)为0.999 7~0.999 9,检出限和定量下限分别为0.02~0.26 μg/L和0.05~0.86 μg/L,日内和日间相对标准偏差分别为1.4%~10.0%和1.7%~10.0%。3个污水处理厂出水在2.5 μg/L和10 μg/L的加标浓度水平下,回收率为85.2%~107.8%。该方法能够满足污水处理厂出水中9种HAAs的检测要求。
卤乙酸;超高效液相色谱-串联四极杆质谱;二级出水;固相萃取
氯和氯胺常被用于饮用水和城市污水处理厂二级出水的消毒,但其在消毒过程中可与水中有机物(NOM或EfOM)发生反应,生成对人体有害的卤代消毒副产物(DBPs)[1-3]。大量研究表明,卤乙酸(HAAs)是仅次于三卤甲烷(THMs)的第二大类DBPs,其浓度约占DBPs总量的13%,但致癌风险占总致癌风险的91.9%以上[4]。常见的HAAs有一氯乙酸(MCAA)、二氯乙酸(DCAA)、三氯乙酸(TCAA)、一溴乙酸(MBAA)、二溴乙酸(DBAA)、三溴乙酸(TBAA)、溴氯乙酸(BCAA)、一溴二氯乙酸(BDCAA)、二溴一氯乙酸(DBCAA) 9种。
我国和美国的HAAs标准检测方法均采用气相色谱-电子捕获检测器(GC-ECD)[5-8],但由于HAAs具有强极性和难挥发性等特点,常需利用液液萃取对卤乙酸进行富集,然后进行衍生化处理。这些样品预处理方法需消耗大量的有毒有机试剂(如重氮甲烷等),且处理步骤复杂,所需时间较长,故不利于样品的快速检测。由于HAAs在水中几乎完全电离(电离度>99%),因此离子色谱法(IC)[9-11]也被应用于HAAs的检测,但该方法易受到水样中无机离子的干扰。US EPA方法557[12]采用离子色谱-电喷雾串联质谱联用仪(IC-ESI-MS/MS)在55 min内分离了饮用水中9种卤乙酸,该方法具有较高的灵敏度,但色谱分离时间较长。采用高效液相色谱-质谱联用仪(HPLC-MS)[13-14]检测HAAs时,由于传统C18色谱柱无法保留离子态的HAAs,故需在流动相中加入离子对试剂,将离子态HAAs变为分子态后进行分离测定,但该方法需进行较长时间的色谱平衡,故单个样品的测定时间较长。
目前,已有的HAAs检测方法基本上是针对饮用水[5-7,9,11-15],以污水为基质的HAAs检测方法较少。与饮用水相比,城市污水处理厂出水中含有浓度较高的有机物(EfOM),因此可能导致氯化消毒后生成更多的卤化DBPs[16-17]。此外,高浓度EfOM的存在也会干扰HAAs的分离与检测。含有高浓度HAAs的城市污水处理厂出水直接排放到自然水体中会对水生态及下游饮水安全造成潜在威胁。因此,有必要建立一种城市污水处理厂出水中的HAAs检测方法,以对出水中的HAAs浓度进行测定、监控并及时采取合理的应对策略。
基于上述讨论,本研究采用固相萃取(SPE)小柱预处理及超高效液相色谱-串联四极杆质谱仪(UPLC-MS/MS)建立了快速检测城市污水处理厂二级出水中9种HAAs的方法,对影响检测的主要参数进行了优化,并对方法的有效性进行了验证。
1 实验部分
1.1 试剂与溶液配制
9种HAAs的混合标准溶液(每种浓度均为2 000 mg/L,德国Sigma-Aldrich公司);甲醇(HPLC级,德国Merck公司);甲酸(HPLC级,天津科密欧化学试剂有限公司);Supel-select HLB SPE小柱(60 mg/3 mL)、Supelclean ENVI-C18SPE小柱(500 mg/3 mL)均购于美国Supelco公司;Sep-Pak C8SPE小柱(500 mg/6 mL,美国Waters公司);玻璃纤维膜(GF/C,英国Whatman公司);超纯水(18.2 MΩ·cm,25 ℃)由英国ELGA超纯水系统(Elga Purelab Ultra Analytic System)制取。
使用超纯水将HAAs混合标准溶液稀释至浓度为40 mg/L的储备溶液,吸取500 μL储备液于100 mL容量瓶中,用超纯水定容至刻度,即得到浓度为200 μg/L的标准中间溶液;再用超纯水将其进一步稀释成100,50,20,5,1,0.5 μg/L的标线标准溶液。上述溶液均置于4 ℃下避光保存,其中标线标准溶液现用现配。
1.2 仪器设备与参数设置
超高效液相色谱-电喷雾-串联三重四极杆质谱联用仪(UPLC-ESI-MS/MS,美国Waters公司)用于HAAs检测;Acquity UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8 μm,美国Waters公司)用于分析物的色谱分离;Masslynx 4.1 软件(Waters)用于仪器控制、数据采集和结果分析。
液相色谱条件:流动相由甲醇(A)和0.000 5%(体积分数)的甲酸水溶液(B)组成,流速0.2 mL/min。单个样品检测时间共15.0 min,洗脱梯度为:1% A保持1.5 min,在4 min内升至40%并保持3 min,然后在0.2 min内快速升至90%并保持2.8 min,最后降至1% A并平衡3.5 min。进样量为10 μL,样品室和色谱柱的温度分别设为25 ℃和35 ℃。
质谱条件:采用电喷雾离子源负离子模式(ESI-);毛细管电压2.5 kV;离子源温度120 ℃;脱溶剂温度350 ℃;脱溶剂气(氮气)流量850 L/h;锥孔气(氮气)流量50 L/h;碰撞气(氩气)流量0.12 mL/min。9种HAAs的名称、保留时间、前级离子、产物离子、锥孔电压以及最优的碰撞能量见表1。
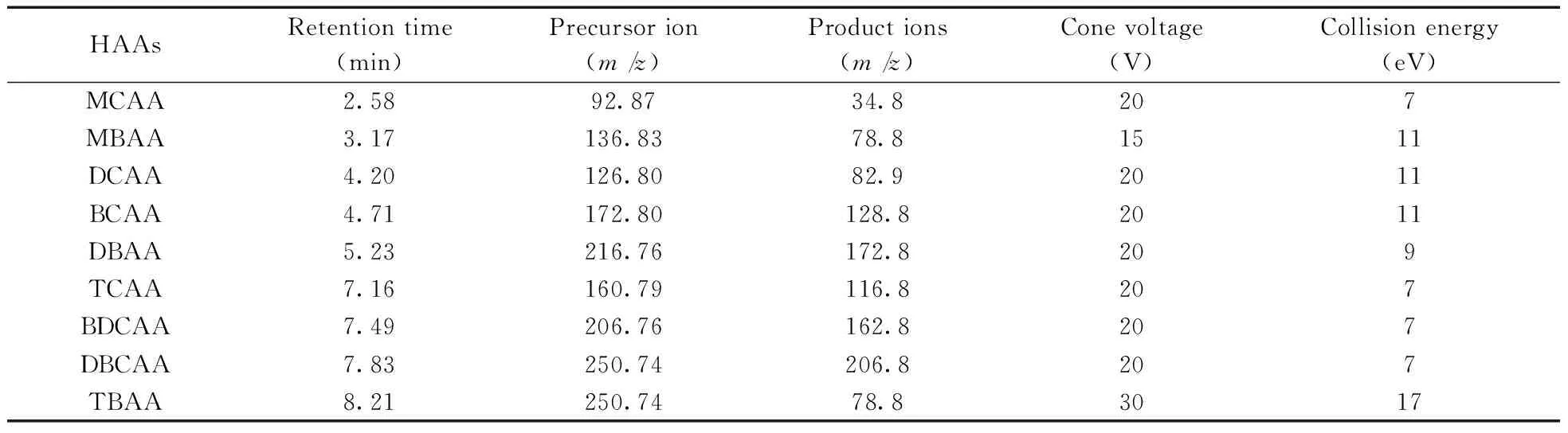
表1 9种HAAs的名称、保留时间、前级离子、产物离子、锥孔电压及最优的碰撞能量Table 1 Names,retention times,precursor and product ions,cone voltages and collision energies of nine HAAs
1.3 样品采集与处理
取自西安市某污水处理厂氯接触消毒池的出水,经GF/C玻璃纤维膜过滤后,以4 mL/min的流速通过淋洗后的ENVI-C18SPE小柱,用硫酸将收集的滤液调至pH 2.5,并使用0.22 μm的滤头式过滤器过滤,置于进样瓶中待测。SPE小柱在使用前依次用10 mL甲醇、20 mL超纯水和20 mL经GF/C玻璃纤维膜过滤的水样淋洗。回收率试验以污水处理厂二沉池的出水为空白样品,加入9种HAAs标准样品后按照上述程序处理后测定。
2 结果与讨论
2.1 流动相的选择
前期研究结果[18]表明,使用UPLC-MS/MS检测饮用水中9种HAAs时,流动相组分(甲醇-超纯水)中的甲酸添加量对色谱分离效果有较大影响,尤其是分子量较小的MCAA,MBAA,DCAA和BCAA。保留时间主要由固定相、目标物和流动相之间的物理化学关系或分子间相互作用力共同决定,改变流动相强度可实现目标物质的分离。当流动相B中甲酸含量为0.022 2%(pH 3.0)时,MCAA与DCAA,MBAA与DBAA相互重叠;当甲酸含量减少至0.004 0%(pH 3.5)时,MBAA的保留时间缩短且与BCAA相互重叠;当甲酸的含量继续降至0.002 0%(pH 3.6)时,MBAA的保留时间进一步减小,而DCAA的保留时间延长,导致这两个峰发生重叠。在上述甲酸浓度条件下均无法实现9种HAAs的完全分离,而当流动相B中甲酸含量降至0.000 5%(pH 4.1)时,9种HAAs的保留时间延长,可实现完全分离。当流动相B中不加甲酸时,9种HAAs也无法分离。因此,本研究以甲醇和0.000 5%的甲酸水溶液作为流动相。
2.2 样品预处理的优化
2.2.1 不同固相萃取柱的对比 与饮用水相比,二沉池出水的基质复杂,高浓度的有机质对液相色谱分离以及电喷雾质谱仪的检测均有不利影响。因此,对于污水样品,直接进样分析不能满足实际检测的要求。鉴于HAAs的离子特性(9种HAAs的pKa=0.51~2.89[18]),污水中绝大部分的HAAs以离子形态存在,水样通过SPE小柱后,有机质被保留在SPE小柱的固定相中,离子态的HAAs通过固定相进入收集液中,SPE小柱对HAAs无富集作用,因此本研究采用反相固相萃取(RSPE),对比二沉池出水经3种不同SPE小柱处理后溶解性有机物(DOM)的去除率。由于SPE小柱淋洗过程中使用了甲醇,水样经过SPE小柱可能会引起总有机碳(TOC)的增加,因此不能使用TOC分析仪测定DOM的去除率,本研究采用紫外-可见分光光度计测定经SPE小柱处理后的水样吸光度(见图1)。其中UV254是水中的某些有机物在254 nm波长紫外光下的吸光度,该值反映了水中有机物的共轭双键含量及芳香性[19]。由图1可知,甲醇的UV254基本可以忽略,因此SPE小柱淋洗过程中使用的甲醇对水样测定无影响。经过SPE小柱处理后,溶液UV254均有不同程度的降低。其中,ENVI-C18SPE,Sep-Park C8以及Supel-select HLB小柱对UV254去除率分别为42%,32%和27%,表明ENVI-C18SPE小柱对有机物的去除率最高。因此,本研究在RSPE预处理中选择使用ENVI-C18SPE小柱。
2.2.2 样品的pH值调节 经RSPE处理后,可消除样品中DOM的影响,但污水处理厂二级出水中无机离子引起的基质效应尚未消除,可能导致9种HAAs无法完全分离。前期研究结果[18]表明,将样品的pH值调至3.0以下时,大多数HAAs以分子状态存在,其与固定相之间的作用力增强;同时,当样品pH值接近色谱柱填料(高纯硅)颗粒的等电点时,硅表面双电层的厚度减小,无机离子能够被强极性流动相快速冲出,因此,无机离子不会影响HAAs的离子化过程,HAAs可获得良好的分离检测。由于所使用的HSS T3色谱柱最低pH耐受值为2.0,为保护色谱柱,故在测定实际样品时将样品pH值调至2.5。
使用上述优化后的处理步骤,10 μg/L的HAAs混合标准样品经UPLC-ESI-MS/MS分离检测的总离子流(TIC)图见图2A。结果表明,超纯水配制的HAAs标准样品中9种分析物得到了较好的分离检测效果。将10 μg/L的HAAs混合标准样品添加到污水处理厂二沉池出水中,经GF/C玻璃纤维膜和0.22 μm滤膜过滤后直接进样检测得到的TIC图见图2B。与图2A相比,图2B中所有分析物均受到不同程度的影响,且色谱保留时间越小的分析物受到的影响越大。其中MCAA和MBAA从色谱图中消失,DCAA则变为双肩峰。而将上述滤液的pH值调至2.5后,除MCAA,MBAA,DCAA和BCAA的色谱峰略变宽外,9种HAAs的分离效果与标准样品的色谱图无明显差异(图2C)。但研究发现,污水样品中的复杂基质会对后续样品测定造成影响,随着进样次数的增加,分析物的回收率降低,这可能是由于样品中的复杂基质对离子源或质谱的污染所致。当上述污水样品先经GF/C玻璃纤维膜过滤,然后将收集到的滤液经C18SPE小柱处理,再经0.22 μm滤膜过滤后测得9种HAAs的TIC图见图2D,此图与图2B相似,无法实现对MCAA,MBAA和DCAA的精确定量分析。将经C18SPE小柱过滤后样品的pH值调至2.5后再进样测定,此时9种HAAs能够实现完全分离(图2E)。且研究发现,连续测定实际样品500次后,9种分析物的信号强度均无明显降低。上述结果表明,将污水处理厂二级出水先经GF/C玻璃纤维膜过滤,然后将滤液经C18SPE小柱处理,再将滤液调至pH 2.5,能够有效地消除污水中基质效应对采用UPLC-ESI-MS/MS分离检测9种HAAs时的影响。
2.3 方法的有效性
2.3.1 标准曲线、检出限与定量下限 在优化条件下,使用UPLC-ESI-MS/MS在MRM模式下建立了9种HAAs(0.5,1,5,20,50,100 μg/L)的标准曲线,测得各HAAs的线性范围为0.5~100 μg/L,相关系数(r2)为0.999 3~0.999 9(见表2)。根据US EPA方法计算出本方法的检出限(LODs)和定量下限(LOQs)分别为0.02~0.26 μg/L和0.05~0.86 μg/L,较HAAs标准检测方法[5-8]及IC方法[9-11]更为灵敏,具有较高的灵敏度。
2.3.2 精密度与准确度 通过向水样中添加浓度为2.0 μg/L和50 μg/L的HAAs混标,通过计算响应强度的相对标准偏差(RSD)来确定方法精密度。其中日内精密度是在同一天内对同一样品进行6次测定的RSD值,日间精密度是在相同条件下对其又进行连续5 d测定的RSD值。结果日内和日间RSD分别为1.4%~10.0%和1.7%~10.0%(见表2),方法的精密度良好。
为进一步验证本方法的准确度,从3个不同污水处理厂(编号为A,B和C)采集二沉池出水样品,向其中添加2.5 μg/L和10 μg/L的9种HAAs混合标准溶液,采用标准添加方法进行回收率测试(见表2)。由表2可知,其回收率为85.2%~107.8%,表明该方法具有较高的准确度。
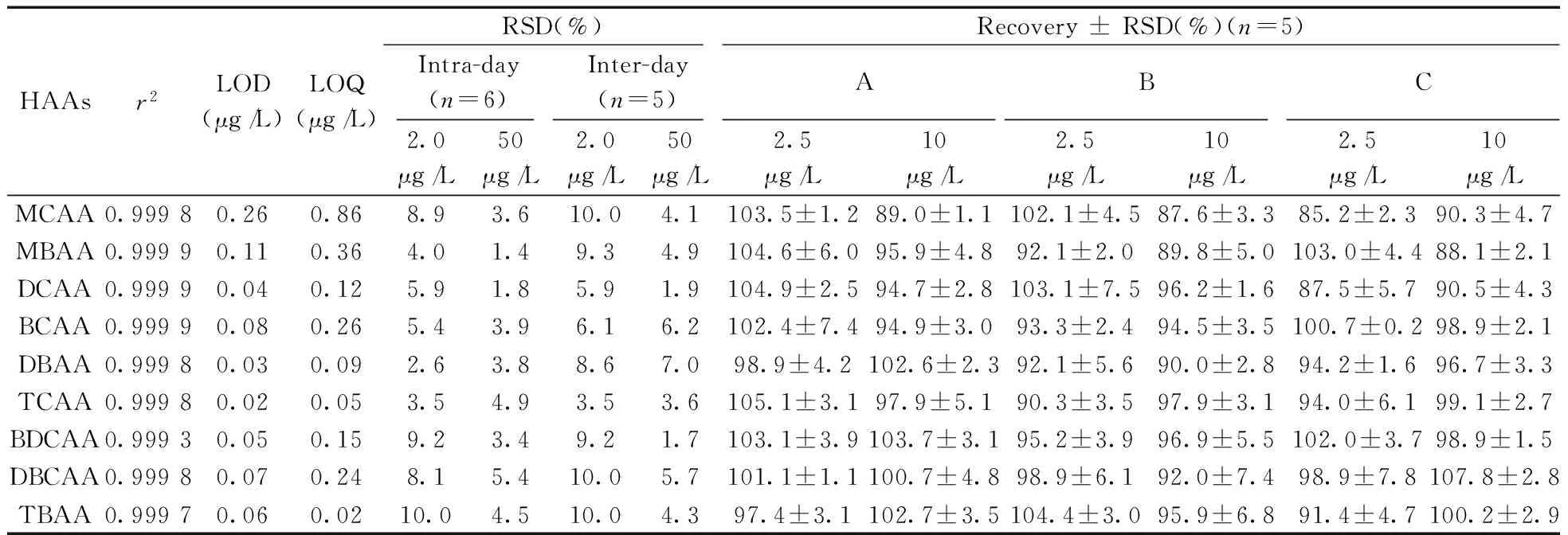
表2 9种HAAs的检出限、定量下限、加标回收率及相对标准偏差Table 2 LODs,LOQs,recoveries and relative standard deviations of nine HAAs
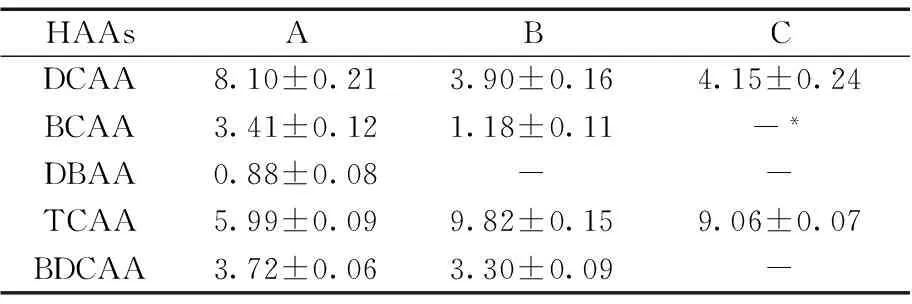
表3 实际污水样中的HAAs浓度Table 3 Concentration of nine HAAs in actual wastewater effluent ρ/(μg·L-1)
*no detected
2.4 实际水样的测定
采用本方法对取自A,B和C污水处理厂氯接触消毒池出水的HAAs进行测定。结果显示,3个污水处理厂的水样均检出DCAA和TCAA,其中TCAA的浓度最高(为9.82 μg/L),此外,A和B污水处理厂水样均检出了BCAA和BDCAA,A污水处理厂还检测出DBAA(表3),而其它HAAs均未检出。
2.5 与标准方法的比较
本研究所建立的方法与HAAs标准检测方法(GC-ECD)[5-8]相比,能够避免样品预处理过程中有毒有机溶剂的使用,且无需对样品进行衍生化,操作步骤简单,大幅缩减了样品预处理时间。已有IC方法[9-12]的色谱分离时间在40.0 min以上(如US EPA标准方法557(IC-ESI-MS/MS)[12]中IC分离时间为55.0 min),本方法的色谱分离时间仅需15.0 min,有利于样品的快速检测。
3 结 论
本研究采用ENVI-C18SPE小柱对污水处理厂出水进行预处理,并将其调至pH 2.5,有效消除了有机基质以及无机离子对检测的影响,以甲醇和0.000 5%甲酸水溶液作为流动相,采用UPLC-ESI-MS/MS在多反应监测(MRM)模式下建立了污水处理厂二级出水中9种HAAs的检测方法。采用优化后的样品处理程序及仪器参数设置,能够实现污水处理厂二级出水中9种HAAs的良好分离,且具有良好的线性关系,较高的灵敏度、准确度和精确度。将所建立的方法对实际水样进行了分析,证实该方法能够满足污水处理厂二级出水中9种HAAs的检测要求。
[1] Zhai H Y,Zhang X R,Zhu X H,Liu J Q,Ji M.Environ.Sci.Technol.,2014,48(5):2579-2588.
[2] Doederer K,Gernjak W,Weinberg H S,Farré M J.WaterRes.,2014,48:218-228.
[3] Le Roux J,Gallard H,Croué J P.WaterRes.,2011,45(10):3164-3174.
[4] Zhang X J,Li S.WaterWastewaterEng.(张晓健,李爽.给水排水),2000,26(8):1-6.
[5] US EPA method 552.1,Revision 1.0.Determination of Haloacetic Acids and Dalapon in Drinking Water by Ion-Exchange Liquid-Solid Extraction and Gas Chromatography with an Electron Capture Detector.United States Environmental Protection Agency,US,1992.
[6] US EPA method 552.2,Revision 1.0.Determination of Haloacetic Acids and Dalapon in Drinking Water by Liquid-Liquid Extraction,Derivatization and Gas Chromatography with Electron Capture Detection.United States Environmental Protection Agency,1995.
[7] US EPA method 552.3,Revision 1.0.Determination of Haloacetic Acids and Dalapon in Drinking Water by Liquid-LiquidMicroextraction,Derivatization,and Gas Chromatography with Electron Capture Detection.United States Environmental Protection Agency,2003.
[8] HJ 758-2015.Water Quality-Determination of Haloacetic Acids-Gas Chromatography.National Standards for Environmental Protection of the People’s Republic of China(水质-卤代乙酸类化合物的测定-气相色谱法.中华人民共和国国家环境保护标准).
[9] Verrey D,Louyer M V,Thomas O,Baurès E.Microchem.J.,2013,110:608-613.
[10] Teh H B,Li S F Y.J.Chromatogr.A,2015,1383:112-120.
[11] Zhong X L.Environ.Chem.(钟新林.环境化学),2013,32(7):1422-1423.
[12] USEPA Method 557.Determination of Haloacetic Acids,Bromate,and Dalapon in Drinking Water by Ion Chromatography Electrospray Ionization Tandem Mass Spectrometry(IC-ESI-MS/MS).United States Environmental Protection Agency,2009.
[13] Loos R,Barcelo D.J.Chromatogr.A,2001,938(1):45-55.
[14] Lei Y,Yasojima M,Wang L Y,Fan X H,Tao Y,Zhang X H.Chin.WaterWastewater(雷颖,八十岛诚,王凌云,范小江,陶益,张锡辉.中国给水排水),2013,29(20):124-129.
[15] Liu Y,Rao Z,Lu G H,Jia J,Shen Y T,Li S.J.Instrum.Anal.(刘艳,饶竹,路国慧,贾静,沈亚婷,李松.分析测试学报),2011,30(3):248-253.
[16] Chang H,Chen C,Wang G.WaterRes.,2013,47(8):2729-2741.
[17] Sun Y X,Wu Q Y,Hu H Y,Tian J.J.Hazard.Mater.,2009,168(2):1290-1295.
[18] Duan J M,Li W,Si J,Mulcahy D.Anal.Methods,2011,3(7):1667-1673.
[19] Puspita P,Roddick F A,Porter N A.Chem.Eng.J.,2011,171(2):464-473.
Determination of Nine Haloacetic Acids in Wastewater Effluents Using Reverse Solid-phase Extraction Pretreatment and Ultra-performance Liquid Chromatography-Tandem Mass Spectrometry
WU Rui-qing, LIANG Xin-ran, LI Wei*, LIU Yu-can
(School of Environmental and Municipal Engineering,Xi’an University of Architecture and Technology,Xi’an 710055,China)
A rapid method for the determination of nine haloacetic acids(HAAs) in wastewater effluent was established using reverse-phase solid-phase extraction pretreatment coupled with ultra-performance liquid chromatography-tandem mass spectrometry(RSPE UPLC-MS/MS).An ENVI-C18cartridge was employed to remove organic substances in water sample to minimize its negative effect on HAAs analysis,and the pH value of sample was adjusted to 2.5 to eliminate the effect of inorganic ions on the ionization of HAAs.Under the optimal conditions,all the nine HAAs were separated within 15.0 min on a reversed phase liquid chromatographic column(HSS T3,2.1 mm×100 mm) using methanol-0.000 5% formic acid as mobile phase.The calibration curves were linear(r2=0.999 7-0.999 9) in the range of 0.5-100 μg/L for all the nine HAAs.The limits of detection(LODs) and limits of quantitation(LOQs) were in the range of 0.02-0.26 μg/L and 0.05-0.86 μg/L,respectively.The intra-day and inter-day relative standard deviations(RSDs) were in the range of 1.4%-10.0% and 1.7% -10.0%,respectively.The method recoveries ranged from 85.2% to 107.8% for effluent samples from three wastewater treatment plants at two spiked concentration levels of 2.5 μg/L and 10 μg/L.This method could meet the detection requirements for nine kinds of HAAs in wastewater effluents.
haloacetic acid;ultra-performance liquid chromatography-tandem mass spectrometry(UPLC-MS/MS);secondary effluent;solid-phase extraction(SPE)
2016-05-08;
2016-06-10
国家自然科学基金项目(51308437);陕西省教育厅基金项目(16JK1447)
10.3969/j.issn.1004-4957.2016.11.009
O657.63;O622.2
A
1004-4957(2016)11-1422-06
*通讯作者:李 伟,博士,副教授,研究方向:水处理理论、水质科学与技术,Tel:029-82201354,E-mail:liwei@xauat.edu.cn
研究简报

