肌筋膜疼痛综合征的影像学研究进展
李真檀秀香吴金鹏李迎新
300192天津,中国医学科学院北京协和医学院生物医学工程研究所
肌筋膜疼痛综合征的影像学研究进展
李真檀秀香吴金鹏李迎新
300192天津,中国医学科学院北京协和医学院生物医学工程研究所
肌筋膜疼痛综合征(MPS)是以肌筋膜激痛点(MTrPs)的存在为特征的一种常见骨骼肌疼痛及功能障碍疾病。目前临床上对该病的诊断主要依靠触诊,激痛点定位信度较低,且临床治疗效果评估也缺乏客观手段。因此,对MPS特征的客观化研究成为热点,已开展的研究手段包括超声成像、磁共振成像及红外热像等,主要从激痛点的硬度、筋膜厚度、激痛点位置的表面温度等方面进行研究。综述了MPS在影像学方面的研究进展及研究方法,旨在为该病种的临床诊断及疗效评估客观化提供依据。
肌筋膜疼痛综合征;超声成像;磁共振成像;红外热像;弹性模量
0 引言
肌筋膜疼痛综合征(myofascial pain syndrome, MPS)是由肌筋膜激痛点(myofascial trigger points, MTrPs)所造成的感觉、运动和自主神经性症状,以激痛点的存在为特征[1],是疼痛门诊、骨科、康复科较为常见的疼痛症,多发于运动员、劳动强度高及长期固定姿势工作人群。流行病学调查显示,85%疼痛门诊患者的疼痛症状是由MTrPs引起,甚至95%的慢性疼痛也与此相关[2-3]。临床上对MPS的诊断主要依据Simons等[1]提出的诊断标准,需要满足5个主要标准和至少1个次要标准。主要标准包括区域性疼痛、感觉异常、可触及紧绷带、点状剧痛及活动受限;次要标准包括按压激痛点产生疼痛和感觉异常、局部抽搐反应、药物注射能够缓解疼痛,这就要求临床医师需具有丰富的临床触诊经验。研究结果表明,激痛点检查各评判者间信度较低[4],只有检查者均经验丰富又训练有素才能得出重复率较高的结果;此外,各种干预手段对该病种的疗效评价缺乏客观指标。因此,MPS的特征客观化成为研究热点,一些研究者积极采用影像学方法开展研究。本文综述了采用常规超声、多普勒超声、弹性超声、磁共振弹性成像及红外热像等技术研究MPS特征的研究进展。
1 超声成像研究
激痛点是骨骼肌紧绷肌带内的过度应激点,包含多个收缩结节,收缩结部位肌纤维直径显著增加,且比正常肌纤维更硬、更紧张。激痛点可分为活化激痛点和隐性激痛点两类,按压时均会引起疼痛,但活化激痛点会引起自发性疼痛。激痛点综合假说认为,创伤等意外事件或终板的乙酰胆碱过度释放导致肌节挛缩,能量消耗增加,肌纤维持续短缩会压迫局部血管,能量供给减少,造成局部能量危机;穿过该区域的自主神经和感觉神经相互作用的物质被释放,反过来又造成乙酰胆碱从神经末梢过度释放,形成恶性循环(图1)。基于该假说,激痛点部位具备3个明显特点:①因能量消耗增加,同时血液循环受损又影响散热,温度会高于周围的肌肉组织。②因缺血而出现严重缺氧。③存在短缩肌节。激痛点的超声研究主要是通过灰阶超声、彩色多普勒超声、弹性超声研究肌筋膜厚度、骨骼肌厚度、激痛点周围血流情况及肌肉硬度等。

图1 激痛点综合假说
1.1 灰阶超声
灰阶超声是基于生物组织的声阻抗差异成像,根据回声反射情况判断组织特征。在二维灰阶图像上,可触摸结节对应位置出现椭圆形的低回声区,且回声不均匀[3],如图2所示,表明该位置组织回声反射情况发生局部变化,可见到斜方肌内独立的结节或几个结节同时存在。从二维灰阶图像上测量得到激痛点大小为(0.16±0.11)cm2,且活化激痛点与隐性激痛点大小无明显差异[3]。在三维灰阶图像的横向、纵向和冠状图像上离散激痛点亦清晰可见,结节的回声不均匀,与正常肌肉组织图像纹理均匀的等回声超声特性有明显差异[3](图3)。在此基础上,Turo等[5]对灰阶超声图像处理后能更直观地反映激痛点的超声特征,运用MATLAB平台图像处理工具箱对二维灰阶图像进行熵滤波,根据图像的灰度分布情况反映回声特性(图4),探索通过感兴趣区域平均熵、整个感兴趣区内熵值小于4的区域面积等指标及其组合鉴别活化激痛点、隐性激痛点与正常组织,能够区分活化激痛点与正常组织。Perez-Palomares等[6]研究肩周炎、肩峰下撞击综合征与MPS在诊断和治疗方面的联系时,用超声扫描法作为对激痛点的物理检查定位可靠性的评估手段。此外,有学者用灰阶超声研究MPS患者受累肌肉、筋膜的厚度,并将此作为评估干预手段治疗效果的方法。Stecco等[7]比较健康人与颈部慢性疼痛患者的筋膜厚度、肌肉厚度,分析按摩、激光等治疗效果,治疗后疼痛程度和筋膜厚度均有所减小,且根据健康人与慢性疼痛患者的胸锁乳突肌筋膜厚度,得到0.15 cm可作为判定颈部肌筋膜疼痛的临界值。Mahyar等[8]研究干针治疗对上斜方肌MPS的治疗效果时采用上斜方肌和筋膜的最大厚度作为评价指标,并通过超声弹性成像研究治疗过程中的应变率。
1.2 彩色多普勒超声
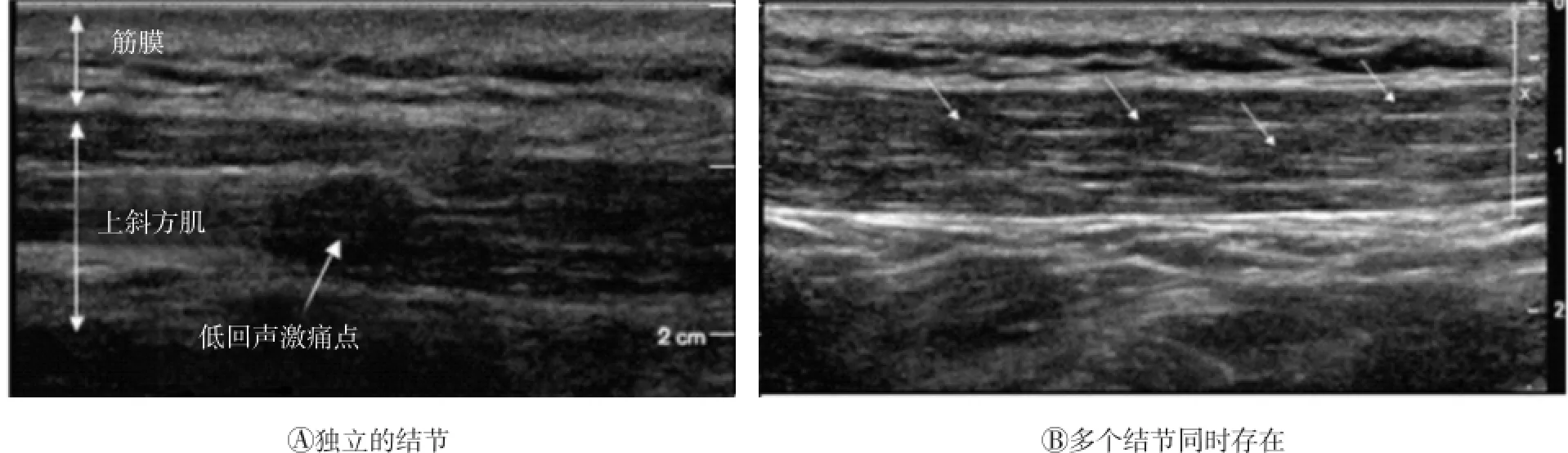
图2 二维灰阶图像上的激痛点
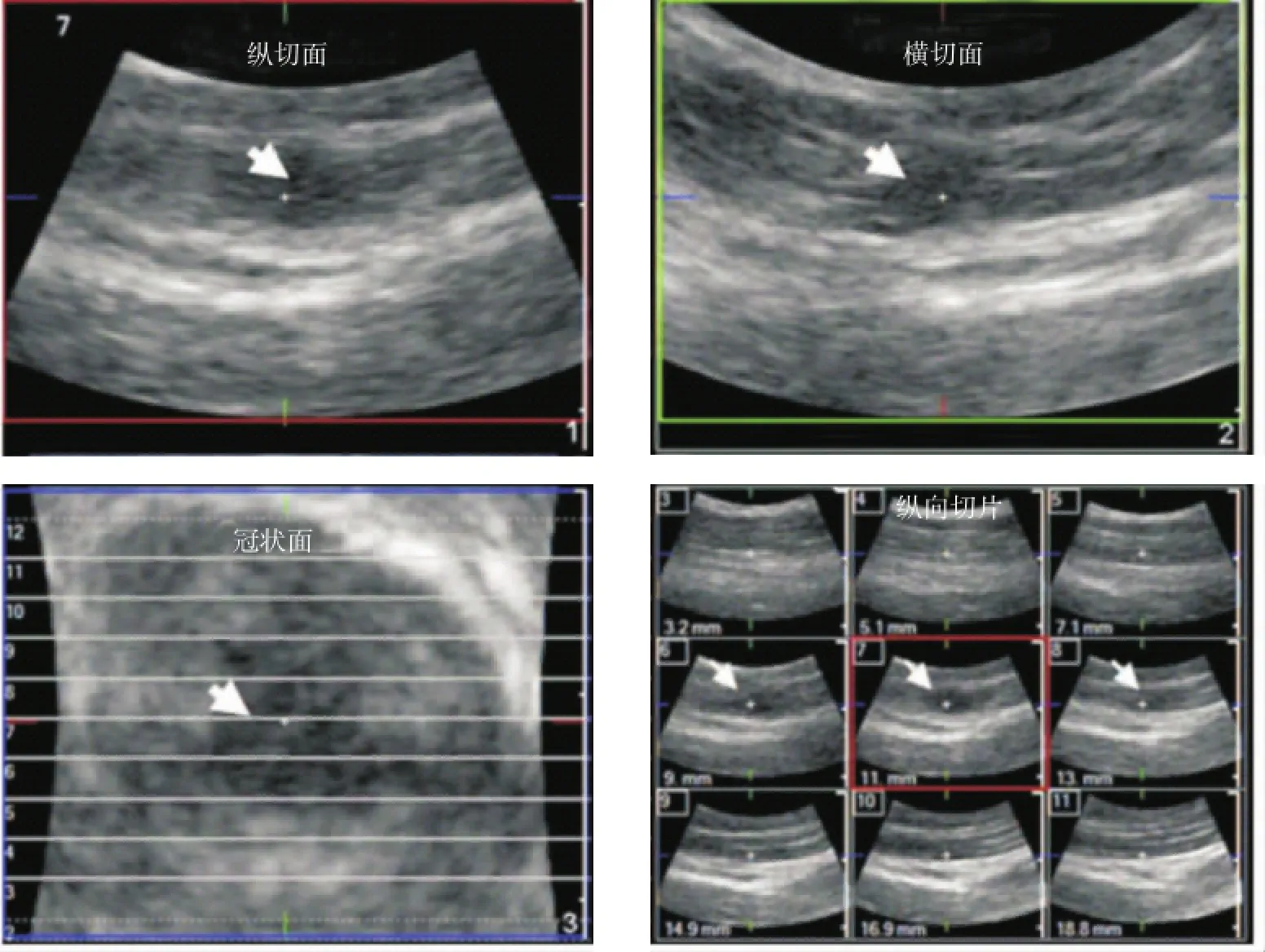
图3 三维灰阶图像上的激痛点
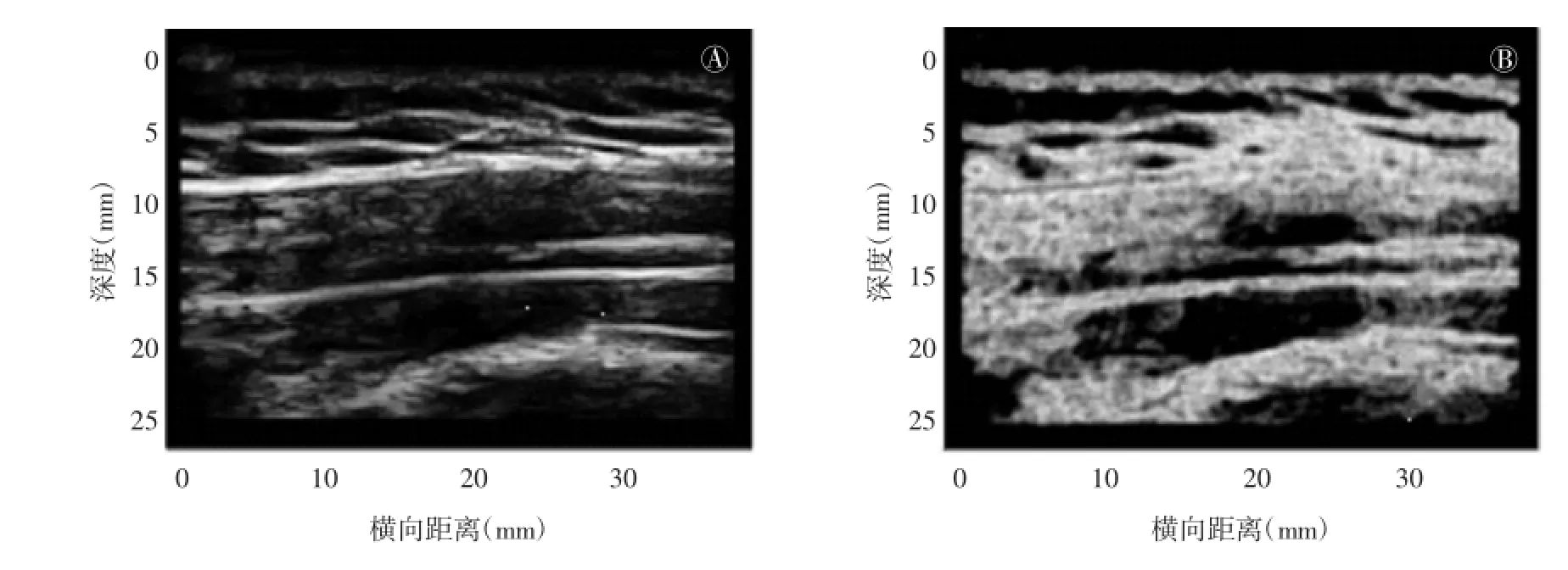
图4 熵滤波前后图像对比
彩色多普勒超声一般是用自相关技术进行多普勒信号处理,把自相关技术获得的血流信号经彩色编码后实时叠加在二维图像上,即形成彩色多普勒超声血流图像。根据激痛点综合假说,肌节持续收缩,局部血管受压迫,血液循环受损,一些学者利用彩色多普勒超声研究激痛点位置的血流情况,涉及的血流动力学指标包括收缩期峰值速度(peak systolicvelocity,PSV)、舒张期最小血流速度(minimum diastolicvelocity,MDV)、阻力指数(resistiveindex,RI)、搏动指数(pulsatilityindex,PI)、加速时间(acceleration time,AT)和时间平均峰值速度(timeaveraged peak velocity,TAPV),其中RI可以表征血管床阻力,通常情况下肌肉组织内RI为1,表明没有舒张流,RI小于1表明血管床阻抗减小,大于1则表示增大。Sikdar等[3]通过研究斜方肌激痛点周围血流情况,检测横向颈动脉的上行分支和激痛点附近动脉或扩张小动脉的PSV和MDV,发现了活化激痛点与隐性激痛点之间的差异。33个激痛点位置中有27个存在明显血管,且有血管直接穿过激痛点,多普勒血流波形显示,69%的活化激痛点位置的动脉具有舒张期逆流的高阻抗血流,结果表明,活化激痛点位置血管床有高阻抗性,而隐性激痛点位置和正常位置很少出现该现象。激痛点位置动脉血流的PSV、MDV、PI与正常肌肉组织位置明显不同,其附近血流波形表现为PSV增大,MDV减小,并出现舒张期持续逆流、早期震荡流动等现象[9](图5)。活化激痛点位置血管阻力的增加,证实了激痛点综合假说,氧化应激引起的挛缩或激痛点持续收缩均会压迫血管,可能导致局部灌注不足、缺氧和其他病理生理的发展,导致活化激痛点位置的疼痛、压痛和结节的生成。此外,Sikdar等[9]还建立了集总参数室模型,分析该种血流波形的生理起源,缩窄的血管床和扩大的血管容量可以解释观察到的流量波形与逆行舒张流。
1.3 弹性超声
弹性超声主要是基于剪切波传播法测量组织弹性,根据剪切波的产生方式分为采用连续振动源的声弹性成像技术、采用脉冲式振动源的瞬时弹性成像技术、声辐射力弹性成像技术[10]。Sikdar等[3]和Shah等[5]研究团队采用声弹性成像技术研究激痛点的弹性特征;声科影像公司的剪切波弹性成像超声诊断仪和西门子公司的Acouson S2000系统中则采用了声辐射力弹性成像技术;已有研究采用声科影像弹性超声诊断系统量化激痛点的组织硬度[11-13]。
声弹性成像技术通过振动幅度大小、剪切波速度和相位量化组织弹性。在声弹性图像上,激痛点振动幅度低于正常组织。有研究结果证明了采用振动声弹性成像定位激痛点的可行性。其先后采用100~250 Hz、92 Hz的外部振源使斜方肌组织产生振动,通过彩色多普勒技术获得振动图像,再根据频谱多普勒分析量化振幅[3,14]。在彩色图像上,激痛点表现为振动幅度减小的局部区域(图6),振幅比正常组织低27%。将弹性彩色图像导入ImageJ中进行二值化处理,自动选出暗区,再在裁剪基础上算出振动幅度减小区域的面积,根据声弹性图像中激痛点面积对激痛点进行分类[14],提出用序数分数描述组织硬度。此后又提出根据剪切波速度和相位角量化组织硬度的方法[15],采用可在60、110、160、200 Hz 4个频率工作的手持直流电动机作为外部振动源,以522帧/s的高帧频收集原始射频数据。每帧包括64个扫描线,50%扇区大小,成像深度为2.5 cm,通过MATLAB在线处理射频数据产生剪切波相位角图像,对射频信号进行希尔伯特变换、自相关算法等处理,估算剪切波速度,进一步计算组织的弹性模量。采用该方法在凝胶假体和人体肱二头肌做实验验证,凝胶假体的实验结果表明,该方法能以<20%的错误率量化剪切模量;检测到的正常肱二头肌的剪切模量也在公开发表的范围内,在高频(>100 Hz)激励下活化激痛点及周围肌肉组织的剪切波速度明显高于正常组织[15](图7)。
声科影像的剪切波弹性成像超声诊断仪和西门子公司的Acouson S2000均采用声辐射力弹性成像技术。声波在传播路径上被反射或吸收时会产生声辐射力,声辐射力的方向与声波传播方向相同,在焦点处产生的脉冲声辐射力会使该处的组织粒子产生振动,从而产生剪切波。二者都是通过声辐射力产生剪切波的波前传播情况,测其波速以计算组织的剪切模量。西门子公司的Acouson S2000超声系统使用单点的声辐射力激励,包含利用声辐射力进行剪切波传播速度测量的功能,称为“虚拟触诊组织量化”。其方法是首先在B模图像上选取某一感兴趣区域,然后在其附近产生声辐射力激励,测量剪切波传播到该感兴趣区域所需的时间计算剪切波速度。测量显示的是区域平均测量值。声科影像的剪切波弹性成像超声诊断仪采用多点激励,使声辐射力从点源变为线源,再用超高速超声成像技术追踪各点位移,计算组织杨氏模量。该技术已广泛应用于肝脏、甲状腺、乳腺、前列腺[16-19]等疾病的诊断。研究小组采用剪切波弹性成像技术量化腰背部MPS患者激痛点病灶区与邻近组织的弹性模量差异,分析年龄、部位等因素对激痛点硬度的影响[11]。Maher等[12]采用该技术量化干针治疗、姿势对上斜方肌激痛点弹性的影响。在干针治疗前、后分别检测坐位、俯卧位同一激痛点的剪切模量,干针治疗后硬度明显减小,与触诊的组织硬度相一致,且俯卧位时激痛点硬度低于坐位(图8)。郭玲等[13]开展了剪切波超声弹性成像技术在颈肩MPS中的应用研究,用杨氏模量作为客观指标评价中医手法治疗的疗效。
2 磁共振成像
由于磁共振成像(magnetic resonance imaging,MRI)对软组织分辨力高,有学者用MRI研究激痛点特征。Landgraf等[20]研究由激痛点引起偏头痛患者的斜方肌MRI图像变化,通过MRI使紧绷带可视化来阐述偏头痛的潜在生理病理学过程。经验丰富的临床医师对斜方肌紧绷带定位后,用硝酸甘油胶囊做标记,用3T MR扫描仪对颈部肌肉扫描,紧绷带MR信号发生改变,研究结果表明,收缩肌纤维或细胞外基质发生了改变。虽然T2加权序列的高信号主要取决于水和蛋白的比例,可能表征组织黏弹性或黏度的变化,但MRI用于检测激痛点的硬度并不直观,因此有学者通过磁共振弹性成像研究激痛点弹性。
磁共振弹性成像(magnetic resonance elastography,MRE)是另外一种能够用作评估激痛点硬度的方法,是基于MR的对比成像技术探测外部振动源引起组织振动的位移大小,通过相位对比检测组织硬度,最初用于肝纤维化的诊断。其基本原理是通过外部振动源向组织引入剪切波,当波通过组织感兴趣区域时获得相位变化图,观察组织的畸变,通过图像计算得到波长、波速,再用反演算法来重建组织的剪切模量。肌筋膜紧绷带的硬度比周围肌纤维高,剪切波传播较快,波长较长。Chen等[21-22]通过自制的声驱动气压传感器振动源产生振动,对凝胶假体紧绷带成像,建立有限元模型分析,验证该方法的正确性,并对人体斜方肌紧绷带进行预实验。将MRI线圈放置在斜方肌,在Z方向获得偏移8个相位的MRE图像(图9)。MPS患者肌肉紧绷带的硬度比周围肌肉组织高50%以上,可以通过MRE对紧绷带进行探测,并量化硬度。虽然MRE能够鉴别剪切波在紧绷带和正常组织传播模式的差异,但是不能鉴别紧绷带中激痛点。
3 红外热成像
红外测温能否准确定位激痛点还存在很大争议。齐峰等[23]研究结果表明,激痛点的体表温度明显高于对侧正常点,温度平均升高为(1.3±0.4)℃。Cojocaru等[24]用红外测温仪检测激痛点温度,结果显示,激痛点区域表现为温度较高,周围区域温度较低;但亦有研究结果表明,激痛点与非激痛点温度没有明显差异,且温度和压力阈值之间没有明显相关性[25]。红外热成像的测量深度为皮下几毫米,所测温度为皮肤表面而非皮肤下面血液循环变化情况,在热像图上发现一个热点并不足以确认下面存在一个激痛点,神经根疾病、关节功能障碍、局部皮下感染都可能出现热点。此外,Dibai-Filho等[26]提出一种斜方肌激痛点的近红外图像分析方法,在激痛点位置放置4个标记物,取得近红外图像,通过快速报告软件对激痛点区域温度进行点、线和面分析,评判者内信度和间信度均较高,认为此方法可适用于临床和科研中。
4 结语
在MPS的临床诊断中,激痛点的定位尤其重要。由于临床医师触诊评判者间信度差,寻求客观成像手段定位激痛点成为研究热点。在超声成像方面,灰阶超声图像上可看到激痛点,通过对灰阶图像进行滤波处理,增强了激痛点与周围组织的对比度,但其灵敏度还不够。研究人员还通过多普勒成像研究激痛点的血管环境,研究结果表明,部分血流动力学指标在含激痛点的组织和正常组织之间表现出明显差异性,但并非所有激痛点附近均能找到明显血管,在激痛点的临床定位中还需做进一步的检查。弹性超声可以测量激痛点的硬度,其硬度明显高于周围组织,这让研究者们看到希望,但是仍处于初级阶段,在应用于临床之前还需要对图像的获取方法和数据处理作进一步规范化;而MRE的高成本限制了在MPS诊断中的应用。
综上所述,本文对MPS的影像学研究进行了分类总结,虽然这些方法还不能够完全应用于临床诊断,但是随着成像技术和图像处理技术的不断发展,运用影像学手段诊断MPS指日可待。
利益冲突无
(图6~9见插页6-12,图5见封三)
[1]Simons DG,Travell JG,Simons LS.Myofascial pain and dysfunction: the trigger point manual[M].Philadelphia:Lippincott Williams Wilkins,1999:185-194.
[2]Malanga GA,Cruz Colon EJ.Myofascial low back pain:a review[J]. Phys Med Rehabil Clin N Am,2010,21(4):711-724.DOI:10.1016/j. pmr.2010.07.003.
[3]Sikdar S,Shah JP,Gebreab T,et al.Novel applications of ultrasound technology to visualize and characterize myofascial trigger points and surrounding soft tissue[J].Arch Phys Med Rehabil,2009,90(11): 1829-1838.DOI:10.1016/j.apmr.2009.04.015.
[4]Barbero M,Bertoli P,Cescon C,et al.Intra-rater reliability of an experienced physiotherapist in locating myofascial trigger points in upper trapezius muscle[J].J Man Manip Ther,2012,20(20):171-177.DOI:10.1179/2042618612Y.0000000010.
[5]Turo D,Otto P,Shah JP,et al.Ultrasonic characterization of the upper trapezius muscle in patients with chronic neck pain[J]. Ultrason Imaging,2013,35(2):173-187.DOI:10.1177/0161734612 472408.
[6]Perez-Palomares S,Oliván-Blázquez B,Arnal-Burró AM,et al. Contributions of myofascial pain in diagnosis and treatment of shoulder pain.A randomized control trial[J].BMC Musculoskelet Disord,2009,10(1):1-7.DOI:10.1186/1471-2474-10-92.
[7]Stecco A,Meneghini A,Stern R,et al.Ultrasonography in myofascial neck pain:randomized clinical trial for diagnosis and follow-up[J]. Surg Radiol Anat,2014,36(3):243-253.DOI:10.1007/s00276-013-1185-2.
[8]Mahyar S,Behnam A,Ismail ET,et al.Sonographic effects of trigger points and fascia dry needling in subjects with myofascial pain syndrome of the upper trapezius muscle[J].Fascia Res IV,2015: 139-140.
[9]Sikdar S,Ortiz R,Gebreab T,et al.Understanding the vascular environment of myofascial trigger points using ultrasonic imaging and computational modeling[J].Conf Proc IEEE Eng Med Biol Soc, 2010:5302-5305.
[10]黄燕平,郑永平.基于超声的组织弹性测量之剪切波传播法[J].中国医疗设备,2011,26(10):1-12.DOI:10.3969/j.issn.1674-1633. 2011.10.001.
Huang YP,Zheng YP.Soft tissue elasticity by ultrasound-based measurement of shear wave propagation[J].China Med Devices, 2011,26(10):1-12.DOI:10.3969/j.issn.1674-1633.2011.10.001.
[11]李真,吕恒勇,任泽阳,等.腰背部肌筋膜疼痛综合征激痛点的剪切波弹性模量研究[J].国际生物医学工程杂志,2016,39(4):207-211,后插4-9.DOI:10.3760/cma.j.issn.1673-4181.2016.04.004.
Li Z,Lyu HY,Ren ZY,et al.Study on the elastic modulus of shear wave for myofascial trigger points of lumber and back myofascial pain syndrome[J].Int J Biomed Eng,2016,39(4):207-211,Ins 4-9. DOI:10.3760/cma.j.issn.1673-4181.2016.04.004.
[12]Maher RM,Hayes DM,Shinohara M.Quantification of dry needling and posture effects on myofascial trigger points using ultrasound shear-wave elastography[J].Arch Phys Med Rehabil,2013,94(11): 2146-2150.DOI:10.1016/j.apmr.2013.04.021.
[13]郭玲,张晨,张丁丁,等.剪切波超声弹性成像技术在颈肩肌筋膜疼痛综合征中的应用[J].中国骨伤,2016,29(2):142-145.DOI: 10.3969/j.issn.1003-0034.2016.02.011.
Guo L,Zhang C,Zhang DD,et al.Application of shear waveelastography in the evaluation of neck-shoulder myofascial pain syndrome[J].Chin J Orthopa Trauma,2016,29(2):142-145.DOI: 10.3969/j.issn.1003-0034.2016.02.011.
[14]Ballyns JJ,Shah JP,Hammond J,et al.Objective sonographic measures for characterizing myofascial trigger points associated with cervical pain[J].J Ultrasound Med,2011,30(10):1331-1340.
[15]Ballyns JJ,Turo D,Otto P,et al.Office-based elastographic technique for quantifying mechanical properties of skeletal muscle [J].J Ultrasound Med,2012,31(8):1209-1219.
[16]Tutar O,Beser OF,Adaletli I,et al.Shear wave elastography in the evaluation of liver fibrosis in children[J].J Pediatr Gastroenterol Nutr, 2014,58(6):750-755.DOI:10.1097/MPG.0000000000000329.
[17]Szczepanek-ParulskaE,WolińskiK,StangierskiA,etal. Comparison of diagnostic value of conventional ultrasonography and shear wave elastography in the prediction of thyroid lesions malignancy[J].PLoS One,2013,8(11):e81532-e81535.DOI: 10.1371/journal.pone.0081532.
[18]冯卉,李俊来,黄炎,等.乳腺小结节实时剪切波弹性模量的定量研究[J].中国超声医学杂志,2013,29(9):782-786.DOI:10.3969/j. issn.1002-0101.2013.09.005.
Feng H,Li JL,Huang Y,et al.Quantitative study on the elastic modulus of real-time shear wave for small mammary nodules[J].Chin J Ultrasound Med,2013,29(9):782-786.DOI:10.3969/j.issn.1002-0101.2013.09.005.
[19]周昀,唐杰,张明博,等.尿道周围前列腺组织弹性模量与良性前列腺增生患者IPSS的相关性研究[J].中国医学影像学杂志, 2012,20(7):540-544.DOI:10.3969/j.issn.1005-5185.2012.07.018.
Zhou Y,Tang J,Zhang MB,et al.Correlation between elastic modulus of periurethral prostatic tissue and IPSS in patients with benign prostatic hyperplasia[J].Chin J Med Imaging,2012,20(7): 540-544.DOI:10.3969/j.issn.1005-5185.2012.07.018.
[20]Landgraf MN,Ertl-Wagner B,Koerte IK,et al.Alterations in the trapezius muscle in young patients with migraine-A pilot case series with MRI[J].Eur J Paediatr Neurol,2015,19(3):372-376.DOI: 10.1016/j.ejpn.2014.12.021.
[21]Chen QS,Bensamoun S,Basford JR,et al.Identification and quantification of myofascial taut bands with magnetic resonance elastography[J].Arch Phys Med Rehabil,2007,88(12):1658-1661. DOI:10.1016/j.apmr.2007.07.020.
[22]Chen QS,Basford J,An KN.Ability of magnetic resonance elastography to assess taut bands[J].Clin Biomech,2008,23(5): 623-629.DOI:10.1016/j.clinbiomech.2007.12.002.
[23]齐峰,韩梅,孟祥水,等.筋膜疼痛综合征扳机点的影像学研究[J].中国麻醉与镇痛,2007,9(1):47-50.
Qi F,Han M,Meng XS,et al.Identification oftrigger points(TrPs)on myofascial pain syndrome patients with infrared thermography and 3.0 T MRI[J].China Anesth Analg,2007,9(1):47-50.
[24]Cojocaru MC,Cojocaru IM,Voiculescu VM,et al.Trigger points--ultrasound and thermal findings[J].J Med Life,2015,8(3):315-318.
[25]吴惠敏.红外线皮温测定不能用于检测肌筋膜压痛点[J].神经损伤与功能重建,2004,24(2):95.
Wu HM.Infrared skin temperature measurement can not be used to detect myofascial trigger points[J].Neural Injury and Functional Reconstruction,2004,24(2):95.
[26]Dibai-Filho AV,Guirro EC,Ferreira VT,et al.Reliability of different methodologies of infrared image analysis of myofascial trigger points in the upper trapezius muscle[J].Braz J Phys Ther, 2015,19(2):122-128.DOI:10.1590/bjpt-rbf.2014.0076.
Research progress on imageology of myofascial pain syndrome
Li Zhen,Tan Xiuxiang,Wu Jinpeng,Li Yingxin
Institute of Biomedical Engineering,Chinese Academy of Medical Sciences&Peking Union Medical College,Tianjin 300192,China
Myofascial pain syndrome(MPS)is a common skeletal muscle pain and dysfunction,characterized by the presence of myofascial pain points(MTrPs).At present,the main method of locating MTrPs is palpation which has lower intra-rater reliability,and lacks an objective evaluation approach for therapeutic effects.Therefore,the research on objective evaluation of the characteristics of MPS has been receiving great attention.These studies involve stiffness of trigger points,fascia thickness,surface temperature and other aspects through various methods, such as ultrasonic imaging,magnetic resonance imaging,infrared thermal imaging.In this paper,the research progress and methods of MPS in imaging were surveyed,which can provide the basis for the clinical diagnosis and objective evaluation of therapeutic effects.
Myofascial pain syndrome;Ultrasound imaging;Magnetic resonance imaging;Infrared thermal imaging;Elastic madulus
Li Yingxin,Email:yingxinli2005@126.com
2016-07-28)
李迎新,Email:yingxinli2005@126.com
10.3760/cma.j.issn.1673-4181.2016.06.013

