碳纳米管在药物递送载体及肿瘤热疗应用方面的研究进展
碳纳米管在药物递送载体及肿瘤热疗应用方面的研究进展
孙志婷董霞冷希岗
300192天津,中国医学科学院北京协和医学院生物医学工程研究所
目前,大多数抗癌药物在临床应用中存在着溶解性差、靶向性低、对正常组织器官毒性大等局限性,而药物载体的应用可在一定程度上缓解这些现象。近年来,一些材料如聚合物、脂质类、碳纳米管(CNTs)等被用作抗癌药物的载体,并通过对载体进行靶向修饰,使其在体内缓慢释放以维持一定的血药浓度,从而提高药物的靶向性,减少不良反应。其中,CNTs作为一种新兴的纳米材料,在纳米医学中的应用备受关注。CNTs具有纳米级管径,中空结构和较大的长径比使其具有较大的药物容量,且CNTs可选择性吸收近红外光并转化为热能,因此采用功能化的CNTs携载药物并结合热疗对肿瘤进行靶向治疗有望成为一种新的治疗手段。就CNTs的基本结构、作为药物载体的应用及其结合热疗在肿瘤治疗方面的研究现状作一综述。
碳纳米管;药物载体;化学药物治疗;热疗
Fund program:National Natural Science Foundation of China(81271693,81601595);National Natural Science Foundation of Tianjing(16JCYBJC27800)
0 引言
近年来全球每年新发癌症患者达一千多万,作为最致命的疾病之一,现有的癌症治疗手段主要有手术治疗、放射治疗(放疗)和化学药物治疗(化疗),但这些方法仅对一部分癌症患者有效,且容易杀死正常细胞,造成不良反应。许多癌症患者并非死于癌症本身,而是癌症从原发部位转移至其他部位造成死亡,故癌症治疗的目的之一就是尽可能早地阻止癌症转移。目前,各种化疗方法的主要缺陷是化疗药物对癌细胞的靶向性不强,既对正常细胞、组织和器官产生不良反应,也限制了药物在治疗中的使用剂量;此外在对晚期肿瘤的化疗中,耐药性也是一个令人担忧的问题。肿瘤纳米技术是一个新兴的领域,是指用纳米载体(如脂质体、聚合物纳米粒子、树枝状大分子、量子点、碳纳米管(carbon nanotubes,CNTs)等)将药物靶向递送至癌症部位,该法可克服传统方法的一些弊端。
CNTs作为一种新兴的纳米材料,在纳米医学中的应用备受关注。CNTs是由碳原子层卷曲而成的无缝、中空的管体,可看作是由石墨烯片层卷曲而成。按石墨烯片的层数,CNTs可分为单壁碳纳米管(single-walled carbon nanotubes,SWCNTs)和多壁碳纳米管(multi-walled carbon nanotubes,MWCNTs)。SWCNTs由单层碳原子构成,而MWCNTs由多个同心碳原子层组成。SWCNTs典型直径在0.6~2 nm,MWCNTs最内层直径小至0.4 nm,最外层直径可达数百纳米,典型管径为2~100 nm。自Iijima发现CNTs以来,CNTs已成为研究热点,并在生物医药领域进行了探索性地应用[1]。
CNTs是一种新型的纳米医学材料,具有独特的物理化学性质和纳米级管径,中空结构及较大的长径比使其具有较大的药物容量,在药物递送和癌症治疗方面有着巨大的潜力,受到纳米医学研究领域专家的青睐。另外,CNTs的独特结构性质使其可选择性吸收近红外光(808 nm),并转化为热量对肿瘤细胞进行破坏而不损伤正常细胞,因此,可利用CNTs作为药物载体结合热疗对肿瘤进行联合治疗。本文综述了CNTs的基本结构、作为药物载体的应用及其结合热疗在肿瘤治疗方面的研究现状。
1 CNTs的基本结构及性质
CNTs又名巴基管,是一种具有特殊结构(径向尺寸为纳米量级,轴向尺寸为微米量级,管两端均基本封口)的一维量子材料,具有质量轻、六边形结构连接完美(图1)、表面积大、纳米尺寸级直径、刚性表面及电磁波吸收等特性。近年随着CNTs及纳米材料研究的深入,其广阔的应用前景也不断地展现出来。根据不同目的,可用不同生物或化学分子对CNTs进行修饰,使其具有靶向性。
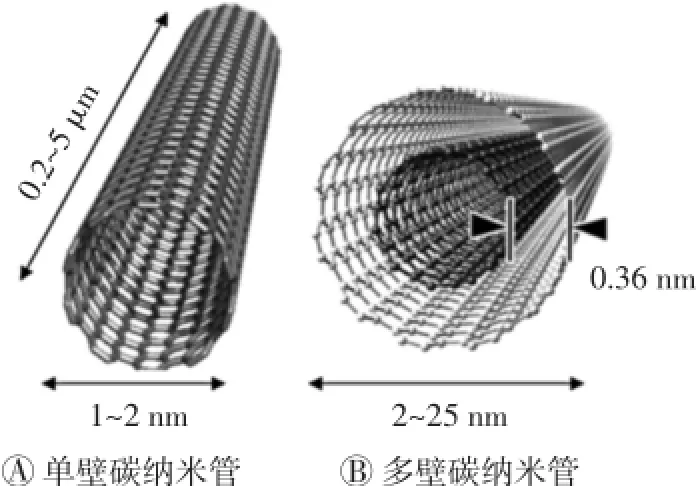
图1 单壁与多壁碳纳米管结构示意图
MWCNTs在开始形成时,层与层间极易成为陷阱中心而捕获各种缺陷,故其管壁上通常布满小洞样的缺陷。与MWCNTs相比,SWCNTs直径的分布范围小、缺陷少,具有更高的均匀一致性。在实际应用中,应根据不同的需要选择合适的CNTs,如在药物递送方面,SWCNTs优于MWCNTs,主要是由于SWCNTs的一维结构及巨大的表面积使其在药物负载效率上优于MWCNTs;而在肿瘤热疗方面,MWCNTs优于SWCNTs,主要是由于MWCNTs对近红外光的吸收性更好,且其吸收近红外光后可产生共振的能量,引起组织发热,从而损伤癌细胞。因此,需综合考虑后做出最适选择。
2 CNTs的功能化
尽管CNTs的自身特性具有众多优势,但其在生物方面的应用仍存在很大局限性。CNTs属于非生物降解材料,不溶于水,制备过程中常会附带金属杂质等,这些因素导致CNTs会具有一定的生物毒性。为了尽可能地减小材料毒性并增强其生物相容性,研究人员利用各种生物分子对CNTs进行修饰[2-3],该过程称之为CNTs的功能化。CNTs的功能化目前已逐步发展成为制备具有某些特定功能的CNTs及其复合材料的手段,CNTs功能化修饰的方式主要有两种:共价修饰和非共价修饰[4]。
非共价修饰主要是通过范德华力、π-π吸附或疏水作用等使生物活性分子吸附于CNTs表面[5],其最大优势是对CNTs表面造成的损伤很小,可保持表面原子结构和电特性,缺陷在于非共价结合能力弱于共价结合;而共价修饰则是通过改变碳原子的sp2构型或破坏管外的电子共轭体系,实现修饰基团与CNTs之间的共价键合,从而创建一个平台,通过该平台来共价黏附其他生物活性分子[6]。强酸氧化是最常用的共价功能化的方法,该法可在CNTs表面或两端形成—COOH功能团,用于黏附其他分子,并能提高CNTs的生物相容性。虽然通过共价修饰法可获得稳定的功能化CNTs,但在反应过程中,CNTs易受到损伤,从而会导致其本身一些特性的改变。CNTs修饰的位置一般位于表面和端部,且表面比端部更稳定,因此CNTs的端部更易结合功能基团[5,7]。
3 CNTs作为载体的抗肿瘤研究
化疗是目前治疗肿瘤及某些自身免疫性疾病的主要手段之一,但在治疗过程中,化疗药物在杀伤肿瘤细胞的同时,也将正常细胞和免疫细胞一同杀灭,甚至导致胃肠功能紊乱及骨髓抑制等多种不良反应,大大降低了患者的生存质量。因此,在癌症的临床治疗中,急需一种载体或技术实现药物的靶向递送。
CNTs在纳米级药物递送中展现出很好的应用前景[8-9],主要是因为CNTs的形状使其可通过多种途径进入细胞内,如被动扩散穿过脂质双层或黏附于细胞表面通过内吞作用进入细胞,从而传递药物至癌细胞。过去主要是将CNTs进行修饰,再负载药物实现靶向递送。CNTs负载药物的方式主要有共价或非共价吸附的方式黏附于CNTs的外表面及填充于CNTs的中空管体。研究涉及到的药物有紫杉醇(paclitaxel,PTX)、阿霉素(doxorubicin,DOX)、10-羟基喜树碱(10-hydroxycamptothecin,HCPT)、甲胺喋呤(methotrexate,MTX)及铂类抗癌药等。
基于CNTs的理化性质,通过对其进行功能化修饰可使其具有良好的生物相容性、低细胞毒性及较好的靶向性,从而具有较长的血液循环时间;同时有研究结果证明,功能化的CNTs可通过代谢完全清除,CNTs有望作为一种理想的抗癌药物纳米载体[10]。近年来,研究者们进行了大量的有关CNTs作为载体治疗肿瘤的体内外实验研究。
3.1 共价黏附药物于CNTs
Bhirde等[11]将SWCNTs置于酸中氧化,使其末端和侧壁形成羧基功能基团,并利用氧化的SWCNTs与抗癌药物顺铂和表皮生长因子(epidermal growth factor,EGF)形成复合物,再以量子点(quantum dot,Qdot)标记制得SWCNTs-Qdot-EGF。体外实验结果表明,头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)细胞对SWCNTs-Qdot-EGF具有很高的摄入率,而对照组SWCNTs-Qdot的摄入量非常有限,且用小干扰RNA(siRNA)阻断EGF受体后,摄入即被阻止;体内实验结果显示,SWCNTs-Qdot-EGF注射入小鼠体内后,可选择性地被HNSCC细胞摄入,而对照组SWCNTs-Qdot在20 min内即在肿瘤组织中被清除,且体内注射SWCNTs-顺铂-EGF的动物,其肿瘤生长被显著抑制。该研究结果表明,利用EGF与EGF受体的相互作用,SWCNTs负载药物可选择性地进入和杀伤肿瘤细胞。Liu等[12]将PTX以共价结合的方式黏附于SWCNTs表面从而将药物传递至癌细胞。制备过程为先将PTX与琥珀酐反应,在PTX表面形成羧基,然后将SWCNTs表面通过非共价的方式修饰聚乙二醇(polyethylene glycol,PEG)-NH2,再以1-(3-二甲氨基丙基)-3-乙基碳二亚胺和N-羟基琥珀酰亚胺作为交联剂,与表面羧基包裹的PTX反应。体外实验结果证实,由于延长了血液循环时间,增强了药物渗透性,肿瘤细胞对PTX的摄入量提高了10倍以上,相对单纯PTX治疗,SWCNTs-PTX显著抑制了肿瘤细胞的生长。
Wu等[13]先将MWCNTs的表面通过氧化形成羧基功能团,再与HCPT以酯键共价结合,从而获得MWCNTs与药物形成的复合物(MWCNTs-HCPT)。体内外实验结果证实,该复合物表现出卓越的抗肿瘤活性和低毒性;同时具有长血液循环时间和在肿瘤部位的高度药物聚集性,这些特性均显著增强了细胞摄入能力。
3.2 非共价吸附药物于CNTs
研究人员先将MWCNTs分散于质量浓度为0.01 g/ml的普朗尼克(Pluronic)F127溶液中,形成终质量浓度为1 mg/ml的溶液,然后将不同质量浓度的Pluronic-MWCNTs溶液(10、20、40 μg/ml)分别与DOX(20 μg/ml)反应,结果显示,随着CNTs质量浓度的提高,DOX的质量浓度不断下降,说明DOX以物理吸附的方式不断结合于CNTs表面,且相对于单独DOX和DOX-Pluronic,MWCNTs-DOX复合物对癌细胞的毒性明显增强[14]。另外,也有以SWCNTs作为药物载体,通过非共价作用吸附DOX用于肿瘤治疗的体内外实验研究[15],研究者先用PEG修饰SWCNTs,然后DOX通过π-π作用有效地吸附于修饰的SWCNTs上,形成SWCNTs-DOX复合物。采用原子力显微镜观察发现,复合物的平均长度约为100nm,直径为2~3 nm。体内实验结果表明,PEG修饰有效地延长了血液循环时间,DOX在血液中的循环半衰期由0.21 h提高至2.22 h,肿瘤组织对DOX的摄入量由0.68%ID/g提高至1.51%ID/g,这是由于血液循环时间的延长增强了高通透性和滞留效应。总体来说,SWCNTs-DOX复合物较单独DOX在体外实验中对癌细胞表现出更大的毒性。分析其原因为SWCNTs-DOX复合物的尺寸较单独DOX更大一些,后者极易被肾小球滤出,从而很快被清除于体内;同时SWCNTs表面包裹着PEG,可减缓SWCNTs-DOX被巨噬细胞清除的速度,从而延长其血液循环时间[8,16]。
3.3 药物填充于CNTs
通过共价方法将药物黏附于CNTs表面意味着需要一个连接平台,通过这个平台药物和CNTs可形成共价绑定。虽然共价吸附方式结合药物比较可行,但研究结果发现,共价修饰可能会导致抗癌药物分子发生化学改变,进而可能导致其抗癌作用发生变化。同时,非共价吸附也存在一定的问题,如非共价吸附效率一般不高,可能未达到靶部位药物就已释放。
由于共价或非共价结合药物于CNTs均存在一定的缺陷,研究者开始采取新的策略,即将适合的抗癌药物通过毛细管效应填充于CNTs内部并递送至细胞[17],但只有末端开放且无任何损伤的原始CNTs才可利用毛细管力实现填充,有缺损或侧壁修饰有功能基团(酯类或羧基基团)的CNTs则会阻碍填充过程并降低药物的包封率。2008年,有研究者利用毛细管效应,采用湿化学法将抗癌药物卡铂填充于CNTs内部,细胞实验结果显示,随着CNTs-卡铂质量浓度的提高,对细胞活性具有显著的抑制作用,细胞数下降,细胞凋亡率增加,细胞周期被阻滞在G2/M期,CNTs与卡铂形成的复合物显著提高了卡铂的细胞毒性作用。由于CNTs开放的末端使包载的药物暴露于外部环境,这有可能造成在到达靶部位之前,药物不受控制地释放。Li等[18]构建了一个“碳纳米管瓶”,即在末端以功能化的金纳米粒子建造了一个“帽子”,较原先文献报道的数据,“帽子”不仅不会阻止药物的装载,反而获得了更高的载药量,且在生理条件下,该法包载抗癌药物顺铂可递送至癌细胞并发挥药理作用。
3.4 药物释放
除了有一个好的靶向性,CNTs作为药物载体的一个很重要方面就是可将药物控制释放至肿瘤细胞。虽然已有关于不同的药物模型从CNTs释放进入靶细胞的文献报道,但关于药物从CNTs释放的速度和量的报道则较少。有报道显示,当环境pH值偏酸时,从CNTs-DOX复合物上释放出的DOX会更多,如pH值为5.5时,1 d内DOX的释放率约为40%;由于肿瘤组织细胞外的微环境及细胞内的溶酶体和核小体均为偏酸性,故DOX类药物在这样的环境中更易获得释放。Zhang等[19]利用SWCNTs建立了一个pH响应性靶向药物传递系统,SWCNTs以羧基及多聚糖材料进行修饰并负载抗癌药物DOX,研究结果显示,在生理pH值(pH7.4)时,药物绑定于SWCNTs上;当pH值下降时,药物从载体上释放出来,并可通过控制SWCNTs的表面电位来控制药物的负载率和释放速度,而表面电位的变化则可通过多聚糖材料的修饰来实现。
除了酸碱度影响外,温度的升高也可影响药物从CNTs上的释放速度。Chen等[20]制备了一种基于CNTs的刺激响应性药物控释系统。他们将CNTs末端修饰—COOH,通过巯基修饰的二氧化硅在CNTs两端加个“帽子”,然后再通过二硫苏糖醇或温度的刺激来移除二氧化硅纳米球,从而实现填充于CNTs内部药物的释放,可通过调节二硫苏糖醇的浓度和温度来控制药物的释放速度。
另外,通过近红外激光照射也可实现刺激响应性药物的控制释放。Li等[21]以叶酸和铁离子联合修饰MWCNTs,制备了双修饰的叶酸-MWCNTs@Fe,并在磁场作用下将抗癌药物DOX递送至HeLa细胞;由于MWCNTs对近红外光具有很好的吸收特性,故可通过近红外光照射很好地实现药物的控制释放。
4 CNTs在肿瘤热疗中的应用
作为纳米医学领域中的一种新兴载体,CNTs的表面结构决定了其具有独特的热学性质,可选择性地吸收近红外光并产热[22]。利用该性质可对肿瘤进行热疗称为纳米光热疗法[23]。
CNTs具有独特的物理化学性质,在药物递送和癌症治疗方面具有较大的潜力。生物功能化修饰的CNTs可靶向至肿瘤部位,并吸收近红外光转化为热量,其机制已被广泛研究:功能化的CNTs可选择性地进入细胞并发生聚集,近红外光照射CNTs时,光电子热量转移至CNTs的石墨烯结构中,产生热量并快速扩散进入CNTs存在的多种细胞成分中,进而造成细胞死亡[24]。CNTs的这种固有性质为肿瘤治疗提供了新思路。
有文献报道,将偶联至SWCNTs的DNA体系导入HeLa细胞中,用1.4 W/cm2的近红外激光照射2 min后,可观察到细胞形态和细胞黏附性均发生改变,细胞器碎片聚集,进而造成细胞大量死亡。拉曼光谱和扫描电镜结果显示,黑色聚集物中存在SWCNTs,进一步证实了局部加热是造成细胞死亡的主要原因。相比之下,将不含SWCNTs的细胞用808 nm的激光在3.5 W/cm2的功率下照射5 min,则并未造成细胞死亡[23]。由此可见,基于CNTs的热疗可对肿瘤起到明显的杀伤作用。Biris等[25]将HeLa细胞与CNTs共孵育48 h,然后用1 064 nm的近红外光照射HeLa细胞发现,随着温度急剧上升,对肿瘤的杀伤作用亦增强;而对照组(不含CNTs的HeLa细胞)的温度则无明显变化(温度变化<1.5℃)。
Zhou等[26]在对前列腺癌的治疗研究中,将含MWCNTs和不含MWCNTs的前列腺癌细胞PC3分别用1 064 nm、15.3 W/cm2的近红外光照射1.5 min和5 min,然后通过细胞毒性检测和热激蛋白的表达来判断MWCNTs的存在与否对热疗效果的影响。结果显示,MWCNTs存在的实验组在激光照射后细胞活力急剧下降,且细胞与MWCNTs共孵育的时间越长,透射电镜下观察到的细胞空泡和细胞核中的MWCNTs数量越多。在运用热疗对脑癌的治疗研究中,先用质量浓度为2.5~10 μg/ml的CNTs处理胶质瘤细胞U251,然后用808 nm、2 W/cm2的近红外光对其照射不同的时间(30~300 s),结果表明,CNTs对U251细胞的细胞毒性呈浓度和时间依赖性[27]。在运用热疗对乳腺癌的治疗研究中,用不同质量浓度的SWCNTs对乳腺癌细胞BT474进行处理,然后用800 nm、200 mW/cm2的激光照射,60 s内即可杀灭所有细胞,且在死细胞周围出现“泡沫”。这种现象主要是由于SWCNTs“爆炸”形成,SWCNTs在局部加热的情况下会形成巨大压力,然后形成“纳米炸药”,当改变近红外光强度时,这种现象依然存在。
在运用热疗对肾癌的治疗研究中,采用低功率(3 W/cm2)、短时间(30 s)的激光对含有MWCNTs的肿瘤细胞进行照射,可引起明显的肿瘤消融作用。小鼠实验结果表明,肿瘤后期的复杂程度与MWCNTs的剂量直接相关,当MWCNTs的剂量为100 μg时,采用上述功率进行治疗,80%的小鼠肿瘤在12周后完全消失,且不再复发;而空白对照组和单独使用MWCNTs实验组的小鼠则均未出现肿瘤消失的现象[28]。还有文献报道,在MWCNTs存在的情况下,用近红外光照射可使肿瘤局部温度达76℃;而当MWCNTs不存在时,近红外光照射的肿瘤局部温度不超过40℃[10,29-30],MWCNTs在热疗中所起的作用不言而喻。
从临床角度来看,对肿瘤患者通过外科手术并结合CNTs运用热疗进行肿瘤治疗是安全的,临床上通过腹腔镜对肿瘤部位的血管供应进行研究,然后采用激光进行局部照射有望杀灭肿瘤细胞。随着科技的发展,未来可研制出迷你激光治疗仪,通过腹腔镜套管将激光仪导入体内对肿瘤实施治疗。这种微创疗法可降低患者的疼痛感,缩短住院时间,并减少并发症的出现。
5 展望
本文主要对以CNTs为药物载体并结合热疗的新型肿瘤疗法作一综述。CNTs的结构特性使得在同一载体上可同时实现多种功能,如靶向分子、药物、受体等可同时修饰于其上,使其成为理想的多功能平台;CNTs还可作为一种肿瘤热疗试剂,有望成为一种理想的载体实现肿瘤化疗与热疗的联合应用。然而,虽然以CNTs为基础的纳米医学研究非常诱人,并已有一些关于其使用剂量、表面化学修饰及尺寸等的研究,但在其正式用于临床治疗前,仍缺乏详细的相关药理学和毒理学特性研究及一个规范的风险/受益评价,这是研究者们面临的一个新挑战。随着科学技术的发展和知识的不断完善,运用功能化的CNTs对肿瘤进行热疗与化疗的联合治疗将指日可待。
利益冲突无
[1]Dai HJ.Carbon nanotubes:synthesis,integration,and properties[J]. Acc Chem Res,2002,35(12):1035-1044.DOI:10.1021/ar0101640.
[2]Klumpp C,Kostarelos K,Prato M,et al.Functionalized carbon nanotubes as emerging nanovectors for the delivery of therapeutics [J].Biochim Biophys Acta,2006,1758(3):404-412.DOI:10.1016/j. bbamem.2005.10.008.
[3]Vardharajula S,Ali SZ,Tiwari PM,et al.Functionalized carbon nanotubes:biomedical applications[J].Int J Nanomed,2012,7(3): 5361-5374.DOI:10.2147/IJN.S35832.
[4]Lay CL,Liu J,Liu Y.Functionalized carbon nanotubes for anticancer drug delivery[J].Expert Rev Med Devic,2011,8(5):561-566.DOI:10.1586/ERD.11.34.
[5]Hwang JY,Shin US,Jang WC,et al.Biofunctionalized carbon nanotubes in neural regeneration:a mini-review[J].Nanoscale,2013, 5(2):487-497.DOI:10.1039/c2nr31581e.
[6]Zhang Y,Bai YH,Yan B.Functionalized carbon nanotubes for potential medicinal applications[J].Drug Discov Today,2010, 15(11/12):428-435.DOI:10.1016/j.drudis.2010.04.005.
[7]Jain KK.Advances in use of functionalized carbon nanotubes for drug design and discovery[J].Expert Opin Drug Discov,2012,7(11): 1029-1037.DOI:10.1517/17460441.2012.722078.
[8]Meng LJ,Zhang XK,Lu QH,et al.Single walled carbon nanotubes as drug delivery vehicles:targeting doxorubicin to tumors[J]. Biomaterials,2012,33(6):1689-1698.DOI:10.1016/j.biomaterials. 2011.11.004.
[9]Bianco A.Carbon nanotubes for the delivery of therapeutic molecules[J].Expert Opin Drug Deliv,2004,1(1):57-65.DOI: 10.1517/17425247.1.1.57.
[10]Hampel S,Kunze D,Haase D,et al.Carbon nanotubes filled with a chemotherapeutic agent:a nanocarrier mediates inhibition of tumor cell growth[J].Nanomedicine(Lond),2008,3(2):175-182.DOI: 10.2217/17435889.3.2.175.
[11]Bhirde AA,Liu G,Jin A,et al.Combining portable raman probes with nanotubes for theranostic applications[J].Theranostics,2011, 1(9):310-321.DOI:10.7150/thno/v01p0310.
[12]Liu Z,Fan AC,Rakhra K,et al.Supramolecular stacking of doxorubicin on carbon nanotubes for in vivo cancer therapy[J]. Angew Chem Int Ed Engl,2009,48(41):7668-7672.DOI:10.1002/ anie.200902612.
[13]Wu PP,Li S,Zhang HJ.Design real-time reversal of tumor multidrug resistance cleverly with shortened carbon nanotubes[J].Drug Des Devel Ther,2014,8:2431-2438.DOI:10.2147/DDDT.S74962.
[14]Ali-Boucetta H,Al-Jamal KT,McCarthy DA,et al.Multiwalled carbon nanotube-doxorubicin supramolecular complexes for cancer therapeutics[J].Chem Commun(Camb),2008(4):459-461.DOI: 10.1039/b712350g.
[15]Hu SS,Wang T,Pei XB,et al.Synergistic enhancement of antitumor efficacy by PEGylated multi-walled carbon nanotubes modified with cell-penetrating peptide TAT[J].Nanoscale Res Lett,2016,11(1): 452.DOI:10.1186/s11671-016-1672-6.
[16]Wong BS,Yoong SL,Jagusiak A,et al.Carbon nanotubes for delivery of small molecule drugs[J].Adv Drug Deliv Rev,2013, 65(15):1964-2015.DOI:10.1016/j.addr.2013.08.005.
[17]Karimi M,Solati N,Ghasemi A,et al.Carbon nanotubes part II:a remarkable carrier for drug and gene delivery[J].Expert Opin Drug Deliv,2015,12(7):1089-1105.DOI:10.1517/17425247.2015. 1004309.
[18]Li J,Yap SQ,Yoong SL,et al.Carbon nanotube bottles for incorporation,release and enhanced cytotoxic effect of cisplatin[J]. Carbon,2012,50(4):1625-1634.DOI:10.1016/j.carbon.2011.11.043. [19]Zhang XK,Meng LJ,Lu QH,et al.Targeted delivery and controlled release of doxorubicin to cancer cells using modified single wall carbon nanotubes[J].Biomaterials,2009,30(30):6041-6047.DOI: 10.1016/j.biomaterials.2009.07.025.
[20]Chen XC,Chen HM,Tripisciano C,et al.Carbon-nanotube-based stimuli-responsive controlled-release system[J].Chemistry Eur J, 2011,17(16):4454-4459.DOI:10.1002/chem.201003355.
[21]Li BB,Wu RA,Zhao L,et al.Folate and iron difunctionalized multiwall carbon nanotubes as dual-targeted drug nanocarrier to cancer cells[J].Carbon,2011,49(5):1797-1805.DOI:10.1016/j. carbon.2011.01.003.
[22]Shanmugam V,Selvakumar S,Yeh CS.Near-infraredlightresponsive nanomaterials in cancer therapeutics[J].Chem Soc Rev, 2014,43(17):6254-6287.DOI:10.1039/c4cs00011k.
[23]Qin YP,Chen J,Bi Y,et al.Near-infrared light remote-controlled intracellular anti-cancer drug delivery using thermo/pH sensitive nanovehicle[J].Acta Biomater,2015,17:201-209.DOI:10.1016/ j.actbio.2015.01.026.
[24]Kim H,Chung K,Lee S,et al.Near-infrared light-responsive nanomaterials for cancer theranostics[J].Wiley Interdiscip Rev Nanomed Nanobiotechnol,2016,8(1):23-45.DOI:10.1002/wnan. 1347.
[25]Biris AS,Boldor D,Palmer J,et al.Nanophotothermolysis of multiple scattered cancer cells with carbon nanotubes guided by time-resolved infrared thermal imaging[J].J Biomed Opt,2009, 14(2):21007.DOI:10.1117/1.3119135.
[26]Zhou FF,Xing D,Ou ZM,et al.Cancer photothermal therapy in the near-infrared region by using single-walled carbon nanotubes[J].J Biomed Opt,2009,14(2):21009.DOI:10.1117/1.3078803.
[27]Santos T,Fang X,Chen MT,et al.Sequential administration of carbon nanotubes and near-infrared radiation for the treatment of gliomas[J].Front Oncol,2014,4:180.DOI:10.3389/fonc.2014. 00180.
[28]Torti SV,Byrne F,Whelan O,et al.Thermal ablation therapeutics based on CNxmulti-walled nanotubes[J].Int J Nanomed,2007,2(4): 707-714.
[29]Gobin AM,Lee MH,Halas NJ,et al.Near-infrared resonant nanoshells for combined optical imaging and photothermal cancer therapy[J].Nano Lett,2007,7(7):1929-1934.DOI:10.1021/ nl070610y.
[30]Kam NW,O'Connell M,Wisdom JA,et al.Carbon nanotubes as multifunctional biological transporters and near-infrared agents for selective cancer cell destruction[J].Proc Natl Acad Sci U S A,2005, 102(33):11600-11605.DOI:10.1073/pnas.0502680102.
Progress in the development of carbon nanotubes as drug delivery carrier combined with thermotherapy in cancer therapy
Sun Zhiting,Dong Xia,Leng Xigang
Institute of Biomedical Engineering,Chinese Academy of Medical Sciences&Peking Union Medical College,Tianjin 300192,China
Most of the anticancer drugs have some limitations in clinical application,such as poor solubility, low targeting and cytotoxicity to normal tissue and organ.The application of drug carriers offers a solution of these problems to a certain extent.In recent years,some materials such as polymers,liposomes,carbon nanotubes(CNTs) were used as carriers of anticancer drugs.The utilization of these carriers improved drug targeting and reduced adverse reactions by targeted modification of carriers which ensured the slow release of the drugs and maintained the plasma concentration.In these carriers,CNTs,as a novel nano-material,have attracted more attention in nanomedical applications.CNTs not only possess nanoscaled diameter,hollow structure and large aspect ratio,resulting in large drug capacity,but also can selectively absorb near infrared lights and transform them into thermal energy, according to the research finding.The functionalized drug-loaded CNTs in combination with thermotherapy shows potential,which is expected to become a new targeting therapy of cancer.In this paper,the basic structure of CNTs, the application of CNTs as drug carriers,and the recent development of functionalized CNTs as drug carriers combined with thermotherapy in tumor therapy were summarized.
Carbon nanotubes;Drug carrier;Chemotherapy;Thermotherapy
Leng Xigang,Email:lengxgyky@163.com
国家自然科学基金面上项目(81271693,81601595);天津市自然科学基金(16JCYBJC27800)
2016-08-17)
冷希岗,Email:lengxgyky@163.com
10.3760/cma.j.issn.1673-4181.2016.06.012

